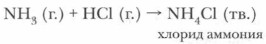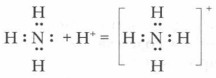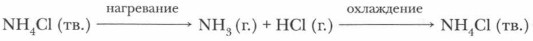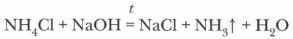как объяснить хорошую растворимость аммиака в воде какие процессы при этом происходят запишите
Аммиак
2. Реакции присоединения. Аммиак активно соединяется как с водой, так и с кислотами.

При взаимодействии аммиака с соляной кислотой происходит реакция присоединения:
Аммиак взаимодействует и с другими кислотами.
Продуктами взаимодействия аммиака с кислотами являются соли аммония.
Проблема. За счет чего аммиак может вступать в реакции присоединения, если все валентные электроны использованы на образование связи, а атомы азота и водорода в его молекуле имеют устойчивые электронные конфигурации?
Откуда они взялись в растворе? По всей вероятности, вследствие отнятия от молекул воды ионов водорода Н + молекулами аммиака.

Вспомните механизм образования иона гидроксония при растворении хлороводорода в воде (см. § 5). За счет неподеленной пары электронов атома азота молекулы аммиака устанавливают прочную ковалентную связь с ионом водорода молекулы воды по донорно-акцепторному механизму с образованием катиона аммония
В водном растворе ион аммония играет роль катиона, а гидроксид-ион воды создает щелочную среду.
Реакции аммиака с кислотами идут по такому же механизму, как и с Н2O.
Задание. Напишите уравнения реакций аммиака с азотной и серной кислотами. Назовите продукты этих реакций.
Соли аммония. С многоосновными кислотами аммиак образует соли двух видов: кислые, например NH4HSO4 (гидросульфат аммония), и средние, например (NH4)2SO4 (сульфат аммония).
Свойства солей аммония сходны со свойствами солей щелочных металлов, особенно солей калия и рубидия. Это белые кристаллические вещества, хорошо растворимые в воде (см. таблицу растворимости). Они сильные электролиты.
Твердые соли термически неустойчивы и при нагревании разлагаются. Если соль аммония образована летучей кислотой, то при нагревании выделяются кислота и аммиак, способные при охлаждении вновь образовать соль:

В остальном соли аммония проявляют общие свойства класса солей.
Качественной реакцией для иона аммония 


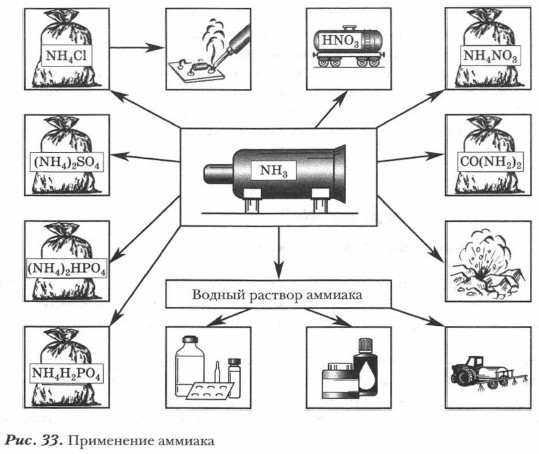
Применение аммиака и солей аммония. Большая часть аммиака используется для производства азотной кислоты и ее солей, соды, минеральных удобрений, содержащих азот. Жидкий аммиак применяют в холодильных установках. Нашатырный спирт применяют в медицине, а также в быту для выведения пятен в составе пятновыводящих смесей. Водные растворы аммиака применяют в химических лабораториях (рис. 33).
Широкое практическое применение находят и соли аммония. Нитрат аммония в смеси с сульфатом аммония используется как азотсодержащее удобрение. Нитрат аммония является компонентом при производстве взрывчатых веществ — аммоналов. Хлорид аммония (нашатырь 1 ) применяют при пайке металлов для очистки их поверхности (за счет хлороводорода, выделяющегося при разложении нашатыря), при их сварке, а кроме того — в сухих элементах (электрических батареях) в качестве электролита.
1 Нашатырь — техническое название хлорида аммония. Не путайте с нашатырным спиртом.
Способы получения аммиака • Свойства аммиака • Соли аммония • Катион аммония и механизм его образования • Качественная реакция на ион аммония




Напишите уравнения этих реакций и укажите их условия.





Cвойства аммиака
Аммиак, формула, газ, характеристики:
Аммиак – химическое соединение азота и водорода, состоящее из одного атома азота и трех атомов водорода, нитрид водорода.
Аммиак (NH3) – наиболее простое и устойчивое соединение азота с водородом.
Химическая формула аммиака NH3. Изомеров не имеет.
Строение молекулы аммиака:
Форма молекулы аммиака напоминает тригональную пирамиду, в вершине которой расположен атом азота. Три неспаренных p-электрона атома азота участвуют в образовании полярных ковалентных связей с 1s-электронами трёх атомов водорода (связи N−H), четвёртая пара внешних электронов является неподелённой, она может образовать ковалентную связь по донорно-акцепторному механизму с ионом водорода, образуя ион аммония NH4+. Несвязывающее двухэлектронное облако строго ориентировано в пространстве, поэтому молекула аммиака обладает высокой полярностью, что приводит к его хорошей растворимости в воде.
Аммиак – при нормальных условиях бесцветный газ, с резким характерным запахом (запах «нашатырного спирта»).
Аммиак – токсичное горючее газообразное вещество, обладающее свойством образовывать при контакте с воздухом взрывоопасную смесь.
Легче воздуха. Плотность по сравнению с плотностью воздуха 0,59. Таким образом, аммиак практически вдвое (в 1,7 раза) легче воздуха. Его можно собирать в перевернутые вверх дном сосуды.
Аммиак – это горючий газ. Пожаро- и взрывоопасен. В чистом кислороде аммиак сгорает бледно-желтым пламенем, превращаясь, в основном, в азот и воду. Аммиак горит при наличии постоянного источника огня. Наличие масел и другого горючего увеличивает пожаровзрывоопасность этого вещества.
Аммиак образует с воздухом взрывоопасную смесь. Концентрационные пределы распространения пламени – 15,0-33,6 объемные доли, %; либо 107-240 г/м3. Наиболее легковоспламеняемая концентрация 24,5% (180 г/м3).
Хорошо растворим в воде как в газообразном, та и в жидком состоянии. Растворимость NH3 в воде чрезвычайно велика – около 1200 объёмов (при 0 °C) или 700 объёмов (при 20 °C) в объёме воды. При растворении аммиака в воде выделяется значительное количество тепла.
Водный раствор аммиака имеет сильную щелочную реакцию вследствие образования гидроокиси аммония NH4OH.
Аммиак относится к токсичным веществам, к IV классу опасности (малоопасные вещества) по ГОСТ 12.1.007. ПДК аммиака в атмосферном воздухе населенных мест по ГОСТ 6221-90 составляет: максимально разовая – 0,2 мг/м3; среднесуточная – 0,04 мг/м3. Предельно допустимая концентрация в воздухе рабочей зоны производственного помещения (ПДКр.з.) по ГОСТ 12.1.005-88 составляет 20 мг/м³. Ощущение запаха аммиака свидетельствует о превышении допустимых норм, т.к. запах аммиака ощущается при концентрации 37 мг/м³.
Аммиак по физиологическому действию на организм относится к группе веществ удушающего и нейротропного действия, способных при ингаляционном поражении вызвать токсический отёк лёгких и тяжёлое поражение нервной системы. Аммиак обладает как местным, так и резорбтивным действием. Пары аммиака сильно раздражают слизистые оболочки глаз и органов дыхания, а также кожные покровы. Жидкий аммиак или струя газа, попадая на кожу человека, вызывает сильные ожоги.
Аммиак в следовых количествах содержится в природе и планетах Солнечной системы. Почки человека выделяют аммиак для нейтрализации избыточной кислоты.
Ежегодное мировое промышленное производство аммиака составляет более 180 млн тонн. Он относится к числу важнейших продуктов химической промышленности. Аммиак выпускается в жидком виде или в виде водного раствора – аммиачной воды, которая обычно содержит 25% NH3.
[править] Химические свойства
Электронная и структурная формулы аммиака
Молекулы аммиака образуются с помощью ковалентных связей. Однако связи N — Н в молекуле аммиака полярные, так как электронная пара смещена к атому азота. Поэтому атом азота имеет отрицательный заряд, а атом водорода — положительный. В химическом отношении аммиак является восстановителем, а сам обычно окисляется до свободного азота. Так, в атмосфере кислорода аммиак горит:
Аммиак также легко восстанавливает монооксид меди до металлической меди при высокой температуре:
Аммиак, жидкость, твердое тело, характеристики:
Жидкий аммиак – бесцветная жидкость, сильно преломляющая свет.
Аммиак как жидкость является хорошим растворителем для очень большого числа органических, а также для многих неорганических соединений. В жидком аммиаке хорошо растворяются щелочные, щелочноземельные металлы, а также другие простые вещества, как, например, фосфор, йод, сера. Слабо растворяются в жидком аммиаке азотнокислые, хлористые и бромистые соли, а соли серной, угольной, уксусной и фосфорной кислот, как правило, нерастворимы.
Чистый жидкий аммиак является диэлектриком, поэтому способен к образованию на стенках сосудов статического электричества.
Сжиженный безводный аммиак относится к трудногорючим веществам.
Жидкий аммиак или струя газа, попадая на кожу человека, вызывает сильные ожоги.
Твёрдый аммиак внешне представляет собой снегообразную массу из кубических кристаллов правильной формы.
Физические свойства аммиака:
| Наименование параметра: | Значение: |
| Цвет | без цвета |
| Запах | с резким характерным запахом (запах «нашатырного спирта») |
| Вкус | едкий |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | газ |
| Плотность жидкости (при температуре кипения и атмосферном давлении 1 атм.), кг/м3 | 682,8 |
| Плотность газа (при температуре кипения и атмосферном давлении 1 атм.), кг/м3 | 0,8886 |
| Плотность (при 15 °C и атмосферном давлении 1 атм.), кг/м3 | 0,73 |
| Плотность (при 25 °C и атмосферном давлении 100 кПа ≈ 1 атм.), кг/м3 | 0,7723 |
| Температура плавления, °C | -77,73 |
| Температура кипения, °C | -33,34 |
| Критическая температура*, °C | 132,4 |
| Критическое давление, МПа | 11,32 |
| Критический удельный объем, м3/кг | 0,00426 |
| Коэффициент теплопроводности газа (при 0 °C и атмосферном давлении 1 атм.), Вт/(м·К) | 0,026 |
| Температура самовоспламенения, °C | 651 ± 1 |
| Взрывоопасные концентрации смеси газа с воздухом, % объёмных | от 14,5 (15,0) до 33,6 |
| Взрывоопасные концентрации смеси газа с кислородом, % объёмных | от 13,5 до 82 |
| Удельная теплота сгорания, МДж/кг | 20,5 |
| Температура пламени, °C | 700 |
| Константа диссоциации кислоты | 9,21 ± 0,01 |
| Молярная масса, г/моль | 17,0304 |
* при температуре выше критической температуры газ невозможно сконденсировать ни при каком давлении.
[править] Физические свойства
Аммиак — бесцветный газ с характерным резким запахом и едким вкусом. Он почти в два раза легче воздуха. При −33,35 °С и обычном давлении аммиак сжижается в бесцветную жидкость, а при −77,75 °C замерзает, превращаясь в бесцветную кристаллическую массу. Его хранят и транспортируют в жидком состоянии в стальных баллонах под давлением 6-7 атм.
В воде аммиак растворяется очень хорошо: при 0 °С и обычном давлении в 1 объеме воды растворяется около 1200 объемов NH3, а при 20 °С — 700 объемов. Концентрированный раствор содержит 25 % NH3 и имеет плотность 0,91 г/см3. Раствор аммиака в воде называют аммиачной водой или нашатырным спиртом. Обычный медицинский нашатырный спирт содержит до 10 % NH3, аммиачная вода — от 10 % и более. При нагревании раствора аммиак легко испаряется.
Химические свойства аммиака:
Основные свойства аммиака обусловлены наличием неподеленной пары электронов у атома азота. Степень окисления азота в аммиаке «-3» – минимальная. Поэтому в химическом отношении аммиак довольно активен: он вступает в реакции взаимодействия со многими веществами и проявляет только восстановительные свойства.
Для аммиака характерны следующие химические реакции:
1. реакция взаимодействия аммиака и воды:
В результате реакции образуется гидрат аммония (NH3•H2O или NH4OН). Раствор аммиака в воде имеет щелочную среду.
NH3•H2O → NH3 + H2O (to).
При кипении гидрат аммиака разлагается с образованием аммиака и воды.
2. реакция взаимодействия аммиака и ортофосфорной кислоты:
NH3 + H3PO4 → NH4H2PO4.
В результате реакции образуется дигидрофосфат аммония.
Аналогичным образом протекают реакции аммиака с другими кислотами – с образованием солей аммония.
3. реакция взаимодействия аммиака и кислорода – горения аммиака:
4NH3 + 3O2 → 2N2 + 6H20.
В результате реакции образуется азот и вода. Реакция носит необратимый характер.
4. реакция каталитического окисления аммиака:
4NH3 + 5O2 → 4NO + 6H2O (kat = Pt и пр., t = 800 оС);
NH3 + 2O2 → HNO3 + H2O (kat = Pt, Rh, t = 850 оС, p = 5 атм.).
В результате первой реакции образуются оксид азота (II) и вода. В качества катализатора используются платина и ее сплавы с металлами-платиноидами, оксиды железа, марганца, кобальта, хрома и др.
В результате второй реакции образуются азотная кислота и вода. Это промышленный способ получения азотной кислоты. При этом смесь воздуха с 10% (по объему) аммиака пропускается над рядами металлических сеток (платина с 5-15% родия) при температуре около 850 оС и давлении 5 атм; время контактирования с катализатором ограничено до ≤ 1 мс чтобы минимизировать нежелательные побочные реакции. Степень превращения составляет около 96% (одна из наиболее эффективных из известных промышленных каталитических реакций); выходящие газы пропускают через абсорбционную колонну и получают 60%-й водный раствор азотной кислоты при 40°C. Реакция протекает в три стадии.
5. реакция взаимодействия аммиака и оксида меди:
2NH3 + 3CuO → N2 + 3Cu + 3H2O (t = 500-550 оС).
В результате реакции образуются азот, медь и вода. В ходе реакции аммиак пропускается через нагретый оксид меди.
6. реакция термического разложения аммиака:
2NH3 ⇄ N2 + 3H2 (t = 1200-1300 оС).
В результате реакции образуются азот и водород.
7. реакция взаимодействия аммиака и фтора:
2NH3 + 3F2 → 6HF + N2 (tо).
В результате реакции образуются фтороводород и азот. Реакция происходит при высоких температурах.
Аналогичным образом протекают реакции аммиака с другими галогенами.
8. реакция взаимодействия оксида калия и аммиака:
В результате реакции образуются амид калия и гидроксид калия. Реакция медленно протекает в жидком аммиаке.
Аммиак. Опасен при вдыхании и незаменим в промышленности
При отравлении аммиаком необходимо принять следующие меры:
Первая медицинская помощь: промыть глаза и лицо водой, надеть противогаз или ватно-марлевую повязку, смоченную 5% раствором лимонной кислоты, открытые участки кожи обильно промыть водой, немедленно покинуть очаг заражения.
Индивидуальная защита: изолирующий и фильтрующие противогазы марок М, КД, респиратор РПГ-67КД, при их отсутствии — ватно-марлевая повязка, смоченная 5% раствором лимонной кислоты, защитный костюм, резиновые сапоги, перчатки.
Действия общего характера: удалить посторонних. Держаться с наветренной стороны.
Изолировать опасную зону и не допускать посторонних. В зону аварии входить только в полной защитной одежде. Соблюдать меры пожарной безопасности, не курить.
При утечке и разливе: устранить источники открытого огня. Устранить течь. Для осаждения газов использовать распыленную воду. Оповестить об опасности отравления местные органы власти. Эвакуировать людей из зоны, подвергшейся опасности заражения ядовитым газом. Не допускать попадания вещества в водоемы, тоннели, подвалы, канализацию. В случае загрязнения воды сообщить СЭС.
При пожаре: убрать из зоны пожара, если это не представляет опасности, и дать возможность догореть. Не приближаться к горящим емкостям. Охлаждать емкости водой с максимального расстояния. Тушить распыленной водой, воздушно-механической пеной с максимального расстояния.
Случаи утечки аммиака
В декабре 1999 года в Калининградской области в приграничном с Литвой городе Советске на целлюлозно-бумажном комбинате произошла авария, в результате которой из резервуаров на почву вытекло более 100 тонн аммиачной воды.
В мае 2000 года в Черкасской области Украины в результате железнодорожной аварии из двух вагонов-цистерн вылилось около 100 тонн аммиачной воды.
В сентябре 2005 года произошел аварийный выброс аммиака на Калининградском мясокомбинате.
В июле 2006 аварийный выброс аммиака произошел в г. Корсакове Сахалинской области. На территории предприятия «Корсаковский рыбоконсервный завод» при замене сальника на вентиле трубопровода, соединяющего емкость для хранения аммиака с компрессором, произошел выброс аммиака в объеме до 70 кг. В результате выброса пострадало 3 человека.
В январе 2007 года на северо-востоке Москвы три человека пострадали в результате утечки аммиака. На территории завода железобетонных конструкций были обнаружены 20 баллонов с аммиаком. Из баллона, в котором еще находился аммиак, произошла утечка, и образовалось небольшое аммиачное облако.
В феврале 2007 года в Дзержинске Нижегородской области произошел выброс аммиака из теплообменника в цехе этанол-амина ООО «Синтез-Ока». Утечка произошла в результате разгерметизации фланцевого соединения аппарата Т-12, предназначенного для испарения аммиака.
Области применения аммиака
Аммиак — один из самых важных продуктов химической промышленности.
Большая часть получаемого в промышленности аммиака идёт на приготовление азотной кислоты, азотных удобрений, красителей. Применяется аммиак и для получения взрывчатых веществ. Широко используются водные растворы аммиака. Как слабое летучее основание, он применяются в химических лабораториях и производствах. С помощью аммиака получают пищевую соду.
В медицине 10% водный раствор аммиака известен как нашатырный спирт. Резкий запах аммиака раздражает специфические рецепторы слизистой оболочки носа и способствует возбуждению дыхательного и сосудодвигательного центров, поэтому при обморочных состояниях или алкогольном отравлении пострадавшему дают вдыхать пары нашатырного спирта.
При пайке металлов используют хлорид аммония — нашатырь — NH4Сl. При высокой температуре нашатырь разлагается с образованием аммиака, который очищает поверхности паяльника и спаиваемого изделия от оксидов металлов.
При испарении жидкого аммиака поглощается большое количество теплоты, поэтому его используют в холодильных установках.
Все справки>>
Получение аммиака в промышленности и лаборатории. Химические реакции – уравнения получения аммиака:
Аммиак в лабораторных условиях получается в результате следующих химических реакций:
NH4Cl + NaOH → NH3 + NaCl + H2O.
В результате реакции образуются газообразный аммиак, хлорид натрия и вода.
(NH4)2SO4 + Ca(OH)2 → 2NH3 + CaSO4 + 2H2O.
В результате реакции образуются газообразный аммиак, сульфат кальция и вода.
NH4Cl + Ca(OH)2→ 2NH3 + CaCl2 + 2H2O.
В результате реакции образуются газообразный аммиак, хлорид кальция и вода.
Таким образом, для получения аммиака в лаборатории используют действие сильных щелочей на соли аммония.
Аммиак в промышленности получают путем прямого взаимодействия водорода и азота:
N2 + 3H2 ↔ 2NH3 (kat = пористое железо с примесями Al2O3 и K2O, t = 500 оС, p = 350 атм.).
За счет высокого давления равновесие в указанной реакции смещается в сторону аммиака. Это так называемый процесс Габера. Немецкий физик Фриц Габер разработал физико-химические основы метода.
Химические
Основные химические свойства описаны в таблице.