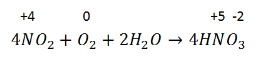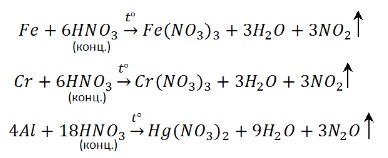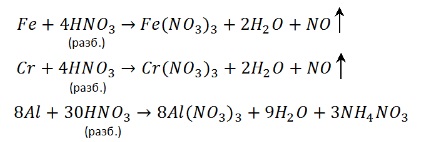как концентрированная серная кислота реагирует с металлами какие металлы пассивируются
Серная кислота
Обладает выраженным дегидратационным (водоотнимающим) действием. При попадании на кожу или слизистые оболочки приводит к тяжелым ожогам.
Получение
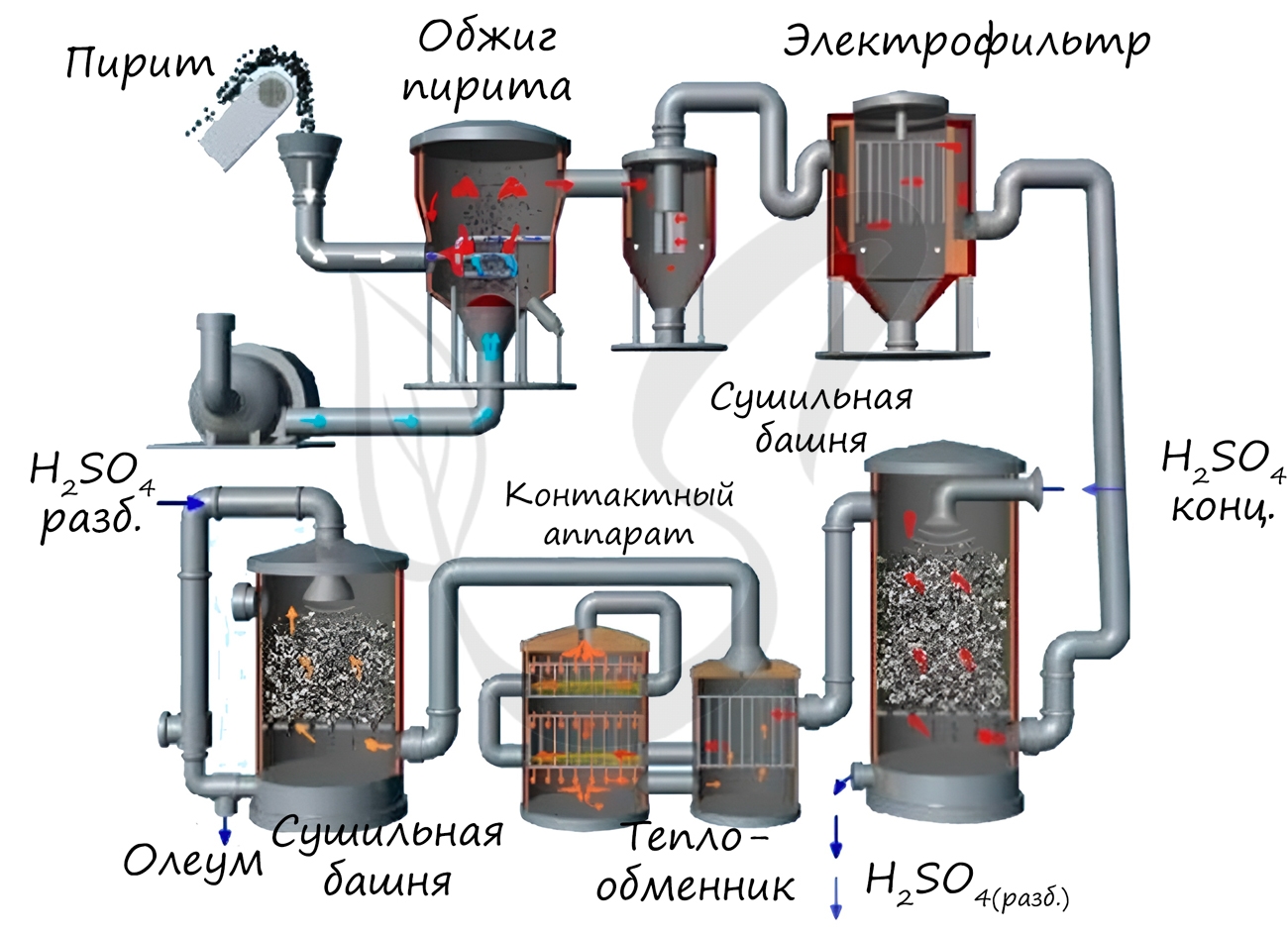
Известны несколько способов получения серной кислоты. Применяется промышленный (контактный) способ, основанный на сжигании пирита, окислении образовавшегося SO2 до SO3 и последующим взаимодействием с водой.
Нитрозный способ получения основан на взаимодействии сернистого газа с диоксидом азота IV в присутствии воды. Он состоит из нескольких этапов:
В окислительной башне смешивают оксиды азота (II) и (IV) с воздухом:
Смесь газов подается в башни, орошаемые 75-ной% серной кислотой, здесь смесь оксидов азота поглощается с образованием нитрозилсерной кислоты:
В ходе гидролиза нитрозилсерной кислоты получают азотистую кислоту и серную:
В упрощенном виде нитрозный способ можно записать так:
Химические свойства
В водном растворе диссоциирует ступенчато.
С солями реакция идет, если в результате выпадает осадок, образуется газ или слабый электролит (вода). Серная кислота, как и многие другие кислоты, способна растворять осадки.
Подчеркну, что реакции разбавленной серной кислоты с железом и хромом не сопровождаются переходом этих элементов в максимальную степень окисления. Они окисляются до +2.
Cu + H2SO4(разб.) ⇸ (реакция не идет, медь не может вытеснить водород из кислоты)
Холодная концентрированная серная кислота пассивирует Al, Cr, Fe, Ni, Be, Co. При нагревании или амальгамировании данных металлов реакция идет.
Обратите особое внимание, что при реакции железа, хрома с концентрированной серной кислотой достигается степень окисления +3. В подобных реакциях с разбавленной серной кислотой (написаны выше) достигается степень окисления +2.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Как концентрированная серная кислота реагирует с металлами какие металлы пассивируются
ОТНОШЕНИЕ МЕТАЛЛОВ К КИСЛОТАМ
Образующиеся в этом процессе ионы водорода H + выполняют роль окислителя, окисляя металлы, расположенные в ряду активности левее водорода. Взаимодействие протекает по схеме:
Me + HCl 
Соляная кислота является слабым окислителем, поэтому металлы с переменной валентностью окисляются ей до низших положительных степеней окисления:
2 Al + 6 HCl → 2 AlCl 3 + 3 H 2 ↑
Соляная кислота пассивирует свинец ( Pb ). Пассивация свинца обусловлена образованием на его поверхности трудно растворимого в воде хлорида свинца ( II ), который защищает металл от дальнейшего воздействия кислоты:
В промышленности получают серную кислоту очень высокой концентрации (до 98%). Следует учитывать различие окислительных свойств разбавленного раствора и концентрированной серной кислоты по отношению к металлам.
Разбавленная серная кислота
В разбавленном водном растворе серной кислоты большинство ее молекул диссоциируют:
Образующиеся ионы Н + выполняют функцию окислителя.
Как и соляная кислота, разбавленный раствор серной кислоты взаимодействует только с металлами активными и средней активности (расположенными в ряду активности до водорода).
Химическая реакция протекает по схеме:
Металлы с переменной валентностью окисляются разбавленным раствором серной кислоты до низших положительных степеней окисления:
Концентрированная серная кислота
В концентрированном растворе серной кислоты (выше 68%) большинство молекул находятся в недиссоциированном состоянии, поэтому функцию окислителя выполняет сера, находящаяся в высшей степени окисления ( S +6 ). Концентрированная H 2 SO 4 окисляет все металлы, стандартный электродный потенциал которых меньше потенциала окислителя – сульфат-иона SO 4 2- (0,36 В). В связи с этим, с концентрированной серной кислотой реагируют и некоторые малоактивные металлы.
Процесс взаимодействия металлов с концентрированной серной кислотой в большинстве случаев протекает по схеме:
Me + H 2 SO 4 (конц.) 
Продуктами восстановления серной кислоты могут быть следующие соединения серы:
Взаимодействие металлов различной активности с концентрированной серной кислотой можно представить схемой:
Концентрированная серная кислота является сильным окислителем, поэтому при взаимодействии с ней металлов, обладающих переменной валентностью, последние окисляются до более высоких степеней окисления, чем в случае с разбавленным раствором кислоты:
Химия, Биология, подготовка к ГИА и ЕГЭ
Давайте рассмотрим свойства
и продукты их реакций
Автор статьи — Саид Лутфуллин
Свойства концентрированной серной кислоты — окислителя
Концентрированная серная кислота – бесцветная тяжелая маслянистая нелетучая жидкость. Не имеет запаха и тянет сказать: «без вкуса», но вкус у нее все же есть, пробовать не советую.
Разбавленная серная кислота ничем особым непримечательна. Свойства как и у других кислот. За исключением того, что она не реагирует со свинцом, так как образующийся сульфат свинца нерастворим. Нерастворимое вещество покрывает кусочек металла и «защищает его от реакции»
А вот концентрированная серная кислота – сильный окислитель (за счет атома серы в высшей степени окисления).
Раз сера – окислитель, то она будет восстанавливаться:
Глубина восстановления серы зависит от активности восстановителя:
На практике образуются несколько продуктов в разных пропорциях. Преобладание того или иного продукта зависит от множества факторов: от вышеупомянутой активности восстановителя, температуры, концентрации кислоты (95%, 90%. 85%, 80%, 75% – это все концентрированная кислота). Но в реалиях школьной программы все схематично и пишем один единственный продукт.
1. Взаимодействие металлов в концентрированной серной кислотой.
Концентрированная серная кислота реагирует с металлами, даже стоящими после водорода. Но кроме платины и золота – эти металлы слишком малоактивны.
Схема этих реакций:
Некоторые металлы (конкретно нужно запомнить — Fe, Al, Cr) при контакте с концентрированной серной кислотой покрываются защитной пленкой – и реакция не идет. Поэтому серную кислоту без всякой опасности перевозят в железных цистернах. Это явление называют пассивацией.
То, что железо, алюминий и хром пассивируются не означает, что реакция невозможна. Просто нужно нагреть – при нагревании от защитной пленки не остаётся и следа:
2. Взаимодействие неметаллов с концентрированной серной кислотой.
Не все неметаллы реагируют с концентрированной серной кислотой: лишь те, что проявляют восстановительные свойства. Поэтому кислород, азот и галогены не вступают в эти реакции.
Мы рассмотрим взаимодействие с фосфором, углеродом, бором, серой. Неметаллы – не такие активные восстановители как типичные металлы – поэтому серная кислота восстанавливается до SO2.
Неметалл окисляется до высшей степени окисления: образуется оксид. Поскольку оксид неметалла – кислотный, то он тут же в момент получения реагирует с водой и образуется кислота:
Угольная кислота не образуется – получается углекислый газ:
Концентрированная серная кислота окисляет серу:
3. Взаимодействие концентрированной серной кислоты с галогенидами.
Галогениды металлов – это соли галогеноводородов (HF, HCl, HBr, HI). Галогеноводороды – летучие кислоты, а HF еще к тому же и слабая.
Поэтому серная кислота их вытесняет из солей:
Соли нужно брать твердые, не раствор. Тогда галогеноводороды будут вытесняться в виде газов.
А к фториду можно и в раствор прилить кислоты, так как фтороводородная кислота – слабая, она вытеснится. Только останется в растворе, вот и вся разница.
С хлоридами и фторидами происходит простая реакция обмена, без изменения степеней окисления.
Галоген окисляется до простого вещества. Сера восстанавливается:
А вот бромиды и иодиды – восстановители. После вытеснения галогеноводорода он тут же окисляется. Поэтому реакции концентрированной серной кислоты с бромидами и иодидами протекают с изменением степеней окисления.
Бромоводород и иодоводород окисляются так же, как и их соли:
Азотная кислота — окислитель.
Производство.
Сырье для производства азотной кислоты – аммиак. Три последовательные реакции окисления:
1. Каталитическое окисление аммиака:
Реакция экзотермическая, необратимая.
2. Окисление NO до NO2:
Реакция экзотермическая, обратимая.
3. Поглощение NO2 водой и одновременно его окисление:
Реакция экзотермическая, обратимая – по этой же схеме азотная кислота разлагается при хранении. Поэтому с течением времени прозрачная изначально азотная кислота буреет. Бурый цвет кислоте придает, образующийся при разложении NO2.
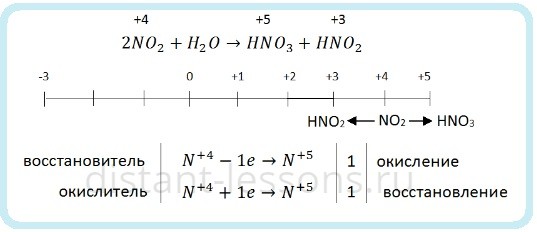
Если растворять NO2 в воде без доступа кислорода, то азот диспропорционирует:
Поэтому оксид азота (IV) NO2 мы относим к кислотным. Хоть у него и нет соответствующей кислоты, при растворении его в воде образуются HNO3 и HNO2.
Азотная кислота – жидкость с резким запахом. Свежая азотная кислота бесцветная. При хранении она разлагается и за счет бурого NO2 приобретает желтоватый цвет.
Важно знать, что азотная кислота летучая, легкокипящая, поэтому и имеет запах. А раз она летучая, то ее можно вытеснить из соли нелетучей кислотой, например, концентрированной серной:
Важно, чтобы нитрат был твердым, а серная кислота концентрированная – меньше воды. Чтобы азотная кислота испарялась, испаряется – значит покидает реакционную смесь, значит реакция идет до конца.
Химические свойства.
Свойства азотной кислоты в целом повторяют свойства концентрированной серной. Но с одной поправкой, в отличие от серной, азотная кислота и концентрированная, и разбавленная проявляет сильные окислительные свойства.
1. Взаимодействие с металлами.
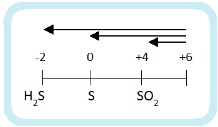
До чего может восстанавливаться азот? Вспомним диаграмму степеней окисления азота:
Получиться может любой из этих продуктов. А на практике – несколько сразу. Мы рассмотрим упрощенный вариант: берем только преобладающий продукт и только два фактора, влияющие на глубину восстановления:
Еще больше упрощая берем только четыре продукта: NH4NO3, N2O, NO, NO2.
Наиболее глубокое восстановление дает разбавленная кислота и активный металл – NH4NO3.
Соответственно при взаимодействии концентрированной кислоты и малоактивного металла образуется NO2. Самое неглубокое восстановление.
Теперь нужно определить в каком случае будет N2O, а в каком NO. Фактор активности металла – решающий. С активным металлом и концентрированной кислотой будет N2O. А с малоактивным металлом и разбавленной кислотой образуется NO.
8Na + 10HNO3 конц → 8NaNO3 + N 2 O ↑ + 5H2O
Концентрированная азотная кислота пассивирует Fe, Cr, Al, как и концентрированная серная.
Чтобы провести реакцию нужно нагреть:
С разбавленной кислотой эти металлы реагируют и без нагревания:
2. Взаимодействие с неметаллами (C, P, B, S).
Неметаллы окисляются до высших кислот. Реагирует и концентрированная, и разбавленная азотная кислота. Неметаллы – не очень хорошие восстановители, поэтому кислота восстанавливается как в реакции с малоактивными металлами (образуются N2O и NO2).
В отличие от серной кислоты, очень концентрированная азотная кислота (безводная) окисляет при нагревании иод до иодноватой кислоты (HIO3):
3. Взаимодействие с галогенидами.
Эти реакции могут запутать, хотя ничего сложного в них нет. Вам нужно просто понять логику каждой из них.
На что следует опираться:
Фториды металлов – это соли слабых кислот, поэтому сильная азотная кислота вытесняет фтороводород. И не важно концентрированная или разбавленная – это простая реакция обмена/p>
Фтороводород не реагирует с азотной кислотой. Реакция обмена невозможна и окислительно-восстановительная тоже: фторид – слабый восстановитель.
Хлориды металлов и хлороводород не реагируют с азотной кислотой. Хлорид ион – слабый восстановитель – не возможна ОВР. Хлориды металлов не реагируют, потому что соляная кислота – сильная (предыдущая плавиковая – слабая, если помните).
Бромиды и иодиды вступают с азотной кислотой в окислительно-восстановительное взаимодействие. Сами окисляются до простых веществ. Азотная кислота восстанавливается до NO2 если концентрированная, разбавленная – до NO, то есть так, как будто взаимодействует с малоактивным металлом.
Как концентрированная серная кислота реагирует с металлами какие металлы пассивируются
Металлы переменной валентности соляной и разбавленной серной кислотами окисляются до низших степеней окисления. Железо имеет наиболее распространенные степени окисления +2 и +3. При реакции с этими кислотами железо окисляется до степени окисления +2.
Свинец является более активным элементом, чем водород, но в процессе реакции на его поверхности образуется плотная нерастворимая пленка хлорида или сульфата свинца(II) и реакция практически не протекает.
Малоактивные металлы восстанавливают серную кислоту преимущественно до SO2. φ 0 (Ag/Ag + ) = +0,8В – неактивный металл.
Металлы переменной валентности окисляются концентрированной серной кислотой, как правило, до высшей степени окисления.
Благородные металлы (Au, Pt и некоторые другие) с концентрированной серной кислотой не взаимодействуют ни при каких условиях. Некоторые металлы (Al, Fe, Cr, Ni и др.) не взаимодействуют с концентрированной серной кислотой при обычных условиях (пассивируются), но взаимодействуют при нагревании. Это свойство железа позволяет хранить и перевозить концентрированную серную кислоту в емкостях из обычной стали.
Свинец с концентрированной серной кислотой взаимодействует с образованием растворимой кислой соли.
Уроки по неорганической химии для подготовки к ЕГЭ
Свойства простых веществ:
Свойства сложных веществ:
Особенности протекания реакций:
Химические свойства металлов
1. Щелочные (Li-Fr), щелочно-земельные (Ca-Ra) металлы, Mg
1) Реагируют с кислородом (подробнее)
Все Щ металлы, кроме Li, образуют не оксиды, а пероксиды:
Оксиды получают взаимодействием пероксидов с металлом:
2) Реагируют с водородом (подробнее)
3) Реагируют с водой (подробнее)
4) Реагируют с галогенами, серой, азотом, фосфором, углеродом:
5) Реагируют с некоторыми кислотными оксидами:
SiO2 + 2Mg → 2MgO + Si
SiO2 + 2Ca → 2CaO + Si
SiO2 + 2Ba → 2BaO + Si
6) Магний как восстановитель используется в производстве кремния и некоторых металлов:
7) Реакции Щ и ЩЗ металлов с растворами солей или кислот не рассматриваются, так как эти металлы очень бурно взаимодействуют с водой, и суммарная реакция изменится.
2. Алюминий
1) Реагирует с кислородом: 4Al + 3O2 → 2Al2O3
2) Не реагирует с водородом (из металлов только Щ и ЩЗ металлы взаимодействуют с водородом)
3) Реагирует с водой, если удалить оксидную пленку:
4) Реагирует с щелочами с выделением водорода (также Be и Zn):
5) Реагируют с галогенами, серой, азотом, фосфором, углеродом:
6) Используется для восстановления менее активных металлов (алюмотермия):
7) Реагирует с кислотами-неокислителями, так как находится до водорода в ряду напряжений, с выделением водорода:
8) Вытесняет менее активные металлы из их солей:
9) На холоде пассивируется концентрированными растворами серной и азотной кислот. При нагревании реагирует без выделения водорода.
3. Железо
1) Реагирует с кислородом:
В присутствии воды образуется ржавчина:
4Fe + 3O2 + 6H2O  → 4Fe(OH)3
2) Не реагирует с водородом (только Щ и ЩЗ металлы взаимодействуют с водородом)
Fe + H2 → реакция не идет
3) Реагирует с парами воды с образованием оксида:
4) Не реагирует с щелочами
Fe + NaOH → реакция не идет
5) Реагирует с кислородом, серой, галогенами при нагревании:
2Fe + 3F2 → 2FeF3 (образуется соль Fe +3 )
2Fe + 3Cl2 → 2FeCl3 (образуется соль Fe +3 )
2Fe + 3Br2 → 2FeBr3 (образуется соль Fe +3 )
Fe + I2 → FeI2 (образуется соль Fe +2 )
6) Реагирует с кислотами-неокислителями, так как находится до водорода в ряду напряжений, с выделением водорода:
7) Вытесняет менее активные металлы из их солей:
Fe + CuSO4 → FeSO4 + Cu (образуется соль Fe +2 )
8) На холодe пассивируется концентрированными растворами серной и азотной кислот (т.е. реакция не протекает). При нагревании реагирует без выделения водорода:
9) Соединения Fe +3 реагируют с железом, медью, восстанавливаясь до Fe +2 :
4. Хром
1) Реагирует с кислородом:
2) Не реагирует с водородом (только Щ и ЩЗ металлы взаимодействуют с водородом)
Cr + H2 → реакция не идет
3) Реагирует с парами воды с образованием оксида:
4) Не реагирует с щелочами
Cr + NaOH → реакция не идет
5) Реагирует с кислородом, серой, галогенами при нагревании:
2Cr + 3Cl2 → 2CrCl3 (образуется соль Fe +3 )
2Cr + 3Br2 → 2CrBr3 (образуется соль Fe +3 )
Cr + S → Cr2S3 (образуется соль Fe +3 )
6) Реагирует с кислотами-неокислителями, так как находится до водорода в ряду напряжений, с выделением водорода:
Cr + 2HCl → CrCl2 + H2 (образуется соль Cr +2 )
7) Пассивируется концентрированным и разбавленным растворами азотной кислоты (т.е. реакция не протекает).
5. Медь
1) Реагирует с кислородом:
2) Реагирует с соединениями Cu +2 с образованием промежуточной степени окисления +1:
3) Не реагирует с водородом (только Щ и ЩЗ металлы взаимодействуют с водородом)
Cu + H2 → реакция не идет
4) Не реагирует с парами воды (так как находится в ряду напряжений после водорода):
Cu + H2O → реакция не идет
5) Не реагирует с щелочами
Cu + NaOH → реакция не идет
6) Реагирует с кислородом, серой, галогенами при нагревании:
Cu + Cl2 → CuCl2 (образуется соль Cu +2 )
Cu + Br2 → CuBr2 (образуется соль Cu +2 )
2Cu + I2 → 2CuI (образуется соль Cu +1 )
Cu + S → CuS (образуется соль Cu +2 )
7) Не реагирует с N2, C, Si.
8) Не реагирует с кислотами-неокислителями, так как находится правее водорода в ряду напряжений:
9) Реагирует с кислотами-окислителями как слабый восстановитель:
7. Цинк
1) Реагирует с кислородом: 2Zn + O2 → 2ZnO
2) Не реагирует с водородом (из металлов только Щ и ЩЗ металлы взаимодействуют с водородом)
3) Реагирует с парами воды, т.е. при сильном нагревании, с образованием оксида:
4) Реагирует с твердыми щелочами и растворами щелочей с выделением водорода (также Be и Al):
5) Реагируют с галогенами, серой при нагревании:
6) Реагирует с кислотами-неокислителями, так как находится до водорода в ряду напряжений, с выделением водорода:
8) Реагирует с кислотами-окислителями:
Так как Zn находится примерно в центре ряда напряжений, то в реакциях с азотной кислотой могут образовываться разные продукты: