к какой группе относится коллаген миозин эластин
Структурная функция белков
Структурная функция белков заключается в том, что белки
Содержание
Белки межклеточного вещества
В теле человека белков межклеточного вещества больше, чем всех остальных белков. Основными структурными белками межклеточного вещества являются фибриллярные белки.
Коллагены
Коллагены — семейство белков, в теле человека составляют до 25 — 30 % общей массы всех белков. Кроме структурной функции коллаген выполняет также механическую, защитную, питательную и репаративную функции.
Молекула коллагена представляет собой правозакрученную спираль из трёх α-цепей.
Всего у человека имеется 28 типов коллагена. Все они сходны по структуре.
Эластин
Эластин широко распространён в соединительной ткани, особенно в коже, легких и кровеносных сосудах. Общими характеристиками для эластина и коллагена являются большое содержание глицина и пролина. В эластине значительно больше валина и аланина и меньше глутаминовой кислоты и аргинина, чем в коллагене. В эластине содержатся десмозин и изодесмозин. эти соединения можно обнаружить только в эластине. Эластин нерастворим в водных растворах (как и коллаген), в растворах солей, кислот и щелочей даже при нагревании. В эластине большое количество аминокислотных остатков с неполярными боковыми группами, что, по-видимому, обусловливает высокую эластичность его волокон.
Другие белки внеклеточного матрикса
Другие белки внеклеточного матрикса — ламинины, фибронектин и др. — выполняют как структурную, так и сигнальную функцию. Взаимодействуя с мембранными рецепторами, они воздействуют на миграции клеток и другие стороны их поведения.
Белки цитоскелета
Кератин
Один из основных структурных белков — кератин. В основном из кератина состоят мертвые клетки ороговевающего эпителия и их производные (волосы млекопитющих, рога, копыта, когти, перья птиц, чешуя рептилий и др.). В живых клетках эпителиальных тканей кератины образуют промежуточные филаменты.
Кератины разделяются на две группы: α-кератины и β-кератины. Прочность кератина уступает, пожалуй, только хитину. Характерной особенностью кератинов является их полная нерастворимость в воде при pH 7,0. Содержат в молекуле остатки всех аминокислот. Отличаются от других фибриллярных структурных белков (например, коллагена) в первую очередь повышенным содержанием остатков цистеина. Первичная структура полипептидных цепей a-кератинов не имеет периодичности.
Другие белки промежуточных филаментов
Тубулин
Тубулин относится к филаментозным белкам. Димеры тубулина после полимеризации превращаются в нити (протофиламенты). Из них собираются микротрубочки, образующие цитоскелет, который помогает клетке поддерживать форму, обеспечивает связь между органеллами и выполняет ряд других функций.
Актин
Актин — тоже филаментозный белок. Из его мономеров при полимеризации образуются тонкие филаменты мышц и микрофиламенты немышечных клеток.
Миозин
Хотя миозин обычно относят к моторным белкам, в мышечных клетках он входит в состав постоянных структур. В скелетных и сердечной мышцах миозин входит в состав саркомеров, образуя толстые филаменты.
Вспомогательные белки цитоскелета
К структурным относятся и многие вспомогательные белки, входящие в состав цитоскелета. Так, в образовании саркомеров участвуют белки титин, тропомиозин и др.
Структурные белки органелл
Белки создают и определяют форму (структуру) многих клеточных органелл. В основном из белков состоят такие органеллы, как рибосомы, протеасомы, ядерные поры и др. Гистоны необходимы для сборки и упаковки нитей ДНК в хромосомы. Из белков состоят клеточные стенки некоторых протистов (например,хламидомонады); в составе оболочки клеток многих бактерий и архей присутствует белковый слой (S-слой), который крепится у грамположительных видов к клеточной стенке, а у грамотрицательных — к наружной мембране. Из белка флагеллина состоят прокариотические жгутики.
Полезное
Смотреть что такое «Структурная функция белков» в других словарях:
Третичная структура белков — Разные способы изображения трёхмерной структуры белка на примере фермента триозофосфатизомеразы. Слева «палочковая» модель, с изображением всех атомов и связей между ними; цветами показаны элементы. В середине изображены структурные мотивы … Википедия
НЕЙТРОНОГРАФИЯ СТРУКТУРНАЯ — исследования атомной структуры конденсир. сред методом дифракции нейтронов низких энергий на атомных ядрах (упругого когерентного рассеяния). В H. с. используются нейтроны с длиной волны де Бройля l >= 0,3 Рассеяние нейтронной волны на… … Физическая энциклопедия
Белки — У этого термина существуют и другие значения, см. Белки (значения). Белки (протеины, полипептиды[1]) высокомолекулярные органические вещества, состоящие из соединённых в цепочку пептидной связью альфа аминокислот. В живых организмах… … Википедия
Биополимеры — высокомолекулярные природные соединения, являющиеся структурной, основой всех живых организмов и играющие определяющую роль в процессах жизнедеятельности. К Б. относятся белки, нуклеиновые кислоты и полисахариды; известны также смешанные… … Большая советская энциклопедия
Протеин — Кристаллы различных белков, выращенные на космической станции «Мир» и во время полётов шаттлов НАСА. Высокоочищенные белки при низкой температуре образуют кристаллы, которые используют для получения модели данного белка. Белки (протеины,… … Википедия
Протеины — Кристаллы различных белков, выращенные на космической станции «Мир» и во время полётов шаттлов НАСА. Высокоочищенные белки при низкой температуре образуют кристаллы, которые используют для получения модели данного белка. Белки (протеины,… … Википедия
Факторы транскрипции — (транскрипционные факторы) белки, контролирующие процесс синтеза мРНК на матрице ДНК (транскрипцию) путём связывания со специфичными участками ДНК[1][2]. Транскрипционные факторы выполняют свою функцию либо самостоятельно, либо в комплексе… … Википедия
Фактор транскрипции — Факторы транскрипции (транскрипционные факторы) белки, контролирующие перенос информации с молекулы ДНК в структуру мРНК (транскрипцию) путем связывания со специфичными участками ДНК.[1][2] Транскрипционные факторы выполняют свою функцию… … Википедия
ЖИЗНЬ — особое качественное состояние мира, возможно, необходимая ступень в развитии Вселенной. Естественно научный подход к сущности Ж. сосредоточен на проблеме ее происхождения, ее материальных носителей, на отличии живого от неживого, на эволюции… … Философская энциклопедия
Химическая связь — взаимное притяжение атомов, приводящее к образованию молекул и кристаллов. Принято говорить, что в молекуле или в кристалле между соседними атомами существуют Х. с. Валентность атома (о чём подробнее сказано ниже) показывает число связей … Большая советская энциклопедия
К какой группе относится коллаген миозин эластин
На долю соединительной ткани приходится более 50 % массы тела животного. Существенной особенностью, отличающей ее от других и присущей в большей или меньшей степени всем ее разновидностям, является количественное преобладание межклеточного вещества над клеточными элементами. Межклеточный матрикс состоит из волокнистых компонентов, а пространство между ними заполнено основным веществом, содержащим гликопротеины. Волокнистые компоненты состоят из коллагеновых и эластиновых волокон.
Для соединительнотканных белков характерно присутствие внутри- и межмолекулярных поперечных сшивок: альдольная, гистидин-альдольная, лейцин-норлейциновая, основание шиффа. В результате появляется возможность ковалентного связывания четырех боковых цепей друг с другом, причем они могут принадлежать разным молекулам белка.
В эластине значительно меньше содержание лизина это обусловлено тем, что боковые цепи четырех остатков аминокислоты ферментативным путем превращаются в десмозин, в результате формируется поперечная сшивка между соседними полипептидными цепями в молекуле эластина. Именно присутствие десмозина отличает эластин от всех других белков, включая и коллаген.
Благодаря своей уникальной структуре белки соединительной ткани в нативном состоянии не подвергаются действию протеолитических ферментов. Ткани, содержащие коллаген и эластин, отличаются особой прочностью, способностью выдерживать значительные нагрузки.
При всем сходстве данных белков, каждый из них является индивидуальным белком, со свойствами присущими только ему одному.
Молекула коллагена имеет относительную молекулярную массу 300000, длину 280 нм и толщину 1,4 нм. Каждая a-цепь содержит в среднем около 1000 аминокислотных остатков. Еще одной особенностью коллагена является его гетерогенность. В настоящее время описано 28 типов коллагена, которые кодируются более чем 40 генами. Они отличаются друг от друга по аминокислотной последовательности, а также по степени модификации – интенсивности гидроксилирования или гликозилирования. Общим для всех коллагенов является существование одного или более доменов, содержащих тройную спираль и присутствие их во внеклеточном матриксе [5].
Практическое применение имеет в основном коллагенсодержащее сырье, это связано со способностью коллагена образовывать гели при взаимодействии с водой. Коллаген находит широкое применение в медицине для пластики сосудов, дефектов кожи, кости, мозговой оболочки, тазового дна, трахеи, печени и селезенки. Применяется в виде гемостатических средств и тампонов, мембран для диализа, шовного материала, а также для доставки лекарственных средств в организм человека, в пищевой промышленности – в качестве гелеобразователя.
Цель работы исследование возможности использования соединительнотканных белков в качестве носителей биологически активных веществ.
Материалы и методы исследований
Объектами исследования были сухожилия и выйная связка крупного рогатого скота, желатин, растворы гидролизатов коллагена и эластина, соли йода и железа, а также растительные настои, содержащие фенольные соединения, в частности антоцианы.
Основные этапы получения гидролизата коллагена: измельчение сухожилий, последовательная солевая и кислотная экстракция, тепловая обработка и охлаждение. Раствор гидролизата коллагена имел светло-матовый цвет, без видимых границ раздела фаз.
Эластин выделяли из выйной связки при последовательной экстракции: солевой, щелочной, водной. Растворимую форму белка получали методом биотрансформации.
Гидролизат представляет собой сложную смесь пептидов, жидкость светло-желтого цвета, без вкуса и запаха. Содержание белка в 1 мл гидролизата коллагена и эластина составило 30 мг и 40 мг соответственно.
При проведении экспериментов использовали аналитические методы качественного и количественного анализа.
Результаты исследований и их обсуждение
В результате проведенных исследований получены растворимые формы соединительнотканных белков – гидролизаты коллагена и эластина, которые исследовали в качестве матрицы микроэлементов, в частности железа и йода.
Источниками микроэлементов служили сульфат железа (II) и йодид калия. Одним из основных условий при проведении реакции являлся показатель рН среды. Выбор рН среды связан со свойствами микроэлементов и фермента. Так, в кислой среде йод восстанавливается до молекулярного состояния и улетучивается, в щелочной среде рН > 8,0 образуется гипойодид. Фермент при рН выше 6,0 инактивируется. Учитывая данные факторы, в растворах устанавливали рН 7,0 – 7,2. Расчет вводимого количества йодида калия производили по содержанию йода (76,5%).
При взаимодействии железа и гидролизатов коллагена и эластина были исследованы значения рН (9,0; 5,5; 3,5)±0,2. При рН 9,0±0,2 наблюдалось изменение окраски от светло-желтого (гидролизат эластина) и светло-матового (гидролизат коллагена) до темно-коричневого цвета с выпадением осадка в виде хлопьев, что снижало органолептические свойства и указывало на окисление железа.
При рН среды 3,5 и 5,5 наблюдалось одинаковое связывание железа без визуальных изменений растворов. Однако, учитывая значения рН максимальной устойчивости комплексов и большинства пищевых систем, выбрано значение 5,5±0,2.
Оптимальная температура процессов связывания йода и железа соединительнотканными белками выбрана 0-4 °С, так как при положительных температурах возможно микробное обсеменение исследуемых растворов.
Известно, что химические процессы протекают во времени. Для установления максимальной степени связывания в растворы гидролизатов эластина и коллагена вносили разные концентрации солей железа и йода и контролировали содержание микроэлементов через каждые 2 часа. Концентрации микроэлементов были подобраны исходя из суточной потребности организма человека в них [3]. Экспериментально установлено, что максимальное взаимодействие железа с гидролизатами наблюдалось по истечении 24 часов, в случае йода – 20 часов.
Для выяснения взаимодействия катиона железа с пептидами эластина и коллагена проведены исследования с использованием методов ИК и ЯМР-спектроскопии.
Для более полной информации о взаимодействии между соедительнотканными белками и железом исследовали ядерно-магнитно-резонансные (ЯМР) спектры опытных образцов.
Анализ спектров показал, что в гидролизатах содержится большее количество СОО- групп (области 160-180 м.д., наличие большего количества пиков), в отличие от той же области в гидролизатах с железом. В области 50-65 м.д., которая отвечает за >СН-N
Кальций и биосинтез коллагена: систематический анализ молекулярных механизмов воздействия
Известно, что повышение уровней внеклеточного кальция стимулирует синтез/секрецию коллагена. В настоящей работе представлены результаты системно-биологического анализа кальций-зависимых белков протеома человека. Проведенный анализ указывает на перспективн
The increase of extra-cellular calcium level is known to stimulate collagen synthesis/secretion. This paper introduces results of systematic and biological analysis of calcium-dependent proteins of human proteome. This analysis indicates promising ways of increase in efficiency of calcium preparations for nutritional support of osseous metabolism.
Достаточный уровень биосинтеза коллагена является одним из важнейших показателей нормофизиологического метаболизма соединительной ткани. Фундаментальные и клинические исследования показали, что уровни кальция во внеклеточной среде стимулируют синтез/секрецию коллагена клетками внеклеточного матрикса соединительной ткани.
В эксперименте недостаточное потребление кальция негативно сказывается на состоянии биосинтеза коллагена в костной ткани [1]. Известно, в частности, что так называемые «блокаторы кальциевых каналов» ингибируют синтез коллагена I типа и его секрецию фибробластами, а аскорбат-анион противодействует эффектам блокаторов кальция [2] (рис. 1). Исследования с использованием изотопных меток показали, что блокаторы кальциевых каналов снижают преимущественно биосинтез коллагена, а не биосинтез неколлагеновых белков соединительной ткани [3].
Показано также, что использование препаратов кальция стимулирует синтез коллагена, ускоряя заживление ран и переломов. Например, альгинат кальция улучшает заживление ран в эксперименте, повышая синтез коллагена I типа и соотношение количеств фибриллярного коллагена I типа и ретикулярного коллагена III типа. Скорость закрытия раны при использовании альгината увеличивалась по сравнению с контрольной группой [4].
В проведенном нами экспериментальном исследовании были изучены эффекты синергидной комбинации кальция с цинком, медью, марганцем, бором, магнием и витамином D (препарат Кальцемин Адванс) на модели резаной раны. Введение препарата в виде водной суспензии в течение 21 сут приводило к снижению среднего времени до полного заживления раны на 6 сут по сравнению с контролем (вода, p 2+ [11]. Рассмотрим и другие потенциальные возможности участия препаратов кальция в процессе биосинтеза коллагена, основные стадии которого представлены на рис. 5.
Осуществляемый фибробластами или другими типами клеток соединительной ткани биосинтез коллагена включает в себя следующие стадии [12]:
Системно-биологический анализ Са-зависимых белков, которые могут воздействовать на биосинтез коллагена
Для установления Са-зависимых белков протеома, которые могут воздействовать на синтез коллагена, был проведен поиск с использованием перечисленных в табл. 2 биологических ролей. В результате был получен список из 15 белков (табл. 3).
Для оценки вклада каждого из анализируемых 15 белков во взаимосвязь между уровнями кальция и коллагена была разработана балльная шкала оценки релевантности биологических функций белков, содержащая следующие пункты:
В табл. 3 приведены результаты оценки релевантности различных Са-зависимых белков по отношению к воздействию ионов Са 2+ на биосинтез коллагена. Очевидно, что наиболее интересными «таргетными белками» являются Са-чувствительный рецептор (CASR) и костный морфогенетический белок 4 (BMP4). Далее представлен более подробный анализ перечисленных в табл. 3 белков.
Са-чувствительный рецептор CASR
.gif)
В паращитовидной железе CASR «измеряет» концентрации ионов Са 2+ в плазме крови и активирует внутриклеточные сигнальные пути, регулирующие секрецию ПТГ или фильтрацию катионов в почках. В остеоцитах CASR детектирует уровни внеклеточного кальция и активирует остеогенез. Высокие внеклеточные уровни ионов Ca 2+ (порядка 10 мМ) стимулируют экспрессию остеогенных маркеров, включая щелочную фосфатазу, костный сиалопротеин, коллаген, остеокальцин IA1, и увеличивают минерализацию кости. Кроме того, блокада рецептора CASR ингибирует клеточный ответ остеоцитов на изменения внеклеточной концентрации Ca2+ [17].
Также CASR является физиологическим регулятором роста, дифференцировки и выживания остеобластов и остеокластов [19]. Экспрессия рецептора CASR в хрящевой и костной ткани непосредственно регулирует скелетный гомеостаз и метаболизм соединительной ткани. Рецептор CASR вносит важный вклад в рост хрящевой пластинки, в т. ч. в процессы роста и дифференцировки остеобластов и остеокластов [20] (рис. 7).
На рис. 7 можно видеть, что остеобластогенез протекает посредством дифференциации мезенхимальных клеток-предшественников остеобластов, которые делятся и дифференцируются в преостеобласты, которые, в свою очередь, созревают в остеобласты. Зрелые остеобласты секретируют неминерализованный костный матрикс (остеоид), который минерализуется с образованием кости, в которой зрелые остеобласты становятся остеоцитами. Во время стимуляции остеобластов экспрессия активной R-формы рецептора CASR увеличивается в остеобластах, а экспрессия неактивной O-формы рецептора снижается, что повышает соотношение R:O и способствует остеокластогенезу. У молодых животных стимулируемый ионами кальция Са 2+ рецептор CASR индуцирует апоптоз зрелых остеокластов и предотвращает резорбцию кости, что ведет к интенсивному росту костной ткани.
В эксперименте было показано, что активируемый ионами Ca 2+ рецептор стимулирует деление фибробластов и секрецию матриксных металлопротеиназ ММР-3, ММР-9 [21]. Повышение уровней внеклеточного кальция in vitro дозозависимо стимулирует деление фибробластов (рис. 8, контроль — 10 5 клеток, кальций — 2,2 × 10 5 клеток, p 2+ является наиболее убедительным механизмом коллаген-продуцирующего действия кальциевых препаратов.
Костный морфогенетический белок 4
Костный морфогенетический белок 4 индуцирует образование хряща и кости, участвует в развитии зубов, формировании конечностей и заживлении переломов. Интересно, что механическая нагрузка на кость способствует синтезу внеклеточного матрикса остеобластами на фоне увеличения уровней белков BMP-2/4 [22].
Повышение уровня внеклеточного кальция стимулирует увеличение числа остеобластов и ингибирует образование остеокластов, в частности, посредством воздействия на уровни экспрессии костных морфогенетических белков. Например, добавление 0,1–0,4 мМ CaCl2 к клеткам в культуре достоверно увеличивало уровни мРНК BMP-2 и BMP-4, количество синтезируемого коллагена I типа, оцененного по уровням карбокси-концевого пептида проколлагена I [23]. Повышенные уровни Ca 2+ увеличивают экспрессию генов белков морфогенеза костей (в частности, BMP-2) [24].
Взаимосвязи между активностью рецептора CASR и экспрессией морфогенетических белков остаются недостаточно изученными. С одной стороны, считается, что регулируемая секреция BMP-2 происходит в ответ на активацию рецептора CASR [25].
О других Са-зависимых белках и их воздействии на метаболизм коллагена
К другим Са-зависимым белкам, так или иначе влияющим на метаболизм коллагена, относятся матриксные металлопротеиназы (ММП) и некоторые ростовые факторы (табл. 3). Матриксные металлопротеиназы осуществляют протеолиз тройных спиралей коллагенов различных типов и играют роль в процессе заживления ран, ремоделировании соединительной ткани, деградации хряща, развитии и минерализации кости и заживлении переломов костей [26]. В структурах ММП содержатся Са-связывающие сайты, так что достаточные уровни кальция необходимы для деградации коллагена посредством ММП. Таким образом, ММП не могут непосредственно усиливать процессы биосинтеза коллагена.
Преобразующий фактор роста бета-1 (TGF-бета1) контролирует деление и дифференцировку многих типов клеток, в т. ч. фибробластов и остеобластов. TGF-бета1 стимулирует приток ионов Са 2+ в цитоплазму клетки [27] и непосредственно стимулирует синтез коллагена в остеобластах (р = 0,001), что имеет важное значение для образования костной ткани. На остеобластах в культуре одновременное добавление к среде Ca(OH)2 и TGF-бета1 значительно увеличило синтез белка вообще и синтез коллагена в частности (р = 0,048) [28].
Фактор роста соединительной ткани (CTGF) способствует делению и дифференцировке хондроцитов, обеспечивает клеточную адгезию фибробластов, осуществляет положительное регулирование процесса биосинтеза коллагена [31] посредством сигнальных путей Rac1/MLK3/JNK/AP-1 [32]. В частности, CTGF связывается с рецептором-2 факторов роста фибробластов (FGFR2) и стимулирует Са-зависимую внутриклеточную передачу сигнала [33].
Заключение
Улучшение биосинтеза коллагена — необходимое условие для восстановления структуры кости при срастании переломов, регенерации кости при постменопаузальном, лекарственном остеопорозе, а также при других нарушениях целостности кости. Нормализация биосинтеза коллагена способствует лучшему удержанию кальция в костной ткани и, следовательно, повышению минеральной плотности кости. Миллионам женщин старше сорока лет грозит перелом из-за хрупкости костей вследствие вымывания кальция. Каждые 5 минут в России происходит перелом кости. В особой группе риска 34 миллиона женщин России старше 40 лет, и 24 миллиона не знают об этом. Основная причина хрупкости костей — вымывание кальция и утрата коллагена. В отличие от других препаратов, Кальцемин Адванс содержит кальций и минералы, формирующие коллагеновую сетку, что удерживает кальций в костях. Она препятствует вымыванию кальция и сохраняет прочность костной ткани.
Системно-биологический анализ кальций-зависимых белков протеома человека показал, что ионы кальция стимулируют биосинтез коллагена посредством действия ионов кальция на Са-чувствительный рецептор CASR и костный морфогенетический белок BMP4.
Литература
* ГБОУ ВПО ИвГМА МЗ РФ, Иваново
** РСЦ Института микроэлементов ЮНЕСКО при РНИМУ им. Н. И. Пирогова, Москва
*** Клиника RHANA, Москва


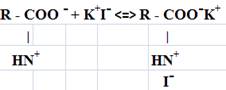
.gif)
.gif)
.gif)
.gif)