к какой группе электродов относится хлорсеребряный электрод
К какой группе электродов относится хлорсеребряный электрод
ФИЗИЧЕСКАЯ И КОЛЛОИДНАЯ ХИМИЯ
Конспект лекций для студентов биофака ЮФУ (РГУ)
3.5 ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
3.5.4 Классификация электродов
По типу электродной реакции все электроды можно разделить на две группы (в отдельную группу выделяются окислительно-восстановительные электроды, которые будут рассмотрены особо в разделе 3.5.5).
Электроды первого рода
К электродам первого рода относятся электроды, состоящие из металлической пластинки, погруженной в раствор соли того же металла. При обратимой работе элемента, в который включен электрод, на металлической пластинке идет процесс перехода катионов из металла в раствор либо из раствора в металл. Т.о., электроды первого рода обратимы по катиону и их потенциал связан уравнением Нернста (III.40) с концентрацией катиона (к электродам первого рода относят также и водородный электрод).
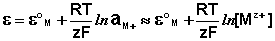
Электроды второго рода
Электродами второго рода являются электроды, в которых металл покрыт малорастворимой солью этого металла и находится в растворе, содержащем другую растворимую соль с тем же анионом. Электроды этого типа обратимы относительно аниона и зависимость их электродного потенциала от температуры и концентрации аниона может быть записана в следующем виде:
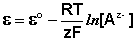
Водородный электрод представляет собой платиновую пластинку, омываемую газообразным водородом, погруженную в раствор, содержащий ионы водорода. Адсорбируемый платиной водород находится в равновесии с газообразным водородом; схематически электрод изображают следующим образом:
Электрохимическое равновесие на электроде можно рассматривать в следующем виде:
Потенциал водородного электрода зависит от активности ионов Н + в растворе и давления водорода; потенциал стандартного водородного электрода (с активностью ионов Н + 1 моль/л и давлением водорода 101.3 кПа) принят равным нулю. Поэтому для электродного потенциала нестандартного водородного электрода можно записать:
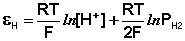
Каломельный электрод обратим относительно анионов хлора и уравнение Нернста для него имеет вид:
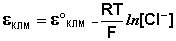
Величина потенциала хлорсеребряного электрода зависит от активности ионов хлора; данная зависимость имеет следующий вид:
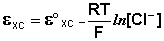
Чаще всего в качестве электрода сравнения используется насыщенный хлорсеребряный электрод, потенциал которого зависит только от температуры. В отличие от каломельного, он устойчив при повышенных температурах и применим как в водных, так и во многих неводных средах.
Электроды, обратимые относительно иона водорода, используются на практике для определения активности этих ионов в растворе (и, следовательно, рН раствора) потенциометрическим методом, основанном на определении потенциала электрода в растворе с неизвестным рН и последующим расчетом рН по уравнению Нернста. В качестве индикаторного электрода может использоваться и водородный электрод, однако работа с ним неудобна и на практике чаще применяются хингидронный и стеклянный электроды.
Хингидронный электрод является т.н. окислительно-восстановительным электродом (см. разд. 3.5.5); зависимость его потенциала от активности ионов водорода имеет следующий вид:
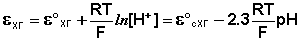
Принцип действия мембранного электрода заключается в следующем. Мембрана, селективная по отношению к некоторому иону (т.е. способная обмениваться этим ионом с раствором), разделяет два раствора с различной активностью этого иона. Разность потенциалов, устанавливающаяся между двумя сторонами мембраны, измеряется с помощью двух электродов. При соответствующем составе и строении мембраны её потенциал зависит только от активности иона, по отношению к которому мембрана селективна, по обе стороны мембраны.
Наиболее часто употребляется стеклянный электрод в виде трубки, оканчивающейся тонкостенным стеклянным шариком. Шарик заполняется раствором НСl с определенной активностью ионов водорода; в раствор погружен вспомогательный электрод (обычно хлорсеребряный). Потенциал стеклянного электрода с водородной функцией (т.е. обратимого по отношению к иону Н + ) выражается уравнением
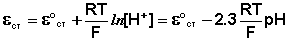
Необходимо отметить, что стандартный потенциал ε °ст для каждого электрода имеет свою величину, которая со временем изменяется; поэтому стеклянный электрод перед каждым измерением рН калибруется по стандартным буферным растворам с точно известным рН.
3.5.5 Окислительно-восстановительные электроды
Зависимость потенциала редокс-электрода ε RO от концентрации (активности) окисленной [Ox] и восстановленной форм [Red] для окислительно-восстановительной реакции, в которой не участвуют никакие другие частицы, кроме окислителя и восстановителя, имеет следующий вид (здесь n – число электронов, участвующих в элементарном акте окислительно-восстановительной реакции):
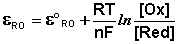
Из данного выражения следует уравнение для потенциала металлического электрода (III.40), т.к. активность атомов металла (восстановленной формы) в материале электрода равна единице.
В случае более сложных систем в выражении для окислительно-восстановительного потенциала фигурируют концентрации всех участвующих в реакции соединений, т.е. под окисленной формой следует понимать все соединения в левой части уравнения реакции
а под восстановленной – все соединения в правой части уравнения. Так, для окислительно-восстановительных реакций, протекающих с участием ионов водорода
уравнение Нернста будет записываться следующим образом:
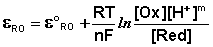
Знание величин электродных потенциалов позволяет определить возможность и направление самопроизвольного протекания любой окислительно-восстановительной реакции при одновременном наличии в растворе двух или более окислительно-восстановительных пар. Восстановленная форма любого элемента или иона будет восстанавливать окисленную форму другого элемента или иона, имеющего более положительный электродный потенциал.
Соответствующие полуреакции можно представить следующим образом:
или можно записать вместе:
который можно упростить:
Эта реакция характеризуется быстрой кинетикой электрода, что означает, что через электрод можно пропускать достаточно большой ток со 100% эффективностью окислительно-восстановительной реакции ( растворение металла или катодное осаждение ионов серебра). Было доказано, что реакция подчиняется этим уравнениям в растворах со значениями pH от 0 до 13,5.
Уравнение Нернста ниже показывает зависимость потенциала хлоридно-серебряного (I) электрода от активности или эффективной концентрации хлорид-ионов:
Стандартный электродный потенциал E 0 относительно стандартного водородного электрода (SHE) составляет 0,230 В ± 10 мВ. Однако потенциал очень чувствителен к следам ионов бромида, которые делают его более отрицательным. (Более точный стандартный потенциал, указанный в обзорной статье IUPAC, составляет +0,22249 В со стандартным отклонением 0,13 мВ при 25 ° C.)
СОДЕРЖАНИЕ
Приложения
Промышленные электроды сравнения состоят из корпуса электрода из пластмассовой трубки. Электрод представляет собой серебряную проволоку, покрытую тонким слоем хлорида серебра, физически путем погружения проволоки в расплавленный хлорид серебра, химически путем гальваники проволоки в концентрированной соляной кислоте или электрохимически путем окисления серебра в растворе хлорида.
Корпус электрода содержит хлорид калия для стабилизации концентрации хлорида серебра. При работе в морской воде это тело можно удалить, а концентрация хлоридов зафиксирована стабильной соленостью воды. Потенциал хлорсеребряного электрода сравнения по отношению к стандартному водородному электроду зависит от состава электролита.
| Электрод | Потенциал E 0 + E lj | Коэф. Температуры. |
|---|---|---|
| ( V ) при 25 ° C | (мВ / ° C) примерно при 25 ° C | |
| ОНА | 0,000 | 0,000 |
| Ag / AgCl / Нас. KCl | +0,197 | -1.01 |
| Ag / AgCl / 3,5 моль / кг KCl | +0,205 | -0,73 |
| Ag / AgCl / 3,0 моль / кг KCl | +0,210 | ? |
| Ag / AgCl / 1,0 моль / кг KCl | +0,235 | +0,25 |
| Ag / AgCl / 0,6 моль / кг KCl | +0,25 | |
| Ag / AgCl (морская вода) | +0,266 |
Электрод имеет множество характеристик, делающих его пригодным для использования в полевых условиях:
Биологические электродные системы
Принцип работы датчиков серебра / хлорида серебра заключается в преобразовании ионного тока на поверхности тканей человека в электронный ток, который подается через подводящий провод к прибору для считывания. Важной частью операции является гель- электролит, который наносится между электродом и тканями. Гель содержит свободные ионы хлорида, так что заряд может переноситься через электролит, поэтому электролит можно рассматривать как проводящий ионный ток, как и ткани человека. Когда существует ионный ток, атомы серебра в электроде окисляются и разряжают катионы в электролит, а электроны переносят заряд через подводящий провод. В то же время ионы хлора, которые являются анионами в электролите, перемещаются к электроду, и они восстанавливаются, поскольку они связываются с серебром электрода, в результате чего хлорид серебра и свободные электроны доставляются к подводящему проводу. Реакция позволяет току проходить от электролита к электроду, а ток электронов проходит через подводящий провод для считывания прибором.
Применение при повышенной температуре
При надлежащей конструкции хлорсеребряный электрод можно использовать при температуре до 300 ° C. Стандартный потенциал (т.е. потенциал, когда активность хлорида составляет 1 моль / кг) хлорсеребряного электрода является функцией температуры следующим образом:
| Температура | Потенциал E 0 |
|---|---|
| ° C | V против SHE при той же температуре |
| 25 | 0,22233 |
| 60 | 0,1968 |
| 125 | 0,1330 |
| 150 | 0,1032 |
| 175 | 0,0708 |
| 200 | 0,0348 |
| 225 | -0,0051 |
| 250 | -0,054 |
| 275 | -0,090 |
Тот же источник также дает соответствие высокотемпературному потенциалу между 25 и 275 ° C, который воспроизводит данные в таблице выше:
Смотрите также
Для использования в почве они обычно производятся с насыщенным электролитом хлористого калия, но могут использоваться и с более низкими концентрациями, такими как 1 М хлорид калия. В морскую воду или хлорированную питьевую воду они обычно погружаются напрямую без отдельного электролита. Как отмечалось выше, изменение концентрации электролита изменяет потенциал электрода. Хлорид серебра плохо растворяется в крепких растворах хлорида калия, поэтому иногда рекомендуется насыщать хлорид калия хлоридом серебра.
К какой группе электродов относится хлорсеребряный электрод
ГОСУДАРСТВЕННЫЙ СТАНДАРТ СОЮЗА ССР
ЭЛЕКТРОД СРАВНЕНИЯ ХЛОРСЕРЕБРЯНЫЙ НАСЫЩЕННЫЙ ОБРАЗЦОВЫЙ 2-го РАЗРЯДА
Standarde reference silver-silver cloride saturate electrode of second class
Дата введения 1973-07-01
Постановлением Государственного комитета стандартов Совета Министров СССР от 15 июня 1972 г. N 1201 срок введения установлен с 01.07.1973 г.
ПЕРЕИЗДАНИЕ (март 1978 г.) с изменением N 1, опубликованным в апреле 1975 г.
Настоящий стандарт распространяется на образцовый электрод сравнения хлорсеребряный насыщенный 2-го разряда (в дальнейшем образцовый электрод), предназначенный для поверки промышленных и лабораторных электродов, используемых при потенциометрических измерениях.
1. ОСНОВНЫЕ ПАРАМЕТРЫ И РАЗМЕРЫ
1.1. Образцовым электродом является насыщенный хлорсеребряный электрод с потенциалообразующей системой:
1.3. Температурный коэффициент потенциала образцового электрода не превышает минус 0,2 мВ/°C в диапазоне температур, указанных в п.1.2.
2. ТЕХНИЧЕСКИЕ ТРЕБОВАНИЯ
2.1. Образцовый электрод должен изготовляться в соответствии с требованиями настоящего стандарта по технической документации, утвержденной в установленном порядке.
2.2. Потенциал образцового электрода относительно нормального водородного электрода при 20 °С должен находиться в пределах от 199,5 до 204,5 мВ.
2.3. Электрическое сопротивление образцового электрода не должно превышать 10 Ом при температуре 20±5 °С.
2.4. Вероятность безотказной работы образцовых электродов за 2000 ч при доверительной вероятности 0,8 должна быть не менее 0,94.
2.5. Электроды должны быть снабжены паспортом и инструкцией по эксплуатации по ГОСТ 2.601-68*.
3. ПРАВИЛА ПРИЕМКИ
3.1. Образцовые электроды должны подвергаться государственным, приемо-сдаточным, периодическим испытаниям и испытаниям на надежность.
3.2. При приемо-сдаточных испытаниях, проводимых предприятием-изготовителем, проверяют соответствие каждого образцового электрода требованиям пп.2.1-2.3 и 2.5.
3.3. При периодических испытаниях, проводимых один раз в год, проверяют не менее 20 шт. образцовых электродов на соответствие требованиям пп.1.5, 2.1-2.3 и 2.5.
Если при периодических испытаниях обнаружено несоответствие хотя бы по одному показателю, проводят повторную проверку удвоенного количества образцовых электродов, взятых от той же партии. Результаты повторной проверки считают окончательными.
Партией считается количество изделий одновременно предъявляемых на аттестацию, но не менее 50 шт.
3.4. Образцовые электроды, прошедшие приемо-сдаточные испытания, подлежат первичной поверке по ГОСТ 8.149-75.
4. МЕТОДЫ ИСПЫТАНИЙ
4.1. Проверку образцовых электродов на соответствие требованиям пп.1.5, 2.1 и 2.5 проводят внешним осмотром и сличением с технической документацией, утвержденной в установленном порядке.
4.2. Потенциал образцового электрода (п.2.2) проверяют измерением в насыщенном растворе хлористого калия при температуре 20±5 °С по отношению к аттестованному образцовому электроду сравнения 2-го разряда. Измерения проводят компенсатором напряжения класса 0,1 с пределом измерения не менее 10 мВ. Индикатор нуля применяют с входным сопротивлением не ниже 10 Ом и чувствительностью не хуже 0,1 мВ.
Температуру раствора, в который погружают электроды, поддерживают с точностью ±0,5 °С.

— потенциал испытуемого образцового электрода относительно аттестованного образцового электрода, мВ.
4.3. Электрическое сопротивление образцового электрода (п.2.3) проверяют по ГОСТ 8.149-75.
4.4. Проверку вероятности безотказной работы (п.2.4) образцовых электродов проводят на основании данных по первичным поверкам, проведенным в течение одного года. Допустимое число отказов определяют по ГОСТ 13216-74. Отказом считают несоответствие электрода требованиям пп.1.3, 1.4, 2.2 настоящего стандарта.
5. УПАКОВКА, МАРКИРОВКА, ТРАНСПОРТИРОВАНИЕ И ХРАНЕНИЕ
5.1. На образцовом электроде должны быть указаны:
обозначение настоящего стандарта.
5.2. Образцовые электроды должны быть упакованы в соответствии с технической документацией, утвержденной в установленном порядке.
На упаковке должны быть указаны:
наименование или товарный знак предприятия-изготовителя;
год и месяц выпуска;
обозначение настоящего стандарта;
5.3. Коробки с электродами должны быть упакованы и маркированы в соответствии с технической документацией, утвержденной в установленном порядке.
5.4. Транспортирование электродов производят любым закрытым транспортом при температуре не ниже 0 °С.
5.5. Упакованные электроды должны храниться в помещении при условиях группы Л по ГОСТ 15150-69.
Воздух помещения не должен содержать агрессивных примесей, вызывающих коррозию.
6. ГАРАНТИИ ИЗГОТОВИТЕЛЯ
6.1. Изготовитель должен гарантировать соответствие образцовых электродов требованиям настоящего стандарта при условии соблюдения потребителем правил эксплуатации, транспортирования и хранения.
Гарантийный срок устанавливается 12 мес со дня ввода в эксплуатацию, но не более 24 мес со дня отгрузки с предприятия-изготовителя.
Хлоридсеребряный электрод
Из Википедии — свободной энциклопедии
Хлоридсере́бряный электро́д (ХСЭ) благодаря стабильности потенциала и простоте конструкции является одним из наиболее часто употребляемых в лабораторной практике электродов сравнения.
Представляет собой серебряную пластинку или проволоку, покрытую слоем малорастворимого хлорида серебра, контактирующую с раствором содержащим хлорид ионы (чаще всего раствором хлорида калия).
Схематически записывается как: Ag(тв.), AgCl(тв.) | КCl (водн.) ┊ исследуемый раствор.
Это электрод второго рода, потенциал которого определяется концентрацией аниона хлорида в равновесии:
В области температур 0-95 °С стандартный потенциал хлорсеребряного электрода описывается уравнением:
Еo ХСЭ = 0,23655 — 4,8564 × 10 −4 t — 3,4205 × 10 −6 t 2 + 5,869 × 10 −9 t 3
Воспроизводимость значений потенциалов ± 0,2 мВ; при низких температурах (15 °С) может быть достигнута воспроизводимость ± 0,05 мВ.
Значения стандартных потенциалов хлорсеребряного электрода при различных температурах:





