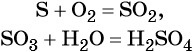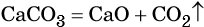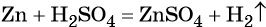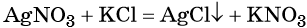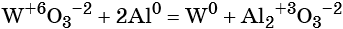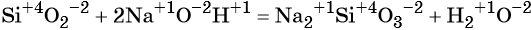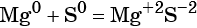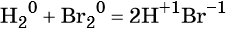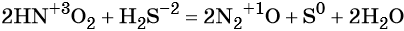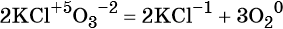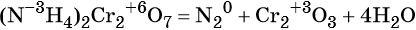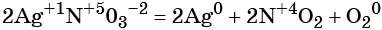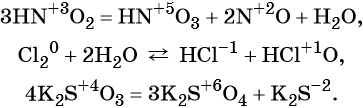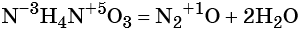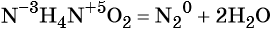к какому типу реакции относятся следующие реакции
Классификация реакций
Существует несколько классификаций реакций, протекающих в неорганической и органической химии.
По характеру процесса
Так называют химические реакции, где из нескольких простых или сложных веществ получается одно сложное вещество. Примеры:
В результате реакции разложения сложное вещество распадается на несколько сложных или простых веществ. Примеры:
В ходе реакций замещения атом или группа атомов в молекуле замещаются на другой атом или группу атомов. Примеры:
К реакциям обмена относятся те, которые протекают без изменения степеней окисления и выражаются в обмене компонентов между веществами. Часто обмен происходит анионами/катионами:
AgF + NaCl = AgCl↓ + NaF
Окислительно-восстановительные реакции (ОВР)
Замечу, что окислителем и восстановителем могут являться только исходные вещества (а не продукты!) Окислитель всегда понижает свою СО, принимая электроны в процессе восстановления. Восстановитель всегда повышает свою СО, отдавая электроны в процессе окисления.
ОВР уравнивают методом электронного баланса, с которым мы подробно познакомимся в разделе «Решения задач».
Обратимые и необратимые реакции
Классическим примером обратимой реакции является синтез аммиака и реакция этерификации (из органической химии):
Необратимые реакции протекают только в одном направлении, до полного расходования одного из исходных веществ. Главное отличие их от обратимых реакций в том, что образовавшиеся продукты реакции не взаимодействуют между собой с образованием исходных веществ.
Примеры необратимых реакций:
NaOH + HCl = NaCl + H2O (образуется вода)
2Na + 2H2O = 2NaOH + H2 (сопровождается выделением большого количества тепла)
Реакции и агрегатное состояние фаз
Фазой в химии называют часть объема равновесной системы, однородную во всех своих точках по химическому составу и физическим свойствам и отделенную от других частей того же объема поверхностью раздела. Фаза бывает жидкой, твердой и газообразной.
К гетерогенным реакциям относятся следующие реакции (примеры): жидкость + газ, газ + твердое вещество, твердое вещество + жидкость. Примером такой реакции может послужить взаимодействие твердого цинка и раствора соляной кислоты:
К гомогенным реакциям относятся (примеры): жидкость + жидкость, газ + газ. Примером такой реакции может служить взаимодействие между растворами уксусной кислоты и едкого натра.
Реакции и их тепловой эффект
NaOH + HCl = NaCl + H2O + 56 кДж
К экзотермическим реакциям часто относятся реакции горения, соединения.
Исключением является взаимодействие азота и кислорода, при котором тепло поглощается:
Как уже было отмечено выше, если тепло выделяется во внешнюю среду, значит, система реагирующих веществ потеряло это тепло. Поэтому не должно казаться противоречием, что внутренняя энергия веществ в результате экзотермической реакции уменьшается.
Энтальпией называют (обозначение Н), количество термодинамической (тепловой) энергии, содержащееся в веществе. Иногда с целью «запутывания» в реакции вместо явного +Q при экзотермической реакции могут написать ΔH 0, так как внутренняя энергия веществ увеличивается. Например:
CaCO3 = CaO + CO2↑ ; ΔH > 0 (значит реакция эндотермическая, так как внутренняя энергия увеличивается)
Замечу, что не все реакции разложения являются эндотермическими. Широко известная реакция разложения дихромата аммония («вулканчик») является примером экзотермического разложения, при котором тепло выделяется.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
К какому типу реакции относятся следующие реакции
Классификацию органических реакций проводят на основе общих для всех реакций признаков: строение и состав исходных и конечных продуктов; изменение степеней окисления реагирующих частиц; тепловой эффект реакции; ее обратимость и т.п.
Наиболее часто органические реакции классифицируют по следующим признакам:
· по конечному результату реакции (на основе сопоставления строения исходных и конечных продуктов);
· по минимальному числу частиц, участвующих в элементарной реакции;
· по механизму разрыва ковалентных связей в реагирующих молекулах.
Тип многостадийных реакций определяют по самой медленной (лимитирующей) стадии. Различные способы классификации часто сочетаются друг с другом.
1. Классификация реакций по конечному результату
В основе этой классификации лежит сопоставление числа, состава и строения исходных и конечных продуктов по уравнению реакции. В соответствии с конечным результатом различают следующие типы органических реакций:
Если процесс сопровождается изменением степени окисления атома углерода в органическом соединении, то выделяют также реакции окисления и восстановления. Окисление и восстановление органических веществ может проходить по какому-либо из названных выше типов реакций.
Атом или атомная группировка в молекуле органического соединения замещается на другой атом (или атомную группировку):
Реакции этого типа можно рассматривать как реакции обмена, но в органической химии предпочтительней термин «замещение», поскольку в обмене участвует (замещается) лишь меньшая часть органической молекулы.
C2H6 + Cl2 (на свету) → CH 3 CH 2 Cl + HCl хлорирование этана
CH 3 CH 2 Cl + KOH (водн. р-р) → CH 3 CH 2 OH + KCl щелочной гидролиз хлорэтана
В реакциях присоединения молекула органического соединения и молекула простого или сложного вещества соединяются в новую молекулу, при этом другие продукты реакции не образуются:
К реакциям присоединения относятся также реакции полимеризации:
В реакции отщепления (элиминирования) происходит отрыв атомов или атомных групп от молекулы исходного вещества при сохранении ее углеродного скелета.
· отщепление хлороводорода (при действии на хлоралкан спиртовым раствором щёлочи)
· отщепление воды (при нагревании спирта с серной кислотой)
CH3-CH2OH → CH 2 =CH 2 + H 2 O дегидратация этанола
· отщепление водорода от алкана (в присутствии катализатора)
Реакции изомеризации или перегруппировки
В органическом соединении происходит переход (миграция) отдельных атомов или групп атомов от одного участка молекулы к другому без изменения ее качественного и количественного состава:
В этом случае исходное вещество и продукт реакции являются изомерами (структурными или пространственными).
Например, в результате перегруппировки может изменяться углеродный скелет молекулы:
В результате реакции разложения из молекулы сложного органического вещества образуется несколько менее сложных или простых веществ:
К этому типу реакций относится процесс крекинга – расщепление углеродного скелета крупных молекул при нагревании и в присутствии катализаторов:
Реакции разложения при высокой температуре называют пиролизом, например:
СН4 → C + 2H2 пиролиз метана (1000 o C)
Реакции окисления и восстановления
Если атом углерода в органической молекуле окисляется (отдает электроны более электроотрицательному атому), то этот процесс относят к реакциям окисления, т.к. продукт восстановления окислителя (обычно неорганическое вещество) не является конечной целью данной реакции. И наоборот, реакцией восстановления считают процесс восстановления атома углерода в органическом веществе.
Часто в органической химии ограничиваются рассмотрением реакций окисления и восстановления как реакций, связанных с потерей и приобретением атомов водорода и кислорода.
Вещество окисляется, если оно теряет атомы H и (или) приобретает атомы O. Кислородсодержащий окислитель обозначают символом [O]:
Вещество восстанавливается, если оно приобретает атомы H и (или) теряет атомы O. Восстановитель обозначают символом [H]:
Классификация реакций по числу частиц, участвующих в элементарной стадии
По этому признаку все реакции можно разделить на диссоциативные (мономолекулярные) и ассоциативные (бимолекулярные, тримолекулярные).
· Мономолекулярные реакции – реакции, в которых участвует только одна молекула (частица):
К этому типу относятся реакции распада и изомеризации. Процессы электролитической диссоциации также соответствуют этому типу, например:
Это самый распространенный тип элементарных реакций.
· Тримолекулярные реакции – реакции типа
в которых происходит столкновение трех молекул.
Тримолекулярные реакции встречаются довольно редко. Одновременное соударение большего числа частиц маловероятно.
Классификация реакций по механизму разрыва связей
В зависимости от способа разрыва ковалентной связи в реагирующей молекуле органические реакции подразделяются нарадикальные и ионные реакции. Ионные реакции в свою очередь делятся по характеру реагента, действующего на молекулу, наэлектрофильные и нуклеофильные.
Разрыв ковалентной связи может происходить двумя способами, обратными механизмам ее образования.
Разрыв связи, при котором каждый атом получает по одному электрону из общей пары, называется гомолитическим:
В результате гомолитического разрыва образуются сходные по электронному строению частицы, каждая из которых имеет неспаренный электрон. Такие частицы называются свободными радикалами.
Если при разрыве связи общая электронная пара остается у одного атома, то такой разрыв называется гетеролитическим:
Электрофильной называется реакция, в которой молекула органического вещества подвергается действию электрофильного реагента.
Электрофильные («любящие электроны») реагенты или электрофилы – это частицы (катионы или молекулы), имеющие свободную орбиталь на внешнем электронном уровне.
CH2=CH2 + HCl → CH3CH2Cl (электрофил – H + в составе HCl)
Механизм электрофильного присоединения обозначается символом AdE (по первым буквам английских терминов: Ad – addition [присоединение], E – electrophile [электрофил]).
Катион NO2 + образуется в смеси конц. кислот HNO3 и H2SO4.
Обозначение механизма – SE (S – substitution [замещение]).
Нуклеофильной называется реакция, в которой молекула органического вещества подвергается действию нуклеофильного реагента.
Строение некоторых нуклеофильных реагентов
Благодаря подвижности π-электронов, нуклеофильными свойствами обладают также молекулы, содержащие π-связи:
(Между прочим, это объясняет, почему этилен CH2=CH2 и бензол C6H6, имея неполярные углерод-углеродные связи, вступают в ионные реакции с электрофильными реагентами).
Примеры нуклеофильных реакций
Механизм нуклеофильного замещения обозначается символом SN (по первым буквам английских терминов: S – substitution [замещение], N – nucleophile [нуклеофил]).
Обозначение механизма – AdN (Ad – addition [присоединение]).
Классификация химических реакций по различным признакам: числу и составу исходных и полученных веществ, изменению степеней окисления химических элементов, поглощению и выделению энергии
Классификацию химических реакций в неорганической и органической химии осуществляют на основании различных классифицирующих признаков.
По числу и составу исходных и полученных веществ различают реакции соединения, разложения, обмена и замещения.
Реакциями соединения называют химические реакции, в результате которых сложные молекулы получаются из двух и более простых, например:
Реакциями разложения называют химические реакции, в результате которых простые молекулы получаются из более сложных, например:
Реакциями замещения называют химические реакции, в результате которых атом или группа атомов в молекуле вещества замещается на другой атом или группу атомов, например:
Реакциями обмена называют химические реакции, протекающие без изменения степеней окисления элементов и приводящие к обмену составных частей реагентов, например:
По изменению степеней окисления химических элементов, входящих в состав реагирующих веществ, реакции делят на окислительно-восстановительные и не окислительно-восстановительные.
Окислительно-восстановительными называют реакции, сопровождающиеся изменением степеней окисления химических элементов, входящих в состав реагентов:
Не окислительно-восстановительными называют реакции, в которых степень окисления химических элементов, входящих в состав реагентов, не изменяется.
Окислительно-восстановительные реакции разделяют на следующие основные типы: реакции межмолекулярного окисления-восстановления, реакции внутримолекулярного окисления-восстановления, реакции диспропорционирования и реакции конмутации.
Реакциями межмолекулярного окисления-восстановления называют реакции, в которых обмен электронами происходит между различными атомами, молекулами или ионами, например:
(сера — окислитель, магний — восстановитель).
(бром — окислитель, водород — восстановитель).
(окислитель — азотистая кислота, восстановитель — сероводород).
Таким образом, атом-окислитель и атом-восстановитель в данных реакциях принадлежат разным веществам.
Реакциями внутримолекулярного окисления-восстановления называют реакции, в которых атом-окислитель и атом-восстановитель входят в состав одной и той же молекулы.
(окислитель — атом хлора в степени окисления +5, восстановитель — атом кислорода в степени окисления –2).
(окислитель — атом хрома в степени окисления +6, восстановитель — атом азота в степени окисления –3).
(окислители — атомы серебра в степени окисления +1 и азота в степени окисления +5, восстановитель — атом кислорода в степени окисления –2).
Реакциями диспропорционирования называют реакции, в которых молекулы или ионы одного и того же вещества реагируют друг с другом как окислитель и восстановитель. При этом содержащиеся в данном соединении атомы с переменной промежуточной степенью окисления переходят один в высшую, другой — в низшую степень окисления, например:
Реакциями конмутации называют реакции окисления-восстановления, в результате которых происходит выравнивание степеней окисления атомов одного и того же элемента, например:
(окислитель — атом азота в степени окисления +5, восстановитель — атом азота в степени окислителя –3).
(окислитель — атом азота в степени окисления +3, восстановитель — атом азота в степени окислителя –3).
По тепловому эффекту, сопровождающему химические реакции, их разделяют на экзотермические и эндотермические.
Экзотермическими называют химические реакции, идущие с выделением теплоты. Условное обозначение изменения энтальпии ΔH, а теплового эффекта реакции Q. Для экзотермических реакций Q > 0, а ΔH 0.
В соответствии с агрегатным состоянием реагентов различают гомогенные и гетерогенные химические реакции.
Гомогенными называют реакции, протекающие в однородной среде.
Гетерогенными называют реакции, протекающие в неоднородной среде, на поверхности соприкосновения реагирующих веществ, находящихся в разных фазах, например твёрдой и газообразной, жидкой и газообразной, в двух несмешивающихся жидкостях.
Тренировочные задания
1. Реакция 3CaО + P2O5 = Ca3(PO4)2 относится к реакциям
1) разложения
2) соединения
3) обмена
4) замещения
2. Реакция Na2SO4 + Ba(OH)2 = BaSO4 + 2NaOH относится к реакциям
1) разложения
2) соединения
3) обмена
4) замещения
3. Реакция H2SO4 + Fe = FeSO4 + H2 относится к реакциям
1) разложения
2) соединения
3) обмена
4) замещения
4. Реакция CaCO3 = CaO + CO2 относится к реакциям
1) разложения
2) соединения
3) обмена
4) замещения
5. Реакция разложения описана уравнением
6. Реакция соединения описана уравнением
7. К каталитическим процессам относят реакцию между
1) калием и водой
2) серой и хлором
3) азотом и литием
4) азотом и водородом
8. К экзотермическим реакциям относится взаимодействие
1) азота с кислородом
2) углерода с углекислым газом
3) воды с углеродом
4) углерода с кислородом
9. К окислительно-восстановительным реакциям не относится взаимодействие
1) натрия и хлора
2) брома и водорода
3) гидроксида калия и уксусной кислоты
4) кальция и уксусной кислоты
10. К реакциям замещения относится взаимодействие
1) серной кислоты и гидроксида натрия
2) серной кислоты и железа
3) серной кислоты и оксида натрия
4) серной кислоты и хлорида бария
11. К экзотермическим реакциям относится
1) взаимодействие соляной кислоты и гидроксида калия
2) взаимодействие азота и кислорода
3) гидролиз сульфата меди
4) разложение карбоната натрия
12. К эндотермическим реакциям относится
1) взаимодействие азота и кислорода
2) взаимодействие азотной кислоты и гидроксида лития
3) взаимодействие кислорода и водорода
4) взаимодействие воды и оксида калия
13. К окислительно-восстановительным реакциям не относится взаимодействие
1) натрия и брома
2) натрия и кислорода
3) оксида калия и воды
4) натрия и уксусной кислоты
14. Взаимодействие брома с гидроксидом калия относится к реакциям
1) нейтрализации
2) межмолекулярного окисления-восстановления
3) диспропорционирования
4) обмена
15. Взаимодействие азота и кислорода относится к реакциям
1) соединения, эндотермическим
2) соединения, экзотермическим
3) разложения, эндотермическим
4) обмена, экзотермическим
16. К эндотермическим реакциям относится взаимодействие
1) азота и лития
2) азота и кислорода
3) кислорода и кальция
4) углерода и кислорода
17. Взаимодействие оксида кальция и воды относится к реакциям
1) каталитическим, экзотермическим
2) разложения, эндотермическим
3) соединения, экзотермическим
4) обмена, эндотермическим
18. К каталитическим экзотермическим реакциям относится
1) получение фосфорной кислоты из оксида фосфора (V) и воды
2) разложение карбоната кальция
3) синтез аммиака из простых веществ
4) получение соляной кислоты из хлора и водорода
19. При нагревании нитрата серебра происходит реакция
1) соединения
2) разложения
3) замещения
4) обмена
20. Реакция, протекающая по схеме: CaCO3 = CaO + CO2 − Q, является реакцией
1) экзотермического разложения
2) разложения
3) замещения
4) эндотермического разложения
К какому типу реакции относятся следующие реакции
1. Составьте молекулярное уравнение упомянутой в тексте реакции между оксидом серы(IV) и гидроксидом кальция.
2. Опишите признаки протекающей реакции между оксидом серы(IV) и раствором гидроксида кальция.
Прочитайте следующий текст и выполните задания 5—7.
Оксид серы (IV) используют в пищевой промышленности в качестве консерванта (пищевая добавка Е220). Поскольку этот газ убивает микроорганизмы, им окуривают овощехранилища и склады. Это вещество также используют для отбеливания соломы, шёлка и шерсти, то есть материалов, которые нельзя отбеливать хлором.
Промышленный способ получения этого вещества заключается в сжигании серы или сульфидов. В лабораторных условиях его получают воздействием сильных кислот на сульфиты, например взаимодействием серной кислоты с сульфитом натрия.
При взаимодействии оксида серы (IV) с гидроксидом кальция образуется соль сульфит кальция. Это вещество применяется в промышленности как пищевая добавка Е226, консервант, для приготовления желе, мармелада, мороженого, напитков и фруктовых соков.
Сложные неорганические вещества условно можно распределить, то есть классифицировать, по четырём группам, как показано на схеме. В эту схему для каждой из четырёх групп впишите по одной химической формуле веществ, упоминаемых в приведённом выше тексте.
| оксид | основание | кислота | соль |
Химические формулы запишите в таблицу в следующем формате: Al2(SO4)3.
1) — оксид.
2) — основание.
3) — кислота.
4) или
— соль.
1. Составьте молекулярное уравнение реакции сжигания серы, о которой говорилось в тексте.
2. Укажите, с каким тепловым эффектом (с поглощением или выделением теплоты) протекает эта реакция.
1)
2) реакция протекает с выделением энергии (экзотермическая), так как большинство реакций присоединения являются экзотермическими.
1)
2) в результате реакции образуется нерастворимое вещество – сульфит кальция; наблюдается помутнение исходного раствора (выпадение осадка)
1) Составьте молекулярное уравнение реакции сульфита натрия с соляной кислотой, о которой говорилось в тексте;
2) Укажите признак, который наблюдается при протекании этой реакции.
Прочитайте следующий текст и выполните задания 5—7.
Сульфит натрия — это синтетически созданный консервант, применяющийся в пищевой, фармацевтической и лёгкой промышленности. На этикетках пищевых продуктов сульфит натрия обозначается как Е221. Ещё одно распространённое название этого вещества — Sodium Sulphite. Е221 незаменим в производстве мармелада, зефира, варенья, пастилы, повидла, джема, соков и пюре из фруктов и ягод, ягодных полуфабрикатов, овощного пюре.
Получить сульфит натрия можно в результате реакции сернистого газа с раствором карбоната натрия
или гидроксида натрия
. При действии на сульфит натрия раствора хлороводорода
выделяется сернистый газ, который относят к веществах третьего класса опасности.
Сложные неорганические вещества можно классифицировать по четырём группам, как показано на схеме. В эту схему для каждой из четырёх групп впишите по одной химической формуле веществ из числа тех, о которых говорится в приведённом тексте.
Химические формулы запишите в таблицу в следующем формате: Al2(SO4)3.
| оксид | основание | кислота | соль |
1. — бинарное соединение, в котором один из атомов является кислородом, что говорит о его принадлежности к классу оксидов.
2. — является основанием, так как это основный гидроксид.
3. Кислота должна иметь ион водорода, примером может служить соляная кислота
4. Соль состоит из иона металла и иона кислотного остатка, известным примером является карбонат натрия
Ответ: оксид — основание —
кислота —
соль —
Для графы «соль» возможен также и другой вариант ответа —
1) Составьте одно из молекулярных уравнений реакций получения сульфита натрия;
2) Укажите, к какому типу (соединения, разложения, замещения, обмена) относится эта реакция.
1.
2. Данная реакция относится к реакциям замещения.
1.
2. Признаком протекания данной химической реакции является выделение бесцветного газа с характерным резким запахом.
1) Составьте молекулярное уравнение реакции серной кислоты с оксидом меди(II), о которой говорилось в тексте;
2) Укажите признак(и), который(-е) наблюдается(-ются) при протекании этой реакции.
Прочитайте следующий текст и выполните задания 5—7.
Сульфат меди(II) — важнейшая из солей меди. Кристаллогидрат сульфата меди(II) называют медным купоросом. В сельском хозяйстве медный купорос применяется как антисептик, фунгицид и медно-серное удобрение. В промышленности эту соль применяют в производстве ацетатного волокна, а также используют в качестве фиксатора окраски и консерванта. Сульфат меди(II) в промышленности получают различными способами, например растворением оксида меди(II)
в серной кислоте
Эта соль часто служит исходным сырьём для получения других соединений, например гидроксида меди(II)
Для водного раствора сульфата меди(II) возможна реакция с металлами активнее меди, например с цинком. Сульфат меди(II) является соединением с умеренной токсичностью. Однако работать с порошком или пудрой сульфата меди(II) следует осторожно, не допуская их пыления.
Сложные неорганические вещества можно классифицировать по четырём группам, как показано на схеме. В эту схему для каждой из четырёх групп впишите по одной химической формуле веществ из числа тех, о которых говорится в приведённом тексте.
| оксид | основание | кислота | соль |
Химические формулы запишите в таблицу в следующем формате: Al2(SO4)3.
1. — бинарное соединение, в котором один из атомов является кислородом, что говорит о его принадлежности к классу оксидов.
2. — является основанием, так как это основный гидроксид.
3. Кислота должна иметь ион водорода, примером может служить серная кислота
4. Соль состоит из иона металла и иона кислотного остатка, известным примером является сульфат меди (II)
Ответ: Оксид — основание —
кислота —
соль —
1) Составьте молекулярное уравнение реакции цинка с раствором сульфата меди(II);
2) Укажите, к какому типу (соединения, разложения, замещения, обмена) относится эта реакция.
1.
2. Данная реакция относится к реакциям замещения.
1.
2. Признаками протекания данной химической реакции являются растворение осадка оксида меди(II) и приобретение раствором голубого оттенка (за счёт образования сульфата меди(II)).
1) Составьте молекулярное уравнение реакции гидроксида железа (II) с соляной кислотой, о которой говорилось в тексте;
2) Укажите признак, который наблюдается при протекании этой реакции.
Прочитайте следующий текст и выполните задания 5—7.
Железо это блестящий, серебристо-белый, мягкий металл, с давних пор широко применяемый человеком. Известно большое количество руд и минералов, содержащих железо. Наибольшее практическое значение имеют красный железняк магнитный железняк
сидерит
мелантерит
вивианит
Свойства соединений железа в значительной степени зависят от степени окисления железа. Так, в степени окисления +2 железо образует оксид
который проявляет основные свойства, ему соответствует гидроксид
Эти соединения способны реагировать с растворами сильных кислот, например с соляной кислотой (
) с образование хлорида железа (II)
Железо один из самых используемых металлов, на него приходится до 95% мирового металлургического производства. Железо является основным компонентом сталей и чугунов важнейших конструкционных материалов.
Сложные неорганические вещества можно классифицировать по четырём группам, как показано на схеме. В эту схему для каждой из четырёх групп впишите по одной химической формуле веществ из числа тех, о которых говорится в приведённом тексте.
| оксид | основание | кислота | соль |
Химические формулы запишите в таблицу в следующем формате: Al2(SO4)3.
1. Оксид бинарное соединение, в котором один из атомов является кислородом в степени окисления −2. Из предложенных соединений оксидами являются и
2. — является основанием, так как это основный гидроксид.
3. Кислота должна иметь ион водорода, примером может служить соляная кислота
4. Соль состоит из иона металла и иона кислотного остатка, примерами являются и
Ответ: Оксид или
или
основание
кислота
соль
или
или
или