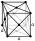к какому семейству относится алюминий
Алюминий
Кусок чистого алюминия
Алюминий — очень редкий минерал семейства меди-купалита подкласса металлов и интерметаллидов класса самородных элементов. Преимущественно в виде микроскопических выделений сплошного мелкозернистого строения. Может образовывать пластинчатые или чешуйчатые кристаллы до 1 мм., отмечены нитевидные кристаллы длиной до 0,5 мм. при толщине нитей несколько мкм. Лёгкий парамагнитный металл серебристо-белого цвета, легко поддающийся формовке, литью, механической обработке.
СТРУКТУРА
Кубическая гранецентрированная структура. 4 оранжевых атома
СВОЙСТВА
Самородный алюминий. Поле зрения 5 x 4 мм. Азербайджан, Гобустанский район, Каспийское море, Хере-Зиря или остров Булла
Алюминий — мягкий, легкий, серебристо-белый металл с высокой тепло- и электропроводностью, парамагнетик. Температура плавления 660°C. К достоинствам алюминия и его сплавов следует отнести его малую плотность (2,7 г/см 3 ), сравнительно высокие прочностные характеристики, хорошую тепло- и электропроводность, технологичность, высокую коррозионную стойкость. Совокупность этих свойств позволяет отнести алюминий к числу важнейших технических материалов. Он легко вытягивается в проволоку и прокатывается в тонкие листы. Алюминий химически активен (на воздухе покрывается защитной оксидной пленкой — оксидом алюминия.) надежно предохраняет металл от дальнейшего окисления. Но если порошок алюминия или алюминиевую фольгу сильно нагреть, то металл сгорает ослепительным пламенем, превращаясь в оксид алюминия. Алюминий растворяется даже в разбавленных соляной и серной кислотах, особенно при нагревании. А вот в сильно разбавленной и концентрированной холодной азотной кислоте алюминий не растворяется. При действии на алюминий водных растворов щелочей слой оксида растворяется, причем образуются алюминаты — соли, содержащие алюминий в составе аниона.
ЗАПАСЫ И ДОБЫЧА
По распространённости в земной коре Земли занимает 1-е место среди металлов и 3-е место среди элементов, уступая только кислороду и кремнию. Массовая концентрация алюминия в земной коре, по данным различных исследователей, оценивается от 7,45 до 8,14%.
Современный метод получения, процесс Холла—Эру был разработан независимо американцем Чарльзом Холлом и французом Полем Эру в 1886 году. Он заключается в растворении оксида алюминия Al2O3 в расплаве криолита Na3AlF6 с последующим электролизом с использованием расходуемых коксовых или графитовых анодных электродов. Такой метод получения требует очень больших затрат электроэнергии, и поэтому получил промышленное применение только в XX веке.
ПРОИСХОЖДЕНИЕ
Аллюминий, агрегированный с коркой байерита на поверхности. Узбекистан, Навойская область, Учкудук
Вследствие высокой химической активности он не встречается в чистом виде, а лишь в составе различных соединений. Так, например, известно множество руд, минералов, горных пород, в состав которых входит алюминий. Однако добывается он только из бокситов, содержание которых в природе не слишком велико. Самые распространенные вещества, содержащие рассматриваемый металл: полевые шпаты; бокситы; граниты; кремнезем; алюмосиликаты; базальты и прочие. В небольшом количестве алюминий обязательно входит в состав клеток живых организмов. Некоторые виды плаунов и морских обитателей способны накапливать этот элемент внутри своего организма в течение жизни.
ПРИМЕНЕНИЕ
Украшение из алюминия
Широко применяется как конструкционный материал. Основные достоинства алюминия в этом качестве — лёгкость, податливость штамповке, коррозионная стойкость. Электропроводность алюминия всего в 1,7 раза меньше, чем у меди, при этом алюминий приблизительно в 4 раза дешевле за килограмм, но, за счёт в 3,3 раза меньшей плотности, для получения равного сопротивления его нужно приблизительно в 2 раза меньше по весу. Поэтому он широко применяется в электротехнике для изготовления проводов, их экранирования и даже в микроэлектронике при напылении проводников на поверхности кристаллов микросхем.
Когда алюминий был очень дорог, из него делали разнообразные ювелирные изделия. Так, Наполеон III заказал алюминиевые пуговицы, а Менделееву в 1889 г. были подарены весы с чашами из золота и алюминия. Мода на ювелирные изделия из алюминия сразу прошла, когда появились новые технологии его получения, во много раз снизившие себестоимость. Сейчас алюминий иногда используют в производстве бижутерии.
Алюминий
Алюминий / Aluminium (Al), 13
Алюми́ний — элемент главной подгруппы третьей группы третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 13. Обозначается символом Al (лат. Aluminium ). Относится к группе лёгких металлов. Наиболее распространённый металл и третий по распространённости химический элемент в земной коре (после кислорода и кремния).
Простое вещество алюминий (CAS-номер: 7429-90-5) — лёгкий, парамагнитный металл серебристо-белого цвета, легко поддающийся формовке, литью, механической обработке. Алюминий обладает высокой тепло- и электропроводностью, стойкостью к коррозии за счёт быстрого образования прочных оксидных плёнок, защищающих поверхность от дальнейшего взаимодействия.
Содержание
История
Впервые алюминий был получен датским физиком Гансом Эрстедом в 1825 году действием амальгамы калия на хлорид алюминия с последующей отгонкой ртути. Название элемента образовано от лат. aluminis — квасцы.
Получение
Современный метод получения был разработан независимо американцем Чарльзом Холлом и французом Полем Эру в 1886 году. Он заключается в растворении оксида алюминия Al2O3 в расплаве криолита Na3AlF6 с последующим электролизом с использованием расходуемых коксовых или графитовых электродов. Такой метод получения требует больших затрат электроэнергии, и поэтому оказался востребован только в XX веке.
Для производства 1000 кг чернового алюминия требуется 1920 кг глинозёма, 65 кг криолита, 35 кг фторида алюминия, 600 кг анодной массы и 17 тыс. кВт·ч электроэнергии постоянного тока. [2]
В лабораторных условиях
Лабораторный способ получения алюминия предложил Фридрих Вёлер в 1827 году. AlCl3+3K → 3KCl + Al (реакция протекает при нагревании)
Физические свойства
Алюминий образует сплавы почти со всеми металлами. Наиболее известны сплавы с медью и магнием (дюралюминий) и кремнием (силумин).
Нахождение в природе
Природный алюминий состоит практически полностью из единственного стабильного изотопа 27 Al со следами 26 Al, радиоактивного изотопа с периодом полураспада 720 тыс. лет, образующегося в атмосфере при бомбардировке ядер аргона протонами космических лучей.
В природе алюминий в связи с высокой химической активностью встречается почти исключительно в виде соединений. Некоторые из них:
Химические свойства
Легко реагирует с простыми веществами:
Сульфид и карбид алюминия полностью гидролизуются:
Со сложными веществами:
Производство
Легенда из «Historia naturalis» гласит, что однажды к римскому императору Тиберию (42 год до н. э. — 37 год н. э.) пришёл ювелир с металлической, небьющейся обеденной тарелкой, изготовленной якобы из глинозёма — Al2O3. Тарелка была очень светлой и блестела, как серебро. По всем признакам она должна быть алюминиевой. При этом ювелир утверждал, что только он и боги знают, как получить этот металл из глины. Тиберий, опасаясь, что металл из легкодоступной глины может обесценить золото и серебро, приказал на всякий случай отрубить ювелиру голову. Данная легенда сомнительна, так как самородный алюминий в природе не встречается в силу своей высокой активности и во времена Римской империи не могло быть технических средств, которые позволили бы извлечь алюминий из глинозёма.
Лишь почти через 2000 лет после Тиберия, в 1825 году, датский физик Ганс Христиан Эрстед получил несколько миллиграммов металлического алюминия, а в 1827 году Фридрих Вёлер смог выделить крупинки алюминия, которые, однако, на воздухе немедленно покрывались тончайшей пленкой оксида алюминия.
До конца XIX века алюминий в промышленных масштабах не производился.
Только в 1854 году Анри Сент-Клер Девиль (его исследования финансировал Наполеон III, рассчитывая, что алюминий пригодится его армии [7] [8] ) изобрёл первый способ промышленного производства алюминия, основанный на вытеснении алюминия металлическим натрием из двойного хлорида натрия и алюминия NaCl·AlCl3. В 1855 году был получен первый слиток металла массой 6—8 кг. За 36 лет применения, с 1855 по 1890 год, способом Сент-Клер Девиля было получено 200 тонн металлического алюминия. В 1856 году он же получил алюминий электролизом расплава хлорида натрия-алюминия.
В 1885 году был построен завод по производству алюминия в немецком городе Гмелингеме, работающий по технологии, предложенной Николаем Бекетовым. Технология Бекетова мало чем отличалась от способа Девиля, но была проще и заключалась во взаимодействии между криолитом (Na3AlF6) и магнием. За пять лет на этом заводе было получено около 58 т алюминия — более четверти всего мирового производства металла химическим путем в период с 1854 по 1890 год.
Метод, изобретённый почти одновременно Чарльзом Холлом в США и Полем Эру во Франции (1886 год) и основанный на получении алюминия электролизом глинозема, растворённого в расплавленном криолите, положил начало современному способу производства алюминия. С тех пор, в связи с улучшением электротехники, производство алюминия совершенствовалось. Заметный вклад в развитие производства глинозема внесли русские учёные К. И. Байер, Д. А. Пеняков, А. Н. Кузнецов, Е. И. Жуковский, А. А. Яковкин и др.
Первый алюминиевый завод в России был построен в 1932 году в Волхове. Металлургическая промышленность СССР в 1939 году производила 47,7 тыс.тонн алюминия, ещё 2,2 тыс.тонн импортировалось.
Вторая мировая война значительно стимулировала производство алюминия. Так, в 1939 году общемировое его производство, без учёта СССР, составляло 620 тыс. т, но уже к 1943 году выросло до 1,9 млн т.
К 1956 году в мире производилось 3,4 млн т первичного алюминия, в 1965 году — 5,4 млн т, в 1980 году — 16,1 млн т, в 1990 году — 18 млн т.
В 2007 году в мире было произведено 38 млн т первичного алюминия, а в 2008 — 39,7 млн т. Лидерами производства являлись:
В России монополистом по производству алюминия является компания «Российский алюминий», на которую приходится около 13 % мирового рынка алюминия и 16 % глинозёма. [10]
Мировые запасы бокситов практически безграничны, то есть несоизмеримы с динамикой спроса. Существующие мощности могут производить до 44,3 млн т первичного алюминия в год. Следует также учитывать, что в будущем некоторые из применений алюминия могут быть переориентированы на использование, например, композитных материалов.
Применение
Широко применяется как конструкционный материал. Основные достоинства алюминия в этом качестве — лёгкость, податливость штамповке, коррозионная стойкость (на воздухе алюминий мгновенно покрывается прочной плёнкой Al2O3, которая препятствует его дальнейшему окислению), высокая теплопроводность, неядовитость его соединений. В частности, эти свойства сделали алюминий чрезвычайно популярным при производстве кухонной посуды, алюминиевой фольги в пищевой промышленности и для упаковки.
Основной недостаток алюминия как конструкционного материала — малая прочность, поэтому для упрочнения его обычно сплавляют с небольшим количеством меди и магния (сплав называется дюралюминий).
Электропроводность алюминия всего в 1,7 раза меньше, чем у меди, при этом алюминий приблизительно в 4 раза дешевле [11] за килограмм, но, за счёт в 3,3 раза меньшей плотности, для получения равного сопротивления его нужно приблизительно в 2 раза меньше по весу. Поэтому он широко применяется в электротехнике для изготовления проводов, их экранирования и даже в микроэлектронике при изготовлении проводников в чипах. Меньшую электропроводность алюминия (37 1/ом) по сравнению с медью (63 1/ом) компенсируют увеличением сечения алюминиевых проводников. Недостатком алюминия как электротехнического материала является наличие прочной оксидной плёнки, затрудняющей пайку.
В качестве восстановителя
Сплавы на основе алюминия
В качестве конструкционного материала обычно используют не чистый алюминий, а разные сплавы на его основе. Нумерация серий сплавов в данной статье приведена для США (стандарт маркировки компании Alcoa)
В сплавах этой системы, содержащих до 6 % Mg, образуется эвтектическая система соединения Al3Mg2 c твердым раствором на основе алюминия. Наиболее широкое распространение в промышленности получили сплавы с содержанием магния от 1 до 5 %.
Рост содержания Mg в сплаве существенно увеличивает его прочность. Каждый процент магния повышает предел прочности сплава на 30 МПа, а предел текучести — на 20 МПа. При этом относительное удлинение уменьшается незначительно и находится в пределах 30…35 %.
Сплавы с содержанием магния до 3 % (по массе) структурно стабильны при комнатной и повышенной температуре даже в значительно нагартованном состоянии. С ростом концентрации магния в нагартованном состоянии структура сплава становится нестабильной. Кроме того, увеличение содержания магния свыше 6 % приводит к ухудшению коррозионной стойкости сплава.
Для улучшения прочностных характеристик сплавы системы Al-Mg легируют хромом, марганцем, титаном, кремнием или ванадием. Попадания в сплавы этой системы меди и железа стараются избегать, поскольку они снижают их коррозионную стойкость и свариваемость.
Основными примесями в сплавах системы Al-Mn являются железо и кремний. Оба этих элемента уменьшают растворимость марганца в алюминии. Для получения мелкозернистой структуры сплавы этой системы легируют титаном.
Присутствие достаточного количества марганца обеспечивает стабильность структуры нагартованного металла при комнатной и повышенной температурах.
В качестве легирующих добавок могут встречаться марганец, кремний, железо и магний. Причем наиболее сильное влияние на свойства сплава оказывает последний: легирование магнием заметно повышает предел прочности и текучести. Добавка кремния в сплав повышает его способность к искусственному старению. Легирование железом и никелем повышает жаропрочность сплавов второй серии.
Нагартовка этих сплавов после закалки ускоряет искусственное старение, а также повышает прочность и сопротивление коррозии под напряжением.
Однако существенным недостатком этих сплавов является крайне низкая коррозионная стойкость под напряжением. Повысить сопротивление коррозии сплавов под напряжением можно легированием медью.
Нельзя не отметить открытой в 60-е годы закономерности: присутствие лития в сплавах замедляет естественное и ускоряет искусственное старение. Помимо этого, присутствие лития уменьшает удельный вес сплава и существенно повышает его модуль упругости. В результате этого открытия были разработаны новые системы сплавов Al-Mg-Li, Al-Cu-Li и Al-Mg-Cu-Li.
Алюминий как добавка в другие сплавы
Алюминий является важным компонентом многих сплавов. Например, в алюминиевых бронзах основные компоненты — медь и алюминий. В магниевых сплавах в качестве добавки чаще всего используется алюминий. Для изготовления спиралей в электронагревательных приборах используют (наряду с другими сплавами) фехраль (Fe, Cr, Al).
Ювелирные изделия
Когда алюминий был очень дорог, из него делали разнообразные ювелирные изделия. Так, Наполеон III заказал алюминиевые пуговицы, а Менделееву в 1889 г. были подарены весы с чашами из золота и алюминия. Мода на них сразу прошла, когда появились новые технологии его получения, во много раз снизившие себестоимость. Сейчас алюминий иногда используют в производстве бижутерии.
В Японии алюминий используется в производстве традиционных украшений, заменяя серебро.
Стекловарение
В стекловарении используются фторид, фосфат и оксид алюминия.
Пищевая промышленность
Алюминий зарегистрирован в качестве пищевой добавки Е173.
Алюминий и его соединения в ракетной технике
Алюминий и его соединения используются в качестве высокоэффективного ракетного горючего в двухкомпонентных ракетных топливах и в качестве горючего компонента в твёрдых ракетных топливах. Следующие соединения алюминия представляют наибольший практический интерес как ракетное горючее:
Триэтилалюминий (обычно, совместно с триэтилбором) используется также для химического зажигания (то есть, как пусковое горючее) в ракетных двигателях, так как самовоспламеняется в газообразном кислороде.
| Окислитель | Удельная тяга (Р1, сек) | Температура сгорания, °С | Плотность топлива, г/см³ | Прирост скорости, ΔVид, 25, м/с | Весовое содерж. горючего, % |
|---|---|---|---|---|---|
| Фтор | 348,4 | 5009 | 1,504 | 5328 | 25 |
| Тетрафторгидразин | 327,4 | 4758 | 1,193 | 4434 | 19 |
| ClF3 | 287,7 | 4402 | 1,764 | 4762 | 20 |
| ClF5 | 303,7 | 4604 | 1,691 | 4922 | 20 |
| Перхлорилфторид | 293,7 | 3788 | 1,589 | 4617 | 47 |
| Фторид кислорода | 326,5 | 4067 | 1,511 | 5004 | 38,5 |
| Кислород | 310,8 | 4028 | 1,312 | 4428 | 56 |
| Перекись водорода | 318,4 | 3561 | 1,466 | 4806 | 52 |
| N2O4 | 300,5 | 3906 | 1,467 | 4537 | 47 |
| Азотная кислота | 301,3 | 3720 | 1,496 | 4595 | 49 |
Алюминий в мировой культуре
…А за окошком в юном инее
лежат поля из алюминия…
Виктор Цой написал песню «Алюминиевые огурцы» с припевом:
Я сажаю алюминиевые огурцы
На брезентовом поле
У ленинградской рок-группы «Народное ополчение» в альбоме «Брежнев жив» 1989 года есть песня «Алюминиевый дом».
Важную роль алюминий играет в историко-мистической трилогии Андрея Валентинова и Олди «Алюмен».
В произведениях эпохи знакомства человечества с алюминием
Токсичность
Отличается незначительным токсическим действием, но многие растворимые в воде неорганические соединения алюминия сохраняются в растворённом состоянии длительное время и могут оказывать вредное воздействие на человека и теплокровных животных через питьевую воду. Наиболее ядовиты хлориды, нитраты, ацетаты, сульфаты и др. Для человека токсическое действие при попадании внутрь оказывают следующие дозы соединений алюминия (мг/кг массы тела):
В первую очередь действует на нервную систему (накапливается в нервной ткани, приводя к тяжёлым расстройствам функции ЦНС). Однако свойство нейротоксичности алюминия стали изучать с середины 1960-х годов, так как накоплению металла в организме человека препятствует механизм его выведения. В обычных условиях с мочой может выделяться до 15 мг элемента в сутки. Соответственно, наибольший негативный эффект наблюдается у людей с нарушенной выделительной функцией почек.
Норматив содержания алюминия в воде хозяйственно-питьевого использования составляет 0,2 мг/л. При этом данная ПДК может быть увеличена до 0,5 мг/л главным государственным санитарным врачом по соответствующей территории для конкретной системы водоснабжения.
Энциклопедия Кольера
АЛЮМИНИЯ СЕМЕЙСТВО
ПОДГРУППА IIIA. СЕМЕЙСТВО АЛЮМИНИЯ
БОР, АЛЮМИНИЙ, ГАЛЛИЙ, ИНДИЙ, ТАЛЛИЙ
Внешняя электронная конфигурация у всех элементов подгруппы s2p1, но наличие внутренней электронной структуры типа электронной конфигурации благородного газа у B и Al и отсутствие ее у Ga, In и Tl, имеющих по 18 электронов, приводит к различию свойств и делению семейства на две группы. У более легких B и Al отличие в поведении валентных s- и p-электронов незначительно, и они проявляют одну стабильную степень окисления III. С ростом атомного номера и соответственно размеров и массы увеличивается возможность проявления меньшей степени окисления (I и II) без использования в химической связи третьего электрона. Наиболее полно эта тенденция проявляется в химии последнего элемента подгруппы таллия, соединения которого со степенью окисления I более устойчивы, чем со степенью окисления III. Отличительной особенностью подгруппы IIIA является практически полное отсутствие металлических свойств у бора и типичные металлические свойства у таллия. Элементы, стоящие между ними в подгруппе, проявляют промежуточные свойства, демонстрируя постепенный переход от неметаллических свойств к металлическим.
Извлечение и применение. Наиболее распространенным и важным в промышленном отношении элементом подгруппы является алюминий. Алюминий проявляет характерные свойства металла, такие, как отражательная способность, проводимость, прочность, деформируемость. Al образует ион в степени окисления III, размер и зарядовая плотность которого обусловливают прочную связь с кислородом гидроксид-иона OHили воды H2O; в последнем случае отщепляется протон H+. Степень диссоциации образующегося Al(OH)3 небольшая, гидроксид проявляет свойства кислоты и основания. Это явление называется амфотерностью и выражается следующим равновесием:
Al(OH)3, как и B(OH)3, растворяется в избытке гидроксида натрия. B(OH)3, или H3BO3, проявляет кислотные свойства настолько, что не растворяется в кислотах, а Al(OH)3 легко растворяется в кислотах. Металлический алюминий получают из природного минерала боксита (основной состав Al2O3), который подвергают обогащению или очистке. Полученный чистый оксид добавляют к расплаву криолита Na3AlF6 в электролизной ванне (катод), сделанной из стали, футерованной графитом. Анодом служат стержни из углерода. В расплаве происходит восстановление оксида до Al, который плавится. По этой технологии (процесс Холла Эру) получают алюминий чистотой 98%. Дальнейшую очистку алюминия проводят повторным электролизом по методу Хупса.
Бор в виде аморфного коричневатого порошка получают восстановлением B2O3 активным металлом (щелочным или магнием). При этом бор загрязняется примесями боридов, например Mg3B2. Наиболее чистый бор получают восстановлением из BBr3 на раскаленной нити в атмосфере водорода. Другие элементы этой подгруппы получают восстановлением их оксидов водородом или углеродом. Из всех элементов подгруппы только алюминий получают в больших количествах для разнообразного применения в авиационной и ракетно-космической технике, строительном деле, мосто- и судостроении. Электрохимическое полирование металла позволяет использовать его в производстве больших и малых зеркал. Анодирование алюминия в присутствии органических красителей расширяет возможности его применения в столовой утвари. В большом количестве производят оксид и сульфат алюминия. Оксид природный и синтетический используют как абразив (алунд, корунд, наждак смесь с оксидами железа). Сочетание природного оксида алюминия со следами некоторых металлических примесей придает неповторимую окраску таким драгоценным и полудрагоценным камням, как сапфир, рубин, топаз, аметист и изумруд. Эти драгоценные камни успешно синтезируют в лабораториях для изготовления украшений, а также в промышленных целях. При окислении алюминия кислородом выделяется много тепла и происходит сильный разогрев, поэтому алюминий является хорошим восстановителем для получения металлического железа из оксида путем прокаливания смеси Al с оксидом железа. При этом получается расплав железа, который используют в сварке (термитный сварочный процесс). Сульфат алюминия Al2(SO4)3 в виде простой или двойной соли (квасцы) применяют в дублении. (Квасцы смешанные сульфаты одновалентного и трехвалентного металлов, MI2SO4*MIII2(SO4)3*24H2O, где MIII любой металл из подгруппы IIIA, кроме бора.)
Из данных табл. 4 видно, что наиболее необычными свойствами обладает галлий. Металл плавится при почти комнатной температуре и сохраняет жидкое состояние до АЛЮМИНИЯ СЕМЕЙСТВО2000° С. Этот интервал жидкого состояния является максимальным среди всех известных металлов.
Химические свойства. Все элементы подгруппы IIIA образуют оксиды и гидроксиды со степенью окисления III, но свойства в ряду элементов заметно различаются с изменением атомного номера. Так, B(OH)3 больше кислота, чем основание, а Al(OH)3 проявляет cвойства кислоты и основания в равной степени, остальные три элемента проявляют основные свойства, а таллий даже образует растворимое в воде сильное основание TlOH со степенью окисления I. Галогениды всех элементов этой подгруппы имеют состав MX3, а таллий кроме того образует и TlX, например TlCl, во многом сходный с AgCl. Галогениды алюминия в жидком и даже в газообразном состоянии сильно димеризованы. Например, хлорид алюминия является димером Al2Cl6, в котором два тетраэдра соединены атомами хлора:
Некоторые данные свидетельствуют от образовании AlCl в газовой фазе при высокой температуре из смеси Al + AlCl3. Однако образующийся монохлорид алюминия неустойчив и легко разлагается на исходные вещества. Галогениды бора BX3 как более тяжелые соединения не имеют такой тенденции к образованию димеров. В галогенидах бора нет полностью завершенного октета электронов (как у галогенидов алюминия), они являются сильными акцепторами электронов, т.е. кислотами Льюиса. Типичный пример трифторид бора BF3. Ионы и молекулы доноры электронов предоставляют электронную пару трифториду бора, образуя с ним прочный комплексный ион, при этом в другой части частицы-донора связи ослабевают. Например,
Галогениды металлов подгруппы IIIA используются как катализаторы в нефтехимической и других отраслях промышленности, а также в лабораторных исследованиях для связывания электронной пары.
Соединения бора. Водородные соединения бора (бороводороды, или бораны) рассматриваются отдельно (см. ВОДОРОД). Аммиачный комплекс бороводорода превращается при нагревании в боразин B3H6N3, который называют также неорганическим бензолом или боразолом из-за его сходства с бензолом. Представляет интерес нитрид бора BN (боразон): при высоких давлениях и температуре гексагональная модификация BN превращается в алмазоподобную тетраэдрическую, отличающуюся высокой твердостью, близкой к твердости алмаза.