к какому электронному семейству относится титан
Титан, свойства атома, химические и физические свойства
Титан, свойства атома, химические и физические свойства.
47,867(1) 1s 2 2s 2 2p 6 3s 2 3p 6 3d 2 4s 2
Титан — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 22. Расположен в 4-й группе (по старой классификации — побочной подгруппе четвертой группы), четвертом периоде периодической системы.
Физические свойства титана
Атом и молекула титана. Формула титана. Строение титана:
Титан – амфотерный металл. Относится к группе переходных металлов и группе цветных металлов.
Титан обозначается символом Ti.
Как простое вещество титан при нормальных условиях представляет собой лёгкий, прочный металл серебристо-белого цвета.
Молекула титана одноатомна.
Химическая формула титана Ti.
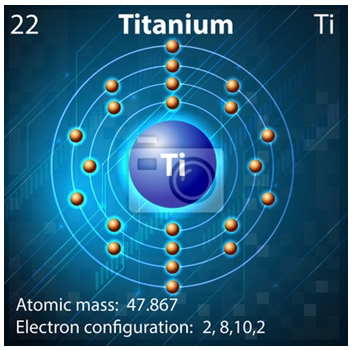
Строение атома титана. Атом титана состоит из положительно заряженного ядра (+22), вокруг которого по четырем оболочкам движутся 22 электрона. При этом 20 электронов находятся на внутреннем уровне, а 2 электрона – на внешнем. Поскольку титан расположен в четвертом периоде, оболочек всего четыре. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлена s- и р-орбиталями. Третья – внутренняя оболочка представлена s-, р- и d-орбиталями. Четвертая – внешняя оболочка представлена s-орбиталью. На внутреннем энергетическом уровне атома титана на 3d-орбитали находятся два неспаренных электрона. На внешнем энергетическом уровне атома титана – на s-орбитали находится два спаренных электрона. В свою очередь ядро атома титана состоит из 22 протонов и 26 нейтронов.
Радиус атома титана (вычисленный) составляет 176 пм.
Атомная масса атома титана составляет 47,867(1) а. е. м.
Титан обладает высокой коррозионной стойкостью.
Изотопы и модификации титана:
Свойства титана (таблица): температура, плотность, давление и пр.:
| 100 | Общие сведения | |
| 101 | Название | Титан |
| 102 | Прежнее название | |
| 103 | Латинское название | Titanium |
| 104 | Английское название | Titanium |
| 105 | Символ | Ti |
| 106 | Атомный номер (номер в таблице) | 22 |
| 107 | Тип | Металл |
| 108 | Группа | Амфотерный, переходный, цветной металл |
| 109 | Открыт | Уильям Грегор, Великобритания, 1791 г., Мартин Генрих Клапрот, Германия, 1795 г. |
| 110 | Год открытия | 1791 г. |
| 111 | Внешний вид и пр. | Лёгкий, прочный металл серебристо-белого цвета |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | 2 аллотропные модификации титана: – α-титан с гексагональной плотноупакованной решёткой, |
| 204 | Радиус атома (вычисленный)* | 176 пм |
| 205 | Эмпирический радиус атома* | 140 пм |
| 206 | Ковалентный радиус* | 160 пм |
| 207 | Радиус иона (кристаллический) | Ti 2+ 4,11 г/см 3 (при 1668 °C и иных стандартных условиях , состояние вещества – жидкость) |
| 402 | Температура плавления* | 1668 °C (1941 K, 3034 °F) |
| 403 | Температура кипения* | 3287 °C (3560 K, 5949 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 14,15 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 425 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | 0,514 Дж/г·K (при 0 °C), 0,524 Дж/г·K (при 25 °C), 0,568 Дж/г·K (при 200 °C) |
| 410 | Молярная теплоёмкость* | 25,060 Дж/(K·моль) |
| 411 | Молярный объём | 10,6 см³/моль |
| 412 | Теплопроводность | 21,9 Вт/(м·К) (при стандартных условиях ), 21,9 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | α-титан |
| 512 | Структура решётки | Гексагональная плотноупакованная |
| 513 | Параметры решётки | a = 2,951 Å, с = 4,697 Å |
| 514 | Отношение c/a | 1,587 |
| 515 | Температура Дебая | 380 K |
| 516 | Название пространственной группы симметрии | P63/mmc |
| 517 | Номер пространственной группы симметрии | 194 |
| 521 | Кристаллическая решётка #2 | β-титан |
| 522 | Структура решётки | Кубическая объёмно-центрированная |
| 523 | Параметры решётки | a = 3,269 Å |
| 524 | Отношение c/a | |
| 525 | Температура Дебая | |
| 526 | Название пространственной группы симметрии | Im_ 3m |
| 527 | Номер пространственной группы симметрии | |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7440-32-6 |
204* Радиус атома (вычисленный) титана согласно [3] составляет 147 пм.
205* Эмпирический радиус титана согласно [1] составляет 147 пм.
206* Ковалентный радиус титана согласно [1] и [3] составляет 160±8 пм и 132 пм соответственно.
401* Плотность титана согласно [3] и [4] составляет 4,54 г/см 3 (при 0 °C и при иных стандартных условиях , состояние вещества – твердое тело) и 4,505 г/см 3 (при 20 °C и при иных стандартных условиях , состояние вещества – твердое тело) соответственно.
402* Температура плавления титана согласно [3] составляет 1943 °C (1670 К, 3529,4 °F).
403* Температура кипения титана согласно [4] составляет 3330 °C (3603,15 К, 6026 °F).
407* Удельная теплота плавления (энтальпия плавления ΔHпл) титана согласно [3] и [4] составляет 18,8 кДж/моль и 15 кДж/моль соответственно.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) титана согласно [3] и [4] составляет 422,6 кДж/моль и 410 кДж/моль соответственно.
410* Молярная теплоемкость титана согласно [3] составляет 25,1 Дж/(K·моль).
Титан Ti
Титан в таблице менделеева занимает 22 место, в 4 периоде.
| Символ | Ti |
| Номер | 22 |
| Атомный вес | 47.8670000 |
| Латинское название | Titanium |
| Русское название | Титан |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
Электронная схема титана
Ti: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 2
Короткая запись:
Ti: [Ar]4s 2 3d 2
Порядок заполнения оболочек атома титана (Ti) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
Титан имеет 22 электрона, заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
6 электронов на 3p-подуровне
2 электрона на 4s-подуровне
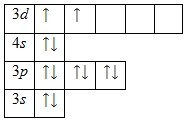
2 электрона на 3d-подуровне
Степень окисления титана
Ионы титана
Валентность Ti
Атомы титана в соединениях проявляют валентность IV, III, II.
Валентность титана характеризует способность атома Ti к образованию хмических связей. Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Ti
Видео заполнения электронной конфигурации (gif):
Результат:
Энергия ионизации
Перейти к другим элементам таблицы менделеева
Титан Ti
Титан в таблице менделеева занимает 22 место, в 4 периоде.
| Символ | Ti |
| Номер | 22 |
| Атомный вес | 47.8670000 |
| Латинское название | Titanium |
| Русское название | Титан |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
Электронная схема титана
Ti: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 2
Короткая запись:
Ti: [Ar]4s 2 3d 2
Порядок заполнения оболочек атома титана (Ti) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
Титан имеет 22 электрона, заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
6 электронов на 3p-подуровне
2 электрона на 4s-подуровне
2 электрона на 3d-подуровне
Степень окисления титана
Ионы титана
Валентность Ti
Атомы титана в соединениях проявляют валентность IV, III, II.
Валентность титана характеризует способность атома Ti к образованию хмических связей. Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Ti
Видео заполнения электронной конфигурации (gif):
Результат:
Энергия ионизации
Перейти к другим элементам таблицы менделеева
Строение атома титана
Общие сведения о строении атома титана
Относится к элементам d — семейства. Металл. Обозначение – Ti. Порядковый номер – 22. Относительная атомная масса – 47,956 а.е.м.
Электронное строение атома титана
Атом титана состоит из положительно заряженного ядра (+22), внутри которого есть 22 протона и 26 нейтронов, а вокруг, по четырем орбитам движутся 22 электрона.
Рис.1. Схематическое строение атома титана.
Распределение электронов по орбиталям выглядит следующим образом:
Внешний энергетический уровень атома титана содержит 4 электрона, которые являются валентными. Степень окисления кальция равна +4. Энергетическая диаграмма основного состояния принимает следующий вид:
Примеры решения задач
| Задание | Сколько энергетических уровней, занятых электронами, имеется в атомах элементов с порядковыми номерами 17, 29, 42? |
| Ответ | Порядковые номера 17, 29 и 42 соответствуют хлору, меди и молибдену. Хлор – элемент 3-го периода, следовательно, электронами занято три оболочки. Медь находится в 4-м периоде – 4 оболочки, молибден – в 5-м периоде, значит пять оболочек занято электронами. |
Копирование материалов с сайта возможно только с разрешения
администрации портала и при наличие активной ссылки на источник.
Титан
История открытия элемента Титан
Происхождение названия
Нахождение в природе
Титан находится на 10-м месте по распространённости в природе. Содержание в земной коре 0,57 % по массе. В свободном виде не встречается. Известно более 100 минералов, содержащих титан. Важнейшие из них: рутил TiO2, ильменит FeTiO3, титаномагнетит FeTiO3 + Fe3O4, перовскит CaTiO3, титанит CaTiOSiO4, танталит (Fe,Mn) 2+ Ta2O6 и манганотанталит MnT2O6. Различают коренные руды титана — ильменит-титаномагнетитовые и россыпные — рутил-ильменит-цирконовые.
Запасы и добыча
Россия обладает вторыми в мире, после Китая, запасами титана. Минерально-сырьевую базу титана России составляют 20 месторождений (из них 11 коренных и 9 россыпных), достаточно равномерно рассредоточенных по территории страны. Самое крупное из разведанных месторождений находится в 25 км от города Ухта (Республика Коми). Запасы месторождения оцениваются в 2 миллиарда тонн.
Крупнейший в мире производитель титана — российская компания «ВСМПО-АВИСМА».
Получение
Концентрат титановых руд подвергают сернокислотной или пирометаллургической переработке. Продукт сернокислотной обработки — порошок диоксида титана TiO2. Пирометаллургическим методом руду спекают с коксом и обрабатывают хлором, получая пары тетрахлорида титана TiCl4: TiO2 + 2C + 2Cl2 =TiCl4 + 2CO
Образующиеся пары TiCl4 при 850 °C восстанавливают Mg: TiCl4+ 2Mg = 2MgCl2+ Ti
Полученную титановую «губку» переплавляют и очищают. Ильменитовые концентраты восстанавливают в электродуговых печах с последующим хлорированием возникающих титановых шлаков. Рафинируют титан иодидным способом или электролизом, выделяя Ti из TiCl4. Для получения титановых слитков применяют дуговую, электроннолучевую или плазменную переработку.
Физические свойства
Имеет высокую вязкость, при механической обработке склонен к налипанию на режущий инструмент, и поэтому требуется нанесение специальных покрытий на инструмент, различных смазок.
При обычной температуре покрывается защитной пассивирующей пленкой оксида TiO2, благодаря этому коррозионностоек в большинстве сред (кроме щелочной).
Титановая пыль имеет свойство взрываться. Температура вспышки 400°С.
Химические свойства
Устойчив к коррозии благодаря оксидной плёнке, но при измельчении в порошок горит на воздухе.
Титан устойчив к разбавленным растворам многих кислот и щелочей (кроме HF,H3PO4 и концентрированной H2SO4).
При нагревании на воздухе до 1200°C Ti загорается с образованием оксидных фаз переменного состава TiOx. Из растворов солей титана осаждается гидроксид TiO(OH)2·xH2O, осторожным прокаливанием которого получают оксид TiO2. Гидроксид TiO(OH)2·xH2O и диоксид TiO2 амфотерны.
При нагревании Ti взаимодействует с галогенами. Тетрахлорид титана TiCl4 при обычных условиях — желтоватая, сильно дымящая на воздухе жидкость, что объясняется сильным гидролизом TiCl4 содержащимися в воздухе парами воды и образованием мельчайших капелек HCl и взвеси гидроксида титана.
Восстановлением TiCl4 водородом, Al, Si, другими сильными восстановителями, получен трихлорид и дихлорид титана TiCl3 и TiCl2 — твердые вещества с сильно восстановительными свойствами. Ti взаимодействует с Br2 и I2.
С N2 выше 400 °C титан образует нитрид TiNx(x=0,58-1,00). При взаимодействии титана с C образуется карбид титана TiCx (x=0,49-1,00).
При нагревании Ti поглощает H2 с образованием соединения переменного состава TiHх (x=1,0). При нагревании эти гидриды разлагаются с выделением H2. Титан образует сплавы со многими металлами.
Применение
В виде сплавов
В виде соединений
Анализ рынков потребления
В 2005 компания Titanium Corporation опубликовала следующую оценку потребления титана в мире:
60 % — краска;
20 % — пластик;
13 % — бумага;
7 % — машиностроение.
Чистота и марка чернового титана (титановой губки) обычно определяется по степени её пластичности.
Физиологическое действие
Периодическая система химических элементов Менделеева
Классификация хим. элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона/
| IA | IIA | IIIB | IVB | VB | VIB | VIIB | —- | VIIIB | —- | IB | IIB | IIIA | IVA | VA | VIA | VIIA | VIIIA | |
| Период | ||||||||||||||||||
| 1 | 1 H Водород | 2 He Гелий | ||||||||||||||||
| 2 | 3 Li Литий | 4 Be Бериллий | 5 B Бор | 6 C Углерод | 7 N Азот | 8 O Кислород | 9 F Фтор | 10 Ne Неон | ||||||||||
| 3 | 11 Na Натрий | 12 Mg Магний | 13 Al Алюминий | 14 Si Кремний | 15 P Фосфор | 16 S Сера | 17 Cl Хлор | 18 Ar Аргон | ||||||||||
| 4 | 19 K Калий | 20 Ca Кальций | 21 Sc Скандий | 22 Ti Титан | 23 V Ванадий | 24 Cr Хром | 25 Mn Марганец | 26 Fe Железо | 27 Co Кобальт | 28 Ni Никель | 29 Cu Медь | 30 Zn Цинк | 31 Ga Галлий | 32 Ge Германий | 33 As Мышьяк | 34 Se Селен | 35 Br Бром | 36 Kr Криптон |
| 5 | 37 Rb Рубидий | 38 Sr Стронций | 39 Y Иттрий | 40 Zr Цирконий | 41 Nb Ниобий | 42 Mo Молибден | (43) Tc Технеций | 44 Ru Рутений | 45 Rh Родий | 46 Pd Палладий | 47 Ag Серебро | 48 Cd Кадмий | 49 In Индий | 50 Sn Олово | 51 Sb Сурьма | 52 Te Теллур | 53 I Иод | 54 Xe Ксенон |
| 6 | 55 Cs Цезий | 56 Ba Барий | * | 72 Hf Гафний | 73 Ta Тантал | 74 W Вольфрам | 75 Re Рений | 76 Os Осмий | 77 Ir Иридий | 78 Pt Платина | 79 Au Золото | 80 Hg Ртуть | 81 Tl Таллий | 82 Pb Свинец | 83 Bi Висмут | (84) Po Полоний | (85) At Астат | 86 Rn Радон |
| 7 | 87 Fr Франций | 88 Ra Радий | ** | (104) Rf Резерфордий | (105) Db Дубний | (106) Sg Сиборгий | (107) Bh Борий | (108) Hs Хассий | (109) Mt Мейтнерий | (110) Ds Дармштадтий | (111) Rg Рентгений | (112) Cp Коперниций | (113) Uut Унунтрий | (114) Uuq Унунквадий | (115) Uup Унунпентий | (116) Uuh Унунгексий | (117) Uus Унунсептий | (118) Uuo Унуноктий |
| 8 | (119) Uue Унуненний | (120) Ubn Унбинилий | ||||||||||||||||
| Лантаноиды * | 57 La Лантан | 58 Ce Церий | 59 Pr Празеодим | 60 Nd Неодим | (61) Pm Прометий | 62 Sm Самарий | 63 Eu Европий | 64 Gd Гадолиний | 65 Tb Тербий | 66 Dy Диспрозий | 67 Ho Гольмй | 68 Er Эрбий | 69 Tm Тулий | 70 Yb Иттербий | 71 Lu Лютеций | |||
| Актиноиды ** | 89 Ac Актиний | 90 Th Торий | 91 Pa Протактиний | 92 U Уран | (93) Np Нептуний | (94) Pu Плутоний | (95) Am Америций | (96) Cm Кюрий | (97) Bk Берклий | (98) Cf Калифорний | (99) Es Эйнштейний | (100) Fm Фермий | (101) Md Менделевий | (102) No Нобелей | (103) Lr Лоуренсий | |||
| Щелочные металлы | Щёлочноземельные металлы | Лантаноиды | Актиноиды | Переходные металлы |
| Лёгкие металлы | Полуметаллы | Неметаллы | Галогены | Инертные газы |
198095, г.Санкт-Петербург, ул.Швецова, д.23, лит.Б, пом.7-Н, схема проезда