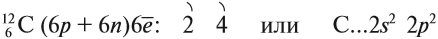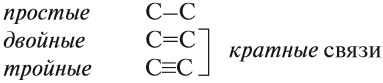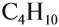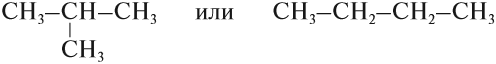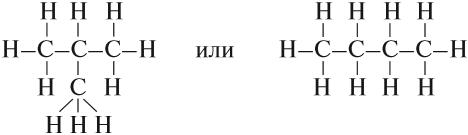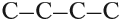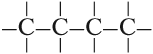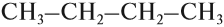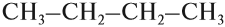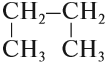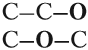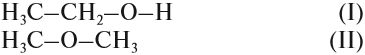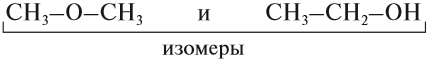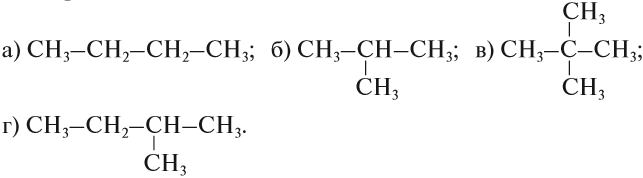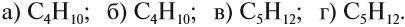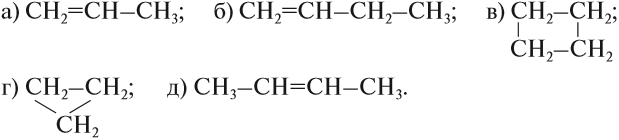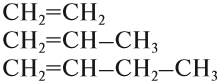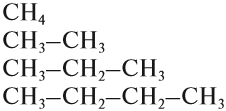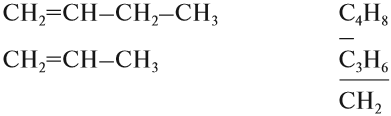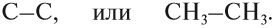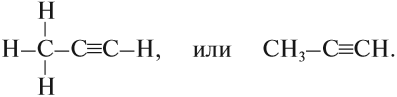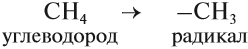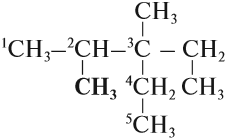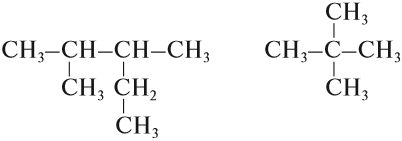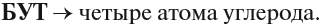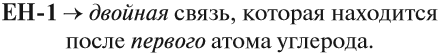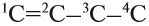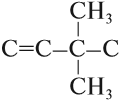изучение соединений какого элемента является основной органической химии
Изучение соединений какого элемента является основой органической химии?
Изучение соединений какого элемента является основой органической химии?
Абсолютно правильным ответом, будет вариант углерод, который по всей видимости стоит под цифрой 3.
Я изучала химию очень давно и мало что из нее помню. Но то, что органическая химия изучает соединения углерода, я запомнила прекрасно. Так что выбираем ответ в третьей строчке. Удивительно, где нам могут пригодиться школьные знания.
Селен защищает нашу иммунную систему, повышая сопротивляемость организма к различным негативным воздействиям, вирусам и бактериям; предупреждает образование свободных радикалов, разрушающих наши клетки, и уменьшает их количество в организме; контролирует жизнь и деятельность каждой клетки, предупреждает воспаления, эндокринные и сердечно-сосудистые заболевания. Уже только эти биологические свойства селена делают его жизненно необходимым для человека и животных.
Другое важное свойство селена – его синергизм с витаминами Е и С. Данные витамины, как и селен, являются мощными антиоксидантами, и могут усиливать действие друг друга, предупреждая окисление клеток и тканей организма, и таким образом существенно замедляя их старение. Селен также предохраняет от повреждений нуклеиновые кислоты.
Общее содержание кальция организме человека составляет примерно 1,9% общего веса человека, при этом 99% всего кальция приходится на долю скелета и лишь 1% содержится в остальных тканях и жидкостях организма. Кальций в пище, как растительной, так и животной, находится в виде нерастворимых солей. Всасывание их в желудке почти не происходит. Абсорбция кальциевых соединений происходит в верхней части тонкого кишечника, главным образом в 12-перстной кишке. Здесь на всасывание оказывают большое влияние желчные кислоты. Физиологическая регуляция уровня кальция в крови осуществляется гормонами паращитовидных желез и витамином D через посредство нервной системы.
Химия
Лучшие условия по продуктам Тинькофф по этой ссылке
Дарим 500 ₽ на баланс сим-карты и 1000 ₽ при сохранении номера
. 500 руб. на счет при заказе сим-карты по этой ссылке
Лучшие условия по продуктам
ТИНЬКОФФ по данной ссылке
План урока:
Что такое органическая химия?
Современное определение органической химии:
– это раздел химической науки, который изучает способы получения углеводородов и их производных, а также свойства, полученных веществ.
Не стоит думать, что предмет органической химии очень узкий, раз объект его исследований можно описать только 2 словами, поскольку количество углеводородов и их производных достаточно превышает все неорганические вещества вместе взятые.
История изучения органической химии
Развитие органической химии, как отдельной науки, началось недавно, но с предметом ее исследования люди были знакомы очень давно.
Первые вещества органической химии получались из живых организмов – растений и животных. Например, духи изготавливались из растительных масел, спирт синтезировали благодаря брожению винограда, а красные красители и вовсе из специальных червей. Поскольку получить искусственно такие вещества из неорганических материалов люди не могли, то предположили, что для их создания нужна «живая сила».
В 1827 году понятие органической химии было введено шведским ученым Й.Я. Берцелиусом.
В 1845 году немецким ученым Г. Кольбе было доказано, что органическое вещество можно добыть из неорганических соединений, и в качестве примера он показал получение уксусной кислоты из углерода, воды, серы и хлора.
В мире стал развиваться новый предмет, получивший название «химия органического синтеза».
С помощью химического анализа было показано, что при сжигании любого органического вещества, продуктами будут вода и углекислый газ, а в отдельных случаях чистая сажа или копоть, основу которых составляет уголь.
Современная задача органической химии – изучить вещества, молекулы которых образованы связями атомов углерода.
Характеристика основного элемента органической химии
Чтобы определить свойства и потенциальные возможности вступления в химические превращения какого-либо элемента, необходимо знать особенности его строения. Какие будут образовываться химические связи и каким образом их можно разорвать зависит от элемента.
Общее строение атома углерода
Зная эти основные цифры, можно подробно разобрать схему строения углеродного атома. У него 2 составляющие: ядро,заряженное положительно и электроны, которые заряжены отрицательно и находятся в пространстве вокруг него.
Порядковый номер элемента численно равен заряду ядра и числу в нем электронов. Число нейтронов вычисляется по формуле:
где А – массовое число, Nп – число протонов, Nн – число нейтронов.
Получаем, что количество нейтронов равно: Nн = А – Nп = 12-6 = 6
На рисунке 1 видно наглядно, какое строение у атома углерода.
Рисунок 1. – Строение атома углерода
Подробное электронное строение атома углерода
Ядро элемента не несет интереса в описаниях химических реакций, так как связи образуются при объединении электронных оболочек. При их связывании и перераспределении электронной плотности образуются новые молекулы.
Электронная структура
По расположению в ПСХЭ наглядно видно, что углерод имеет:
На первом энергетическом уровне в s-орбитали у всех элементов находятся 2 электрона. (см.рис.1). Второй уровень, он же и внешний для углерода, состоит из одной s и трех p орбиталей, и расположение электронов в них зависит от того, в каком состоянии находится атом.
Основное и возбужденное состояние
В основном состоянии на s и p орбиталях расположено по 2 электрона.
Если электрону, находящемуся на s-орбитали, добавить некоторое количество энергии из вне, то он может «перескочить» в пустую p-орбиталь с большей энергией.
Возбужденное состояние атома углерода представляет собой такую конфигурацию, при которой на внешнем уроне каждая его орбиталь имеет по 1 электрону.
Переход из основного состояния в возбужденное называется активацией.
На рисунке 2 схематически изображен процесс активации.
Рисунок 2. – Переход электрона с 2s-орбитали на 2p-орбиталь под действием дополнительной энергии
Атом углерода образует связи с другими элементами и между собой благодаря объединению неспаренных электронов. Если сравним конфигурацию атома углерода в возбужденном состоянии с конфигурацией в основном, можно сделать вывод о том, что в возбужденном состоянии он способен образовать больше ковалентных связей. В этом состоянии ему нужно быстро находить в окружении себя другие элементы и химически с ними связываться, так как при отсутствии дополнительной энергетической подпитки электрон снова перейдет с p-орбитали на s.
Знание о возбужденном состоянии атома углерода позволило в дальнейшем описывать механизмы реакций, рисовать структурные формулы веществ и описывать расположение молекул в пространстве.Полученные знания в 1861 году обобщил А.М. Бутлеров.
Степень окисления
В любых соединениях степень окисления определяет, какой условный заряд имеет тот или иной элемент в молекуле, если бы все связи были ионные.
Таблица 1. – Постоянные степени окисления элементов
Молекула спирта имеет формулу СH3-CН2-ОН, найдите значения степеней окисления атомов углерода в ней.
Разбиваем молекулу по связям С-С на участки. Получаем частицы СН3— и –СН2OH.
Для тренировки постарайтесь найти степень окисления углерода в соединениях, формулы которых: СH3CH2CH3, CH2CHCOH; CH3C(NH2)CH2CH2OH.
Валентность атома углерода
Под валентностью понимают, что это то количество связей, которые образовывает химический элемент. Один из основополагающих законов органической химии гласит, что в органических соединениях у атома углерода валентность постоянна и равняется 4 (т. к. в возбужденном состоянии у него 4 неспаренных электрона)
Углеродные связи в органических веществах
В ходе протекания химической реакции органические вещества претерпевают изменения, поскольку происходит разрушение старых и образование новых связей. Глядя на молекулу, опытный химик-органик скажет, какая именно связь разрушится, под действием каких факторов и предскажет, какие продукты и какого строения получатся в конце превращения.
Одинарные химические связи углерода
При объединении 2 неспаренных электронов 2 разных элементов, образуется одинарная связь.
Рассмотрим на конкретном примере, каким образом можно изобразить на бумаге структурные формулы веществ,имеющих состав С4H9Cl.
Помня о том, сколько связей может образовывать атом углерода, рисуем углеродный скелет органической молекулы (см. рис.3 а). Связи между атомами углерода ковалентные неполярные, т.к. образованы элементами с одинаковой электроотрицательностью.
Затем добавим к этому углеродному скелету атомы водорода и хлора (см. рис 3 б). Образовавшиеся связи хлор-углерод и углерод-водород – ковалентные полярные, т.к. образованы элементами с разной электроотрицательностью.Кроме изображенной на рисунке структурной формулы, для вещества состава С4H9Cl можно записать и некоторые другие (см. рис. 3 в). Ковалентные связи, образуемые атомом углерода, позволяют создать огромное количество соединений, у которых физические и химические свойства будут уникальны.
Рисунок 3. – Этапы построения органической молекулы
Формулу органического соединения, представленного на рисунке 3 б, можно записать проще, не изображая столько разветвлений.
Кратные связи углерода
В некоторых молекулах атомы углерода могут образовывать двойные и даже тройные связи. Это такой тип связей, на которые стоит обращать внимание, изучая строение веществ, потому что их наличие в молекуле придает соединению определенные свойства. Например, соединения с чередующимися кратными и одинарными связями могут проводить электрический ток.
Помимо кратных связей между собой, атом углерода образует двойные связи и с другими элементами (N, P, O, S). На схеме ниже представлен пример органической молекулы, которая содержит связи разных типов.
Разнообразие органических молекул
Молекулы органических соединений являются «кирпичиками» в построении живой материи и различных веществ. На свойства таких веществ влияет количество атомов в молекуле и их расположение друг относительно друга в пространстве. По строению органических молекул определяют их реакционные способности, цвет и токсичность.
Знание строения материалов позволило выбирать самые качественные для использования в постройке домов, автомобилей, ракет и многих других конструкций.
Одна из задач химиков-органиков получить материалы с определенным порядком расположения молекул.
Форма, объем, а также расположение молекулы в пространстве, зависят от того, в каких направлениях в ней связаны атомы. Это может быть объемная структура, расположение в одной плоскости или линяя.
Если бы мы рассмотрели расположение орбиталей в возбужденном состоянии атома углерода, и присоединили другие элементы к его s и p орбиталям, то все получившиеся молекулы имели бы строго объемное строение, однако на практике это не так. Чтобы объяснить расположение атомов в молекуле и пространстве, было предложено понятие гибридизации.
Гибридизация
Гибридизация – объединение орбиталей атома, которые имеют разные формы (s и p). Объединенные орбитали получаются с одинаковой формой, размером и энергией (рисунок 4).
Объединяться могут не только s и p орбитали, но и d и f, однако в атоме углерода таких нет, поэтому на уроках органической химии их объединения рассматриваться не будут.
Рисунок 4. – Образование гибридных орбиталей из s и p
Основные типы гибридизации атома углерода в молекулах
Наглядно разберемся, как можно представить объединение орбиталей.
Предположим, что у нас есть синяя краска и белая краска, и мы в палитре их объединяем, т.е. смешиваем. При «смешении» мы получили краску нового голубого цвета. Тоже самое происходит и с орбиталями в атоме, только смешиваются не цвета, а формы и энергии.
Объединение орбиталей в углероде может проходить по 3 путям:
Зная, как гибридизация влияет на взаимное расположение атомов друг относительно друга, можно изобразить схематически строение молекулы любого органического вещества.
Рассмотрим молекулу, в которой есть участки с одинарными, двойными и тройными связями, и изобразим ее в пространстве (см.рис. 5).
Рисунок 5. – Пространственное расположение молекулы, в которой есть одинарные и кратные связи.
Стоит отметить, что представленные типы гибридизаций атомов в молекулах, характерны не только органическим соединением, но многим неорганическим веществам.
Важнейшие представители органических соединений
Соединения, у которых небольшое количество атомов в молекуле, простые структурные формулы и из которых путем последовательных химических реакций можно получить все остальные химические вещества, называют фундаментальными.
Самые простые органические соединения
Вещества, состоящие только из 2 видов атомов, называются простейшими. В органической химии соединения, образованные только атомами углерода и водорода, называют простыми. На их основе можно создавать другие классы органических веществ, путем замены водорода на другие группы, называемые функциональными.
Общая классификация органических молекул
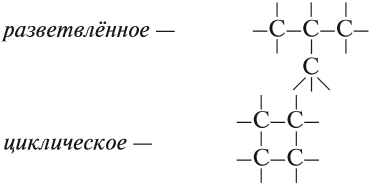
Классификация органических соединений начинается с анализа углеродного скелета молекулы. Он может быть замкнутый в «кольцо» или в виде цепочки (по-научному: циклический и ациклический).
Циклические соединения делятся на те, в которых цикл состоит только из атомов углерода (тогда такие называются карбоциклические) и на те, у которых помимо него есть еще другой элемент (тогда такие соединения называют гетероциклические).
Карбоциклические подразделяются по наличию кратных связей в цикле на ароматические (когда цикл содержит кратные связи) и алициклические (в которых кратных связей не содержится).
Ациклические делятся на соединения, которые состоят только из одинарных связей (такие соединения называются предельными) и те, которые содержат в структуре углеродного скелета кратные связи (такие соединения называют непредельными).
Классификация углеводородов
Углеводороды можно разделить на разные группы по аналогичным признакам классификации органических соединений.По видам связей углеводороды делятся на те, в которых:
Каждый класс соединений вступает в химические реакции по определенным механизмам и будет рассмотрен более подробно на последующих уроках.
Агрегатные состояния простых органических веществ
Органические вещества выпускаются в мире в промышленных масштабах. Поступающие на завод вещества, называются сырьем, а выпускаемые из него – целевым продуктом.
В зависимости от того, какое сырье использует предприятие, его доставка может осуществляться разными способами: трубопроводами или с помощью транспортировочных машин.
Основная сырьевая база для производства сложных веществ и материалов – углеводороды, которые впоследствии претерпевают химические изменения и превращаются в другие вещества, которые используют для создания более сложных продуктов, например лекарств, пластмасс, клеев, пленок и др.
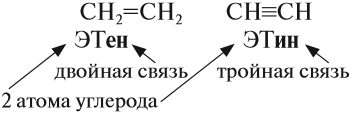
Самыми востребованными веществами из углеводородов являются этен и этин (вещества, в которых содержится только 2 атома углерода, которые соединены двойной и тройной связью).
Газообразные углеводороды
Этен и этин представляют собой газообразные органические вещества и для их транспортировки используют специальные газовые трубопроводы и баллоны, где они хранятся в сжиженном виде.
Изготавливают из них полимеры, например, полиэтиленовые пакеты или реактивы для более узкого органического синтеза.
Обычно, вещества в газообразном состоянии имеют в составе молекул от 1 до 4 углеродных атомов.
Жидкие органические вещества класса углеводородов
Состав таких веществ обычно подразумевает наличие атомов в своем составе больше, чем в молекулах газообразных веществ. Из-за утяжеления молекул их подвижность падает и в них могут образовываться межмолекулярные связи.
Для их транспортировки используют бочки, трубопроводы и цистерны. В составе молекул в жидком состоянии содержится от 5 до 18 атомов углерода.
Твердые углеводороды
Если увеличивать количество углеродных атомов в структуре органической молекулы, то углеводороды будут представлять из себя твердые, но пластичные материалы. Примером такого органического вещества является воск или парафин, в состав которых входят тяжелые углеводороды.
Для их транспортировки используют грузовые машины, а складывают их в коробки или ящики.
Кратко примеры агрегатных состояний органических веществ представлены в таблице 2.
Таблица 2. – Агрегатные состояния органических веществ
Урок 17. Основные понятия органической химии
Известно, что все сложные вещества условно можно разделить на органические и неорганические.
В состав неорганических веществ может входить любой элемент периодической системы. Основными классами неорганических веществ являются оксиды, кислоты, основания и соли. Свойства этих веществ были рассмотрены в первых двух разделах.
В состав органических веществ обязательно входит атом углерода, который в подавляющем числе органических соединений образует цепи. Эти цепи имеют разную длину и разное строение, поэтому органических соединений теоретически может быть бесчисленное множество.
Основу любого органического соединения составляет углеводородная цепь, которая может соединяться с функциональными группами.
Свойства органического соединения описывают по схеме:
Прочитав очередной урок, попробуйте описать изучаемые соединения на любом примере, используя эту схему. И всё получится!
Предмет органической химии. Теория строения органических веществ
Органические вещества известны людям с давних пор. Ещё в древности люди использовали сахар, животные и растительные жиры, красящие и душистые вещества. Все эти вещества выделялись из живых организмов. Поэтому такие соединения стали называться органическими, а раздел химии, который изучал вещества, образующиеся в результате жизнедеятельности живых организмов, получил название «органическая химия». Это определение было дано шведским учёным Берцелиусом* в 1827 году.
* Берцелиус Йенс Якоб (20.08.1779–7.08.1848) — шведский химик. Проверил и доказал ряд основных законов химии, определил атомные массы 45 химических элементов, ввёл современное обозначение химических элементов (1814) и первые химические формулы, разработал понятия «изомерия», «катализ» и «аллотропия».
Уже первые исследователи органических веществ отмечали особенности этих соединений. Во-первых, все они при сжигании образуют углекислый газ и воду, значит, все они содержат атомы углерода и водорода. Во-вторых, эти соединения имели более сложное строение, чем минеральные (неорганические) вещества. В-третьих, возникали серьёзные затруднения, связанные со способами получения и очистки этих соединений. Полагали даже, что органические соединения невозможно получить без участия «жизненной силы», которая присуща только живым организмам, то есть органические соединения нельзя, казалось, получить искусственно.
И, наконец, были обнаружены соединения одинакового молекулярного состава, но различные по свойствам. Такое явление не было характерно для неорганических веществ. Если для неорганического вещества известен состав, то известны и его свойства.
А химики-органики обнаружили, что вещество состава С2Н6О у одних исследователей является достаточно инертным газом, а у других — жидкостью, активно вступающей в разнообразные реакции. Как это объяснить?
К середине 19-го века было создано немало теорий, авторы которых пытались объяснить эти и другие особенности органических соединений. Одной из таких теорий стала теория химического строения Бутлерова*.
* Бутлеров Александр Михайлович (15.09.1928–17.08.1886) — русский химик. Создал теорию химического строения органических веществ, лежащей в основе современной химии. Предсказал изомерию многих органических соединений, заложил основы учения о таутомерии.
Некоторые её положения были изложены А. М. Бутлеровым в 1861 году на конференции в г. Шпейере, другие были сформулированы позже в научных работах А. М. Бутлерова. В целом, основные положения этой теории в современном изложении можно сформулировать так.
1. Атомы в молекулах располагаются в строгом порядке, согласно их валентности.
2. Атом углерода в органических молекулах всегда имеет валентность равную четырём.
3. Порядок соединений атомов в молекуле и характер химических связей между атомами называется химическим строением.
4. Свойства органических соединений зависят не только от того, какие атомы и в каких количествах входят в состав молекулы, но и от химического строения:
5. Изучая свойства органических соединений, можно сделать вывод о строении данного вещества и описать это строение одной-единственной химической формулой.
6. Атомы в молекуле влияют друг на друга, и это влияние сказывается на свойствах вещества.
При изучении органической химии нужно чаще вспоминать эти положения и, прежде чем описывать свойства какого-либо вещества, следует указать его строение при помощи химической формулы, в которой будет показан порядок соединения атомов в молекуле — графическая формула.
Особенности строения органических соединений
Органическая химия изучает строение молекул и свойства соединений углерода, кроме самых простых (угольная и синильная кислоты и их соли).
В состав неорганических соединений могут входить любые из 114 известных в настоящее время химических элементов. Сейчас известно более 0,5 млн неорганических веществ.
В состав органических молекул обычно входят атомы 6 химических элементов: C, H, O, N, P, S. И тем не менее в настоящее время известно более 20 миллионов органических соединений.
Почему органических веществ так много?
Поскольку в состав любого органического соединения входит атом углерода, попробуем найти ответ на этот вопрос, рассмотрев особенности строения атома углерода.
Углерод — химический элемент 2-го периода, IV группы Периодической системы химических элементов Менделеева, следовательно, строение его атома можно изобразить так:
Таким образом, на внешнем уровне атома углерода находится четыре электрона. Являясь неметаллом, атом углерода может и отдавать четыре электрона, и принимать до завершения внешнего уровня также четыре электрона. Поэтому:
В состав углеродных цепочек может входить разное число атомов углерода: от одного до нескольких тысяч. Кроме того, цепочки могут иметь разное строение:
Между атомами углерода могут возникать химические связи разного типа:
Поэтому всего лишь четыре (!) атома углерода могут образовать более 10 соединений разного строения, даже если в состав таких соединений будут входить только атомы углерода и водорода. Эти соединения будут иметь, например, следующие «углеродные скелеты»:
Задание 17.1. Попробуйте составить сами 2–3 цепочки атомов углерода иного строения из четырёх атомов углерода.
Выводы
Способность атомов углерода образовывать УГЛЕРОДНЫЕ ЦЕПИ разного состава и строения — главная причина многообразия органических соединений.
Классификация органических соединений
Поскольку органических соединений очень много, их классифицируют по разным признакам:
В данном пособии будут рассмотрены свойства соединений различных классов, поэтому определения и примеры будут даны позднее.
Формулы органических соединений
Формулы органических соединений можно изображать по-разному. Состав молекулы отражает молекулярная (эмпирическая) формула:
Но эта формула не показывает расположения атомов в молекуле, т. е. строения молекулы вещества. А в органической химии это понятие — химическое строение молекулы вещества — самое главное! Последовательность соединения атомов в молекуле показывает графическая (структурная) формула. Например, для вещества строения С4Н10 можно написать две такие формулы:
Можно показать все химические связи:
Такие развёрнутые графические формулы наглядно показывают, что атом углерода в органических молекулах четырёхвалентен. При составлении графических формул нужно сначала изобразить углеродную цепь, например:
Затем чёрточками обозначить валентность каждого атома углерода:
У каждого атома углерода должно быть четыре чёрточки!
Затем заполнить «свободные» валентности атомами водорода (или другими одновалентными атомами или группами).
Теперь можно переписать эту формулу в сокращённом виде:
Если вы хотите сразу написать такую формулу для бутана — ничего сложного нет, нужно только считать до четырёх. Изобразив углеродный «скелет», нужно задать себе вопрос: сколько валентностей (чёрточек) имеет данный конкретный атом углерода?
Две. Значит, нужно добавить 2 атома водорода:
Следует помнить, что графические формулы можно записывать по-разному. Например, графическую формулу бутана можно записать так:
Поскольку последовательность расположения атомов не нарушилась, то это формулы одного и того же соединения(!) Проверить себя можно, составив названия этих соединений (см урок 17.7). Если названия веществ совпадают, то это — формулы одного и того же вещества.
Изомерия
К середине 19-го века, когда было получено и изучено достаточно много органических соединений, химики-органики обнаружили непонятное явление: соединения, имеющие одинаковый состав, имели разные свойства! Например, газ, который с трудом вступает в реакции и не реагирует с Nа, имеет состав C2H6O. Но существует жидкость, имеющая тот же состав и очень активная в химическом отношении. В частности, эта жидкость состава C2H6O активно реагировала с Na, выделяя водород. Совершенно разные по физическим и химическим свойствам вещества имеют одинаковую молекулярную формулу! Почему? Ответ на этот вопрос можно получить при помощи теории строения органических соединений Бутлерова, одно из положений которой утверждает: «Свойства органических соединений зависят от химического строения их молекул».
Так как химические свойства рассматриваемых соединений различны, значит, их молекулы имеют разное строение. Попробуем составить графические формулы этих соединений. Для вещества состава C2H6O можно предложить только два вида цепочек:
Заполнив эти «скелеты» атомами водорода, получаем:
Вопрос. Какое из этих соединений способно реагировать с Nа, выделяя водород?
Очевидно, к такому взаимодействию способно только вещество (I), содержащее связь «О–Н», которой нет в молекуле (II). И газ Н2 выделяется потому, что разрушается связь «О–Н». Если бы для образования водорода нужно было бы разрушить связь «С–Н», то поскольку такие связи есть в обоих веществах, газ Н2 выделялся бы в обоих случаях. Таким образом, формула (I) отражает строение молекулы жидкости, а формула (II) — газа.
Существование соединений, которые имеют одинаковый состав, но разное химическое строение, называется изомерией.
ИЗОМЕРЫ — это соединения, которые имеют одинаковый состав, но разное химическое строение, а значит, и разные свойства.
Поэтому молекулы органических соединений следует изображать при помощи графических (структурных) формул, так как в этом случае будет видно строение изучаемого вещества, а значит, будет видно, как и за счёт чего происходит химическая реакция.
Упражнение 17.1. Среди следующих соединений найдите изомеры:
Решение. Поскольку изомеры имеют одинаковый состав, определим состав (молекулярные формулы) всех этих соединений, то есть пересчитаем число атомов углерода и водорода:
Ответ. Соединения а) и б) изомерны друг другу, так как имеют одинаковый состав C4H10, но различное химическое строение.
Соединения в) и г) изомерны друг другу, так как имеют одинаковый состав C5H12, но различное химическое строение.
Задание 17.2. Среди следующих соединений найдите изомеры:
Гомологи
Из того же положения теории строения органических соединений Бутлерова следует, что вещества, имеющие похожее (сходное) строение молекул, должны иметь и похожие (сходные) свойства. Органические соединения, которые имеют похожее строение, а, значит, и похожие свойства, образуют гомологические ряды.
Например, углеводороды, в составе молекул которых есть только одна двойная связь, образуют гомологический ряд алкенов:
Углеводороды, в молекулах которых имеются только простые связи, образуют гомологический ряд алканов:
Члены любого гомологического ряда называются ГОМОЛОГАМИ.
Гомологи — это органические соединения, которые похожи по химическому строению и, значит, по свойствам. Гомологи отличаются друг от друга по составу на группу СН2 или (СН2)n.
Убедимся в этом на примере гомологического ряда алкенов:
Задание 17.3. Сравните состав членов гомологического ряда алканов (гомологов алканов) и убедитесь, что по составу они отличаются на группу СН2 или (СН2)n.
Выводы
Гомологи похожи по строению, а значит, и по свойствам; гомологи отличаются по составу на группу СН2. Группа СН2 называется гомологической разностью.
Названия углеводородов. Правила международной номенклатуры
Для того чтобы понимать друг друга, нужен язык. Люди говорят на разных языках и не всегда понимают друг друга. Химики же, для того чтобы понимать друг друга, пользуются одним и тем же международным языком. Основу этого языка составляют названия соединений (номенклатура).
Правила номенклатуры (названий) органических соединений были приняты в 1965 году. Они называются правилами ИЮПАК (IUPAC)*.
* IUPAC — International Union of Pure and Applied Chemistry — Международный союз чистой и прикладной химии.
За основу названий органических соединений принимаются названия гомологов-алканов:
** Для этих соединений имеется ввиду, что они имеют линейное строение.
В этих названиях КОРНИ слов (полужирный шрифт) — мет-, эт-, проп- и так далее — указывают на число атомов углерода в цепи:
Задание 17.4. Сколько атомов углерода содержит углеродная цепь соединений:
Суффикс в названии указывает на характер (тип) связей. Так, суффикс -ан- показывает, что все связи между атомами углерода простые.
Задание 17.5. Вспомните, что такое гомологи, и установите, являются ли гомологами алканов следующие вещества:
В названиях могут быть и другие суффиксы:
Упражнение 17.2. Попробуйте составить графические формулы ЭТана, ЭТена и ЭТина.
Решение. Все эти вещества имеют корень -ЭТ-, то есть в состав этих веществ входит . атома углерода. В первом веществе имеется . связь, так как суффикс -ан-:
Рассуждая аналогично, Вы получите:
Предположим, нужно изобразить графическую формулу пропина.
1. Корень -проп- указывает, что в цепи 3 атома углерода:
2. Суффикс -ин- указывает, что имеется одна тройная связь:
3. Каждый атом углерода имеет валентность IV. Поэтому допишем недостающие атомы водорода:
Задание 17.6. Составить графическую формулу пропена.
Теперь, предположим, нужно составить графическую формулу бутена. Корень -бут- означает, что в цепи имеется 4 атома углерода, суффикс -ен- указывает, что имеется двойная связь. Но где расположена эта связь? Возможны варианты:
Значит, в этом случае необходимо обозначить место двойной связи. Для этого атомы углерода нумеруют. Нумерацию начинают с того конца углеродной цепи, к которому ближе кратная двойная связь:
Хотя двойная связь в каждом случае соединяет два атома углерода, после суффикса -ен- записывают меньший номер.
Задание 17.7. Составьте графические формулы соединений: а) пентен-2; б) бутин-1.
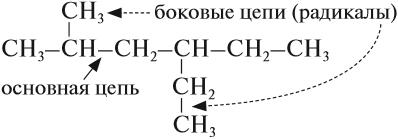
Ранее было сказано, что углеродные цепи могут быть линейными и разветвлёнными. Мы научились составлять названия линейных углеводородов. Теперь рассмотрим правила составления названий разветвлённых углеводородов. Для этого вспомним, что разветвлённые углеводороды имеют ответвления (боковые цепи, радикалы) от основной цепи:
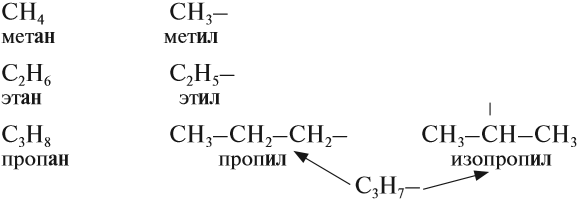
Ответвления от основной (главной) цепи называются радикалами.
Радикалы по составу отличаются от соответствующего углеводорода на один атом водорода:
Названия радикалов предельных углеводородов имеют суффикс -ил-:
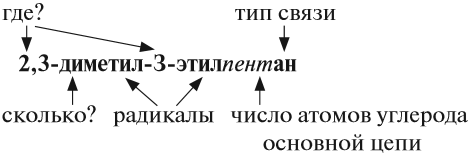
Правила составления названий углеводородов:
1) выбрать главную цепь: она должна быть самой длинной и самой разветвлённой (содержать максимальное число радикалов);
2) атомы углерода, которые не вошли в состав главной цепи, образуют боковые цепи (радикалы);
3) нумерацию атомов главной (основной) цепи начинают с того конца, от которого ближе кратная связь, а для предельных углеводородов — с того конца, к которому ближе радикал. В любом случае сумма номеров, которые появились в названии, должна быть наименьшей;
4) перед названием радикала ставят номер атома углерода (адрес), с которым он соединён;
5) если одинаковых радикалов несколько, то их число обозначают так:
6) затем записывают названия соответствующих радикалов (начиная с самых простых) и в конце названия записывают название углеводорода — основной цепи, указывая тип связи и место положения этой связи.
Упражнение 17.3. Назвать углеводород:
1. Выберем самую длинную цепь; в данном случае она содержит 5 атомов углерода: корень — пент.
2. Все связи простые: суффикс -ан-. Получается: пентан.
3. Нумеруем главную цепь слева направо, так как к левому концу ближе радикал «метил-»:
4. У второго атома углерода и у третьего атома углерода имеется по одному радикалу «метил-», то есть всего два радикала «метил-»; обозначим их «ди»; получаем: 2,3-диметил…
5. У третьего атома углерода есть ещё один радикал «этил-», поэтому получаем:
Упражнение 17.4. Назвать:
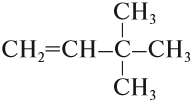
Пример. Составить графическую формулу углеводорода: 3,3-диметилбутен-1.
1. Определим число атомов углерода в основной цепи:
2. Определим тип химической связи в основной цепи:
3. Составляем «углеродный скелет»:
4. У атома углерода № 3 имеется два (ДИ) радикала «метил», т. е. каждый радикал имеет один атом углерода:
5. Допишем атомы водорода согласно валентности:
Задание 17.8. Составьте структурные (графические) формулы: