использование плазмид какая инженерия
Что такое генная инженерия и зачем вмешиваться в природу организмов
Содержание:
Генная инженерия — это современное направление биотехнологии, объединяющее знания, приемы и методики из целого блока смежных наук — генетики, биологии, химии, вирусологии и так далее — чтобы получить новые наследственные свойства организмов.
Перестройка генотипов происходит путем внесения изменений в ДНК (макромолекулу, обеспечивающую хранение, передачу из поколения в поколение и реализацию генетической программы развития и функционирования живых организмов) и РНК (одну из трех основных макромолекул, содержащихся в клетках всех живых организмов).
Если внести в растение, микроорганизм, организм животного или даже человека новые гены, можно наделить его новой желательной характеристикой, которой до этого он никогда не обладал. С этой целью сегодня генная инженерия используется во многих сферах. Например, на ее основе сформировалась отдельная отрасль фармацевтической промышленности, представляющая собой одну из современных ветвей биотехнологии.
История развития
Истоки
Основы классической генетики были заложены в середине XIX века благодаря экспериментам чешского-австрийского биолога Грегора Менделя. Открытые им на примере растений принципы передачи наследственных признаков от родительских организмов к их потомкам в 1865 году, к сожалению, не получили должного внимания у современников, и только в 1900 году Хуго де Фриз и другие европейские ученые независимо друг от друга «переоткрыли» законы наследственности.
Параллельно с этим шел процесс формирования знаний о ДНК. Так, в 1869 году швейцарский биолог Фридрих Мишер открыл факт существования макромолекулы, а в 1910 году американский биолог Томас Хант Морган обнаружил на основе характера наследования мутаций у дрозофил, что гены расположены линейно на хромосомах и образуют группы сцепления. В 1953 году было сделано важнейшее открытие — американец Джон Уотсон и британец Фрэнсис Крик установили молекулярную структуру ДНК.
На подъеме
К концу 1960-х годов генетика активно развивалась, а ее важными объектами стали вирусы и плазмиды. Были разработаны методы выделения высокоочищенных препаратов неповрежденных молекул ДНК, плазмид и вирусов, а в 1970-х годах был открыт ряд ферментов, катализирующих реакции превращения ДНК.
Генная инженерия как отдельное направление исследовательской работы зародилась в США в 1972 году, когда в Стэнфордском университете ученые Пол Берг, Стэнли Норман Коэн, Герберт Бойер и их научная группа внедрили новый ген в бактерию кишечной палочки (E. coli), то есть создали первую рекомбинантную ДНК.
Техника ПЦР была впервые разработана в 1980-х годах американским биохимиком Кэри Маллисом. Будущий лауреат Нобелевской премии по химии (1993 года), обнаружил в специфический фермент — ДНК-полимеразу, который участвует в репликации ДНК. Этот фермент буквально считывает отрезки цепи нуклеотидов молекулы и использует их в качестве шаблона для последующего копирования генетической информации.
Новая эра
В 1996 году методом пересадки ядра соматической клетки в цитоплазму яйцеклетки на свет появилось первое клонированное млекопитающее — овца Долли. Это событие стало революционным в истории развития генной инженерии, потому что впервые стало возможным серьезно говорить о создании клонов и выращивании живых организмов на основе молекул.
Технологии генной инженерии
Генная инженерия за короткий срок оказала огромное влияние на развитие различных молекулярно-генетических методов и позволила существенно продвинуться на пути познания генетического аппарата.
Так, появилась технология CRISPR — инструмент редактирования генома. В 2014 году MIT Technology Review назвал его «самым большим биотехнологическим открытием века». Он основан на защитной системе бактерий, которые производят специальные ферменты, позволяющие им защищаться от вирусов.
«Каждый раз, когда бактерия убивает вирус, она разрезает остатки его генома, будь то ДНК или РНК, и сохраняет их внутри последовательности CRISPR, как в архив. Как только вирус атакует снова, бактерия использует информацию из «архива» и быстро производит защитные белки Cas9, в которых заключены фрагменты генома вируса. Если вдруг эти фрагменты совпадают с генетическим материалом нынешнего атакующего вируса, Cas9 как ножницами разрезает захватчика, и бактерия снова в безопасности», — поясняет Алевтина Федина, медицинский директор Checkme.
Уникальное открытие состоялось в 2011 году, когда биологи Дженнифер Дудна и Эммануэль Шарпантье обнаружили, что белок Cas9 можно обмануть. Если дать ему искусственную РНК, синтезированную в лаборатории, то он, найдя в «архиве» соответствие, нападет на нее. Таким образом, с помощью этого белка можно резать геном в нужном месте — и не просто резать, а еще и заменять другими генами.
Теоретически, технология CRISPR может позволить редактировать любую генетическую мутацию и излечивать заболевание, которое она вызывает. Но практические разработки CRISPR в качестве терапии еще только в начальной стадии, и многое еще непонятно.
Есть и другие методы генной инженерии, например, ZFN и TALEN.
Где и как применяется генная инженерия
Медицина
Уже сейчас активно применяется инсулин человека (хумулин), полученный посредством рекомбинантных ДНК. Клонированные гены человеческого инсулина были введены в бактериальную клетку, где начался синтез гормона, который природные микробные штаммы никогда не синтезировали. С 1982 года компании США, Японии, Великобритании и других стран производят генно-инженерный инсулин.
Кроме того, несколько сотен новых диагностических препаратов уже введены в медицинскую практику. Среди лекарств, находящихся в стадии клинического изучения, препараты, потенциально лечащие артрозы, сердечно-сосудистые заболевания, онкологию и СПИД. Среди нескольких сотен генно-инженерных компаний 60% заняты именно разработкой и производством лекарственных и диагностических средств.
«В медицине среди достижений генной инженерии сегодня можно выделить терапию рака, а также другие фармакологические новинки — исследования стволовых клеток, новые антибиотики, прицельно бьющие по бактериям, лечение сахарного диабета. Правда, пока все это на стадии исследований, но результаты многообещающие», — говорит Алевтина Федина.
Сельское хозяйство
В сельском хозяйстве одна из важнейших задач генной инженерии — получение растений и животных, устойчивых к вирусам. В настоящее время уже есть виды, способные противостоять воздействию более десятка различных вирусных инфекций.
Еще одна задача связана с защитой растений от насекомых-вредителей. Путем генетической модификации растений можно уменьшить интенсивность обработки полей пестицидами. Например, трансгенные растения картофеля и томатов стали устойчивы к колорадскому жуку, растения хлопчатника — к разным насекомым, в том числе и к хлопковой совке.
Использование генной инженерии позволило сократить применение инсектицидов (препаратов для уничтожения насекомых) на 40–60%.
Благодаря генной инженерии зерновые культуры стали более устойчивы к климатическим условиям, кроме того появилась возможность увеличить количество витаминов и полезных веществ в продукте. Например, можно обогатить рис витамином «А» и выращивать его в тех регионах, где люди имеют массовую нехватку этого элемента.
С помощью генной инженерии пытаются решить и экологические проблемы. Так, уже созданы особые сорта растений с функцией очистки почвы. Они поглощают цинк, никель, кобальт и иные опасные вещества из загрязненных промышленными отходами почв.
Скотоводство
В Кемеровской области работа генетиков позволила получить устойчивое к вирусу лейкоза племенное поголовье высокопродуктивных животных. Для проведения эксперимента кузбасские ученые отобрали здоровых коров черно-пестрой породы массой до 500 кг. Животным трансплантировали модифицированные эмбрионы, устойчивые к вирусу лейкоза. В середине сентября 2020 года родилось 19 телят с измененными генами.
«В месячном возрасте была проведена оценка, которая показала, что телята отличаются от своих сверстников только устойчивостью к вирусу. Пять особей отобрали для дальнейшей селекционной работы. Это позволит закрепить наследственные признаки устойчивости к вирусу лейкоза у последующих поколений», — пояснила руководитель проекта, доктор биологических наук, профессор кафедры зоотехнии Кузбасской ГСХА Татьяна Зубова.
По словам Зубовой, лейкоз крупного рогатого скота — вирусная хронически неизлечимая болезнь, при которой возникают поражение кроветворной системы и новообразования. Данное заболевание наносит значительный ущерб генофонду пород и мясной промышленности в целом, потому что мясо зараженных животных запрещено употреблять в пищу. Единственным доступным методом борьбы с лейкозом ранее было только уничтожение зараженного скота.
Этот успех позволяет говорить о том, что в дальнейшем будет возможно редактировать гены крупного рогатого скота и от других болезней.
С прицелом на человека
В 2009 году группа ученых под руководством молодого исследователя Джея Нейтца из Вашингтонского университета сумели с помощью генной терапии вернуть обезьянам способность различать оттенки зеленого и красного, которой они были лишены от рождения.
В область сетчатки глаза двух подопытных обезьян был введен безвредный вирус, несущий недостающий ген фоточувствительного рецептора. Вскоре после процедуры обе обезьяны начали различать оттенки красного и зеленого на сером фоне. Два года наблюдения не выявили у них каких-либо нарушений, поэтому ученые не исключают, что данную методику уже вскоре можно будет применять у людей, страдающих дальтонизмом.
Ученые шагнули еще дальше и уже пробуют выращивать в теле животных органы для трансплантации людям. Для минимизации риска отторжения тканей животным вводят специальные гены. Этими опытами занимается научная лаборатория Рослинского института в Великобритании, которая представила миру овцу Долли.
В 2019 году британские ученые вывели кур, яйца которых содержат два вида человеческих белков, способных противодействовать артриту и некоторым видам онкологических заболеваний. В яйцах содержится человеческий белок под названием IFNalpha2a, обладающий мощными противовирусными и противораковыми свойствами, а также человеческий и свиной вариант белка под названием макрофаг-CSF, который планируют использовать для создания препарата, стимулирующего самостоятельное заживление поврежденных тканей.
Изменение ДНК человека
Первые клинические испытания методов генной терапии были предприняты 22 мая 1989 года с целью генетического маркирования опухоль-инфильтрующих лимфоцитов в случае прогрессирующей меланомы.
14 сентября 1990 года в Бетесде (США) четырехлетней девочке, страдающей наследственным иммунодефицитом, обусловленным мутацией в гене аденозиндезаминазы (АDA), были пересажены ее собственные лимфоциты.
Работающая копия гена ADA была введена в клетки крови с помощью модифицированного вируса, в результате чего клетки получили возможность самостоятельно производить необходимый белок. Через шесть месяцев количество белых клеток в организме девочки поднялось до нормального уровня.
После этого область генной терапии получила толчок к дальнейшему развитию. С 1990-х годов сотни лабораторий ведут исследования по использованию генной терапии для лечения различных заболеваний. Уже сегодня с помощью генной терапии можно лечить диабет, анемию и некоторые виды онкологии.
Генная терапия
Генная терапия — введение, удаление или изменение генетического материала, в частности ДНК или РНК, в клетке пациента для лечения определенного заболевания.
Существует три основных стратегии использования генной терапии:
Наиболее часто применяемый метод включает вставку «терапевтического» гена для замены «ненормального» или «вызывающего болезнь».
В 2015 году впервые была проведена процедура изменения ДНК человека с целью продления молодости клеток, когда американке Элизабет Пэрриш 44 лет ввели в организм препарат, влияющий на ДНК, а в 2018 году китайский ученый Хэ Цзянькуй заявил, что с его помощью у двух детей-близнецов якобы изменены гены для выработки у них иммунитета к вирусу ВИЧ, носителем которого являлся их отец.
Все это, с одной стороны, выглядит грандиозно и обнадеживает, но с другой, — вызывает опасения, ведь генетические манипуляции, теоретически, возможно использовать не только в благих и мирных целях.
После эксперимента с ДНК близнецов в Китае, ЮНЕСКО выступила с инициативой о запрете изменения генов у новорожденных до того момента, пока достоверно не будет доказана безопасность таких манипуляций.
Этическая сторона вопроса
В 1997 году ЮНЕСКО выпустила Всеобщую декларацию о геноме человека и его правах, рекомендовав мораторий на генетическое вмешательство в зародышевую линию человека, а в декабре 2015 года на международном саммите по геномному редактированию человека изменение гаметоцитов и эмбрионов для генерации наследственных изменений у людей было объявлено безответственным.
Российское сообщество генетиков в большинстве своем считает, что такие эксперименты на данный момент преждевременны и требуют более глубокого исследования и обсуждений.
«Вопрос клонирования уже давно стоит на горизонте. Этично ли выращивать клонов, чтобы потом забирать их органы для трансплантации человеку… Большой вопрос. Само собой, это абсолютно нормально, что нет единой точки зрения, ведь смысл подобных дискуссий как раз в том, чтобы найти правильные формулировки и отрегулировать потенциально спасительное, но при этом очень опасное знание», — говорит Алевтина Федина.
Страх неизвестности
Вариантов развития событий в области генной инженерии существует множество, и далеко не все они изучены и, в принципе, известны. Поэтому они должны быть последовательно зафиксированы и регламентированы.
Естественно, больше всего опасений вызывают плохие сценарии развития событий. Как правило, все начинается с помощи людям и изобретения новых лекарств. Но потом человек может прийти к желанию сделать своего ребенка светловолосым и зеленоглазым или создать армию универсальных солдат, не боящихся боли и не ведающих страха.
Олег Долгицкий, социальный философ, отмечает, что современное общество настолько неоднородно в культурном и экономическом плане, что любые методы, способные существенно изменить геном, могут создать условия не только для классового, но и видового расслоения, где представители «первого мира» смогут существенно продлевать свою жизнь и не бояться никаких болезней, в отличие от менее богатых людей. Это является серьезнейшей почвой для конфликтов и столкновений.
Эксперты убеждены, что генная инженерия — это будущее медицины. Возможность избавить младенца от пожизненного гнета заболевания, излечить людей от рака, найти лекарство против ВИЧ — за всем этим будет стоять генная инженерия. При этом желание человека изменить, например, цвет глаз или предотвратить наследственное заболевание, несмотря на все риски, будет только расти. И похоже, что остановить этот процесс уже не представляется возможным.
Генная инженерия бактерий: с чего всё начиналось и как это работает в лаборатории сегодня

Что такое ГИ и зачем она нам нужна? Почему бактерии так популярны у генных инженеров? В каком виде проще всего внести нужный ген в бактерию? С какими трудностями можно столкнуться, работая с этими организмами? Что произошло раньше: создание первой генноинженерной бактерии или открытие структуры ДНК и генома? Об этом и многом другом читайте под катом.
0. Краткий ликбез по биологии
В данном пункте приведено краткое описание так называемой Центральной догмы молекулярной биологии. Если вы обладаете базовыми знаниями в молекулярной биологии, то смело переходите к пункту 1.
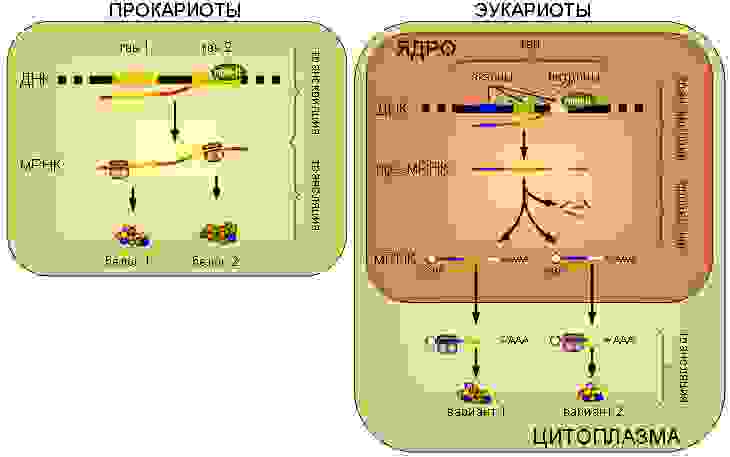
Центральная догма молекулярной биологии в одной картинке
Итак, начнём. Вся информация о всех стадиях развития и свойствах любого организма, будь то прокариоты (бактерии), археи или эукариоты (все остальные одно- и многоклеточные), закодирована в геномной ДНК, которая представляет собой комплекс двух комплементарных друг другу полинуклиотидных цепей, образующих двойную спираль (комплементарные нуклеотиды ДНК: A-T и G-C). Хромосомы эукариот представляют собой линейные двухцепочечные молекулы ДНК, а хромосомы прокариот закольцованы. Зачастую гены составляют лишь небольшую часть всего генома (у человека — около 1,5%).
Примеры мономеров ДНК и РНК. «Дезокси» в названии ДНК означает отсутствие атома кислорода в положении 2′ (на рисунке положение 2′ обведено красным).

Две комплементарные друг другу цепи ДНК. Пунктирными линиями показаны водородные связи между основаниями. Как видно, аденин и тимин образуют между собой две водородные связи, а гуанин и цитозин — три. Поэтому связь G-C прочнее и GC-богатые участки двухцепочечной ДНК сложнее разделить на две цепочки.
Обратите внимание, что у каждой из цепей обозначены 5′-конец и 3′-конец. Видно, что около 5′-конца левой цепи находится 3′-конец правой и наоборот, поэтому цепи называют «антипараллельными». Также 5′- и 3′-конец есть и у РНК. Сами положения 5′ и 3′ выбраны для обозначения начала и конца потому, что именно через них образуются ковалентные связи в цепочках ДНК и РНК.
Цепочки ДНК и РНК.
Последовательности ДНК и РНК всегда записывают от 5′-конца к 3′-концу. На то есть ряд причин:

Процесс трансляции, катализируемый рибосомой. На рисунке находящиеся в составе мРНК кодоны UUU и UCG распознаются находящимися в составе молекул тРНК антикодонами AAA и AGC. Транспортная РНК с антикодоном CCC уже отдала свою аминокислоту растущей белковой цепочке, а тРНК с антикодоном CAG ждёт своей очереди. Показанный на рисунке участок молекулы мРНК состоит из четырёх кодонов: GGGUUUUCGGUC. Кодон GGG соответствует аминокислоте глицину, UUU — фенилаланину, UCG — серину, GUC — валину. Значит данный участок мРНК кодирует фрагмент белка с аминокислотной последовательностью глицин-фенилаланин-серин-валин.
Рибосомные РНК — незаменимые компоненты рибосомы. Основной функцией рРНК является обеспечение процесса трансляции: она участвует в считывании информации с мРНК при помощи адапторных молекул тРНК и катализе образования пептидных связей между присоединёнными к тРНК аминокислотами и растущей цепью белка.
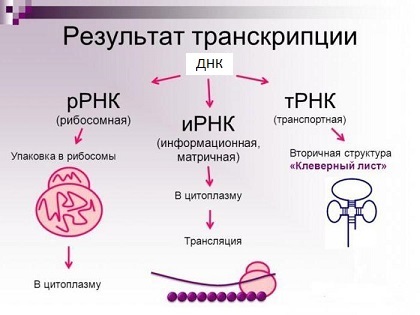
Основные типы молекул РНК (на самом деле их куда больше).
Белок же представляет собой цепочку аминокислот, ковалентно связанных между собой через пептидную связь (про то, что это такое можно посмотреть в спойлере чуть дальше). После синтеза цепь аминокислот должна принять определённую пространственную структуру — «конформацию» (про пространственную структуру белков на Geektimes уже рассказывали до меня). Кроме того, многие крупные белки на самом деле состоят из нескольких белков, объединённых гидрофобными взаимодействиями и водородными связями в единую устойчивую конструкцию. В этом случае каждый из «строительных белков» называют «субъединица», а получившийся крупный белок называют «мультисубъединичным».

Рибосомный комплекс. Картинка взята из публикации OlegKovalevskiy «3D-печать моделей молекул белка».
В случае с генами, кодирующими белок процесс расшифровки генетической информации выглядит так:
Также у каждого гена может быть несколько регуляторных последовательностей, которые могут находиться как непосредственно вблизи промотора (или даже перекрываться с ним), так и на расстоянии десятков тысяч пар нуклеотидов от него. Элементы, усиливающие транскрипцию называются «энхансерами», подавляющие транскрипцию называются «сайленсерами», а взаимодействующие с ними белки называются «факторами транскрипции». Хотя также факторами транскрипции принято называть и необходимые компоненты комплекса инициации транскрипции, без которых транскрипция невозможна в принципе. Дело в том, что только для запуска синтеза молекулы РНК на матрице ДНК у эукариот и архей необходима сборка целого супрамолекулярного комплекса. Простейший подобный комплекс включает в себя холофермент РНК-полимеразу и шесть так называемых «общих факторов транскрипции» (TFIIA, TFIIB, TFIID, TFIIE, TFIIF, и TFIIH). Сам комплекс называется «Transcription preinitiation complex» (видео, каждый компонент комплекса выделен тем или иным цветом).
Прокариотический транскрипционный комплекс устроен совершенно иначе, поэтому нет смысла встраивать в бактерию эукариотический ген вместе с эукариотическим промотором. Прокариотическим аналогом общих факторов транскрипции эукариот и архей можно назвать белок, называемый «сигма фактор».

Прокариотический транскприпционный комплекс. Указанные на рисунке буквы являются общепринятыми обозначениями соответствующих субъединиц. σ70 — сигма фактор генов домашнего хозяйства E. coli
Геномы прокариот и эукариот имеют много общих черт, да и упомянутая ранее Центральная догма молекулярной биологии является справедливой для обоих надцарств. Однако, существует также много существенных отличий. Например, для бактерий типична система оперонов — сгруппированных вместе генов, которые участвуют в одном и том же процессе и транскрибируются не по отдельности, а в составе одной длинной мРНК. У эукариот всё совсем иначе: гены, участвующие в одном процессе разбросаны по разным хромосомам, а сами гены разделены на кодирующие фрагменты «экзоны» некодирующими участками «интронами». При этом сначала ген транскрибируется полностью, а потом, уже на стадии РНК, интроны вырезаются, а экзоны сшиваются с образованием кодирующей мРНК. Данный процесс называется «сплайсинг». При этом в готовую мРНК могут быть вшиты не все доступные экзоны, а только часть из них, в данном случае говорят об «альтернативном сплайсинге». Таким образом, эукариотическая клетка может синтезировать несколько белков, транскрибирую при этом один и тот же ген. Кроме прочего это даёт очень важное следствие: вставлять ген эукариота в бактерию «как он есть в хромосоме» зачастую не имеет смысла, так как бактерия просто не в состоянии производить сплайсинг.
Существует и другое важное отличие. Для прокариот характерно наличие ДНК-ового генетического материала вне кольцевой «хромосомы», так называемых «плазмид» — небольших кольцевых двухцепочечных молекул ДНК. Кроме того, у прокариот нет органоидов, в том числе и ядра: все компоненты бактериальной клетки вольны путешествовать по всему внутриклеточному пространству. У эукариот же нет плазмид, зато есть пластиды и митохондрии, в геном которых плазмиды входят (согласно наиболее обоснованной гипотезе пластиды и митохондрии — это «потомки» имевших прокариотическую архитектуру генома цианобактерий и бактерий, захваченных внутрь себя древними одноклеточными протоэукариотами). При этом для эукариот уже типично наличие ядра и других внутриклеточных компартментов, окружённых собственной мембраной. Поэтому генная инженерия эукариотической клетки требует иных подходов, нежели генная инженерия бактерий.
Сам генетический код устроен следующим образом. Каждый ген/экзон состоит из набора триплетов/кодонов — последовательностей из трёх нуклеотидов, между которыми нет никаких промежутков. Триплетная организация справедлива как для генов в составе ДНК, так и для кодирующей части мРНК. В процессе трансляции транспортные РНК (тРНК), несущие определённую аминокислоту, «узнают» соответствующие им трёхбуквенные триплеты. Рибосома отсоединяет аминокислоту от тРНК и присоединяет её к растущей аминокислотной цепочке, которая по окончанию трансляции либо сразу станет зрелым полнофункциональным белков, либо перед этим дополнительно пройдёт ряд модификаций. При этом каждому триплету соответствует только одна аминокислота, но одной аминокислоте может соответствовать несколько разных кодонов. Оно и понятно, ведь в стандартном генетическом коде насчитывается 61 кодирующий кодон, а протеиногенных аминокислот всего 20 (всего кодонов, конечно, 4*4*4=64, но три из них являются некодирующими, вместо этого они служат сигналом остановки трансляции и называются «стоп-кодонами»).

Кодоны в стандартном генетическом коде. Спасибо википедии за картинку.
Так вот белки — это как раз те самые элементы, которые являются последним звеном цепочки между геномной ДНК и свойствами организма, так называемым «фенотипом». Поэтому для того, чтобы как-то изменить нужную нам характеристику важного для нас организма нам нужно таким образом изменить его ДНК, чтобы в итоге в его клетках появились определённые белки, которые и обеспечат нам целевой результат. В этом заключается основная идея всей генной инженерии.
1) Для каких целей используются бактерии в генной инженерии и почему именно они
Итак, мы разобрались с тем, как и почему последовательность геномной ДНК влияет на свойства и характеристики организма. Разумеется, будет очень хорошо, если признак полностью определяется всего одним геном — встройка небольшого фрагмента уже давно не является серьёзной проблемой. Например, часто устойчивость растения к гербициду или вредителю определяется одним геном, поэтому создание сортов с нужной резистентностью в таких случаях не составляет труда (в отличие от вывода такого растения на рынок). То же самое справедливо и для многих резистентностей бактерий к антибиотикам (на самом деле у бактерий много защитных механизмов против антибиотиков, но они работают в независимом друг от друга ключе). Противоположным примером является, например, попытка учёных научить растения усваивать азот из атмосферы. Дело в том, что единственным источником азота для растений является почва, в которой подходящие для усвоения растением азотсодержащие соединения синтезируются микроорганизмами (либо внесены в виде удобрений заботливым садоводом или проходившей мимо собачкой). Очевидно, что создание растения с альтернативным механизмом питания было бы весьма полезным для сельского хозяйства. Но, к сожалению, данный процесс настолько сложен, что проблему его «переноса» из микроорганизма в растение не удалось решить до сих пор.
Наконец, если нашей целью является получение белка для каких-то конкретных целей (исследование структуры и функций белка, создание медицинских препаратов или лабораторных реактивов на его основе, etc.) то нас, очевидно, также вполне устраивает встраивание одного единственного гена в клетку, которую в данном случае принято называть «организм-продуцент».
Бактерия в генной инженерии — это потенциальный исходный материал для создания:
Интересным является тот факт, что первые успешные опыты в области генной инженерии бактерий произошли задолго до эпохальной работы Уотсона и Крика. Более того, на основании этих опытов был доказан сам факт того, что информация содержится именно в ДНК, после чего учёные могли не тратить своё время на гипотезы об РНК и белке.
Данная работа, проведённая в 1944 году, известна, как Эксперимент Эвери, Маклеода и Маккарти, основой для которого послужила работа Фредерика Гриффита, в ходе которой было установлено, что заражение убитым патогенным и живым непатогенным штаммами пневмококка вызывает развитие болезни, в том время как по отдельности они не вызывают значительных симптомов. Из данного эксперимента был сделан вывод, что убитая бактерия способна что-то передать непатогенной «коллеге», в результате чего та становится опасной. Но что они передают друг другу? К 1944 году было три основных кандидата: ДНК, РНК и белок. Для того, чтобы установить переносчик был проведён элегантный эксперимент: в то время уже были доступны ферменты, способные разрушать отдельно ДНК (ДНКаза), отдельно РНК (РНКаза) и отдельно белки (протеиназа). Было показано, что передача патогенных свойств не происходила только в тех случаях, когда препарат мёртвого патогенного штамма был обработан ДНКазой и при этом не зависела от обработки препарата РНКазой и протеиназой.
Таким образом, было доказано, что носителем информации о признаках является именно ДНК. Кроме того, было наглядно показано, что возможно самопроизвольное проникновение инородной молекулы ДНК в бактериальную клетку.
Почему бактерии так популярны при очевидных недостатках (например, отсутствие эукариотических посттрансляционных модификаций)? Всё просто. Они неприхотливы в работе, просты в использовании и не требуют дорогих питательных сред.
2) Как создаётся генетическая конструкция, которую внедряют в бактерию
Современная генная инженерия бактерий в основном представляет собой внедрение плазмидного вектора (модифицированной бактериальной плазмиды, содержащей целевой ген и набор других необходимых элементов, о которых речь пойдёт ниже). Изменение хромосомы бактерии менее типично, но эта процедура также не является чем-то диковинным: например, ген РНК-полимеразы бактериофага Т7 был введёт в хромосому кишечной палочки с помощью вектора на основе профага λ в процессе создания одного из популярных в лабораторной плактике штаммов. Причин, по которым зачастую исследователь выберет внедрение гена в составе плазмидного вектора три:
Кроме гена и промотора основными элементами плазмидного вектора являются:
Другим примером может служить, использование гена β-глюкуронидазы (GUS). Данный фермент превращает определённые соединения в окрашенные или флуоресцирующие, что может быть обнаружено визуально по окрашенности колонии. Естественно, данные соединения нужно добавлять в питательную селективную среду. Ещё один пример — использование гена зелёного флуоресцентного белка (GFP) (хотя использование GUS и GFP более типично для работ с клетками растений и животных);

Упрощённая схема плазмидного вектора. На рисунке обозначены ori, ген резистентности к антибиотику и полилинкер, содержащий 10 сайтов рестрикции эндонуклеазами.
Что ж, вектор у нас на руках. Как в него встроить ген? И вообще, где этот ген взять?
Допустим, что мы знаем последовательность нуклеотидов нужного нам гена. Тогда поступают следующим образом:

Слева изображён процесс сборки гена методом перекрывающихся праймеров (более подробно процедура описана в спойлере ниже). Справа изображён процесс вставки гена в вектор.
Перекрывающиеся праймеры синтезированы таким образом, что после сборки образуется полноразмерный ген, по бокам которого расположены сайты разрезания теми же эндонуклеазами, сайты которых расположены в полилинкере вектора. Таким образом, если обработать нужными эндонуклеазами (в моём примере это ферменты BamH1 и EcoR1) вектор и собранный ген, то на них образуются липкие концы, которые могут «узнать друг друга» за счёт комплементарных взаимодействий нуклеотидов липких концов. Но одного узнавания мало, так как пока что липкие концы держаться друг за друга исключительно за счёт непрочных водородных связей. Эта проблема решается за счёт добавления в реакционную смесь одновременно разрезанного вектора, разрезанного гена и фермента ДНК-лигазы, который устраняет разрывы цепей в двухцепочечных молекулах ДНК.
Также важным фактором при сборке гена является тот факт, что частоты тех или иных кодонов у разных организмов различны, при этом в клетках как правило больше тех тРНК, которые соответствуют более «популярным» кодонам. Поскольку многие аминокислоты кодируются несколькими кодонами, то велика вероятность того, что бездумно скопировав ген из одного организма в другой мы рискуем получить сильную задержку процесса трансляции. Действительно, если в новом организме многие кодоны этого гена редки, то рибосома будет дольше «ждать» когда же наконец приплывёт нужная тРНК.
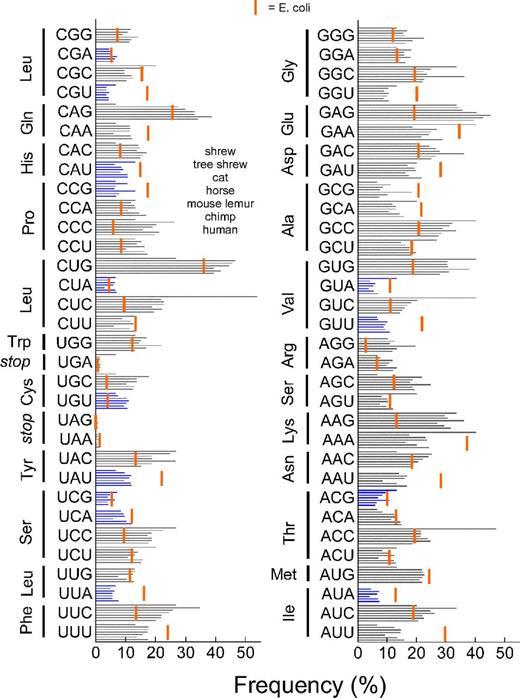
На рисунке синими полосками показаны частоты кодонов у землеройки, тупайи, домашней кошки, лошади, мышиного лемура, шимпанзе и человека. Красной полосой отмечена частота кодонов у кишечной палочки E. coli.
Теперь несколько слов о промоторе. Выбор подходящего промотора очень важен, так как процесс транскрипции во многом зависит от него. Промоторы условно делят на сильные, средней силы и слабые. «Сила» промотора определяется тем, насколько активно транскрибируются гены под его контролем при прочих равных: чем активнее транскрипция, тем сильнее промотор. Очевидно, что когда мы хотим создать продуцент белка, то начинать следует с сильных промоторов. В некоторых случаях чрезмерно быстрая транскрипция (следовательно, и активная трансляция) наносит вред клетке, в таком случае можно попробовать использовать более слабый промотор. Хотя на деле повлиять на активность транскрипции уже имеющегося продуцента куда проще, чем создавать новый.
Важно другое. Зачастую кодируемые вектором белки оказывают крайне негативное влияние на жизнеспособность бактерии. Мало того, что синтез этих белков забирает на себя большое количество ресурсов (а количество целевого белка по хорошему должно быть не ниже 10% от общей сухой массы клетки), так они к тому же мёртвым грузом плавают туда-сюда по цитоплазме! Поэтому до поры до времени лучше экспрессию чужеродного для клетки гена вообще выключить. С этой целью были разработаны контролируемые экспрессионные системы, позволяющие «включать» экспрессию нужного нам гена «по команде». Наиболее распространены:
Дело в том, что у кишечной палочки есть свои правила питания. Во-первых, существует механизм подавления активности lac-оперона, который включён только тогда, когда в клетку не поступает лактоза. Это логично: зачем тратить силы на синтез того, что не пригодится? Но как только лактоза начинает поступать в клетку в достаточном количестве этот механизм выключается.
Однако, есть второй механизм подавления активности lac-оперона. Если в среде есть глюкоза, то клетка питается исключительно глюкозой, так как она активирует второй механизм ингибирования транскрипции lac-оперона. Таким образом, lac-оперон активен только тогда, когда в окружающем клетку пространстве есть только лактоза. Минусом лактозного оперона является крайне слабый промотор, поэтому в штаммах продуцентах он заменён на сильный. Сильные промоторы часто получают из патогенов. Наиболее широко используемые в генной инженерии прокариот сильные промоторы выделены из бактериальных вирусов — бактериофагов. Например, широко используется промотор фага Т7.
К слову, некоторые сильные промоторы для генной инженерии растений также выделены из вирусов, например, это промотор вируса мозаики цветной капусты.
Как было указано выше, у E. coli нет РНК-полимеразы, которая бы узнавала промоторы бактериофагов, поэтому предварительно в продуцент встраивают ген РНК-полимеразы соответствующего бактериофага.
Популярная система синтеза белка на основе E. coli несёт ген РНК-полимеразы фага Т7 под контролем промотора бактериальной РНК-полимеразы, регулируемый по механизму lac-оперона. Если данный штамм трансформировать вектором, несущим целевой ген под контролем комплекса «промотор фага Т7 + регуляция промотора по типа lac-оперона», то возникнет двухуровневый механизм ингибирования транскрипции целевого гена.
При использовании такой конструкции в питательную среду добавляют одновременно глюкозу и лактозу. В течение некоторого времени клетки будут питаться глюкозой и спокойно делится, так как синтез чужеродного белка полностью подавлен. К тому моменту, когда закончится глюкоза и клетки перейдут на метаболизм лактозы в культуре будет уже достаточно биомассы, как раз самое время начинать синтез нужного нам белка. Такая процедура называется «автоиндукция».
Можно поступить и по-другому: вообще не добавлять в питательную среду глюкозу и лактозу, а потом, когда культура дорастёт до нужной плотности, добавить то, что клетка примет за лактозу, но не сможет метаболизировать или разрушить. Сейчас в качестве такого индуктора используют ИПТГ.
Данный промотор инактивируется белком-репрессором cI. При этом была обнаружена термочувствительная форма этого белка, названная cI857: данный фактор транскрипции сохраняет функциональность при температуре около 30⁰С и теряет её при 42⁰С. Поэтому при использовании такой системы сначала бактериальную культуру растят до нужной плотности при 30⁰С, а затем поднимают температуру до 42⁰С, тем самым запуская синтез целевого белка.
Ну что же, вектор разработан. Дальше дело за малым — найти подходящий метод для его внесения в бактериальную клетку. Но это уже совсем другая история.