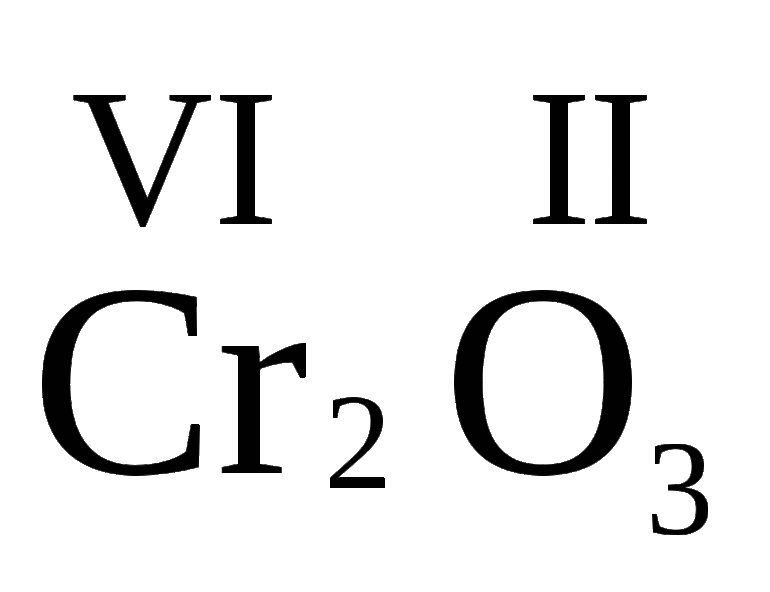Что таоке валентность в химии
Валентность и степень окисления
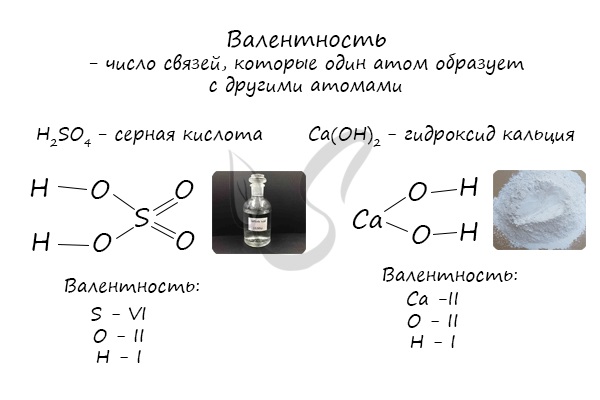
Валентность
Определяют валентность по числу связей, которые один атом образует с другими. Для примера рассмотрим две молекулы
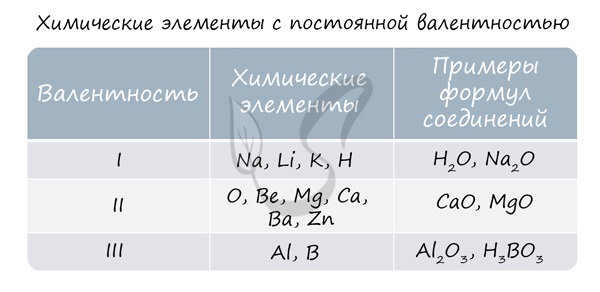
Для определения валентности нужно хорошо представлять графические формулы веществ. В этой статье вы увидите множество формул. Сообщаю вам также о химических элементах с постоянной валентностью, знать которые весьма полезно.
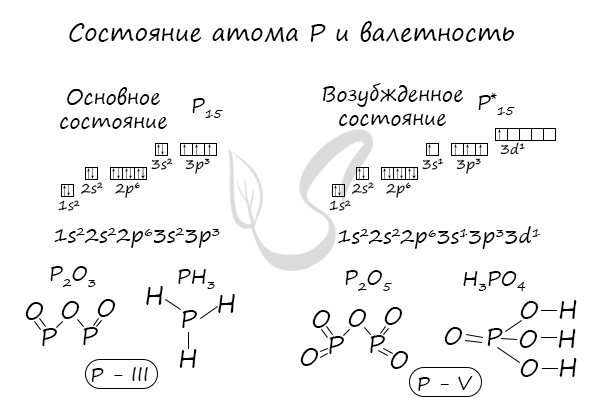
В электронной теории считается, что валентность связи определяется числом неспаренных (валентных) электронов в основном или возбужденном состоянии. Мы касались с вами темы валентных электронов и возбужденного состояния атома. На примере фосфора объединим эти две темы для полного понимания.
Подавляющее большинство химических элементов обладает непостоянным значением валентности. Переменная валентность характерна для меди, железа, фосфора, хрома, серы.
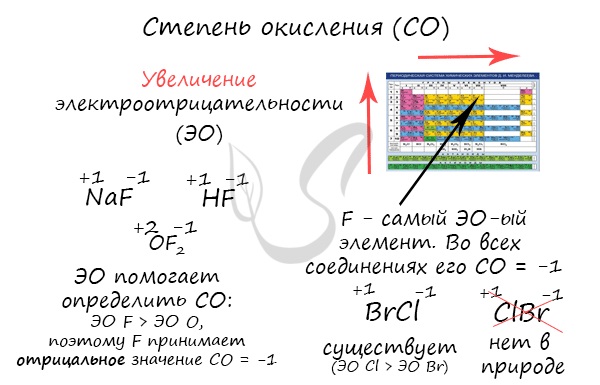
Степень окисления
Численно степень окисления равна условному заряду, который можно приписать атому, руководствуясь предположением, что все электроны, образующие связи, перешли к более электроотрицательному элементу.
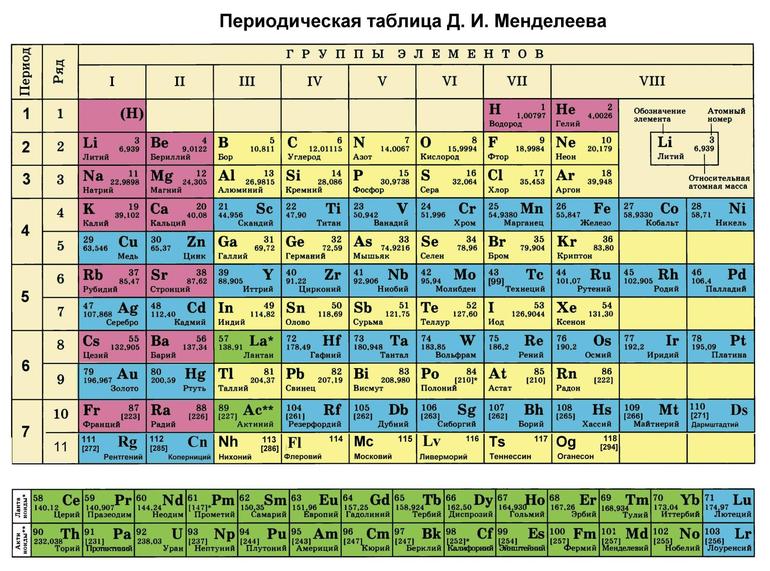
Зная изменения электроотрицательности в периодах и группах периодической таблицы Д.И. Менделеева, можно сделать вывод о том какой элемент принимает «+», а какой минус. Помогают в этом вопросе и элементы с постоянной степенью окисления.
Самостоятельно определите степени окисления атомов в следующих веществах: RbOH, NaCl, BaO, NaClO3, SO2Cl2, KMnO4, Li2SO3, O2, NaH2PO4. Ниже вы найдете решение этой задачи.
Сравнивайте значение электроотрицательности по таблице Менделеева, и, конечно, пользуйтесь интуицией 🙂 Однако по мере изучения химии, точное знание степеней окисления должно заменить даже самую развитую интуицию 😉
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Валентность и степень окисления
Валентность химических элементов
Общая характеристика
Валентность представляет способность атомов создавать химические соединения, добавлять другие атомы. С давних времен известны исторические данные о молекулярной, атомной структуре веществ.
Необходимость и основные понятия
Определение в переводе характеризует силу, создание. Главное суждение введено до открытия строения атома. Природа химических соединений заключается в делении между собой пары частиц на валентные электроны.
Число обобществленных связей, которыми атом соединяется с другими элементами, называется валентностью. В учет не берется полярность связей, поэтому показатель не имеет знака и не равен 0. В химических сочетаниях атомные частицы находятся в числовом соотношении.
Соединения водорода H с разными микрочастицами:
Атом Cl (хлора) связан с одним А. водорода, О2 (кислорода) — с двумя, азота (N)-с тремя, а углерода — с 4 атомными частицами. В молекуле углекислого газа СО2 частица Н связана с двумя атомами кислорода.
А. соединяются по-разному с другими элементами. Такая способность выражается численной характеристикой.
Обозначение валентности:
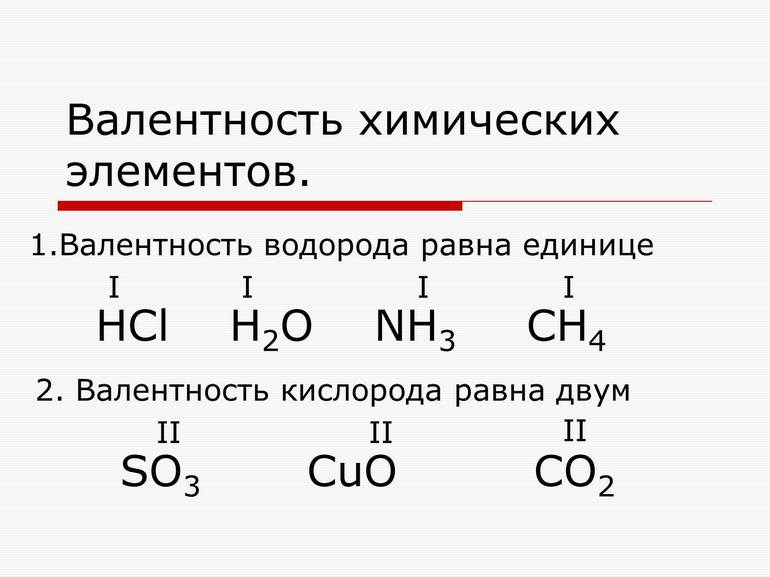
Один атом водорода соединяется только с одной частью другого элемента, соответственно, валентность принимают за 1. Объясняя «химическим» языком, атомная частица водорода обладает единицей валентности (В), он одновалентен.
Образование химических связей атома любого элемента соответствует количеству соединившихся мелких частиц водорода. В молекуле хлороводорода валентность Cl равна 1, а в молекуле воды у атома кислорода — двум. В структурной составляющей метана В. углерода равна 4. Условно в химии обозначают единицы валентности римскими цифрами I-Х.
Историческая справка и взгляды ученых
Скудные знания о строении молекулярных и атомных частицах 19 века не позволяли объяснить причины, по которым атомы образуют связи с другими элементами. Валентность как основной принцип химии изучается до сих пор.
Ученый Э. Франкленд ввел терминологию «связь» в научные труды для характеристики взаимодействия атомов между собой. Специалист выяснил, что некоторые элементы образуют соединения с одними и теми же атомами. Азот прикрепляет три водородных частицы в молекуле аммиака.
Позже ученый выдвинул теорию о существовании конкретных чисел химической связи и назвал ее «соединительной силой». Труды Франклина стали значимым вкладом в структурную химию.
Мнения, научные работы доказаны в 1860 г. немецким деятелем Ф. Кекуле. По его мнению, углерод является из четырех основным, в самом простейшем его соединении частиц (метане) образуются связи с 4 атомами Н.
В Советском союзе информацию о строении веществ систематизировал А. Бутлеров. Последующее развитие связей получило введение периодической теории Д. Менделеева. Он подтвердил, что валентность Э. в соединениях и прочие свойства обусловлены занятым положением в периодической системе.
Главным преимуществом теории В. является возможность наглядного изображения молекулярного строения. Первые модели возникли в середине 19 века, а позже использовались структурные формулы в виде окружности с химическим знаком. Между обозначений атомов черточкой выделяется связь, а число линий соответствует В.
Основная классификация
Элементы распределяются с постоянной и переменной валентностью. Углерод соединяется с различными атомами кислорода, поэтому имеет переменную валентность. Многие элементы имеют неустойчивую величину.
| Валентность | |||
| Постоянная | Переменная | ||
| Элемент | В | Элемент | В |
| H (Водород) | I | I (Йод) | I |
| Li (Литий) | S (Сера) | II, IV, VI | |
| Na (Натрий) | N (Азот) | I-V | |
| K (Калий) | F | II, III | |
| F (Фтор) | Cu | I, II | |
| Al (Алюминий), B, Р | III, V | C, Si | II, IV |
| O (Кислород), Mg (Магний), Ca (Кальций), Ba (Барий), Zn (Цинк) | II | Cl, Br, I | I, III, V, VII |
Водород образует связь не с каждым элементом, а кислородные соединения имеются почти у всех. В таких сочетаниях атомы О2 проявляют двукратную валентность.
Ковалентная связь осуществляется из-за образования общих электронных пар. Когда между 2 атомными структурами (А) существует совместная электронная пара, она называется одинарной, при наличии двух — двойной, трех — тройной.
Валентность азота N в связи NH3 составляет III, поскольку один атом Н связан с тремя частицами N. Валентность углерода в метане (СН4), по тому же принципу будет 4 (IV).
Валентность хлора в молекуле хлороводорода равна единице, индекс не применяется. Одному атому H соответствует 1 атом Cl. Если образованная химическая связь углерода © в метане равна 4, валентность Н — всегда 1. Рядом с Н ставится индекс 4, а формула метана выглядит следующим образом: CH4.
Постоянной одной В. остается H, K, F. Двухвалентные — кислород, магний, кальций, цинк, а трехвалентные — алюминий. Валентность брома, железа, меди, хлора или прочих элементов модифицируется, когда они формируют различные соединения.
Йод представлен в таблице 53 по счету. Присутствие одного неспаренного электрона говорит о способности проявлять низшую В., равную единице в соединениях. Зная валентность, можно легко составить формулы соединений.
Определение по формуле
Если под рукой нет таблицы Менделеева, то существует возможность установления В. элемента с помощью несложных расчетов. Для примера выбирается формула оксида марганца — Mn2O7.
Кислород двухвалентный, а для определения марганца В. кислорода умножают на число атомов газа в сочетании 2*7, получается 14. Это число делится на количество мелких атомных частиц Mn:14/2 = 7. В полученном соединении валентность составляет VII.
Индексы в молекулярных веществах отображают число А., входящих в состав. Получив формулу вещества, в котором известна В. одного элемента, можно определить В. другого. В веществе, состоящем из молекул число В. обоих элементов равно. Используется минимальное общее кратное для определения неизвестной В.
Например, в образовании формулы связи оксида железа Fe2O3 участвуют пара атомов Fe с валентностью III и три атома O с двойной валентностью. Минимальным общим кратным будет 6.
Для правильной формулировки записи оксида фосфора учитывается В кислорода (II) и фосфора (V). Наименьшее общее кратное для Р и О получается десять. Обозначение записывается Р2О5.
Понимая и зная свойства элементов, проявляющих в разных сочетаниях, можно находить валентность по внешнему параметру соединений. Оксиды меди (купрум) имеют красный (Cu2O) и черный (CuО) цвет. Гидроксиды меди будут желтыми (CuОН) и синими (Cu (ОН)2).
Чтобы составить формулу бинарных соединений элементов, достаточно определить валентность. Если требуется записать формулу кислородного соединения хлора (ClO), в котором валентность Cl равна 7, соблюдают последовательность:
Записывают индексы возле знаков элементов. Получается Cl2O7.
Труды Менделеева
Согласно электронной теории, В. атома определяется из числа непарных электронов (Э)., участвующих в формировании пар с Э. других атомов. Понятие В. связано с созданием закона Менделеева.
Теория электронов
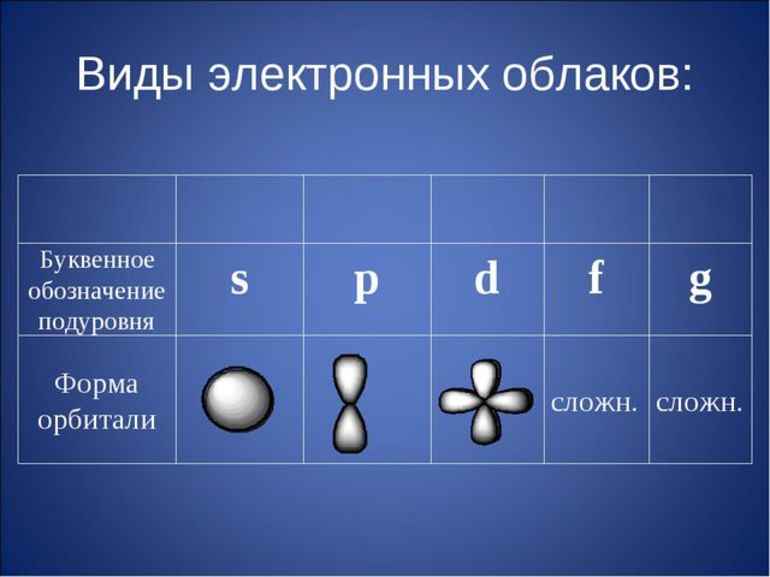
Атомы представляют положительную основу (ядро), вокруг которой расположены отрицательно заряженные электроны. Наружная оболочка последних бывает недостроенной, а завершенная структура устойчивее, она включает восемь электронов.
Создание связи за счет общих пар электронов приводит к благоприятному состоянию атомов.
Максимальная В. — это величина Э. во внешней оболочке атома. Химические связи составляют Э., находящиеся на наружной оболочке атома. Изучив таблицу Менделеева, можно определить, что положение веществ в периодической системе и его В. взаимосвязаны.
Валентность:
Основанием для образования соединений является прием электронов.
Виды электронов:
Когда атом отрицательно заряжен частицами без пары для взаимодействия, то они образуются в таком количестве, сколько имеется неспаренных электронов.
В молекулярной структуре водорода и серы H2S последнее вещество приобретает двойную валентность (-), потому что каждый атом участвует в образовании 2 электропар. Знак черточка или тире указывает на притяжение пары к более отрицательному элементу. У менее отрицательного к валентности добавляют знак плюс.
Распределение свойств
В периодической таблице указаны все 118 химических элементов (водород, литий, бор, натрий, магний, кальций, ванадий, уран и другие).
Химические и физические свойства каждого вещества похожи с предшествующим ему в таблице элементом. Закономерность проявляется у всех, кроме нескольких первых, потому что они не включают перед собой элементов, аналогичных по атомному объему.
Валентность металлов:
| Элемент | В |
| Серебро | I-III |
| Ртуть | I-II |
| Золото | I-III |
| Никель | I- IV |
| Мышьяк | -III, II, III, V |
| Свинец | II-IV |
| Кобальт | II-IV |
| Олово | II, IV |
В периодической таблице элементы классифицированы, упорядочены с учетом атомного числа, электронной конфигурации и повторяющихся химических свойств. Ряды называются периодами, а столбцы — группами. В самой первой таблице содержалось не более шестидесяти элементов, теперь продолжительность списка увеличили до 118 элементов. Систематизированы не только химические вещества, но и их свойства.
Достаточно ученому-химику взглянуть на таблицу, и он сможет ответить на разные экзаменационные, научные вопросы.
Говоря о степени окисления, предполагают, что атом в веществе ионной природы имеет заряд, и если валентность нейтральная, то уровень окисления будет нулевым, положительным или отрицательным. Узнать информацию можно из таблицы Менделеева.
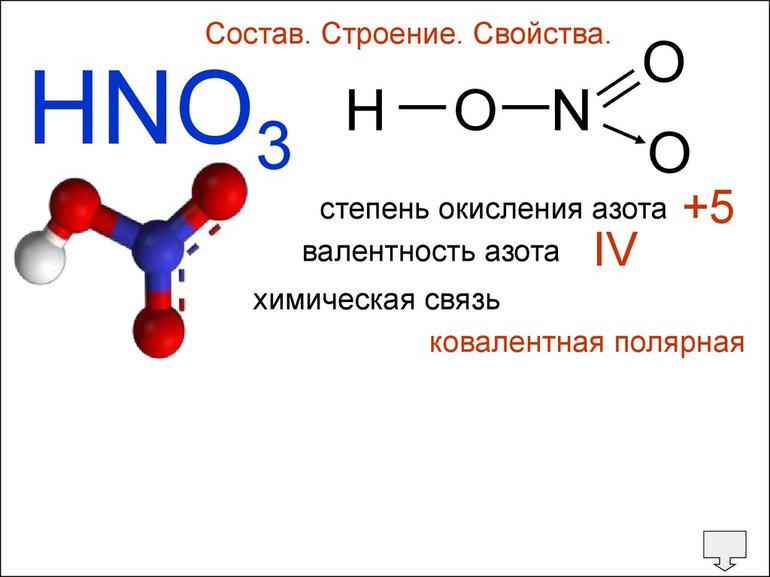
Для атома одного и того же Э., в зависимости от элементов, с которыми он сформирует химическое соединение, В. и стадия окисления совпадают (Н2О, СН4) и различаются (Н2О2, HNO3). Само понятие валентности ученые-химики не используют по Менделеевской таблице.
Валентность
Валентность — это способность атомов химических элементов образовывать определенное число химических связей с атомами других химических элементов.
Обменный механизм образования ковалентной связи — в образовании связи участвуют одноэлектронные атомные орбитали, т.е. каждый из атомов предоставляет по одному неспаренному электрону.
Донорно-акцепторный механизм — образование связи происходит за счет электронной пары одного из атомов (атом-донор) и вакантной орбитали другого атома (атом-акцептор):
Таким образом, атомы могут образовывать химическую связь не только за счет неспаренных электронов на внешнем энергетическом уровне, но и за счет неподеленных электронных пар, или свободных орбиталей на этом уровне.
Большинство элементов характеризуются высшей, низшей или промежуточной валентностью в соединениях.
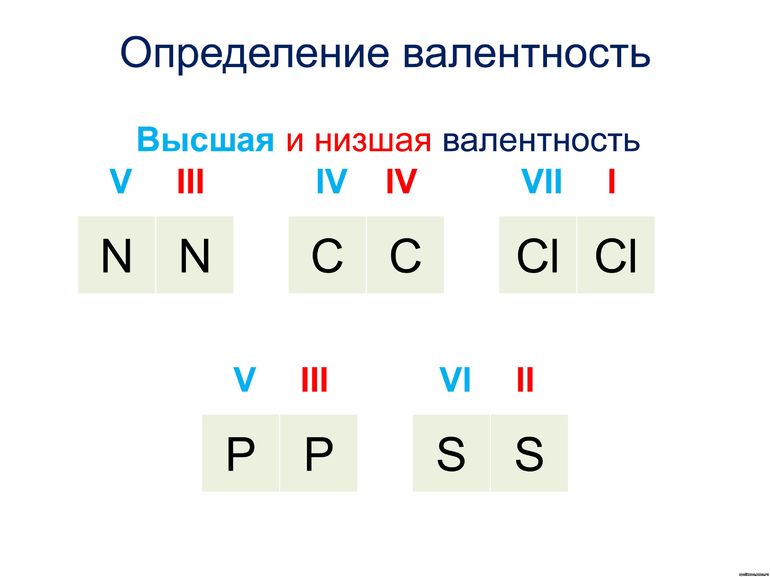
Для большинства элементов высшая валентность, как правило, равна номеру группы, низшая валентность определяется по формуле: 8 — № группы. Промежуточная валентность – это число между низшей и высшей валентностями.
Обратите внимание! Степень окисления и валентность — это не одно и то же. Хотя иногда степени окисления совпадают с валентностями. Стпень окисления — это условный заряд атома, он может быть и положительным и отрицательным. А вот образовать отрицательное число связей атом никак не может.
| Элемент | Валентность |
| Фтор F | I |
| Кислород О | II |
| Металлы IA группы (Li, Na, K, Rb, Cs, Fr) | I |
| Металлы IIA группы (Be, Mg, Ca, Sr, Ba, Ra) | II |
| Алюминий Al | III |
Как определить валентность атома в соединении?
Рассмотрим валентные возможности атомов второго периода. В силу некоторых ограничений они не соответствуют традиционным «школьным» представлениям.
Следовательно, литий может образовывать одну связь и валентность лития I.
+4Be * 1s 2 

Таким образом, на внешнем э нергетическом уровне бериллия в возбужденном энергетическом состоянии есть 2 неспаренных электрона и две вакантные электронные орбитали. Следовательно, бериллий может образовать 2 связи по обменному механизму, т.е. валентность бериллия равна номеру группы и равна II.
Электронная конфигурация атома бора в основном состоянии +5B 1s 2 2s 2 2p 1 :
+5B 1s 2 

+5B 1s 2 

Следовательно, бор может образовывать 3 связи по обменному механизму (за счет неспаренных электронов). Валентность бора в соединениях — III.
Однако, при этом у бора остается еще одна вакантная электронная орбиталь. Следовательно, бор может выступать, как акцептор электронной пары.
За счет 3 неспаренных электронов на p-подуровне азот может образовывать 3 связи по обменному механизму (валентность III), и еще 1 связь азот может образовать по донорно-акцепторному механизму за счет неподеленной электронной пары. Таким образом, максимальная валентность азота в соединениях — IV. На примере азота можно убедиться, что высшая валентность атома и максимальная степень окисления — разные величины, которые далеко не всегда совпадают. Возбужденное состояние с 5 неспаренными электронами для атома азота не реализуется, т.к. на 2 энергетическом уровне есть только s и p орбитали.
Валентность.
Валентность – свойство атомов одного химического элемента присоединять или замещать определённое количество атомов другого.
За единицу валентности принята валентность атома водорода, равная 1, то есть водород одновалентен. Поэтому валентность элемента указывает на то, со сколькими атомами водорода соединён один атом рассматриваемого элемента. Например, HCl, где хлор – одновалентен; H2O, где кислород – двухвалентен; NH3, где азот – трёхвалентен.
Таблица элементов с постоянной валентностью.
Валентности
Элементы
O, Be, Mg, Ca, Sr, Ba, Ra, Zn, Cd
Формулы веществ можно составлять по валентностям входящих в них элементов. И наоборот, зная валентности элементов, можно составить из них химическую формулу.
Алгоритм составления формул веществ по валентности.
1. Записать символы элементов.
2. Определить валентности входящих в формулу элементов.
3. Найти наименьшее общее кратное численных значений валентности.
4. Найти соотношения между атомами элементов путём деления найденного наименьшего общего кратного на соответствующие валентности элементов.
5. Записать индексы элементов в химической формуле.
Пример: составим химическую формулу оксида фосфора.
2. Определим валентности:
3. Найдём наименьшее общее кратное:
4. Найдём соотношения между атомами:
Алгоритм определения валентности по формулам химических элементов.
1. Записать формулу химического соединения.
2. Обозначить известную валентность элементов.
3. Найти наименьшее общее кратное валентности и индекса.
4. Найти соотношение наименьшего общего кратного к количеству атомов второго элемента. Это и есть искомая валентность.
5. Сделать проверку путём перемножения валентности и индекса каждого элемента. Их произведения должны быть равны.
Пример: определим валентность элементов сульфида водорода.
2. Обозначим известную валентность:
3. Найдём наименьшее общее кратное:
4. Найдём соотношение наименьшего общего кратного к количеству атомов серы: