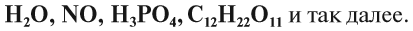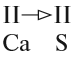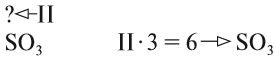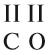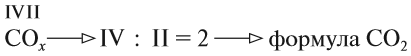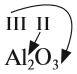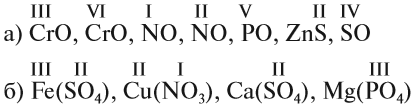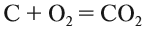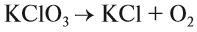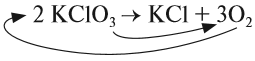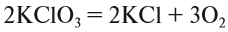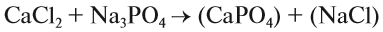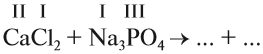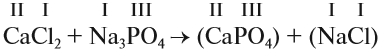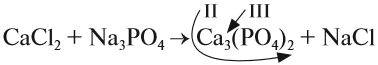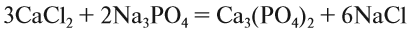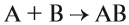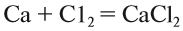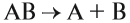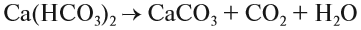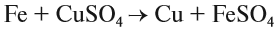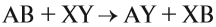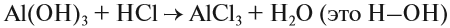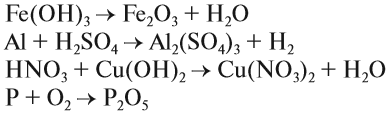что такое ухр в химии
Конспект урока по химии на тему «Классификация химических реакций» (11 класс)
Онлайн-конференция
«Современная профориентация педагогов
и родителей, перспективы рынка труда
и особенности личности подростка»
Свидетельство и скидка на обучение каждому участнику
Чернавина Ирина Алексеевна,
учитель химии МОАУ «СОШ № 85»
УМК О.С. Габриелян Химия
Тема урока: Классификация химических реакций
Общее количество часов, отведенное на изучение темы 4. Химические реакции: 11ч
Место урока в системе уроков по теме: 1
Цель урока: систематизировать знания учащихся о классификации химических реакций.
расширить и углубить знания о химических реакциях, сравнить их с другими видами явлений;
выделить существенные признаки, которые могут быть положены в основу классификации химических реакций;
рассмотреть классификацию химических реакций по различным признакам;
формировать образовательную, коммуникативную (умение работать в группе) общекультурную компетентности;
формировать умение проводить химические эксперименты с соблюдением правил техники безопасности, наблюдать за реакциями, умение работать в команде, выполнять творческие проекты;
развивать логическое мышление путём сравнения, анализа, обобщения и систематизации.
Обучающиеся должны уметь
определять тип химических реакций;
выявлять признаки, свидетельствующие о протекании химической реакции при выполнении химического опыта;
составлять уравнения химических реакций;
соблюдать правила безопасной работы при проведении опытов; проводить самостоятельный поиск химической информации с использованием различных источников;
использовать приобретенные знания и умения в практической деятельности и повседневной жизни для объяснения химических явлений, происходящих в природе, быту.
Техническое обеспечение урока:
Оборудование: таблица «Периодическая система химических элементов Д.И. Менделеева», ПК с проектором; таблица «Растворимость солей, кислот и оснований в воде»
Лабораторное оборудование: пробирки, штатив для пробирок.
Реактивы: цинк, растворы нитрата серебра, соляной кислоты, гидроксида натрия, карбоната калия, сульфата меди ( II ).
Дополнительное методическое и дидактическое обеспечение урока: видеоролик «Пробуждение природы», рабочие листы № 1-2, инструктивные карты по химическому эксперименту, эталоны заданий 1-2, слайды с заданиями контроля и ответами.
Химия может открыть определенную
последовательность даже в хаосе.
Мотивация учебной деятельности учащихся
Обобщение и систематизация знаний. Воспроизведение на новом уровне (переформулированные вопросы).
Применение знаний и умений в новой ситуации. Химический эксперимент.
Контроль усвоения, обсуждение допущенных ошибок и их коррекция.
Рефлексия (подведение итогов занятия)
I. Организационный момент.
II . Мотивация учебной деятельности учащихся.
Учитель: Здравствуйте, ребята! Сегодня я предлагаю начать урок с просмотра видеофрагмента
Видеофрагмент: ускоренная съёмка «Пробуждение природы»
Почему это происходит?
Как это может быть связано с химией?
Если бы миллионы разнообразных веществ, а, следовательно, и тела, из которых они состоят, не претерпевали изменения, мир бы был застывшим, лишенным развития, движения.
Течет жизнь… благодаря химическим реакциям. В живом организме одновременно протекают миллиарды химических реакций, в результате которых человек двигается, думает, дышит, чувствует, говорит, слушает, ощущает запахи, переваривается пища, строятся новые клетки и т.п.
III . Актуализация знаний учащихся.
Что такое «химическая реакция»?
Приведите пример конкретной химической реакции, опишите её.
Ребята описывают химические реакции, используя различные определения, признаки
Учитель: Какой приём вы использовали, ребята, при описании конкретных реакций?
Предполагаемый ответ: Приём классификации.
Учитель: что означает термин «классификация»?
«Классификация-это осмысленный порядок вещей, явлений, разделение их на разновидности согласно каким-либо важным признакам»
Итак, ребята, какова же тема сегодняшнего урока и что нам предстоит с вами сделать?
Предполагаемый ответ: Классификация химических реакций
Итак, наша задача собрать отдельные, обрывочные, разрозненные знания в единую упорядоченную систему и тогда мы легко сможем ориентироваться в любом количестве химических реакций.
Учитель: Тема для нас эта не новая, поэтому предлагаю имеющиеся знания оформить в виде кластера.
Что положим в основу?
Назовите известные вам признаки классификации химических реакций
Признаки классификации химических реакций
По числу и составу исходных веществ и продуктов реакции
По тепловому эффекту
По признаку обратимости
По признаку изменения степеней окисления
По признаку однородности реакционной системы
По наличию катализатора
IV . Обобщение и систематизация знаний
Самостоятельная работа в группах: составление кластера
Задание №1: используя текст учебника §§13-16, заполните ячейки кластера «Классификация химических реакций»
Задание выполняется на рабочих листах №1(Приложение №1)
Проверка кластера по эталону: обсуждение результатов, коррекция знаний
А теперь проиллюстрируем составленную классификацию химических реакций конкретными примерами:
Для этого, используя текст учебника §§13-16, дополните таблицу уравнениями соответствующих реакций.
Задание выполняется на рабочих листах №2 (Приложение №2)
и конечных веществ
Наличие окислительно-восстановительного процесса
Без изменения степени окисления
По признаку однородности реакционной системы
Проверка таблицы по эталону: обсуждение результатов, коррекция знаний
Учащиеся проверяют правильность выполнения работы (Приложение 3)
V . Применение знаний и умений в новой ситуации
Химический эксперимент: предложен набор реактивов и соответствующего оборудования для осуществления реакций по одному из признаков классификации ХР.
Задание №3 (на 4 варианта)
Выполняется в парах
Осуществите данные реакции, классифицируйте их по данному признаку, составьте соответствующие уравнения.
Получают экспериментальное задание, все результаты заносят в таблицу, представитель от каждой группы записывает УХР на доске, полную характеристику по классификационным признакам.
Внимание: соблюдайте ТБ!
Используя реактивы, которые находятся у вас на столе, проведите реакцию, идущую с изменением степени окисления атомов элементов, запишите соответствующее уравнение реакции, составьте электронный баланс, определите окислитель и восстановитель. Дайте характеристику данной реакции по всем признакам.
Используя реактивы, которые находятся у вас на столе, проведите реакцию обмена, запишите соответствующее уравнение реакции в молекулярном, полном и сокращенном ионном виде. Дайте характеристику данной реакции по всем признакам.
Используя реактивы, которые находятся у вас на столе, проведите экзотермическую реакцию, запишите соответствующее уравнение реакции в молекулярном, полном и сокращенном ионном виде. Дайте характеристику данной реакции по всем признакам.
Используя реактивы, которые находятся у вас на столе, проведите реакцию замещения, запишите соответствующее уравнение реакции. Дайте характеристику данной реакции по всем признакам.
Обсуждение результатов лабораторной работы, на основе чего учащиеся делают выводы, какие типы реакций были осуществлены:
Результат: сводная таблица на доске и в тетрадях
VI . Контроль усвоения, обсуждение допущенных ошибок и их коррекция.
Выполнение задания по вариантам в тетрадях.
Взаимопроверка по эталону ( Слайд)
Взаимооценивание по шкале (Слайд)
Обсуждение допущенных ошибок
Охарактеризуйте УХР по известным вам признакам классификации
2. Восстановите утраченные фрагменты УХР
5. NH 4 Cl + NaOH → NaCl + NH 3↑ + H 2 O
1) Выберите уравнения экзотермических реакций.
2) Выберите уравнение химической реакции, соответствующей характеристике: реакция разложения, эндотермическая, некаталитическая, необратимая, окислительно-восстановительная.
3) Найдите уравнение реакции обмена, идущей до конца вследствие образования газа.
4) Выберите уравнение химической реакции замещения.
5) Найдите уравнение обратимой каталитической реакции.
2. Восстановите утраченные фрагменты УХР
1) Выберите уравнения эндотермических реакций.
2) Выберите уравнение химической реакции, соответствующей характеристике: реакция разложения, эндотермическая, некаталитическая, идущая без изменения степени окисления атомов химических элементов.
3) Найдите уравнение реакции обмена, идущей до конца вследствие образования осадка.
4) Выберите уравнение химической реакции замещения.
5) Найдите уравнение обратимой каталитической реакции.
VII . Домашнее задание.
1. О. С. Габриелян, “Химия 11 класс”, §13-16.
2. Предложить примеры химических реакций, с которыми вы встречаетесь в быту или наблюдаете в природе. Составить УХР, классифицировать по известным признакам.
Оформить в виде презентации.
VIII . Подведение итогов:
Итак, ребята соотнесите, пожалуйста, ту цель, которую мы поставили перед собой в начале урока и те результаты, которые нам удалось достичь.
Предполагаемый ответ: нашей целью было собрать отдельные, обрывочные, разрозненные знания о типах химических реакций в единую упорядоченную систему, чтобы уметь ориентироваться в любом количестве химических реакций, описывать их с различных точек зрения.
Скажите, пожалуйста, ребята, приём классификации можно применить для характеристики вашей работы на уроке?
Какие критерии вы можете предложить для этой цели?
А теперь, ребята, классифицируйте свою работу на уроке по заданным критериям:
11 класс Проверочная работа
«Классификация химических реакций»
Охарактеризуйте УХР по известным вам признакам классификации
2. Восстановите утраченные фрагменты УХР
5. NH 4 Cl + NaOH → NaCl + NH 3 ↑ + …
1) Выберите уравнения экзотермических реакций.
2) Выберите уравнение химической реакции, соответствующей характеристике: реакция разложения, эндотермическая, некаталитическая, необратимая, окислительно-восстановительная.
3) Найдите уравнение реакции обмена, идущей до конца вследствие образования газа.
4) Выберите уравнение химической реакции замещения.
5) Найдите уравнение обратимой каталитической реакции.
11 класс Проверочная работа
«Классификация химических реакций»
1. Охарактеризуйте УХР по известным вам признакам классификации
2. Восстановите утраченные фрагменты УХР
1. Na + …… → 2 NaOH + H 2 + Q
1) Выберите уравнения эндотермических реакций.
2) Выберите уравнение химической реакции, соответствующей характеристике: реакция разложения, эндотермическая, некаталитическая, идущая без изменения степени окисления атомов химических элементов.
3) Найдите уравнение реакции обмена, идущей до конца вследствие образования осадка.
4) Выберите уравнение химической реакции замещения.
5) Найдите уравнение обратимой каталитической реакции.
11 класс Проверочная работа
«Классификация химических реакций»
Охарактеризуйте УХР по известным вам признакам классификации
2. Восстановите утраченные фрагменты УХР
5. NH 4 Cl + NaOH → NaCl + NH 3 ↑ + …
1) Выберите уравнения экзотермических реакций.
2) Выберите уравнение химической реакции, соответствующей характеристике: реакция разложения, эндотермическая, некаталитическая, необратимая, окислительно-восстановительная.
3) Найдите уравнение реакции обмена, идущей до конца вследствие образования газа.
4) Выберите уравнение химической реакции замещения.
5) Найдите уравнение обратимой каталитической реакции.
11 класс Проверочная работа
«Классификация химических реакций»
1. Охарактеризуйте УХР по известным вам признакам классификации
2. Восстановите утраченные фрагменты УХР
1. Na + …… → 2 NaOH + H 2 + Q
1) Выберите уравнения эндотермических реакций.
2) Выберите уравнение химической реакции, соответствующей характеристике: реакция разложения, эндотермическая, некаталитическая, идущая без изменения степени окисления атомов химических элементов.
3) Найдите уравнение реакции обмена, идущей до конца вследствие образования осадка.
4) Выберите уравнение химической реакции замещения.
5) Найдите уравнение обратимой каталитической реакции.
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
Курс профессиональной переподготовки
Методическая работа в онлайн-образовании
Курс повышения квалификации
Современные педтехнологии в деятельности учителя
Ищем педагогов в команду «Инфоурок»
Номер материала: ДБ-717725
Не нашли то что искали?
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Учителям предлагают 1,5 миллиона рублей за переезд в Златоуст
Время чтения: 1 минута
ВПР для школьников в 2022 году пройдут весной
Время чтения: 1 минута
Путин поручил не считать выплаты за классное руководство в средней зарплате
Время чтения: 1 минута
В МГПУ сформулировали новые принципы повышения квалификации
Время чтения: 4 минуты
Школьники из Москвы выступят на Международной олимпиаде мегаполисов
Время чтения: 3 минуты
Более 50 российских школ перешли на дистанционку из-за коронавируса
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Соединения химических элементов
Словарь химических терминов
АЛЛОТРОПИЯ
АМОРФНОЕ вещество
не кристаллическое вещество, т.е. вещество, не имеющее кристаллической решетки. Примеры: бумага, пластмассы, резина, стекло, а также все жидкости.
Анион
отрицательно заряженный ион
мельчайшая частица элемента, сохраняющая все его химические свойства
Атомная масса
масса атома, выраженная в атомных единицах массы. Атомная масса меньше суммы масс, составляющих атом частиц (протонов, нейтронов, электронов), на величину, обусловленную энергией их взаимодействия
Атомные радиусы
характеристики, позволяющие приближенно оценивать межатомные (межъядерные) расстояния в молекулах и кристаллах. Определяются главным образом из данных рентгеновского структурного анализа
Атомный вес
среднее значение массы атома химического элемента, выраженной в относительных углеродных единицах
Атомный номер
то же, что порядковый номер элемента в периодической системе Д.И.Менделеева. атомный номер численно равен положительному заряду ядра этого элемента, т.е. числу протонов в ядре данного элемента
Валентность
свойство атома данного элемента присоединять или замещать определенное число атомов другого элемента
Вещество
вид материи, который обладает массой покоя (элементарные частицы, атомы, молекулы и др.). В химии вещества принято подразделять на простые, образованные атомами одного химического элемента, и сложные (химические соединения)
Химиотерапия: что это и как ее делают при онкологии
Лекарственная противоопухолевая терапия, в том числе и химиотерапия, – один из основных методов лечения рака. При химиотерапии в человеческий организм вводятся различные токсические вещества, которые губительно воздействуют на клетки злокачественных опухолей. Важно при этом, чтобы яды и токсины оказывали наименьшее отрицательное воздействие на весь организм больного.
Схемы химиотерапевтического лечения регламентируются международными методиками и правилами, и рассчитываются индивидуально. Врач-химиотерапевт подбирает пациенту лечение, руководствуясь различными критериями, среди которых:
Виды химиотерапии
Сложные комбинации из нескольких химиопрепаратов на сегодняшний день используются чаще, так как они более эффективные.
Химиотерапия нередко применяется как часть комбинированного лечения рака:
Дозы и режимы применения противоопухолевых препаратов
Противоопухолевые лекарственные препараты и их дозировка подбираются строго индивидуально.
У каждого препарата имеются свои характеристики и особенности. При проведении химиотерапии важными являются следующие параметры:
Дозу препарата рассчитывают исходя из схемы химиотерапии, роста, веса, возраста, состояния больного, а в некоторых случаях, на основании лабораторных показателей пациента.
Режимы
Если необходимо повысить интенсивность химиотерапии, то увеличивают дозу препарата, это так называемая высокодозная терапия, либо сокращают интервал между курсами ХТ, то есть вводят уплотненные режимы.
Также существуют метрономные режимы применения цитостатических препаратов, когда вводятся малые дозы препаратов, но постоянно в течение длительного времени.
После каждого курса химитерапевтического лечения обязательно делается определенный перерыв для восстановления организма. Как правило, повторные курсы ХТ проводят через каждые три-четыре недели, это период, в течение которого восстанавливаются показатели лейкоцитов, тромбоцитов и пр.
При использовании некоторых химиопрепаратов, к примеру, нитрозопроизводных, этот интервал увеличивается до 6 недель.
Продолжительность лечения и количество курсов химиотерапии зависит от вида опухоли, от особенностей течения болезни от того, как организм реагирует на лечение. Иногда возникает необходимость прекратить или изменить лечение, и это решение принимает лечащий врач.
Способы применения химиопрепаратов
Правила введения противоопухолевых препаратов
Наиболее широко используется внутривенное введение противоопухолевых средств. При этом врач обязательно учитывает индивидуальные особенности вен пациентов.
Имплантируемые порт-системы
Имплантируемая порт-система — это катетер, установленный в сосуд или полость и соединенный с ним резервуар-камера. Система «порт — катетер» широко используется в медицине уже более чем 30 лет.
Порт-системы помогают проходить лечение более эффективно, безопасно и качественно. Особенно актуальна их установка в качестве устройства сосудистого доступа пациентам, которым назначено длительное лечение, при осложнениях на фоне химиотерапии, которые привели к затруднению венозного доступа.
При этом терапию пациент может получать как в условиях стационара, так и амбулаторно.
Инфузия лекарственных препаратов производится с помощью специальных игл типа Губера, которые, пунктируя силиконовую мембрану порта, позволяют вводить инфузионный раствор в резервуар, не повреждая силиконовую мембрану. Далее препарат попадает через катетер в кровоток или полость, в зависимости от вида порт-системы и места расположения катетера.
Порт- система полностью скрыта под кожей. Поэтому она подходит для длительного использования, не обременяет пациента и не мешает проведению гигиенических процедур. Необходимо помнить, что при отсутствии использования порт-систему необходимо промывать как минимум 1 раз в 2 месяца.
Подготовка к химиотерапии
Чтобы не было проблем с поиском вен и установкой катетера за день до химиотерапии желательно выпить 1,5-2 литра жидкости.
Для тренировки вен рекомендуется периодически сжимать кистевой эспандер по 10 мин 3 раза в день или до усталости. При этом рука должна быть свешена ниже уровня сердца.
В день проведения ХТ нужно держать руки в тепле, возможно применение теплых обертываний на места инъекций. Можно периодически обрабатывать руки теплыми полотенцами.
Во время прохождения химиотерапии
В день химиотерапии, с утра необходимо позавтракать.
Далее необходимо соблюдать несколько несложных правил:
Об осложнениях после химиотерапии читайте здесь.
Возможно ли повысить эффективность химиотерапии?
Поиск основных направлений повышения эффективности терапии опухолей осуществляется в разных направлениях:
Урок 1. Основные понятия и законы предмета «Химия»
Простейшие понятия: вещество, молекула, атом, химический элемент
Что такое химия? Где мы встречаемся с химическими явлениями? Везде. Сама жизнь — это бесчисленное множество разнообразных химических реакций, благодаря которым мы дышим, видим голубое небо, ощущаем изумительный запах цветов…
Что изучает химия? Химия изучает вещества, а также химические процессы, в которых участвуют эти вещества.
Что такое вещество — понятно: это то, из чего состоит окружающий нас мир и мы сами. Но что такое химический процесс (явление)?
К химическим явлениям относятся процессы, в результате которых изменяется состав или строение молекул, образующих данное вещество. Изменились молекулы — изменилось вещество (оно стало другим!), — изменились его свойства:
Все эти изменения — следствие сложных и многообразных химических процессов. Итак,
химия — это наука о веществах и их превращениях.
При этом исследуются не всякие превращения, а только такие, при которых
В этом определении встречаются такие понятия, как «вещество», «молекула», «атом». Разберём их подробнее.
Вещество — это то, из чего состоят окружающие нас предметы. Каждому абсолютно чистому веществу (таких в природе, кстати, не существует) приписывают определённую химическую формулу, которая отражает его состав, например:
Выше приведены молекулярные формулы двух веществ. Следует отметить, что далеко не все вещества состоят из молекул, так как существуют вещества, которые состоят из атомов или ионов. Например, алмаз состоит из атомов углерода, а обычная поваренная соль — из ионов Na + и ионов Cl – (условная «молекула» — NaСl).
Наименьшая частица вещества, которая отражает его качественный и количественный состав, называется молекулой.
Молекулы состоят из атомов. Атомы в молекуле соединены при помощи химических связей. Каждый атом обозначается при помощи символа (химического знака):
Число атомов в молекуле обозначают при помощи индекса:
Но! Если атомы не связаны химической связью, то их число обозначают при помощи коэффициента:
Аналогично изображают число молекул:
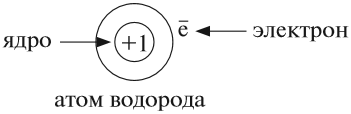
Почему атомы водорода и кислорода имеют разное название, разный символ? Потому что это атомы разных химических элементов.
Химический элемент — это частицы с одинаковым зарядом ядер их атомов.
Что такое ядро атома? Почему заряд ядра является признаком принадлежности атома к данному химическому элементу? Чтобы ответить на эти вопросы, следует уточнить: изменяются ли атомы в химических реакциях? Из чего состоит атом*?
* Подробнее о строении атома будет рассказано в уроке 3.
Атом не имеет заряда, хотя и состоит из положительно заряженного ядра и отрицательно заряженных электронов:
В ходе химических реакций число электронов любого атома может изменяться, но заряд ядра атома в химических реакциях НЕ МЕНЯЕТСЯ!
Поэтому заряд ядра атома — своеобразный «паспорт» химического элемента. Все атомы с зарядом ядра +1 принадлежат химическому элементу под названием «водород». Атомы с зарядом ядра +8 составляют химический элемент «кислород».
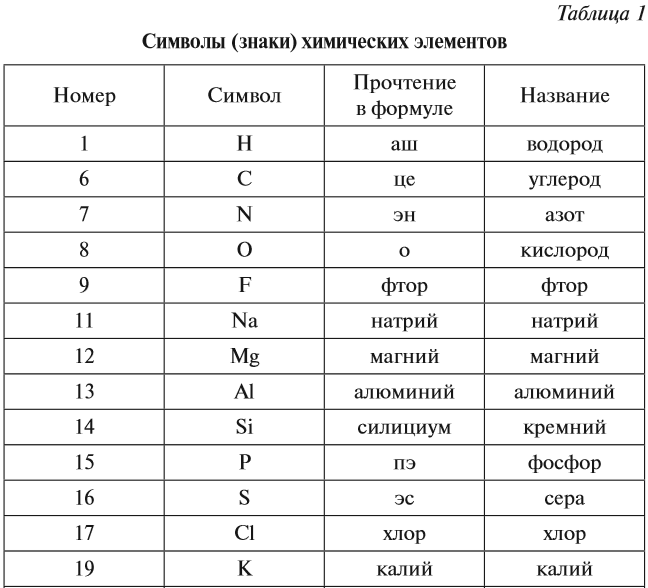
Каждому химическому элементу присвоен химический символ (знак), порядковый номер в таблице Менделеева (порядковый номер равен заряду ядра атома); определённое название и, для некоторых химических элементов, особое прочтение символа в химической формуле (табл. 1).
Подведём итог. Вещества состоят из молекул, молекулы состоят из атомов, атомы с одинаковым зарядом ядра относятся к одному и тому же химическому элементу.
Но, если вещество состоит из молекул, то любое изменение состава или строения молекулы приводит к изменению самого вещества, его свойств.
Вопрос. Чем отличаются химические формулы веществ: Н2О и Н2О2?
Хотя по составу молекулы этих веществ отличаются на один атом кислорода, сами вещества по свойствам сильно отличаются друг от друга. Воду Н2О мы пьём и жить без неё не можем, а Н2О2 — перекись водорода, пить нельзя, а в быту её используют для обесцвечивания волос.
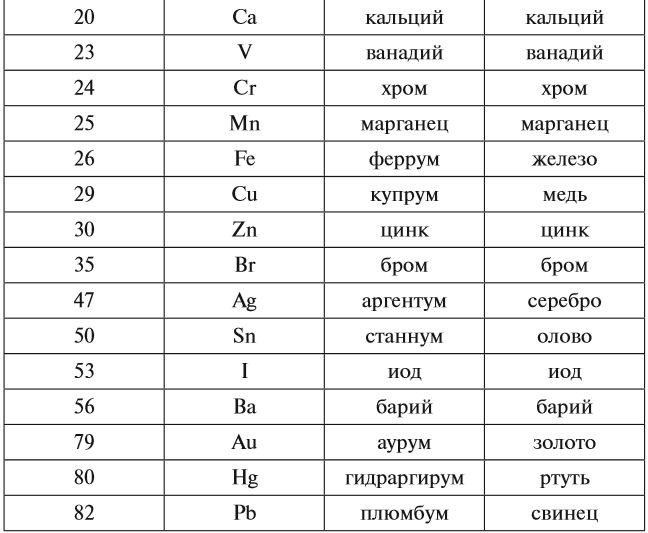
Вопрос. А чем отличаются химические формулы веществ:
Состав этих веществ — аллозы (А) и глюкозы (Б) — одинаков — С6Н12О6. Отличаются они строением молекул, в данном случае — расположением групп ОН в пространстве. Глюкоза — универсальный источник энергии для большинства живых организмов, а аллоза практически не встречается в природе и не может быть источником энергии.
Простые и сложные вещества. Валентность
Вещества бывают простые и сложные. Если молекула состоит из атомов одного химического элемента, — это простое вещество:
Если в состав вещества входят атомы только одного химического элемента — это простое вещество. Причём некоторые химические элементы образуют несколько простых веществ. Так, химический элемент кислород образует простое вещество «кислород» О2 и простое вещество «озон» О3*.
* В 2002 г. появилось сообщение о существовании ещё одного простого вещества кислорода — O4.
А химический элемент углерод образует четыре простых вещества, причём ни одно из них не называется «углерод». Эти вещества отличаются пространственным расположением атомов:
В четвертой модификации «углерода» — фуллерене — атомы углерода образуют сферу, т. е. молекулы фуллерена напоминают мячик.
Существование элемента в виде нескольких простых веществ называется аллотропией. Алмаз, графит, карбин, фуллерен — аллотропные модификации элемента «углерод», а кислород и озон — аллотропные модификации элемента «кислород».
Таким образом, не следует путать эти понятия: «химический элемент» и «простое вещество», а также «молекула» и «атом».
Очень часто в письменных записях слова «молекула» или «атом» заменяют соответствующими символами, но не всегда правильно. Так, нельзя писать: «В состав воды входит Н2», так как речь здесь идёт о химическом элементе водороде — Н. Нужно писать: «В состав воды входит (Н)». Аналогично, правильной будет запись: «При действии металла на раствор кислоты выделится Н2», т. е. вещество водород, молекула которого двухатомна.
Молекулы сложных веществ состоят из атомов разных химических элементов:
Как известно, в состав сложных веществ входят атомы разных химических элементов. Эти атомы соединяются между собой химическими связями: ковалентными, ионными, металлическими.
Способность атома образовывать определённое число ковалентных химических связей называется валентностью. (Подробнее см. урок 4 «Химическая связь».) Правильнее всего определять валентность по графическим или структурным формулам:
В таких формулах одна чёрточка обозначает одну ковалентную связь, т. е. «одну валентность». На практике чаще всего валентность определяют по молекулярной формуле, хотя здесь правильнее говорить о степени окисления элемента (см. урок 7). Иногда результат определения степени окисления соответствует реальному значению валентности, но бывают и неодинаковые результаты.
Задание 1.1. Определите «валентность» (степени окисления) атомов кальция и углерода по формуле СаС2. Совпадает ли полученный результат с реальным значением валентности?
В устойчивой молекуле не может быть «свободных», «лишних» валентностей! Поэтому для двухэлементной молекулы число химических связей (валентностей) атомов одного элемента равно общему числу химических связей атомов другого элемента.
Валентность атомов некоторых химических элементов постоянна (табл. 2).
Для других атомов валентность можно определить (вычислить) из химической формулы вещества.
Строго говоря, по нижеизложенным правилам определяют не валентность, а степень окисления (см. урок 7). Но поскольку в некоторых соединениях числовые значения этих понятий совпадают, то иногда по формуле можно определять и валентность.
При этом следует учитывать изложенное выше правило о химической связи.
Сделаем практические выводы.
1. Если один из атомов в молекуле одновалентен, то валентность второго атома равна числу атомов первого элемента (см. на индекс!):
2. Если число атомов в молекуле одинаково, то валентность первого атома равна валентности второго атома:
3. Если у одного из атомов индекс отсутствует, то его валентность равна произведению валентности второго атома на его индекс:
4. В остальных случаях ставьте валентности «крест-накрест», т. е. валентность первого атома равна числу атомов второго элемента и наоборот:
Задание 1.2. Определите валентности элементов в соединениях:
Вначале укажите валентности атомов, у которых она постоянна! Аналогично определяется валентность атомных групп (ОН), (РО4), (SО4) и так далее.
Задание 1.3. Определите валентности атомных групп (в формулах выделены курсивом):
Обратите внимание! Одинаковые группы атомов (OH), (РО4), (SO4) имеют одинаковые валентности во всех соединениях.
Зная валентности атома или группы атомов можно составить формулу соединения. Для этого пользуются правилами:
Задание 1.4. Составьте химические формулы соединений:
Уравнения химических реакций
Вещества, состав которых отражают химические формулы, могут участвовать в химических процессах (реакциях). Графическая запись, соответствующая данной химической реакции, называется уравнением химической реакции. Например, при сгорании (взаимодействии с кислородом) угля происходит химическая реакция:
Запись показывает, что один атом углерода С, соединяясь с одной молекулой кислорода O2, образует одну молекулу углекислого газа СО2. Число атомов каждого химического элемента до и после реакции должно быть одинаково! Это правило — следствие Закона сохранения массы вещества: масса исходных веществ равна массе продуктов реакции. Закон был открыт в 18-м веке М. В. Ломоносовым и, независимо от него, А. Л. Лавуазье.
Выполняя этот закон, необходимо в уравнениях химических реакций расставлять коэффициенты так, чтобы число атомов каждого химического элемента не изменялось в результате реакции. Например, при разложении бертолетовой соли КClO3, получается соль КСl и кислород О2:
Число атомов калия и хлора одинаково, а кислорода — разное. Уравняем их:
Теперь изменилось число атомов калия и хлора до реакции. Уравняем их:
Теперь между правой и левой частями уравнения можно поставить знак равенства:
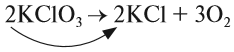
Полученная запись показывает, что при разложении двух молекул КClO3 получается две молекулы КСl и три молекулы кислорода O2. Число молекул показывают при помощи коэффициентов.
При подборе коэффициентов необязательно считать отдельные атомы. Если в ходе реакции не изменился состав некоторых атомных групп, то можно учитывать число этих групп, считая их единым целым:
Последовательность действий такова:
1. Определим валентность исходных атомов и группы PO4:
2. Перенесём эти числа в правую часть уравнения:
3. Составим химические формулы полученных веществ по валентностям составных частей:
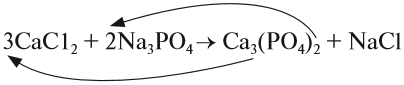
4. Обратим внимание на состав «самого сложного» соединения: Ca3(PO4)2 и уравняем число атомов кальция (их три) и число групп РО4 (их две):
5. Число атомов натрия и хлора до реакции теперь стало равным шести; доставим соответствующий коэффициент:
Эти правила образуют Алгоритм составления уравнений химических реакций обмена, так как, пользуясь этой последовательностью, можно уравнять схемы многих химических реакций, за исключением более сложных окислительно-восстановительных реакций (см. урок 7).
Химические реакции бывают разных типов. Основными являются:
1. Реакции соединения:
Здесь из двух и более веществ образуется одно вещество:
2. Реакции разложения:
Здесь из одного вещества получаются два вещества и более веществ:
3. Реакции замещения:
Здесь реагируют простое и сложное вещества, образуются также простое и сложное вещества, причём простое вещество замещает часть атомов сложного вещества:
4. Реакции обмена:
Здесь реагируют два сложных вещества и получаются два сложных вещества. В ходе реакции сложные вещества обмениваются своими составными частями:
Существуют и другие типы химических реакций.
Задание 1.5. Расставьте коэффициенты в предложенных выше примерах.
Задание 1.6. Расставьте коэффициенты и определите тип химической реакции:
Выводы
Вещества бывают простые и сложные. Состав веществ показывают при помощи химических формул. Формулы веществ составляют, учитывая валентности составных частей этих веществ. Запись химического процесса при помощи формул называется уравнением химической реакции. Химические реакции бывают разных типов: обмена, замещения, разложения, соединения и другие.