Что такое цикл амплификации
Сущность ПЦР и циклы синтеза ДНК
В современной медицине интенсивно применяются новые технологии для диагностики и лечения заболеваний. Для выявления возбудителей инфекции в последние годы в дополнение к традиционным микробиологическим и иммунологическим исследованиям все более широко используются методы молекулярной биологии.
В настоящее время амплификация нуклеиновых кислот полимеразной цепной реакцией (ПЦР) достаточно широко распространена в практической медицине. Данный метод незаменим в следующих случаях:
В основе полимеразной цепной реакции лежит достраивание ДНК-матрицы по принципу комплементарности с помощью фермента ДНК-полимеразы, что носит название репликации или амплификации.
In vivo она включает несколько стадий:
Открытие у бактерий Thermis aguatis термостабильной ДНК-полимеразы, которая действует при температуре 70-72 °С, позволило осуществить репликацию ДНК in vitro и сделать процесс циклическим. При многократном повторении циклов репликации происходит увеличение числа копий фрагмента ДНК. Все это позволяет из единичных клеток микроорганизмов, содержащихся в анализируемом биологическом материале, получить необходимое количество ДНК для их идентификации. Чувствительность метода составляет 0,5-1 бактерия или вирусная частица на пробу.
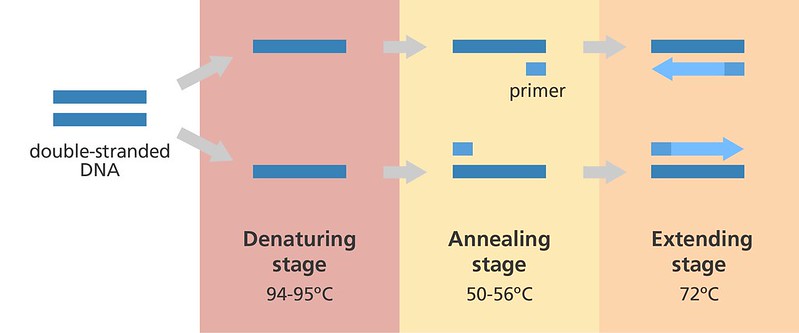
Каждый цикл синтеза (амплификации) состоит из 3-х этапов, протекающих в различных температурных режимах.
При его разработке требуется найти фрагмент молекулы ДНК, который бы отличался генетической консервативностью и присутствовал только у интересующего нас вида микроорганизмов, при этом длина фрагмента должна составлять примерно 20 нуклеотидов.
Поскольку наращивание дочерних нитей ДНК может идти одновременно на обеих цепях материнской ДНК, то для работы ДНК-полимеразы на второй цепи тоже требуется свой праймер. Таким образом, в реакционную смесь вносятся два праймера. Фактически праймеры, присоединившись к противоположным цепям молекулы ДНК, ограничивают собой тот ее участок, который будет в дальнейшем многократно удвоен или амплифицирован. Такие фрагменты ДНК называются ампликонами. Длина ампликона может составлять несколько сот нуклеотидов. Меняя пару праймеров, мы можем переходить от анализа одного возбудителя к анализу другого.
Если в растворе не окажется ни одной молекулы ДНК с участком, комплементарным внесенным праймерам, даже несмотря на то, что в растворе будет плавать миллион других молекул ДНК, реакция полимеразной цепной реакции не произойдет.
В случае диагностики некоторых инфекций, например, вирусного гепатита В, С, D, необходимо большее число ампликонов, а значит, и циклов (40-45).
Весь технологический процесс с использованием полимеразной цепной реакции осуществляется в виде трех основных процедур: пробоподготовка клинических образцов; проведение самой полимеразной реакции, направленной на умножение (амплификацию) фрагментов ДНК биологического возбудителя; детекция продукта ПЦР, т.е. оценка результата.
Результаты ПЦР анализируют с использованием метода иммуноферментного анализа, электрофореза в плоском агаровом геле. Его окрашивают бромистым этидием, и полосы анализируют с последующим фотографированием. При этом расстояние пробега полосы исследуемой пробы, соответствующее таковому в положительном контроле, свидетельствует о синтезе фрагмента ДНК возбудителя.
=================
Вы читаете тему:
Полимеразная цепная реакция. Сущность метода, его преимущества и возможности.
Костюк С. А. БелМАПО.
Опубликовано: «Медицинская панорама» № 9, ноябрь 2003.
Что такое полимеразная цепная реакция и как она работает?
ДНК (дезоксирибонуклеиновая кислота) составляет основу бесчисленных исследований с участием живых организмов. Из кода ДНК мы можем определить генетическую основу заболеваний, разработать лекарства, провести судебно-медицинскую экспертизу, идентифицировать микробы и многое другое.
Самое главное, что нужно для такого исследования, — это большое количество исследуемого фрагмента ДНК. Однако ДНК, выделенной из клеток, тканей или любого другого биологического источника, часто бывает недостаточно для анализа. Таким образом, ученым нужно делать больше копий ДНК.
Именно здесь и проявляется решающая роль «полимеразной цепной реакции».
Что такое полимеразная цепная реакция?
ПЦР использует способность ферментов полимеразы создавать копии генетического материала в лабораторных условиях.
До появления ПЦР копии ДНК создавались путем выделения определенного фрагмента ДНК и вставки его в геном живых клеток. Живые клетки реплицировали вставленную ДНК, одновременно реплицируя свою собственную ДНК. Этот метод был трудоемким и длительным способом получения копий ДНК, достаточных для дальнейшего изучения.
Однако теперь это уже не так. Основная заслуга в этом принадлежит Кэри Маллису, который в 1983 году изобрел «полимеразную цепную реакцию» (ПЦР), положив начало «биотехнологической революции». Сегодня ПЦР является очень распространенной лабораторной техникой даже в небольших лабораториях и используется для создания копий ДНК на регулярной основе.
ПЦР может избирательно создавать копии интересующей ДНК посредством процесса, часто называемого «молекулярным фотокопированием». После синтеза нескольких копий ДНК с помощью ПЦР ДНК подвергается «амплификации».
Каковы компоненты реакции ПЦР?
Ключевыми компонентами реакции ПЦР являются матричная ДНК, праймеры, нуклеотиды и термостойкая ДНК-полимераза. Давайте кратко узнаем о каждом из этих компонентов.
Для ПЦР можно использовать ДНК от простейших бактерий до самых сложных животных и растений. Однако вся ДНК (шаблонная ДНК) не проходит ПЦР; в ходе процесса будет амплифицирована только небольшая часть.
Нуклеотиды, используемые для реакции ПЦР, представляют собой смесь всех четырех азотистых оснований, обнаруженных в ДНК. Это аденин (A), тимин (T), гуанин (G) и цитозин (C).
ДНК-полимераза, используемая в ПЦР, представляет собой термостабильную ДНК-полимеразу (часто называемую полимеразой Taq), выделенную из термофильных организмов, способных выдерживать высокие температуры.
Каковы этапы реакции ПЦР?
Активность полимеразы зависит от наличия одноцепочечной ДНК, с которой могут связываться праймеры. Этого можно добиться, нагрев образец ДНК при температуре 94-98 °C.
На следующем этапе праймеры связываются (отжигаются) с шаблонной ДНК в определенных местах. Прямой праймер связывается с началом шаблонной ДНК (одна нить двухцепочечной ДНК) на 3 п.н. нуклеотидной последовательности ATG (стартовый кодон). Обратный праймер связывается с концом комплементарной ДНК (второй нити двухцепочечной ДНК) на 3 п.н. нуклеотидных последовательностей TAG, TAA или TGA (стоп-кодоны). ДНК между стартовым и стоп-кодонами амплифицируется.
Успех этого этапа зависит от последовательности праймеров и температуры, выбранной для отжига, обычно 50-65 °C.
Последним и завершающим этапом является элонгация или терминация, которая происходит при 72 °C, оптимальной температуре для активности Taq-полимеразы. ДНК-полимераза распознает связанный с праймером участок ДНК и добавляет нуклеотиды, комплементарные нити шаблонной ДНК. Это происходит до тех пор, пока она не встретит второй праймер.
После успешной реакции терминации вместо одной спирали ДНК, использовавшейся на начальном этапе, образуются две спирали ДНК. В каждой из двух спиралей ДНК одна нить будет исходной нитью, полученной из образца ДНК. Другая нить будет комплементарной нитью, синтезированной ДНК-полимеразой в ходе ПЦР.
В чем заключается принцип амплификации ДНК с помощью ПЦР?
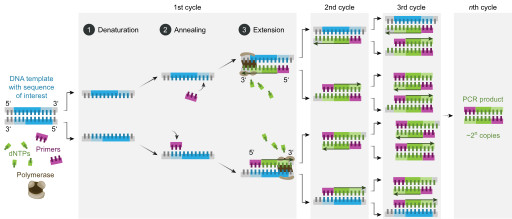
Этапы денатурации, отжига и полимеризации составляют один цикл ПЦР. Типичная реакция ПЦР может потребовать 25-35 циклов для оптимальной амплификации ДНК.
В конце одного цикла из одного шаблона ДНК образуются две молекулы ДНК. В конце двух циклов две ДНК образуют четыре молекулы ДНК, которые затем амплифицируются до восьми молекул ДНК в конце трех циклов. В конце n циклов будет 2n копий исходного шаблона ДНК.
После каждого цикла количество молекул ДНК, которые могут служить шаблонами для следующего цикла, увеличивается экспоненциально. Это увеличение числа шаблонов цикл за циклом является основой амплификации молекул ДНК в ПЦР.
Экспоненциальная амплификация молекул ДНК с помощью метода ПЦР
Каковы плюсы и минусы ПЦР?
Основные плюсы метода ПЦР заключаются в том, что он способен создавать миллионы и миллиарды копий ДНК всего за несколько часов. Этот метод быстр, относительно прост в освоении и может быть выполнен в базовых лабораторных условиях.
Основным недостатком является высокая чувствительность метода, поэтому образец, используемый для амплификации, должен быть свободен от загрязнений. Даже небольшие следы нежелательной ДНК могут амплифицироваться вместе с интересующей ДНК, что дает ложные результаты.
Другим недостатком является требование информации о последовательности ДНК для разработки праймеров. Кроме того, праймеры могут иногда отжигать не на тех участках ДНК. Такой неспецифический отжиг праймеров может привести к амплификации неправильного фрагмента ДНК.
В редких случаях ДНК-полимераза может включить неправильное основание, что приведет к изменению последовательности интересующей ДНК, что может повлиять на последующий процесс.
Для успешного проведения реакции ПЦР необходимо иметь чистый генетический материал, соответствующий набор праймеров и подходящую температуру отжига.
Где можно использовать эту технологию?
Он составляет основу большинства приложений, связанных с молекулярной биологией, клонированием генов, технологией рекомбинантной ДНК и мутагенезом.
Практическое развитие простой и универсальной техники ПЦР, предложенной Кэри Маллис, радикально изменило биологические исследования. Все, что нам нужно сделать, это смешать все компоненты ПЦР в соответствующих концентрациях в маленькой пробирке, загрузить ее в ПЦР-машину (термоциклер) и подождать несколько часов. После периода ожидания исследователи получат от миллионов до миллиарда копий интересующей вас ДНК. Разве это не удивительно?
Вот почему ПЦР всегда будет быстрым и надежным методом создания копий ДНК по сравнению с методами, использовавшимися до этого революционного открытия.
Особенности выполнения диагностического ПЦР-анализа
Особенности выполнения диагностического ПЦР-анализа
Успех диагностических анализов на основе полимеразной цепной реакции (ПЦР) в значительной степени вызван скоростью получения результата по сравнению со многими общепринятыми методами диагностики. Например, обнаружение и идентификация микобактерий, хламидий, микоплазм, бруцелл и других медленно-растущих бактерий можно ускорить от нескольких дней до одного рабочего дня, если клинические образцы исследуются напрямую. Другие микробные агенты, которые трудно размножать за пределами их естественного хозяина, часто обнаруживаются с помощью техник, основанных на обогащении питательной среды, поэтому применение ПЦР является единственной альтернативой демонстрации их наличия. Кроме того, метод амплификации ДНК имеет огромный потенциал в плане чувствительности и специфичности.
Сегодня, если в лаборатории вводится ПЦР-анализ, диагносты рассчитывают на ускорение исследования клинических образцов без предварительного обогащения и, в то же время, возможность проведения специфической дифференциации между близкородственными видами или подтипами. В то время как потенциал ПЦР-методов в выполнении этих требовательных критериев не вызывает сомнений, часто возникает необходимость в критической оценке предложенной методологии не только на случай очевидного провала или неэффективности, но также и для оптимизации определенных параметров для дальнейшего повышения эффективности или снижения затрат.
Выбор таргетной последовательности нуклеотидов
Выбор области генома для амплификации определяет специфичность детекции с самого начала. Очевидно, что необходимо подобрать характеристику геномного сегмента ДНК соответствующего микроорганизма или группы видов, а информация о нуклеотидной последовательности практически незаменима для достижения комплементарности. В связи с постоянным увеличением общедоступной базы данных последовательностей ДНК, не является проблемой проверить предложенную последовательность на уровень гомологичности к другим организмам.
Чувствительность метода детекции связана с природой таргетного региона через эффективность связывания праймеров, которая определяет эффективность амплификации. Тот факт, что разные пары праймеров к одному и тому же гену могут проявлять 1000-кратные различия в чувствительности, иллюстрируют степень этой взаимосвязи. Аналогично, пары праймеров, фланкирующих разные участки генома, ожидаемо проявляют себя иначе в реакциях амплификации.
Поскольку длина продукта ПЦР обратно-пропорционально коррелирует с эффективностью амплификации, относительно короткие мишени не только облегчают получение высокой чувствительности при детекции, но и значительно лучше подходят для проведения количественного ПЦР-анализа. Кроме того, относительно короткие участки генома могут оставаться невредимыми в условиях умеренной деградации ДНК, тем самым делая детекцию более обильной и менее зависимой от использования образцов со свежим материалом. Таким образом существует определенный консенсус об оптимальном размере в 100-300 пн фрагментов ПЦР для детекции.
В отличие от методов детекции, применяемых в 1980-х и в начале 1990-х годов и основаных на случайном выборе таргетных последовательностей, сейчас подавляющее большинство используемых таргетов хорошо охарактеризованы.
Рибосомные РНК гены
Регион генов рибосомных (р)РНК стал наиболее известной мишенью в детекции микроорганизмов. Около 50% от всех исследований проводятся на основе последовательностей генов рРНК, то есть рДНК. Такая популярность обычно связана с тем, что этот регион представлен универсальной смесью высококонсервативных и средне- и высоковариабельных сегментов. Более того, практически для всех микроорганизмов, встречающихся в ветеринарной и медицинской практике, известны последовательности генов рРНК.
Строение рРНК оперона у бактерий схематично представлена на Рис.1 и состоит из трех последовательностей генов и двух спейсерных участков.
Рис. 1. Структурная организация генов рибосомной РНК бактерий.
Благодаря своему размеру примерно в 1500 пн ген 16S рРНК является наиболее описанной частью оперона с доступными в базе данных GenBank® более чем 33’000 последовательностями только бактериального происхождения. Многие исследования по генетическому родству с последующим построением филогенетических деревьев проводятся с помощью анализа последовательностей области 16S. Широкая система диагностики на основе амплификации гена 16S рРНК была предложена Greisen et al. для дифференциации многих патогенных бактерий, включая виды Campylobacter, Lactococcus lactis, Listeria monocytogenes, Staphylococcus aureus и Streptococcus agalactiae. ПЦР систему детекции на основе 16S рРНК таргетной последовательности также используют для выявления Campylobacter, Leptospira или стрептококков, а также дифференциации между видами хламидий, микобактерий, микоплазм или для идентификации Clostridium perfringens и Yersinia enterocolitica.
Однако, следует отметить, что выявление и дифференциация на основе 16S рРНК может осложняться значительной внутривидовой гетерологией как для Riemerella anatipestifer, или высокой гомологией между родственными видами, например, Mycoplasma bovis/Mycoplasma agalactiae и Bacillus anthracis/Bacillus cereus/Bacillus thuringiensis.
Ген большой субъединицы рибосомы, 23S рДНК, используется для диагностики реже, возможно в связи с его большими размерами. Количество полных последовательностей бактериальных генов 23S рДНК доступных в базах данных до сих пор очень мала по сравнению с 16S. Однако, принимая во внимание известную на сегодня степень вариабельности последовательности, эта геномная область, вероятно, является весьма перспективной в дифференциации видов. Существуют примеры использования последовательностей 23S рРНК в качестве таргетного региона для идентификации видов, в том числе для кампилобактер и хламидий.
Межгенный спейсер 16S-23S (или внутренний транскрипционный спейсер), который расположен между двумя главными генами рибосомной рРНК, может быть перспективной альтернативной мишенью. Кроме вариации последовательности, именно вариация размера делает данный сегмент пригодным для идентификации и дифференциации. Было установлено, что длина спейсера варьирует между 60 пн для Thermoproteus tenax и 1529 пн для Bartonella elizabethae. В результате систематического исследования, Scheinert et al. смогли различить 55 бактериальных видов, 18 из которых были образцами клостридий и 15 –микоплазмы, на основе длины ПЦР-амплифицированного спейсера 16S – 23S. Существуют методики для видов Campylobacter, хламидий, Clostridium difficile, Cryptococcus neoformans, видов Listeria, микобактерий, микоплазм, Pasteurella multocida, видов Pseudomonas, стрептококков, и стафилококков.
Хотя приведенные примеры четко иллюстрируют широкие возможности ПЦР-анализов на основе рДНК, пригодность любых других методик необходимо исследовать сначала линейными последовательностями, поскольку отсутствие достаточной вариабельности последовательности в зоне оперона может помешать созданию родо- или видоспецифических методик с определенными группами микроорганизмов. Более того, диагностический потенциал этого таргетного региона обычно недостаточен при внутривидовой дифференциации. Если изолятов дифференцируют в медицинских целях, например с серотипом или факторами вирулентности, целесообразнее использовать другие таргетные последовательности.
Гены белков
Повторяющиеся элементы
Некоторые микроорганизмы имеют повторяющиеся последовательности или вставные элементы. Поскольку эти сегменты имеются в нескольких копиях, то логичным является идея об использовании их в качестве мишеней. И действительно, это является благоприятной предпосылкой для развития высокочувствительных методов детекции. Предел обнаружения определенного микробактериального генома был установлен в результате применения последовательность-специфического захвата ДНК перед амплификацией.
Эффективность реакции амплификации
Ранние, Средние и поздние циклы
ПЦР амплификация ДНК базируется на циклической ферментативной реакции, в которой продукты (ампликоны) предыдущего цикла используются как субстрат для следующего цикла. Таким образом, теоретически, количество таргетных молекул должно вырастать експонециально, то есть удваиваться после каждого цикла. Эффективность реакции на практике не равна 100% и известно, что на самом деле амплификационные кривые отклоняются от экспоненциальной формы. Путь продуктов амплификации ДНК в течение 30 циклов при идеальной и реальной ПЦР показано на рис. 2. Степень отклонения от теоретического выхода продукта определяется эффективностью амплификации, которую можно примерно оценить по формуле:
Y = (1 + ε) n
где, Y – это выход амплификации (выражается коэффициентом количества молекул продуктов ПЦР и начальным количеством таргетных молекул), n – количество циклов, а ε – средняя эффективность всех циклов при 0 ≤ ε ≤ 1.
Факторы, влияющие на кинетику и выход амплификации ДНК
Отношение Праймер-матрица
В процессе реакции баланс массы между партнерами реакции меняется после каждого цикла. Ключевым параметром в этой динамичной системе является количество амплифицированного продукта. Поскольку его количество увеличивается с каждым циклом, постоянно уменьшается эффективность реакции. При использовании непрерывной математической модели на основе закона массового действия, Schnell и Mendoza показали, что эффективность реакции может достигать около 100% только тогда, когда в системе очень мало продукта. В ходе реакции до момента, когда концентрация исходного ДНК (матрица dNTP праймеров) и продукта амплификации становится одинаковой, эффективность падает до 50% перед тем как достичь нуля перед насыщением системы в фазе плато (см. Рис. 3). Снижение соотношения праймер-матрица на поздних циклах также способствует самоотжигу ампликонов, что приводит к снижению количества свободных сайтов связывания праймера.
Другим эффектом повышения концентрации продукта является снижение эффективности денатурации дуплекса. Концентрация таргетной ДНК обычно составляет от 103 до 106 копий в начале и может увеличиваться до 1012 после около 40 циклов. Однако, температура плавления (Tm) ДНК дуплекса поднимается при высокой концентрации, а эффект измеряют по концентрации продукта, соответствующей фазе плато ПЦР.
Описанные выше параметры могут помочь объяснить почему ПЦР методы амплификации часто не работают в случаях, когда к реакционной смеси добавляют слишком много ДНК образца и данную проблему обычно решают разведением образца. Избежать неэффективной денатурации можно строго соблюдая протоколы и обеспечивая достаточно высокую температуру денатурации (94°-95°C) и время денатурации от 30 до 60 сек. Сведения о кинетических характеристиках фазы плато также помогают понять, что продолжение протоколов амплификации до более чем 40-45 циклов увеличивает возможность возникновения неспецифической амплификации.
Эффективность отжига праймеров
Оптимальная конструкция праймеров направлена на достижение как высокой специфичности (например, исключительная амплификация выбранной мишени), так и эффективности (например, высокий выход амплифицированной ДНК через выбор термодинамически эффективных сайтов связывания праймера), хотя часто приходится принимать компромиссные решения для достижения универсальности и практичности.
Рис. 3. Изменение эффективности ε ПЦР в виде функции [ДНК’], отношение амплифицированного продукта к исходной концентрации матрицы. Точка p, где [ДНК’] 1, соответствует эффективности ε 0,5.
Специфичность амплификации в основном определяется температурой отжига (Tотж) и, в меньшей степени, длиной праймера. Tотж анализа ПЦР часто устанавливается в пределах нескольких градусов от температуры плавления праймера Tпл. Для отдельной реакции оптимальную Tотж можно рассчитать по формуле:
Tотж = 0.3 Tпл-праймера + 0.7 Tпл-продукта – 14.9
Рисунок. 4. Влияние температуры отжига на специфичность амплификации. Из двух образцов птичьего помета экстрагировали ДНК и исследовали с помощью вложенной ПЦР на Chlamydia psittaci. Температура отжига второй амплификации варьировала между 50-60°C. Дорожка 1, образец A; дорожка 2, образец B; полоса 3, контроль реагентов; дорожка 4, ДНК штамма C1 (Chlamydia psittaci) и дорожка 5, маркер размера ДНК (100 пн). Заметим, что правильный продукт амплификации на дорожке 4 находится на 390 пн, тогда как неспецифические полосы в дорожках 1 и 2 при 50°, 54° и 57°C находятся вблизи 400 пн. В этом случае проведение ПЦР-анализа при субоптимальный температуре отжига приводит к ложно-положительным результатам.
Соотношение фермент-матрица
Методологические приемы для улучшения результатов амплификационных анализов
Применяя ПЦР анализ к клиническим образцам, содержащим лишь несколько клеток патогена, необходимо помнить об особых кинетических условиях, которые превалируют в такой реакционной смеси. В начале реакции может иметься малое количество копий (от 1 до 100) таргетной последовательности и крайне важный шаг отжига праймера трудно контролировать. Из-за этого могут понадобиться дополнительные меры для обеспечения специфичности связывания олигонуклеотидов праймеров с как можно большим количеством мишеней и, в то же время, во избежание неспецифического связывания синтезированной ДНК.
ПЦР с горячим стартом
Основная идея ПЦР с горячим стартом заключается в снижении неспецифической амплификации на начальной фазе путем активации фермента сразу перед первым этапом связывания праймера. Этот подход разработан для предупреждения формирования димеров праймеров, миспрайминга и спонтанной инициации синтеза цепи ДНК, хотя большинство из этих процессов уже происходит при комнатной температуре между смешиванием реагентов и началом собственно ПЦР реакции. Наиболее распространенный вариант ПЦР с горячим стартом связан с применением термостабильной ДНК полимеразы, которая поставляется в активной форме и требует 10-ти минутного нагрева при 94°-96°C для активации. Многие протоколы «традиционного» ПЦР-анализа можно усовершенствовать в плане специфичности путем применения процедуры горячего старта и ее специальных реагентов.
Другой подход включает так называемые праймеры петли, несущие дополнительные 5′-концы, которые приводят к самоотжигу олигонуклеотидов или к олигомеризации при температуре окружающей среды. При нагревании реакционной смеси, праймеры линеаризируются только при повышенной температуре, таким образом инициируя горячий старт. Для повышения специфичности амплификации протокол начинают с шести тачап циклов, в которых Tотж постоянно повышается с 60° до 72°C. Условия горячего старта можно создать путем добавления коротких двухцепочечных фрагментов ДНК.
Вложенная ПЦР
Использование вложенной ПЦР часто может позволить решить проблемы детекции, связанные с клиническими образцами тканей, содержащих низкое количество копий мишеней против высокого фонового количества ДНК тканей хозяина и ингибиторов ДНК полимеразы. Типичный протокол необходимо начинать с первой серии амплификации (30-35 циклов), используя набор внешних праймеров, а затем использовать маленькую аликвоту продукта первого серии во второй серии со свежими реагентами и использованием пары внутренних праймеров. Такой подход оказался более удачным чем разведение и повторная амплификация с теми же праймерами. Часто позиция внутренних праймеров является определяющим фактором чувствительности и специфичности анализа.
Теоретически, даже при оптимальных условиях, любая ПЦР достигает природного плато, поэтому не следует ожидать увеличения выхода (т.е. чувствительности) от повторной амплификации разбавленного продукта предыдущей реакции. Однако, существует множество примеров, когда необходимая чувствительность детекции была достигнута только благодаря вложенной ПЦР, в основном за счет того, что многие методики ПЦР детекции оптимизированы не полностью. Кроме того, клинические и полевые образцы часто содержат ингибиторы, которые препятствуют высокой эффективности первой ПЦР. В таких обстоятельствах, вторая серия амплификации может существенно все изменить.
С кинетической точки зрения, вторую ПЦР можно рассматривать как продолжение первой реакции с сильно пониженным количеством продукта – мера, которая может повысить эффективность и выход.
В диагностических целях, вложенная ПЦР является мощным инструментом для дифференциации, из-за возможности выбора сайтов связывания внешних праймеров в геномном сегменте, который является общим для группы организмов, например, семьи, рода, вида и помещать внутренние праймеры в сайты, которые являются специфическими для отдельного вида, серовара, или биоваров. В этой области применения вложенная ПЦР может обеспечить важную информацию для эпидемиологии и таксономии. Другим преимуществом является сведение к минимуму повторной амплификации неспецифических продуктов с первой серии в результате использования других праймеров во второй серии.
Что касается рутинной диагностики, существуют определенные предостережения относительно использования вложенной ПЦР из-за ее особой уязвимости к выносу продукта. Тот факт, что многие лаборатории используют протоколы вложенной ПЦР в рутинных целях также указывает на ее практичность, но этот метод остается сферой исключительной компетенции для более опытных или специализированных лабораторий.