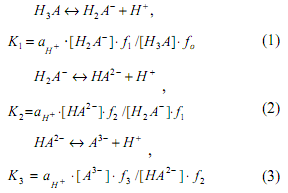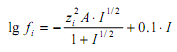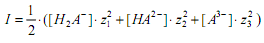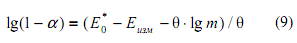что такое трехосновная кислота
Карбоновые кислоты
Классификация карбоновых кислот
Высшие карбоновые кислоты называют жирными кислотами. Более подробно мы изучим их теме, посвященной жирам, в состав которых они входят.
Номенклатура и изомерия карбоновых кислот
Названия карбоновых кислот формируются путем добавления суффикса «овая» к названию алкана с соответствующим числом атомов углерода и слова кислота: метановая кислота, этановая кислота, пропановая кислота, и т.д.
Для предельных карбоновых кислот характерна структурная изомерия: углеродного скелета, межклассовая изомерия со сложными эфирами.
Получение карбоновых кислот
При повышенной температуре и в присутствии катализатора становится возможным неполное окисление алканов, в результате которого образуются кислоты.
При реакции спиртов с сильными окислителями, такими как подкисленный раствор перманганата калия, спирты окисляются до соответствующих кислот.
Обратите особое внимание, что при написании реакции с аммиачным раствором серебра в полном виде, правильнее будет указать не кислоту, а ее аммиачную соль. Это связано с тем, что выделяющийся аммиак, который обладает основными свойствами, реагирует с кислотой с образованием соли.
При дальнейшей обработке формиата серной кислотой образуется муравьиная кислота.
Специфичность синтеза уксусной кислоты заключается в реакции угарного газа с метанолом, в результате которой она образуется.
Также уксусную кислоту можно получить другим путем: сначала провести реакцию Кучерова, в ходе которой образуется уксусный альдегид. Окислить его до уксусной кислоты можно аммиачным раствором оксида серебра или гидроксидом меди II.
Химические свойства карбоновых кислот
Для карбоновых кислот не характерны реакции присоединения. Карбоновые кислоты обладают более выраженными кислотными свойствами, чем спирты.
Карбоновые кислоты вступают в реакции с металлами, которые способны вытеснить водород (стоят левее водорода в ряду напряжений металлов) из кислоты. Реагируют также с основаниями, с солями более слабых кислот, например, угольной кислоты.
Перераспределение электронной плотности в молекулах этих кислот для лучшего запоминания лучше увидеть наглядно. Это перераспределение обусловлено большей электроотрицательностью хлора, который притягивает электронную плотность.
Муравьиная кислота отличается от своих гомологов. За счет наличия у нее альдегидной группы, она, единственная из карбоновых кислот, способна вступать в реакцию серебряного зеркала.
В такой реакции идет ее окисление до нестойкой угольной кислоты, которая распадается на углекислый газ и воду.
При нагревании и в присутствии серной кислоты (водоотнимающего компонента) муравьиная кислота распадается на воду и угарный газ.
Сложные эфиры
Ангидриды
Хлорангидриды карбоновых кислот образуются в реакции карбоновых кислот с хлоридом фосфора V.
Следующая реакция не имеет отношения к ангидридам, однако (из-за их схожести) вы увидите ее здесь для наилучшего запоминания. Это реакция галогенирования гидроксикислот, в результате которой гидроксогруппа в радикале меняется на атом галогена.
Непредельные карбоновые кислоты
Распределение электронной плотности в молекулах творит чудеса: иногда реакции идут против правила Марковникова. Так происходит в непредельной акриловой кислоте.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
трехосновная кислота
Смотреть что такое «трехосновная кислота» в других словарях:
Лимонная кислота — (хим.) 4 атомнотрехосновная оксикислота состава C6H8O7 = СН2(СООН)·С(ОН)(СООН)·СН2(СООН), открыта Шееле в 1784 г. Л. кислота очень распространена в растениях; в свободном виде и почти без примеси других кислот находится в значительном количестве… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Меллитовая кислота — шестиосновная кислота ароматического ряда, состава С6(СООН)6 (бензолгексакарбоновая кислота), находится в природе в медовом камне, который встречается в бурых углях и представляет алюминиевую соль М. кислоты Al2C12O12+18H2O. В чистом виде… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Ортофосфорная кислота — Ортофосфорная кислота … Википедия
Мышьяковая кислота — Мышьяковая кислота … Википедия
Борная кислота — ортоборная кислота, H3BO3, слабая неорганическая трехосновная кислота; бесцветные кристаллы в виде чешуек, плотность 1,48 г/см3. Умеренно растворима в холодной воде, лучше в горячей, чем пользуются для её очистки (растворимость в г на 100 … Большая советская энциклопедия
Тримеллитовая кислота — Общие … Википедия
изолимонная кислота — 1 оксипропан 1,2,З трикарбоновая кислота, природная предельная трехосновная трикарбоновая кислота ациклического ряда; промежуточный продукт превращения трикарбоновых кислот, играющий важную роль в тканевом обмене … Большой медицинский словарь
Изолимо́нная кислота́ — 1 оксипропан 1, 2, 3 трикарбоновая кислота, природная предельная трехосновная трикарбоновая кислота ациклического ряда; промежуточный продукт превращения трикарбоновых кислот, играющий важную роль в тканевом обмене … Медицинская энциклопедия
ФОСФОРНАЯ КИСЛОТА — (Acidum phosphori cum), этим наименованием охватывают к ты 5 валентного фосфора. Для удобства классификации их можно рассматривать как продукты взаимодействия фосфорного ангидрида (Р206) и воды; известны одноосновная метафосфор ная к та, НР03( =… … Большая медицинская энциклопедия
Лимонная кислота — (Acidum citricum) трехосновная органическая оксикислота С6Н8О7 Н2О или Лимонная кислота представляет собой внешне мелкие бесцветные прозрачные кристаллы без запаха, но очень кислого вкуса, легко превращающиеся при… … Большая энциклопедия кулинарного искусства
Научная электронная библиотека
4.1.5. Термодинамические константы трех- и четырехосновных кислот в органических растворителях
Концептуальный подход к оценке ионной силы раствора электролита заключался в полном учете концентраций всех равновесных частиц в титруемой системе. Отметим еще раз, что для сложных систем, к которым относится титруемый полиэлектролит, традиционно применялась концентрация только первого диссоциированного иона полиэлектролита, несмотря на присутствие двух- и многозарядных ионов, так как не было предложено реального инструмента, позволяющего количественно оценить продукты диссоциации.
В работе предложена модель оценки термодинамических констант диссоциации трехосновных кислот в среде органических растворителей на примере лимонной кислоты в этаноле при совместной нейтрализации функциональных групп [20].
Если константы диссоциации водных растворов одноосновных кислот могут быть определены при непосредственном измерении рН (активности ионов водорода), значительные трудности возникают при определении растворов многоосновных кислот при совместной нейтрализации кислотных групп, то есть при близости значений рК1, pK2,…, pKn.
Экспериментальное определение рК даже одноосновных кислот в органических растворителях (где обычные рН теряют физический смысл), тем более поликислот, в связи с невозможностью прямого измерения активности лионий-ионов, представляет известную проблему.
Преобразуем уравнения (2.1) и (2.2) и рассмотрим диссоциацию трехосновной кислоты и соответствующие константы диссоциации в любом растворителе в упрощенном виде (без представления различных комплексов или сольватированных частиц, которые реально существуют в растворах):
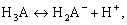
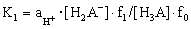
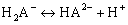
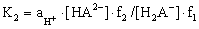
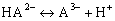
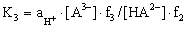
Для определения термодинамических констант диссоциации поликислот воспользуемся методами прямой потенциометрии и потенциометрического титрования, как наиболее наглядными и оптимальными среди известных методов. При этом требуется учитывать основные количественные законы теории растворов электролитов: закон электронейтральности, закон сохранения материального баланса, правило стехиометрии и ряд других.
Существующие методы оценок ионной силы при кислотно-основном равновесии основаны на использовании концентрации первой ионизированной частицы, например, 
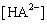
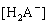
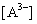
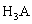
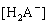
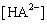
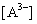
Оценка значения коэффициентов активности 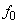
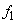
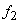
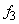
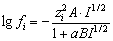
или по уравнению Дэвиса [9]
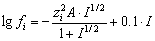
где 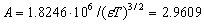
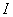
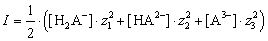
а – расстояние наибольшего сближения ионов,
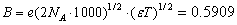
Полиэлектролиты, как правило, характеризуются близостью констант диссоциации. Поэтому определение значений последовательных констант равновесий затруднено.
Уравнения (4.11), (4.12) и (4.13) позволяют определить константы диссоциации электролитов как при дифференцированном титровании многоосновной кислоты, так и при совместной нейтрализации всех кислотных групп. Это становится возможным при экспериментальном определении стандартного потенциала 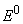
Стеклянный электрод / НСl / AgCl, Ag (I)
Cтеклянный электрод / НСlО4 / AgCl, Ag (II)
в соответствующих растворителях, величина которого (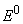
В табл. 4.12 приведены данные измерения ЭДС цепи (I) в среде этанола в зависимости от моляльной концентрации хлороводородной кислоты, приготовленной насыщением растворителя сухим хлористым водородом, а также результаты оценки степени диссоциации HCl и исходные величины для расчета стандартного потенциала цепи.
Данные для расчета стандартного потенциала цепи (I)
Что такое трехосновная кислота
Данная работа является продолжением исследований по более приемлемому подходу к оценке ионной силы раствора полиэлектролита, являющейся немаловажным фактором, влияющим на ионную составляющую раствора и термодинамическую константу диссоциации по известному уравнению (закону разбавления) Оствальда.
Как отмечалось в предыдущих работах 3, концептуальный подход к оценке ионной силы раствора электролита заключается в полном учете концентраций всех равновесных частиц в титруемой системе. Обычно для сложных систем, к которым относится полиэлектролит, традиционно применялась концентрация только первого диссоциированного иона полиэлектролита 4, несмотря на присутствие двух- и многозарядных ионов.
Существующие методы расчета и определения констант диссоциации, предложенные Спикменом [4, 5], позднее Бейтсом [6], ограничиваются двухосновными кислотами и справедливы лишь для водных растворов.
Рассмотрим диссоциацию трехосновной кислоты и соответствующие константы диссоциации в упрощенном виде (без учета различных комплексов или сольватированных частиц, которые реально существуют в растворах):
Равновесные концентрации всех частиц
Для определения активностей ионов лиония ан+ и последующего расчета термодинамических констант диссоциации предварительно устанавливают концентрационную зависимость ЭДС цепи (I) и ее стандартный потенциал E 0 электрохимической цепи без переноса [9]
В табл. 1 приведены данные измерения ЭДС цепи (I) в среде диметилформамида (ДМФ) в зависимости от моляльной концентрации хлороводородной кислоты, а также результаты оценки степени ее диссоциации и исходные величины для расчета стандартного потенциала цепи.
ЭДС цепи (I) описывается уравнением Нернста
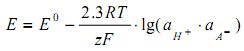
где 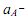
В уравнение (5) введем константу диссоциации кислоты
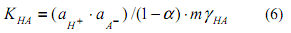
и получим следующее уравнение:
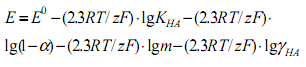
Здесь: a и γHA — степень диссоциации и коэффициент активности хлороводородной кислоты в растворе.
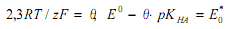
уравнение (7) может быть трансформировано в следующее:
Величину E0 * определяют по линейной регрессии при lg m = 0 (компьютерная программа «Расчет нормального потенциала цепи без переноса Е*» [7]), получена величина 0.3473 В (коэффициент регрессии r = 0.9880).
Степень диссоциации хлороводородной кислоты может быть оценена по уравнению (8) при допущении, что коэффициент активности нейтральной молекулы HCl в разбавленных растворах равен нулю:
Таблица 1. Данные для расчета стандартного потенциала цепи (I)
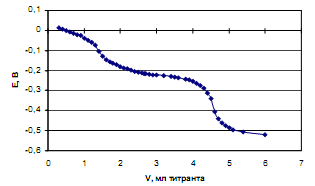
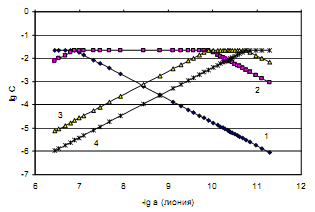
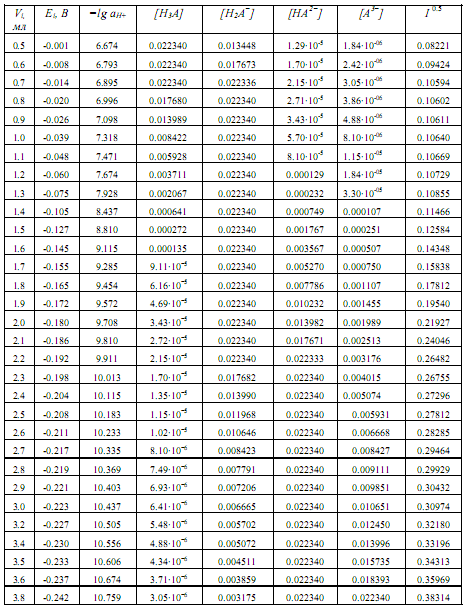
Рассмотрим пример определения термо-динамических констант диссоциации трехосновной (лимонной) кислоты в среде ДМФ. В табл.2 приведена часть данных потенциометрического титрования 0.073125 н. раствора лимонной кислоты 0.11207 н. раствором гуанидина в ДМФ (Vi мл титранта, Еизм, В), активности лионий-ионов (lg aH+) в процессе титрования, равновесные концентрации всех частиц ([H3A], [H2A — ], [HA 2- ], [A 3- ]) в титруемой системе, определяемые по рис.2, ионная сила и коэффициенты активности ионов по ур. (4).
Рис. 1. Кривая потенциометрического титрования 0.073125 н. раствора лимонной кислоты 0.11207 н. раствором гуанидина в ДМФ
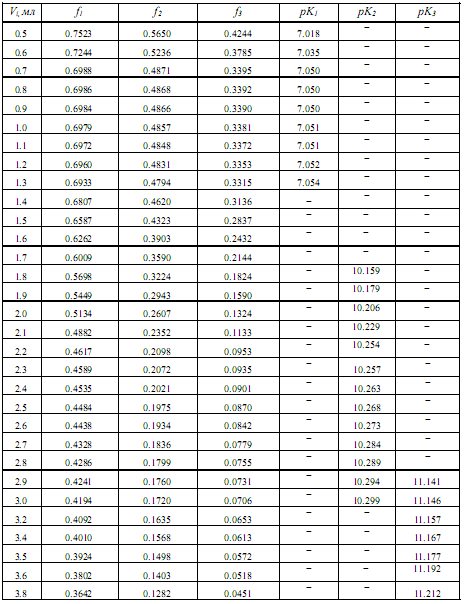
Таблица 2. Данные для оценки термодинамических констант диссоциации лимонной кислоты в ДМФ
Продолжение таблицы 2.
В последних колонках табл. 2 представлены коэффициенты активности по уравнению Дэвиса, показатели последовательных констант диссоциации лимонной кислоты (pK1, pK 2, pK3) с учетом коэффициентов активности ионов по Дэвису в среде ДМФ и их статистически обработанные по авторской программе «Математическая обработка результатов количественных определений» [7] величины: pK1 = 7.04 ± 0.04; pK2 = 10.25 ± 0.09; pK3 = 11.17 ± 0.05.
Что такое никотиновая кислота и как ее можно использовать
В чем польза никотиновой кислоты, помогает ли она при выпадении волос и в каких продуктах содержится? Разбираемся вместе с экспертами.
Что такое никотиновая кислота
Никотиновая кислота (ниацин), или витамин B3, — это водорастворимое вещество, которое присутствует во многих продуктах питания и назначается врачами дополнительно [1]. Она участвует в клеточном обмене, помогает правильной работе нервной системы, поддерживает здоровье волос и кожи, а также используется для профилактики и лечения пеллагры (авитаминоза, с характерной пигментацией кожи и воспалением слизистых рта). Отсюда еще одно название — «витамин PP» (preventing pellagra, или «предупреждающий пеллагру»).
Никотиновая кислота самостоятельно синтезируется в организме человека из аминокислоты — триптофана. Но этого количества, как правило, недостаточно, чтобы покрыть всю потребность. Из 60 мг триптофана образуется 1 мг ниацина, при суточной норме от 11 до 25 мг [2].
При сбалансированном питании витамин B3 поступает в организм в нужном количестве с пищей. Продукты, богатые ниацином [3]:
Как добавку ниацин назначают при дефиците витамина B3. Потребность в нем возникает при скудном рационе питания (чаще встречается в очень бедных регионах), нехватке витаминов B2 и B6, генетических заболеваниях и некоторых видах онкологии [4].
Никотиновая кислота выпускается в таблетках и растворе для инъекций. Форму и дозировку подбирают с лечащим врачом, учитывая основное заболевание, патологии и аллергические реакции. Может отпускаться по рецепту или без.
Для чего нужна никотиновая кислота
В организме алиментарный ниацин, который поступает с пищей, превращается в никотинамид. В виде никотинамидадениндинуклеотида (НАД) и никотинамидадениндинуклеотидфосфата (НАДФ) он участвует сразу в нескольких процессах.
«Эти два вещества действуют как доноры водорода в окислительно-восстановительных процессах, вовлечены в процессы синтеза и метаболизма углеводов, жирных кислот и белков», — объясняет врач-дерматолог, трихолог, миколог холдинга «СМ-Клиника» Наталья Щеплева.
В организме ниацин также [5]:
Никотиновую кислоту назначают при лечении неврита лицевого нерва, различных интоксикациях, заболеваниях ЖКТ и при других состояниях [6].
Ниацин также добавляют в средства для волос и по уходу за кожей лица [7].
Никотиновая кислота для волос: советы
трихологов
«При нанесении на кожу головы никотиновая кислота усиливает приток крови к волосяному фолликулу, благодаря чему он получает полноценное питание», — объясняет врач-трихолог Юлия Нагайцева.
Витамин B3, а именно ниацинамид, также улучшает синтез белка кератина, который отвечает за защиту эпителиальных клеток, присутствует в волосах и ногтях [9].
Никотиновая кислота стимулирует рост волос, придает им эластичность и уменьшает ломкость [10]. Кроме того, некоторые исследования отмечают положительный эффект от ее приема при женской алопеции [11]. Но ученые признают, что этот вопрос пока требует дальнейшего изучения.
Как использовать никотиновую кислоту для волос
Никотиновая кислота для волос (не путать с ампулами для инъекций) выпускается в виде раствора. По инструкции, его наносят на предварительно вымытые голову и волосы массирующими движениями. После — раствор не смывают.
Процедуру проводят один раз в три дня, но не более двух недель. Курс можно повторить через три месяца.
Вместе с тем врачи-трихологи предупреждают, что ниацин — это не единственный источник здоровья волос. «Волосяной фолликул — слишком сложная структура, для его функционирования необходимы не только витамины и микроэлементы, а гормональный баланс, отсутствие хронических и аутоиммунных заболеваний, отсутствие стрессовых ситуаций, воспалений и т. д.», — поясняет Нагайцева.
По ее словам, самостоятельно добавлять никотиновую кислоту в шампуни, маски или бальзам смысла нет — из-за большого объема разведения, взаимодействия с другими компонентами и небольшого времени экспозиции.
Кроме того, при нанесении на голову возможно стойкое покраснение кожи, предупреждает президент Союза трихологов Спартак Каюмов. По словам эксперта, в некоторых случаях никотиновая кислота может спровоцировать усиление жирности кожи головы.
Никотиновая кислота для лица: советы дерматолога
Все большее внимание косметологов привлекает производное никотиновой кислоты — ниацинамид. Сегодня особенно популярны кремы и маски для лица с ним в составе.
Он стабилизирует эпидермальный барьер, увлажняет кожу, разглаживает морщины и подавляет фотоканцерогенез [10].
По словам дерматолога Натальи Щеплевой, основными показаниями к применению считаются:
В чем еще польза никотиновой кислоты
Никотиновая кислота используется при лечении таких заболеваний и решении таких проблем, как:
Кроме того, ее применяют при профилактике мигреней, нарушения мозгового кровообращения, включая ишемический инсульт и стенокардии [11].
Ограничения и побочные эффекты
Принимать никотиновую кислоту с осторожностью стоит при беременности и в период лактации (введение больших доз в этом случае запрещено). К противопоказаниям также относят язвенную болезнь желудка и двенадцатиперстной кишки (в стадии обострения), выраженные нарушения функции печени, подагру, а также тяжелые формы артериальной гипертензии и другие состояния.
Побочные эффекты могут выражаться в покраснение кожи лица и верхней половины туловища, с ощущением покалывания и жжения (так называемый «прилив»), возможны головокружение и крапивница.
При длительном применении больших доз встречается диарея, рвота, нарушение функции печени и другие нарушения [12].
При наружном применении следует нанести раствор на небольшой участок кожи. Возможны покраснение и чувство жжения.