что такое транспозиция сосудов
Что такое транспозиция сосудов
Центральный цианоз часто является первым симптомом врожденного порока сердца. В данной главе приведены ВПС, для которых артериальная гипоксемия — ведущий синдром, несмотря на то, что некоторым из них свойственна также сердечная недостаточность. Причины гипоксемии при ВПС следующие: 1) шунт крови справа налево; 2) уменьшение легочного кровотока; 3) разобщение малого и большого кругов кровообращения.
Нарушения гемодинамики во многом определяются конкретно представленным вариантом порока:
1) ТМА с интактной межжелудочковой перегородкой;
2) ТМА с интактной межжелудочковой перегородкой и сужением выводного отдела левого желудочка;
3) ТМА с ДМЖП;
4) ТМА с ДМЖП и сужением выводного отдела левого желудочка.
У больных с транспозицией магистральных сосудов существует резкий контраст между газовым составом крови в легочных венах и аорте. Так как газообмен в легких не нарушен, в оттекающей от них крови р02 может достигать 110 ммрт. ст., а рС02 составляет 15-25 мм рт. ст. В то же время в системной «артериальной» крови рО, редко превышает 35 мм рт. ст., а рС02 равно приблизительно 45 мм рт. ст. Придыхании 100% кислородом системное рО, обычно поднимается не более чем на 5—10 мм рт. ст. и отражает величину межциркуляторного смешивания крови.
Величина легочного кровотока определяется анатомией порока. При простой транспозиции магистральных сосудов он несколько усилен за счет увеличения минутного объема сердца как одного из механизмов компенсации гипоксемии. Значительная гиперволемия МКК возникает при большом диаметре ОАП или сопутствующем ДМЖП. При сужении выхода из левого желудочка легочный кровоток уменьшен.
Фетальная ЭхоКГ.
Так как транспозиция магистральных сосудов не сопровождается кардиомегалией и редко сочетается с хромосомными аномалиями, процент ее выявления при акушерском скрининге не превышает 19%. Правильное заключение возможно, если исследуются выводные тракты желудочков. При этом выявляют параллельное, а не перекрещивающееся положение магистральных сосудов. В дальнейшем устанавливают, что аорта отходит от морфологически правого, а легочная артерия — от морфологически левого желудочка.
Естественное течение транспозиции магистральных сосудов. В силу особенностей внутриутробного кровообращения транспозиция магистральных сосудов практически не влияет на развитие плода, верхняя и нижняя половины тела оксигенируются адекватно.
В случаях, когда диагноз поставлен, следует обратить внимание на функцию овального окна и ОАП. В 4-6% наблюдений уже пренатально можно выявить симптомы их рестриктивности (фиксированное выбухание межпредсердной перегородки в левое предсердие, малый диаметр ОАП с высокоскоростным потоком крови в нем), приводящей к ранней неонатальной смертности. Родоразрешение рекомендуется проводить в учреждении, располагающем возможностями для терапии простагландинами и выполнения процедуры Рашкинда. Порок относится ко 2-й категории тяжести.
В большинстве случаев ребенок рождается в срок, с нормальным весом. В первые часы после рождения не возникает обычного для новорожденных резкого перераспределения крови в сторону легких и отсутствует возврат большого объема крови из них в левое предсердие. Кроме того, в правом желудочке сохраняется повышенное давление, так как он изгоняет кровь в аорту. В результате давление в правом предсердии сохраняется более высоким, чем в левом и клапан овального окна не закрывается. Кроме того, через ОАП существует двунаправленный поток крови (в систолу — из легочной артерии в аорту, в диастолу — из аорты в легочную артерию). Данные механизмы поддерживают некоторое время удовлетворительную системную оксигенацию крови. Однако уже через несколько часов развивается дефицит кислорода, усиливаются анаэробный метаболизм и продукция лактата, истощаются запасы гликогена. Развиваются метаболический ацидоз и нарушения функции различных органов. Это сопровождается быстрой гибелью больных: 30% умирают на первой неделе жизни, 50% — в периоде новорожденности и 90% — в течение первого года жизни.
Относительно благоприятный прогноз имеют больные с большим межпредсердным сообщением или при комбинации транспозиции магистральных артерий с ДМЖП и с умеренным легочным стенозом. Однако при изолированном большом ДМЖП легочная гипертензия определяется уже к 3—4 мес и быстро приобретает склерозирующий характер. В связи с этим рекомендуют выполнять раннюю операцию.
Транспозиция магистральных сосудов
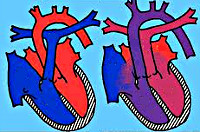
Транспозиция магистральных сосудов – тяжелая врожденная патология сердца, характеризующаяся нарушением положения главных сосудов: отхождением аорты от правых отделов сердца, а легочной артерии – от левых. Клинические признаки транспозиции магистральных сосудов включают цианоз, одышку, тахикардию, гипотрофию, сердечную недостаточность. Диагностика транспозиции магистральных сосудов основана на данных ФКГ, ЭКГ, рентгенологического исследования органов грудной клетки, катетеризации полостей сердца, вентрикулографии. Методами оперативной коррекции транспозиции магистральных сосудов служат паллиативные вмешательства (баллонная атриосептостомия) и радикальные операции (Мастарда, Сеннинга, Жатене, Растелли, артериального переключения).
Общие сведения
В кардиологии транспозиция магистральных сосудов относится к критическим порокам сердца синего типа, не совместимым с жизнью, поэтому требует хирургического вмешательства в первые недели жизни.
Причины транспозиции магистральных сосудов
Аномалии развития магистральных сосудов формируются в первые 2 месяца эмбриогенеза в результате хромосомных аберраций, неблагоприятной наследственности или отрицательных внешних воздействий. Экзогенными факторами могут выступать вирусные инфекции, перенесенные беременной (ОРВИ, краснуха, ветряная оспа, корь, эпидемический паротит, герпес, сифилис), токсикозы, радиоактивное облучение, лекарственные вещества, алкогольная интоксикация, полигиповитаминоз, заболевания матери (сахарный диабет), возрастные изменения в организме женщины старше 35 лет. Транспозиция магистральных сосудов встречается у детей с синдромом Дауна.
Классификация транспозиции магистральных сосудов
В зависимости от количества сопутствующих коммуникаций, выполняющих компенсирующую роль, и состояния малого круга кровообращения различают следующие варианты транспозиции магистральных сосудов:
1. Транспозиция магистральных сосудов, сопровождающаяся гиперволемией или нормальной величиной легочного кровотока:
2. Транспозиция магистральных сосудов, сопровождающаяся уменьшением легочного кровотока:
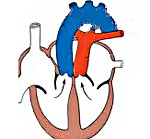
В 80% случаев транспозиция магистральных сосудов сочетается с одной или несколькими дополнительными коммуникациями; у 85-90% больных порок сопровождается гиперволемией малого круга кровообращения. Для транспозиции магистральных сосудов характерно параллельное расположение аорты относительно легочного ствола, тогда как в нормальном сердце обе артерии перекрещиваются. Чаще всего аорта находится впереди легочного ствола, в редких случаях сосуды располагаются в одной плоскости параллельно, или аорта локализуется кзади от легочного ствола. В 60% наблюдений обнаруживается D-транспозиция – положение аорты справа от легочного ствола, в 40%- L-транспозиция – левостороннее положение аорты.
Особенности гемодинамики при транспозиции магистральных сосудов
С позиций оценки гемодинамики важно различать полную транспозицию магистральных сосудов и корригированную. При корригированной транспозиции аорты и легочной артерии имеет место желудочково-артериальная и предсердно-желудочковая дискордантность. Другими словами, корригированная транспозиция магистральных сосудов сочетается с инверсией желудочков, поэтому внутрисердечная гемодинамика осуществляется в физиологическом направлении: в аорту поступает артериальная кровь, а в легочную артерию венозная. Характер и выраженность гемодинамических нарушений при корригированной транспозиции магистральных сосудов зависят от сопутствующих пороков – ДМЖП, митральной недостаточности и др.
Полная форма сочетает в себе дискордантные желудочково-артериальные взаимоотношения при конкордантном взаимоотношении других отделов сердца. При полной транспозиции магистральных сосудов венозная кровь из правого желудочка поступает в аорту, разносится по большому кругу кровообращения, а затем вновь поступает в правые отделы сердца. Артериальная кровь выбрасывается левым желудочком в легочную артерию, по ней – в малый круг кровообращения и вновь возвращается в левые отделы сердца.
Во внутриутробном периоде транспозиция магистральных сосудов практически не нарушает фетальное кровообращение, поскольку легочный круг у плода не функционирует; циркуляция крови осуществляется по большому кругу через открытое овальное окно или открытый артериальный проток. После рождения жизнь ребенка с полной транспозицией магистральных сосудов зависит от наличия сопутствующих коммуникаций между малым и большим кругом кровообращения (ООО, ДМЖП, ОАП, бронхиальных сосудов), обеспечивающих смешение венозной крови с артериальной. При отсутствии дополнительных пороков дети погибают сразу после рождения.
При транспозиции магистральных сосудов шунтирование крови осуществляется в обоих направлениях: при этом, чем больше размер коммуникации, тем меньше степень гипоксемии. Наиболее благоприятными являются случаи, когда ДМПП или ДМЖП обеспечивают достаточное смешивание артериальной и венозной крови, а наличие умеренного стеноза легочной артерии предотвращает чрезмерную гиперволемию малого круга.
Симптомы транспозиции магистральных сосудов
Дети с транспозицией магистральных сосудов рождаются доношенными, с нормальным или несколько повышенным весом. Сразу после рождения, с началом функционирования отдельного легочного круга кровообращения, нарастает гипоксемия, что клинически проявляется тотальным цианозом, одышкой, тахикардией. При транспозиции магистральных сосудов, сочетающейся с ОАП и коарктацией аорты, выявляется дифференцированный цианоз: синюшность верхней половины тела выражена в большей степени, чем нижней.
Уже в первые месяцы жизни развиваются и прогрессируют признаки сердечной недостаточности: кардиомегалия, увеличение размеров печени, реже – асцит и периферические отеки. При осмотре ребенка с транспозицией магистральных сосудов обращает внимание деформация фаланг пальцев, наличие сердечного горба, гипотрофия, отставание в моторном развитии. При отсутствии стеноза легочной артерии переполнение кровью малого круга кровообращения приводит к частому возникновению повторных пневмоний.
Клиническое течение корригированной транспозиции магистральных сосудов без сопутствующих ВПС длительное время бессимптомное, жалобы отсутствуют, ребенок развивается нормально. При обращении к кардиологу обычно выявляется пароксизмальная тахикардия, атриовентрикулярная блокада, шумы в сердце. При наличии сопутствующих ВПС клиническая картина корригированной транспозиции магистральных сосудов зависит от их характера и степени гемодинамических нарушений.
Диагностика транспозиции магистральных сосудов
Наличие у ребенка транспозиции магистральных сосудов обычно распознается еще в родильном доме. Физикальное обследование выявляет гиперактивность сердца, выраженный сердечный толчок, который смещен медиально, расширенную грудную клетку. Аускультативные данные характеризуются усилением обоих тонов, систолическим шумом и шумом ОАП или ДМЖП.
У детей в возрасте 1-1,5 месяцев по ЭКГ обнаруживаются признаки перегрузки и гипертрофии правых отделов сердца. При оценке рентгенографии грудной клетки высокоспецифичными признаками транспозиции магистральных сосудов являются: кардиомегалия, характерная конфигурация тени сердца яйцеобразной формы, узкий сосудистый пучок в переднезадней проекции и расширенный в боковой проекции, левое положение дуги аорты (в большинстве случаев), обеднение рисунка легких при стенозе легочной артерии или его обогащение при дефектах перегородки.
Лечение транспозиции магистральных сосудов
Всем пациентам с полной формой транспозиции магистральных сосудов показано экстренное оперативное лечение. Противопоказанием служат случаи развития необратимой легочной гипертензии. До операции новорожденным проводится медикаментозная терапия простагландином Е1, помогающим сохранить артериальный проток незаращенным и обеспечить адекватный кровоток.
Паллиативные вмешательства при транспозиции магистральных сосудов необходимы в первые дни жизни для увеличения размера естественного или создания искусственного дефекта между малым и большим кругами кровообращения. К такого рода операциям относятся эндоваскулярная баллонная атриосептостомия (операция Парка–Рашкинда) и открытая атриосептэктомия (резекция межпредсердной перегородки по Блелоку–Хенлону).
Варианты анатомической коррекции транспозиции магистральных сосудов включают различные способы артериального переключения: операцию Жатене (пересечение и ортотопическую реплантацию магистральных сосудов, перевязку ОАП), операцию Растелли (пластику ДМЖП и устранение стеноза легочной артерии), артериальное переключение с пластикой МЖП. Специфическими послеоперационными осложнениями, сопровождающими коррекцию транспозиции магистральных сосудов, могут служить СССУ, стеноз устьев легочных и полых вен, стеноз выносящих трактов желудочков.
Прогноз транспозиции магистральных сосудов
Полная транспозиция магистральных сосудов – критический, несовместимый с жизнью порок сердца. При отсутствии специализированной кардиохирургической помощи половина новорожденных погибает в первый месяц жизни, более 2/3 детей – к 1 году от тяжелой гипоксии, недостаточности кровообращения и нарастания ацидоза.
Хирургическая коррекция простой транспозиции магистральных сосудов позволяет достичь хороших отдаленных результатов в 85–90% случаев; при сложной форме порока – в 67% случаев. После операций пациенты нуждаются в наблюдении кардиохирурга, ограничении физических нагрузок, профилактике инфекционного эндокардита. Важное значение имеет пренатальное выявление транспозиции магистральных сосудов с помощью фетальной ЭхоКГ, соответствующее ведение беременности и подготовка к родам.
Транспозиция магистральных сосудов
Вариантов транспозиции может быть много: полная, неполная, корригированная, в сочетании с другими пороками.
Пока мы коснемся только полной транспозиции, т.е. ситуации, когда сосуды полностью переместились, поменялись своими местами. Аорта отходит от правого желудочка, а легочная артерия — от левого. Остальные отделы сердца, т.е. предсердия с впадающими в них венами, и желудочки, нормальны и не имеют никаких других пороков (иногда применяют термин «простая ТМС»). Как не трудно себе представить, но такое бывает с сердцем, и не так уж редко. Это как если бы там, где должна быть руки – выросли ноги, а там, где ноги — руки. К счастью, это не так страшно выглядит. Дети рождаются доношенными, совершенно нормальными, но, в отличие от тетрады Фалло, сразу очень синюшными. Становится очевидным, что ребенку сразу после рождения очень трудно просто — жить.
Венозная кровь, бедная кислородом, поступает в правое предсердие, в правый желудочек, а отсюда — снова в отходящую от него аорту и в большой круг кровообращения, так и не пройдя через легкие, не насытившись кислородом и не отдав углекислый газ. А кровь из легких по легочным венам идет в левое предсердие, в левый желудочек, и снова – в легочную артерию и в легкие, что с точки зрения ее насыщения кислородом бессмысленно, т.к. она уже насыщена. Образуется два разобщенных круга кровообращения.
И, если мы ранее условно изобразили взаимоотношение кругов кровообращения в виде восьмерки, лежащей на боку, то при транспозиции — это два замкнутых кольца, не связанных между собой.
Ясно, что такое положение дела просто несовместимо с жизнью. Но природа решает по-своему: оставляет открытым овальное окно (т.е. естественный дефект) в межпредсердной перегородке, через который происходит утечка части венозной крови в левые отделы, и потом — в легкие. Оба круга между собой связаны только этим шунтом.
Понятно, что количество крови, которое пройдет через дефект с каждым сердечным циклом, и от которого зависит ее насыщение, очень мало и никак не может обеспечить потребность организма. Если дефектов два, или добавляется еще дефект межжелудочковой перегородки – то это несколько лучше, т.к. количество окисленной крови в артериальной системе становится больше. Но все равно ее крайне недостаточно.
Это достигается так называемой процедурой Рашкинда, суть которой сводится к тому, что в открытое овальное окно проводится катетер с баллончиком, который раздувают, тем самым разрывая межпредсердную перегородку и увеличивая дефект в диаметре. Процедура выполняется в кабинете рентгенохирургии и подготовка к ней включает все моменты, которые мы описали выше, когда говорили о зондировании сердца или о закрытии открытого артериального протока.
При полной транспозиции расширение дефекта должно быть сделано экстренно. Но это расширение — и увеличение потока смешанной крови — само по себе ничего не решает. Оно только немного улучшает состояние ребенка и продлевает ему жизнь, и надо что-то делать дальше, не откладывая. Эффект процедуры будет очень недолгим — всего несколько недель, а если ждать дольше, то ребенок может погибнуть от сердечной недостаточности и постоянного кислородного голодания.
Понятно, что идеальным методом лечения транспозиции является полное устранение этой «ошибки природы» — т.е. хирургическое перемещение аорты и соединение ее со «своим» левым желудочком (тогда как она сейчас отходит от правого), а легочной артерии – с правым желудочком.
Описание операции хирургического перемещения аорты и соединения ее со «своим» левым желудочком
После обычного введения ребенка в наркоз, открытия грудной клетки, соединения с аппаратом, начинают искусственное кровообращение, с помощью которого кровь одновременно охлаждают (это всегда делается и при других операциях, которые могут потребовать достаточно длительного времени — 1,5-2 часа и больше). Дело в том, что при охлаждении замедляются все обменные процессы (как у медведя в зимней спячке), а это – защита организма от всевозможных осложнений в последующем. С помощью аппарата охлаждение происходит быстро (как и согревание в завершающей стадии операции).
Аорта и легочная артерия рассекаются пополам. Коронарные артерии отрезаются от аорты и вшиваются в начало легочной артерии, которое будет потом устьем новой аорты. К этому участку подшивают отсеченную «свою» аорту, а затем из кусочка собственного перикарда делают трубку, которая вшивается в новую легочную артерию, восстанавливая и ее.
Таким образом, достигают истинной анатомической коррекции порока. Теперь все нормально: магистральные сосуды отходят от тех желудочков, от которых и должны отходить. Эта операция, как видим, сложная и длительная. Но сегодня ее делают достаточно успешно в нескольких кардиологических клиниках страны. Однако чтобы рассчитывать на успех, ее надо делать очень рано, т.е. в первые недели жизни.
Дело в том, что при рождении оба желудочка, правый и левый, хорошо развиты, имеют одинаковую мышечную массу и толщину стенок. При нормальном развитии у правого желудочка нагрузка оказывается меньше, чем у левого: ему не надо качать кровь в большой круг, т.е. по всему телу, и он довольно быстро привыкает к этому. Пройдет немного времени — и его стенка станет тоньше, и масса мышц уменьшится: зачем работать, если можно и не работать? То же самое происходит и при транспозиции — но с левым желудочком. При транспозиции желудочки новорожденного тоже изначально одинаковы, и то, что они работают против разных сопротивлений большого и малого кругов кровообращения, в первое время их никак не касается. Но потом левый желудочек истончается и теряет массу, а ведь после операции перемещения сосудов именно ему предстоит выполнять главную работу. И вот тут важно не упустить время, т.к. если ждать несколько месяцев, то даже в случае хорошего эффекта процедуры Рашкинда, радикальная коррекция будет уже невозможна. Наилучшее время для такой коррекции — первый месяц жизни.
Надо сказать, что такое лечение полной транспозиции применяется в течение уже 25 лет, а в последние годы становится стандартным. Понятно, что для успешного выполнения этой сложной операции необходима не только хорошо отработанная методика, но и безопасные для грудного ребенка методы обеспечения наркоза, искусственного кровообращения, ведения послеоперационного периода, т.е. всего того, что и приводит к окончательному успеху. Это может быть сделано только в крупных детских кардиохирургических центрах, имеющих большой опыт лечения врожденных пороков сердца.
Чего ждать после операции? В целом, результаты очень хорошие. Сегодня сотни оперированных больных ведут нормальный образ жизни, а продолжительность жизни некоторых детей, прооперированных одними из первых, уже насчитывает 20 и более лет. Конечно, наблюдение кардиолога, а иногда и подробные обследования, являются обязательными, т.к. по мере роста ребенка и самого сердца могут возникнуть проблемы. Однако, главные из этих проблем вполне можно устранить рентгенохирургическим путем, не прибегая к повторной операции.
К сожалению, радикальную операцию сделать можно не всегда. Главная из причин — позднее обращение к специалистам, когда время уже упущено. Нередко приходится видеть детей с полной транспозицией в возрасте одного-двух лет. Они очень синие и сильно отстают в физическом развитии. Их глаза — умные, страдающие, и как будто все понимающие — невозможно забыть никогда. Этим детям тоже можно и нужно срочно помочь, и такие методы есть, их применяют давно, и они хорошо себя зарекомендовали. Задолго до того, как хирургическая наука сделала возможным раннее и анатомически радикальное лечение транспозиции, был предложен другой, менее радикальный, но достаточно эффективный метод.
Идея заключается не в исправлении анатомии (тогда это было технически невозможно), а в изменении путей потоков крови, т.е. направлении крови из вен в легкие, в малый круг, а окисленной крови — в левый желудочек и в аорту, т.е. в большой круг.
Методы, известные как «внутрипредсердная коррекция» были долгое время единственными в лечение транспозиции, но они применяются и сегодня, когда по каким-то причинам нет возможности выполнить анатомическую коррекцию.
Суть операции сводится к рассечению правого предсердия, удалению всей межпредсердной перегородки и вшиванию внутри полости заплаты из собственных тканей ребенка (перикарда, или стенки предсердия) таким образом, что кровь из полых вен направляется в левый желудочек, от которого отходит легочная артерия, и затем — в легкие, а из легочных вен — в правый желудочек, в аорту и в большой круг кровообращения. Эти операции, известные по имени их авторов – Мастарда и Сеннинга, исправляют гемодинамику, но не сам порок. Сегодня в мире накоплен большой опыт таких операций, и судьба оперированных больных прослежена в течение уже нескольких десятков лет. У половины из них нормальная, достаточно активная и длительная жизнь. У другой части могут со временем возникать осложнения в виде нарушений ритма, недостаточности предсердно-желудочковых клапанов — ведь желудочки сердца остались на месте и работают не так, как предусмотрено природой. Люди, перенесшие такую операцию, иногда немного синюшные — особенно губы и ногти на руках и ногах. Остаются ограничения в физических нагрузках. Девочкам, достигшим зрелого возраста, могут не рекомендовать рожать детей, и не из-за того, что ребенок будет с пороком – это полное заблуждение, а из-за того, что беременность и роды могут оказаться чересчур большой физической нагрузкой. Но, как бы то ни было, методы внутрипредсердной коррекции спасли жизнь сотням детей. Так что, если и упущен момент для анатомической коррекции, выход есть, и хороший выход.
Тем более что в последние годы начали осуществлять операции перемещения сосудов с удалением старых внутрипредсердных заплат. Такое — не всегда возможно и необходимо, и, кроме как «высшим пилотажем» в кардиохирургии это нельзя и назвать. Но время идет вперед, и я только хочу, чтобы вы поверили: транспозиция магистральных сосудов сегодня — вполне излечимый порок, и ни один ребенок, родившийся с ним, погибать не должен. Но при этом его будущее зависит во многом и от вас, и от вашей веры в современные возможности медицины.
Хирургическое лечение транспозиции магистральных сосудов у детей
Общая информация
Краткое описание
Рекомендовано
Экспертным советом
РГП на ПХВ «Республиканский центр
развития здравоохранения»
Министерства здравоохранения
и социального развития
Республики Казахстан
от «30» сентября 2015 года
Протокол № 10
Хирургическое лечение транспозиции магистральных сосудов у детей.
Код протокола:
Код(ы) МКБ:
Q20.3 – Транспозиция магистральных сосудов
Q 20.3 – Дискордантное предсердно желудочковой соединение.
Q20.5 – Дискордантное желудочково-предсердное соединение.
Q25.8 – Другие врожденные аномалии крупных артерий
Q21.0 – Дефект межжелудочковой перегородки
Q21.1 – Дефект межпредсердной перегородки
Q25.0 – Открытый артериальный проток
Сокращения, используемые в протоколе:
| АВ –- атриовентрикулярный АоК –- аортальный клапан ВИЧ –- вирус иммунодефицита человека ВПС –- врожденные пороки сердца ДМЖП –- дефект межжелудочковой перегородки ДОС от ПЖ –- двойное отхождение сосудов от правого желудочка ИК –- искусственное кровообращение ИФА –- Иммуноферментный анализ КоА –- коарктация аорты КТ –- компьютерная томография МРТ –- магнитно-резонансная томография ЛА –- легочная артерия ЛГ –- легочная гипертензия ОАП –- открытый артериальный проток ОВТЛЖ – обструкция выводного отдела из левого желудочка ООО –- открытое овальное окно ТМС –- транспозиция магистральных сосудов ЭКГ –- электрокардиограмма ЭхоКГ –- эхокардиография D-ТМС –- простая транспозиция магистральных сосудов L-TMA –- корригированная транспозиция магистральных сосудов PVR –- pulmonary vascular resistance SVR –- systemic vascular resistance АлТ –- аланинаминотрансфераза АсТ –- аспартатаминотрансфераза Qp/Qs – отношение легочного кровотока к системному |
Дата разработки протокола: 2015 год.
Категория пациентов: дети.
Пользователи протокола: детские кардиохирурги, детские кардиологи, неонатологи, педиатры.
Примечание: в данном протоколе используются следующие классы рекомендаций и уровни доказательств:
Классы рекомендаций:
Класс I – польза и эффективность диагностического метода или лечебного воздействия доказана и и/или общепризнаны
Класс II – противоречивые данные и/или расхождение мнений по поводу пользы/эффективности лечения
Класс IIа – имеющиеся данные свидетельствуют о пользе/эффективности лечебного воздействия
Класс IIb – польза / эффективность менее убедительны
Класс III – имеющиеся данные или общее мнение свидетельствует о том, что лечение неполезно/ неэффективно и в некоторых случаях может быть вредным
| А | Высококачественный мета-анализ, систематический обзор РКИ или крупное РКИ с очень низкой вероятностью (++) систематической ошибки результаты которых могут быть распространены на соответствующую популяцию. |
| В | Высококачественный (++) систематический обзор когортных или исследований случай-контроль или Высококачественное (++) когортное или исследований случай-контроль с очень низким риском систематической ошибки или РКИ с невысоким (+) риском систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| С | Когортное или исследование случай-контроль или контролируемое исследование без рандомизации с невысоким риском систематической ошибки (+). Результаты которых могут быть распространены на соответствующую популяцию или РКИ с очень низким или невысоким риском систематической ошибки (++ или +), результаты которых не могут быть непосредственно распространены на соответствующую популяцию. |
| D | Описание серии случаев или неконтролируемое исследование или мнение экспертов. |
| GPP | Наилучшая фармацевтическая практика. |
Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
Автоматизация клиники: быстро и недорого!
Мне интересно! Свяжитесь со мной
Классификация
Классификация: [19]
Полная транспозиция магистральных артерий (d-TMA) представляет собой аномалию вентрикуло-артериального соединения, при котором на фоне предсердного situs solitus аорта отходит от анатомически правого желудочка, а легочная артерия – от анатомически левого желудочка.
Классическую полную ТМС называют D-транспозицией, при которой аорта расположена спереди и справа от легочного ствола. Полная транспозиция магистральных артерий составляет 5–7 % всех ВПС; чаще она наблюдается улиц мужского пола (соотношение мужчин и женщин с данным пороком – 3:1)
В зависимости от сочетания ТМС с сопутствующими аномалиями выделяют четыре основных типа порока:
· Транспозиция магистральных артерий с интактной межжелудочковой перегородкой (простая транспозиция) (50%);
· Транспозиция магистральных артерий с ДМЖП;
· Транспозиция магистральных артерий с интактной МЖП/ДМЖП и ОВТЛЖ (КоА, перерыв дуги аорты);
· ТМС с ДМЖП и стенозом ЛА.
Классификация типов отхождения коронарных артерий:
Лейденская классификация коронарной анатомии при D-ТМС
Данная классификация определяет синусы аорты, от которых отходят три главные коронарные артерии. Два аортальных синуса Вальсальвы, прилежащие к аортолегочной перегородке, обращены к соответствующим синусам легочной артерии и в 99% случаев содержат устья коронарных артерий. Их называют «септальными» или «facing» (обращенные лицом) синусами.
Согласно конвенции, принято обозначать цифрами коронарные синусы:
· синус 1 – прилежащий к легочной артерии с левой стороны;
· синус 2 – прилежащий к легочной артерии с правой стороны.
Если магистральные артерии расположены в переднезадней проекции, септальные синусы направлены влево и вправо.
Если артерии расположены бок о бок, синусы направлены соответственно кпереди и кзади.
Если аорта расположена спереди и справа от легочной артерии (типичное взаимоотношение при ТМА), септальные синусы имеют переднелевое и заднеправое расположение.
Синус
Синус 1 – прилежащий к легочной артерии с правой стороны от наблюдателя;
Синус 2 – прилежащий к легочной артерии с левой стороны от наблюдателя.
Коронарные артерии:
Правая коронарная артерия (RСА);
Передняя нисходящая артерия (LAD);
Огибающая артерия (CX).
Буквой А обозначают отхождение большинства ветвей от общего сосуда, точкой с запятой (;) – отдельное отхождение.
ДОПОЛНИТЕЛЬНАЯ ОПИСАТЕЛЬНАЯ КЛАССИФИКАЦИЯ:
Прохождение главных ветвей коронарных артерий
По эпикарду:
· Переднее А: ветви проходят впереди аорты;
· Заднее А: ветви проходят позади легочной артерии;
· Между А: ветви проходят между магистральными артериями (обычно интрамурально).
Необычное отхождение:
· Комиссуральное А: коронарное устье располагается близко к комиссуре клапана;
· Раздельное: отдельные источники двух ветвей, от одного синуса аорты;
· Отдаленное или дистальное: отхождение огибающей и задней нисходящей артерии в качестве дистальной бифуркации правой коронарной артерии.
Расположение аорты относительно легочной артерии:
Справа или спереди, слева, «бок о бок», сзади.
Наиболее часто встречающийся вариант анатомии коронарных артерий; 1LCx2R
Показания к госпитализации: наличие врожденного порока сердца с нарушениями гемодинамики
Диагностика
Перечень основных и дополнительных диагностических мероприятий:
Основные (обязательные) диагностические обследования:
· определение суммарных антител к HBsAg вируса гепатита B в сыворотке крови ИФА-методом;
· определение суммарных антител к вирусу гепатита C в сыворотке крови ИФА-методом;
· исследование на возбудителя сальмонеллёза, дизентерии, брюшного тифа;
· бактериологическое исследование испражнений на патогенную и условно- патогенную микрофлору;
· исследование кала на яйца гельминтов;
· рентгенография органов грудной клетки в одной проекции;
· мазок из зева на патологическую флору
· микрореакция;
· исследование крови на ВИЧ;
· эхокардиография;
· ЭКГ;
· общий анализ мочи;
· общий анализ крови;
· биохимический анализ крови: (определение общего белка, глюкозы, креатинина, мочевины, АлТ, АсТ).
Дополнительные диагностические обследования:
· холтеровское мониторирование ЭКГ;
· электроэнцефалография;
· КТ и/или МРТ головного мозга;
· КТ и/или МРТ грудного, брюшного сегмента;
· УЗИ почек.
Эхокардиография: Предсердно-желудочковая конкордантность и желудочково-артериальной дискордантность. ЭХО-признаки дискордантности:
· аорта отходит от ПЖ, легочная артерия от ЛЖ;
· магистральные сосуды и выводные тракты желудочков параллельны (выводятся одновременно без ротации датчика);
· полулунные клапаны расположены на одном уровне;
· митрально-легочное фиброзное продолжение (+);
· желудочки сердца расположены обычно, ПЖ гипертрофирован исследовании, дилатация ПЖ, различной степени, дилатация ЛА.
Задачи эхокардиографического исследования: установить наличие дискордантных вентрикулоартериальных соотношений, пространственную ориентацию магистральных сосудов, отхождение проксимальных сегментов коронарных артерий, большинство важных сопутствующих аномалий, включая количество, размер и локализацию межкамерных коммуникаций (ООО, ОАП, ДМЖП), анатомический тип обструкции выводного тракта левого желудочка, аномалии AВ-клапанов, наличие пороков, обусловленных нарушением частей межжелудочковой перегородки и связанным с ней отхождением обоих магистральных сосудов от правого желудочка с подлегочным ДМЖП и нависающей легочной артерией.
Компьютерная ангиография/магнитно-резонансная томография: с целью диагностики анатомии порока и выявления сопутствующих ВПС.
Катетеризация полостей сердца: с целью проведения процедуры Рашкинда и диагностики сложных сопутствующих ВПС (обструкция ВОЛЖ). Катетеризацию проводят с измерением давления в левом желудочке, уточнения деталей анатомии порока и особенностей отхождения коронарных артерий, измерение давления в легочной артерии, что особенно важно при ТМС с ДМЖП и легочной сосудистой болезнью.
Показания для консультации специалистов:
· Консультация аритмолога: наличие нарушений ритма сердца (пароксизмальная предсердная тахикардия, фибрилляция и трепетание предсердий, синдром слабости синусового узла), диагностированные клинически, по данным ЭКГ и ХМЭКГ.
· Консультация невропатолога: наличие эпизодов судорог, наличие парезов, гемипарезов и других неврологических нарушений;
· Консультация инфекциониста: наличие признаков инфекционного заболевания (выраженные катаральные явления, диарея, рвота, сыпь, изменение биохимических показателей крови, положительные результаты ИФА исследований на внутриутробные инфекции, маркеры гепатитов);
· Консультация оториноларинголога: носовые кровотечения, признаки инфекции верхних дыхательных путей, тонзиллиты, синуситы;
· Консультация гематолога: наличие анемии, тромбоцитоза, тромбоцитопении, нарушение свертываемости, другие отклонения гемостаза;
· Консультация нефролога: наличие данных за ИМВП, признаки почечной недостаточности, снижение диуреза, протеинурия.
Лечение
· пациенты с подозрением на ТМС;
· хирургическое лечение патологической гемодинамики (восстановление нормальной гемодинамики);
· комплексное обследование;
· установление точного диагноза;
· определение критериев операбельности;
· выбор способа хирургического лечения;
· проведение операции, послеоперационное ведение.
Показание и противопоказание для проведения процедуры:
Показания для проведения процедуры/вмешательства:
· пациенты с диагностируемой транспозицией магистральных сосудов.
Противопоказание к проведению процедуры/вмешательства:
· гипоплазия системного (левого) желудочка, не устраненная предшествующим подготовительным этапом (суживания СЛА).
Требования к проведению процедуры/вмешательства:
Операции при ТМС осуществляется в хирургическом отделении или в центре, оснащенном в соответствии со стандартами оснащения отделений хирургического профиля, утвержденными в установленном порядке.
Требования к санитарно-противоэпидемическому режиму:
Меры безопасности и противоэпидемический режим согласно Санитарным правилам «Санитарно-эпидемиологические требования к объектам здравоохранения», утвержденным постановлением Правительства Республики Казахстан от 17 января 2012 года № 87.
Требования к оснащению:
Требования к основному перечню оснащения медицинской организации, в которой осуществляется операции по поводу ТМС
| N п/п | Наименование |
| 1 | Аппарат для гемодиализа и гемодиафильтрации |
| 2 | Аппарат искусственного кровообращения |
| 3 | Центрифужный насос крови |
| 4 | Молекулярно-адсорбирующая-циркулирующая система |
| 5 | Аппарат для экстракорпоральной мембранной оксигенации (ЭКМО) |
| 6 | Аппарат ультразвуковой диагностики экспертного класса с доплером |
| 7 | Компьютерный томограф |
| 8 | Магнитно-резонансный томограф |
| 9 | Ангиограф |
| 10 | Система для очистки и аутотрансфузии крови |
| 11 | Аппарат рентгеновский стационарный |
| 12 | Мобильная рентгенографическая система |
Требования к расходным материалам:
Стерильные разовые расходные материалы:
· канюли для проведения ИК;
· нити синтетические монофиламентные;
· нити с покрытием из полимера (этилен терефталат);
· многонитчатый шовный материал из синтетического сополимера, состоящего на 90% из гликолида и на 10% из L-лактида, титановая проволока.
Отдельные формы ТМС требуют:
· биологические клапансодержащие кондуиты.
Требования к лекарственным средствам:
Медикаментозное лечение: Внутривенная инфузия препаратов простагландина Е1 с целью препятствования закрытия ОАП.
· коррекция метаболического ацидоза;
· коррекция гипогликемии;
· коррекция гипокальциемии.
Медикаментозное лечение:
На первом этапе проводится постоянная инфузия простагландина E1 (из расчета 0,01 – 0,04 мкг/кг/мин) для предупреждения закрытия артериального протока. Это особенно важно при ТМС с ДМЖП и обструкцией выводного тракта левого желудочка. Во время катетеризации сердца у новорожденных с выраженной гипоксемией проводится баллонная атриосептостомия Рашкинда.
Эффективной считают процедуру, после которой сатурация повысилась на 10% и более и не развивается метаболический ацидоз. Косвенными признаками успешной процедуры являются: увеличение потока через межпредсердное сообщение, определяемое с помощью цветной допплерографии, появление флотирующих краев перегородки в области отверстия, изменение относительных размеров предсердий.
Проводится коррекция метаболического ацидоза бикарбонатом натрия.
При развитии отека легкого и тяжелой гипоксемии при необходимости больной переводится на искусственную вентиляцию легких.
В случаях ригидной межпредсердной перегородки возможно применение ножевой атриосептостомии или дилатации отверстия баллоном высокого давления.
Следует отметить, что активное применение простагландинов в условиях малого межпредсердного сообщения может быть опасным. Это связано с тем, что большой сброс через ОАП, приводящий к увеличенному возврату крови из легких в левое предсердие, сопровождается неадекватным опорожнением последнего и чревато развитием отека легких.
Мероприятия, направленные на купирование симптомов недостаточности кровообращения: нормализация сердечного выброса:
Диуретики:
при недостаточности кровообращения – фуросемид 1-3 мг/кг/сут в 3 приема с переходом на триамтерен 1-3 мг/кг/сут или верошпирон 2-4 мг/кг/сут;
Сердечные гликозиды:
при наличии недостаточности кровообращения 2-ой и более степени – дигоксин в поддерживающей дозе 0,006-0,008 мг/кг/сут в 2 приема через 12 часов;
Ингибиторы ангиотензин-превращаюшего фермента:
снижение периферического тонуса, уменьшение постнагрузки:
· каптоприл 0,05 – 0,5 мг/кг/сут детям младше 6 месяцев, детям старше 6 месяцев 0,5-2,0 мг/кг/сут в 3 приема;
· эналаприл (энам) 0,1-0,5 мг/кг/сут в 2 приема.
Антибактериальная терапия:
с учетом интеркуррентных заболеваний, застойной пневмонии (предпочтительно назначение цефалоспоринов 2 – 3 поколения, возможно назначение в сочетании с аминогликозидами) с последующим переходом на пероральную антибактериальную терапию.
В тяжелых случаях использование антибиотиков резерва: имипенем, карбипенем, ванкомицин, ципрофлоксацины, макролиды.
«Защищенные» пенициллины (амоксиклав, аугментин из расчета 20-50 мг/кг сутки) в 2-3 приема перорально;
Макролиды: спирамицин 1,5 млн Е./10 кг/сутки – 2 раза в день; сумамед в суточной дозировке 10 мг/кг в 1 день приема, 5 мг/кг со 2 по 5-ый день приема, курсом 3-5 дня);
Цефалоспорины II—III поколения в суточной дозе 70-100 мг/кг сутки (цефуроксим, цефтазидим, цефтриаксон, цефаперазон, цефотаксим) – 2 раза в день в/в, в/м;
«защищенные цефалоспорины» – сульфперазон 20-40 мг/кг;
Цефалоспорины IV-го поколения – максипим – 70- 100 мг/кг в сутки – 2 приема, в/в или в/м;
Аминогликозиды: гентамицин 2-4 мг/кг в сутки в 2 приема, предпочтительно в/м не более 7 дней, амикацин 10-15 мг/кг в сутки в 2 приема в/м иди в/в – под контролем диуреза, уровня мочевины, креатинина в крови, мониторинг слуха;
Карбопенемы: меропенем– 15-20 мг/кг – 3-4 раза в сутки в/в струйно или капельно, тиенам – 15-20 мг/кг в сутки каждые 6-8 часов в/в струйно и капельно;
Гликопептиды: (Ванкомицин) 15-30 мг/кг.
Основные лекарственные препараты, применяемые при лечение новорожденных с транспозицией магистральных сосудов:
| 4. | Антибактериальные препараты | |
| Цефазолин | 100 мг/кг в сутки В 2-4 приема в/в | 10 дней |
| Цефуроксим | 100 мг/кг в сутки в 2-4 приема в/в | 10 дней |
| Фортум | 100 мг/кг/сутки | 10 дней |
| Амикацин | 10-15 мг/кг/сутки В 2 введения в/в | 7-10 дней |
| 5. | Диуретики | |
| Фуросемид | 0,5 – 1 мг/кг разовая доза 3-4 раза в сутки | 14 дней |
| Верошпирон | 2-4 мг/кг в сутки в 2 приема перорально в 8.00, в 12.00 | 14 дней |
| 6. | Ингибиторы АПФ | |
| капотен 1 т. 25 мг | 0,1-0,5 мг/кг в сутки в 3 приема | 14 дней |
| энап 1 т. 2,5 мг | 0,1-0,5 мг/кг/ сутки | 14 дней |
| 7. | блокаторы – β-адренорецепторов | |
| карведилол | 0,1-0,8 мг/кг в сутки в 2 приема | 14 дней |
| анаприлин | 1 мг/кг/сутки в 3 приема | 14 дней |
| метопролол | 5 мг/кг/сутки в 2 приема | 14 дней |
| 8. | Растворы для в/венных инфузий | |
| Физ. Р-р | 10 мл/кг | 14 дней |
| Глюкоза 10% | 10 мл/кг | 14 дней |
| Аминоплазмаль | 14 дней; | |
| Гидрокарбонат натрия | Расчет на основании показателей КЩС | По потребности |
Требования к подготовке пациента:
Письменное информированное согласие пациента на проведение процедуры;
В виду сложности порока пациенты с диагнозом ТМС без дефекта межжелудочковой перегородки в дооперационном периоде должны находится в ОАРИТ. Пациенты с ТМС и дефектом межжелудочковой перегородки с хорошим сбросом на уровне дефекта – пребывание в дооперационном периоде возможно в отделение кардиохирургии в случае стабильного исходного состояния.
Непосредственная предоперационная подготовка:
Возможна госпитализация, как в плановом порядке, так и по линии санитарной авиации.
· прекращение приема пищи и жидкости (не менее 6 часов до начала операции);
· установка внутрисосудистых катетеров.
Препараты выбора для наркоза:
– фентанил 5-10 мкг/кг в/в
– изофлуран и десфлуран
– аркурон 0,08 мг/кг в/в каждые 60-90 мин.
· режим ИВЛ направлен на нормализацию газового состава крови: нормовентиляция, дыхательный объем – 6-8 мл/кг идеальной массы тела, I:E/1:2, ПДКВ – 5-7 см.вод.ст, с повышением FiO2 – 80-100% на начальном этапе операции, капнография – нормокапния;
· инфузионная терапия направлена на поддержание адекватной волемии, достаточного коллоидного давления плазмы, восполнение потери эритроцитов, факторов свертывания и тромбоцитов: препараты крови – эритроцитарная масса 5-20 мл/кг, СЗП 5-20 мл/кг мл, концентрат тромбоцитов 1-2 дозы.
· целевые значения Нв не менее 130 г/л, кристаллоидные растворы, применение коллоидных растворов возможно при гиповолемии под контролем центрального венозного давления;
Основной этап операции проводится в условиях искусственного кровообращения.
Канюляция: центральная
Гепарин 300 ед/кг перед канюляцией для ИК, контроль АВС во время работы ИК.
Кардиотоническая поддержка инотропными препаратами:
· норэпинефрин 0,02- 0,5 мкг/кг/мин;
· эпинефрин 0,02- 0,3 мкг/кг\мин;
· дофамин 3-15 мкг/кг/мин;
· добутамин 3-15 мкг/кг/мин;
· милринон 0,1-0,5 мкг/кг/мин;
· симдакс 0,2 мкг/кг/мин;
· фенилэфрин.
После завершения хирургического гемостаза производится нейтрализация гепарина протамин-сульфатом под контролем активированного времени свертывания. Ингибиторы фибринолиза (транексамовая кислота).
Инфузия свежезамороженной плазмы (5-20 мл/кг), криопреципитата, тромбомассы, крововозамещение свежей эритроцитарной массой осуществляется строго по показаниям (согласно Приказу № 666 Министерства здравоохранения РК «Об утверждении Номенклатуры, Правил заготовки, переработки, хранения, реализации крови и ее компонентов, а также Правил хранения, переливания крови, ее компонентов и препаратов» и приложения к нему).
Лечение когулопатических кровотечений:
Октаплекс 0,9-1,9 мл/кг, максимальная разовая доза 500 МЕ (20 мл Октаплекса). Расчет необходимой дозы для лечения является в основном эмпирическим, из расчета, что 1МЕ фактора II или фактора Х на 1 кг/массы тела, соответственно, увеличивает активность плазменного фактора II или Хна 0,02 и 0,017 МЕ/мл.
Эптаког альфа: начальная доза 90 мкг/кг, которая вводится через 2 ч, а затем препарат вводится с 2-3-часовыми интервалами на протяжении первых 24-48 ч в зависимости от проводимого вмешательства и клинического состояния пациента.
Лечение легочной гипертензии:
· монооксид азота 10-40 ppm под контролем тромбоцитов и метHb;
· илопрост ингаляции 2,5-10 мкг 4 раза в день.
Антибиотикопрофилактика:
Антибактериальные средства.
Цефалоспорины II, III поколения в качестве базовой антибиотикотерапии. Карбопенемы назначаются в зависимости от результатов бактериальных посевов пациента.
Антимикотики:
· Амфотерицин В липидный комплекс, ингаляционно, через небулайзер, 50 мг/сут для экстубированных пациентов, 100 мг/сут для интубированных пациентов. В течении 4 дней после трансплантации, далее по потребности.
· Нистатин, суспензия, 100 тыс. ед/мл, 5 мл 4 раза в день, 6 мес. после трансплантации.
· Вориконазол 6 мг/кг, в/в (или 400 мг peros), каждые 12 часов, далее 4 мг/кг в/в (или 200 мг peros), каждые 12 часов, в течении 4 мес. после трансплантации.
Методика проведения процедуры/вмешательства: (см. Приложение 1)
Эндоваскулярная баллонная атриальная септостомия – паллиативный метод лечения в случае абсолютных противопоказаний по сопутствующей патологии и как метод стабилизации состояния ребенка перед радикальной хирургической операцией.
Баллонная атриальная септостомия (процедура Рашкинда): показана, если имеется рестриктивный ДМПП при следующей патологии:
– ТС с интактной межжелудочковой перегородкой (класс I);
– ТМС в сочетании с ДМЖП/ОАП, если хирургическая коррекция откладывается на несколько недель в силу объективных причин (класс I), (градиент давления между предсердиями более 6 мм рт.ст. – рестриктивная коммуникация) хирургическая коррекция, как наиболее традиционный метод.
· Артериальное переключение является операцией выбора, оптимальное время ее выполнения в первые 2 недели жизни, но не позже 4-недельного возраста. Ранняя хирургическая летальность в клиниках, имеющих опыт, составляет 2–5%.
· Суммарная 5 летняя выживаемость в среднем равна 85%.
· Если сроки артериального переключения упущены (т.е. после месячного возраста), может быть предпринято двухэтапное лечение. Оно предполагает суживание легочной артерии с межартериальным шунтом или без него и затем.
· Артериальное переключение.
· Детям с неблагоприятной анатомией коронарных артерий выполняют операцию переключения на предсердном уровне (операции Сеннинга или Mастард) в возрасте 3–9 мес. или артериальное переключение при достаточном опыте выполнения этих операций.
Младенцы с ОАП.
При наличии небольшого ОАП тактика та же, что и при ИМЖП. При большом ОАП, протекающем с сердечной недостаточностью, сроки операции могут быть удлинены до 2–3 недель. Риск летального исхода не превышает 5%.
ТМС с изолированным СЛА.
· Динамическая обструкция выводного тракта левого желудочка не препятствует выполнению артериального переключения. Этот тип обструкции разрешается спонтанно после операции.
· Невыраженный анатомический клапанный или подклапанный стеноз устраняется во время операции артериального переключения без увеличения хирургического риска.
· При наличии выраженного СЛА оптимальным вмешательством является операция Senning хирургическое устранение стеноза в 3–6месячном возрасте.
ТМС с ДМЖП.
· При небольшом ДМЖП тактика та же, что и при простой ТМА.
· При наличии большого ДМЖП наиболее распространенной практикой является операция артериального переключения с одновременным закрытием ДМЖП без предшествующего суживания легочной артерии в возрасте 2 недели – 2 месяцев. Риск операции при этом не повышается. Допустимым, но не лучшим методом является операция Senning с одновременным закрытием ДМЖП без суживания легочной артерии в возрасте 3 – 4 мес.
· Множественный ДМЖП представляет особую, редко встречающуюся патологию. Этим пациентам показано суживание легочной артерии к 3 – 4 месяцев жизни, в более позднем периоде – операция Фонтен.
· Больным с большим ДМЖП и сопутствующим субаортальным стенозом показана операция артериального переключения с резекцией элементов подклапанного сужения. При диффузной гипоплазии выводного тракта правого желудочка и клапанного кольца аорты показана операция Дамус-Кей-Стэнсел в сочетании с Растеллив возрасте 1–2 года. Летальность составляет 15–30%.
· При гипоплазии дуги и коарктации аорты предпочтительнее одномоментная реконструкция аорты и артериальное переключение.
· Больным с большим ДМЖП и гипоплазированным правым желудочком или «верхом сидящим» АВ клапаном не может быть выполнена ни одна из приведенных выше операций, так как в первом случае анатомия порока соответствует функционально единственному желудочку сердца, а во втором — разделение левых и правых отделов сердца технически невозможно. Для этого варианта показано раннее суживание легочной артерии и позднее – операция Фонтен.
Уровень сложности по базовой шкале Аристотеля:
| Процедура/ операция | Сумма балов (базовая шкала) | Уровень сложности | Смертность | Риск осложнений | Сложность |
| Операция артериального переключения при транспозиции магистральных сосудов | 10.0 | 4 | 3.5 | 3.0 | 3.5 |
| Операция артериального переключения при транспозиции магистральных сосудов в сочетании с пластикой дефекта межжелудочковой перегородки | 11.0 | 4 | 4.0 | 3.0 | 4.0 |
| Формирование модифицированного системно-легочного анастомоза по Блэлок-Тауссиг | 6.3 | 2 | 2.0 | 2.0 | 2.3 |
| Операция Сеннинга | 8.5 | 3 | 3.0 | 2.5 | 3.0 |
| Операция Мастарда | 9.0 | 3 | 3.0 | 3.0 | 3.0 |
| Операция Растелли | 10.0 | 4 | 3.0 | 3.0 | 4.0 |
| Процедура REV (reparation a l’etageventriculaire) | 11.0 | 4 | 4.0 | 3.0 | 4.0 |
| Операция Nikaidoh (Никайдо) | |||||
| Процедура Дамус-Кей-Стэнсел | 9.5 | 3 | 3.0 | 3.0 | 3.5 |
| Бэндинг легочной артерии | 6.0 | 2 | 2.0 | 2.0 | 2.0 |
| Создание/ увеличение дефекта межпредсердной перегородки | 4.0 | 1 | 1.0 | 2.0 | 1.0 |
Значимость баллов по базовой шкале Аристотеля
Смертность
Длительность пребывания
в ОИТ
Сложность
Послеоперационное наблюдение:
Длительность наблюдения пациентов прооперированных по поводу ТМС пожизненная с интервалом 6-12 мес.
Цель наблюдения: диагностика возможных осложнений в отдаленном послеоперационном периоде. При развитии того или иного осложнения решение о виде лечения принимается в индивидуальном порядке.
Профилактика бактериального эндокардита проводится по показаниям в первые 6 месяцев после хирургической коррекции порока или более в случае наличия резидуальных шунтов в МЖП.
В случае регистрации в послеоперационном периоде непродолжительной преходящей атриовентрикулярной блокады необходимо длительное наблюдение без ограничения сроков (ЭКГ 1 раз в 6 месяцев, ХМЭКГ 1 раз в год).
Наиболее частые проблемы раннего послеоперационного периода при коррекции ТМС:
· наличие резидуального сброса;
· нарастание сердечной недостаточности;
· артериальная гипертензия;
· нарушение ритма сердца и атриовентрикулярной проводимости (пароксизмальная предсердная тахикардия, фибрилляция и трепетание предсердий, синдром слабости синусового узла);
· повреждение возвратного гортанного нерва (чаще при «неудобном расположении» протока).
· повреждение диафрагмального нерва.
· хилоторакс (возникает в результате повреждения грудного протока). Лечение включает в себя дренирование грудной полости.
· постперикардиотомный синдром (перикардит);
· экссудативный перикардит.
· инфекционные осложнения: госпитальная пневмония, инфекция раны, бактериальный эндокардит, активизация хронической инфекции, в том числе вызванной внутриклеточными возбудителями (хламидии, микоплазмы, ЦМВ, ВПГ).
· инфекционный эндокардит;
· неврологические нарушения: энцефалопатия, судорожный синдром.
Поздние осложнения:
Индикаторы эффективности процедуры/вмешательства:
Результат считается хорошим, если клинически ребенок чувствует себя удовлетворительно, аускультативно отсутствует шумовая симптоматика, по данным ЭХОКГ-нет градиента на неоаорте, неолегочной артерии, хорошей сократительная способность миокарда, в случае сопутствующего ДМЖП-заплата герметична, нет жидкости в перикарде, плевральных полостях. Рана заживает первичным натяжением.
Результат считается удовлетворительным при наличии удовлетворительного самочувствия ребенка, аускультативно незначительного систолического шума по левому краю грудины, по данным ЭХОКГ – имеетсягемодинамически не значимый градиент на неоаорте, неолегочной артерии, в случае сопутствующего дмжпрезидуальный дефект допустимых размеров, с высоким чрежжелудочковым градиентом, удовлетворительной сократительной способности миокарда, нет жидкости в перикарде, плевральных полостях.
Результат считается неудовлетворительным при сохраняющейся клиники сердечной недостаточности. Аускультативно – глухость тонов, систолический шум по левому краю грудины, по данным ЭХОКГ – имеется гемодинамически значимый градиент на неоаорте, неолегочной артерии, низкой сократительной способностью миокарда, в случае сопутствующего ДМЖП имеется резидуальный дефект с большим лево-правым шунтом, с низким чрежжелудочковым градиентом, наличие жидкости в перикарде, плевральных полостях. Показана повторная операция.
Препараты (действующие вещества), применяющиеся при лечении
| Алпростадил (Alprostadil) |
| Амикацин (Amikacin) |
| Аминокислоты для парентерального питания + Прочие препараты (Минералы) (Aminoacids for parenteral nutrition + Other medicines (Multimineral)) |
| Амфотерицин B (Amphotericin B) |
| Вориконазол (Voriconazole) |
| Гепарин натрия (Heparin sodium) |
| Декстроза (Dextrose) |
| Десфлуран (Desflurane) |
| Дигоксин (Digoxin) |
| Добутамин (Dobutamine) |
| Допамин (Dopamine) |
| Изофлуран (Isoflurane) |
| Илопрост (Iloprost) |
| Каптоприл (Captopril) |
| Карведилол (Carvedilol) |
| Концентрат тромбоцитов (КТ) |
| Криопреципитат |
| Левосимендан (Levosimendan) |
| Метопролол (Metoprolol) |
| Милринон (Milrinone) |
| Монооксид азота |
| Натрия гидрокарбонат (Sodium hydrocarbonate) |
| Натрия хлорид (Sodium chloride) |
| Нистатин (Nystatin) |
| Норэпинефрин (Norepinephrine) |
| Пипекурония бромид (Pipekuroniyu bromide) |
| Плазма свежезамороженная |
| Пропранолол (Propranolol) |
| Спиронолактон (Spironolactone) |
| Транексамовая кислота (Tranexamic acid) |
| Факторы свертывания крови II, VII, IX и X в комбинации Протромбиновый комплекс) (Coagulation Factor II, VII, IX and X in combination (Prothrombin complex)) |
| Фенилэфрин (Phenylephrine) |
| Фентанил (Fentanyl) |
| Фуросемид (Furosemide) |
| Цефазолин (Cefazolin) |
| Цефтазидим (Ceftazidime) |
| Цефуроксим (Cefuroxime) |
| Эналаприл (Enalapril) |
| Эналаприлат (Enalaprilat) |
| Эпинефрин (Epinephrine) |
| Эптаког альфа (активированный): рекомбинантный коагуляционный фактор VIIa (Eptakog alfa (activated, 1); recombinant coagulation factor VIIa) |
| Эритроцитарная масса |
Группы препаратов согласно АТХ, применяющиеся при лечении
| (J01DH) Карбапенемы |
| (J01DC) Цефалоспорины второго поколения |
| (J01DD) Цефалоспорины третьего поколения |
Информация
Источники и литература
Информация
1) Горбунов Дмитрий Валерьевич – кандидат медицинских наук АО «Национальный научный кардиохирургический центр» заведующий детским кардиохирургическим отделением.
2) Иванова-Разумова Татьяна Владимировна – кандидат медицинских наук АО «Национальный научный кардиохирургический центр» заведующий отделением детской реабилитации.
3) Ибраев Талгат Ергалиевич – АО «Национальный научный кардиохирургический центр» заведующий отделением детской анестезиологии, реанимации и интенсивной терапии
4) Утегенов Галымжан Маликович – АО «Национальный научный кардиохирургический центр» кардиохирург
5) Мамежанова Людмила Ильинична – АО «Национальный научный кардиохирургический центр» кардиолог
6) Тулеутаева Райхан Есенжановна – кандидат медицинских наук РГП на ПХВ «Государственный медицинский университет города Семей», заведующая курсом клинической фармакологии, врач – клинический фармаколог.
Конфликт интересов: финансовая или другая заинтересованность в теме обсуждаемого документа отсутствует.
Рецензенты: Куатбеков Кайрат Ниеталиевич – кандидат медицинских наук, ГКП на ПХВ «Центр перинатологии и детской кардиохирургии» Управления здравоохранения города Алматы, заведующий отделением детской кардиохирургии, врач – кардиохирург высшей квалификационной кардиохирургии, главный специалист по детской кардиохирургии Управление здравоохранения города Алматы.
Условия пересмотра протокола: пересмотр протокола через 3 года после его опубликования и с даты его вступления в действие или при наличии новых методов с уровнем доказательности.