что такое титрование в лаборатории
Титриметрия. Посуда, титрованные растворы, способы и методы
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
ТИТРИМЕТРИЯ
Основные понятия титриметрии
Титриметрический анализ основан на точном измерении реактива, израсходованного на реакцию с определяемым веществом. Раньше этот вид анализа называли объемным, так как в расчетах используют объем раствора, пошедшего на реакцию. Титриметрия отличается от гравиметрии малой трудоемкостью, простотой аппаратурного оформления. Титриметрический анализ в отношении скорости выполнения дает огромное преимущество по сравнению с гравиметрическим, являющимся, однако, наиболее точным химическим методом анализа.
Титриметрия возникла в середине XVIII века. Многие ученые внесли вклад в ее развитие. У. Льюис (1767) дал определение понятия «точки насыщения», т. е. точки эквивалентности. Благодаря работам Ж. Гей-Люссака титриметрия превратилась из метода анализа в самостоятельный раздел науки. Э. Мор разработал много методик по данному виду анализа, написал учебник по химико-аналитическому методу титрования (1856); В. Оствальд и А. Ганч развили теорию индикаторов (1894).
Титриметрия широко применяется в настоящее время для научных исследований и при контроле технологических процессов.
Титруемое вещество — вещество, количество которого определяется непосредственно в процессе титрования.
Титрант — вещество, вступающее в реакцию с титруемым веществом. Концентрация стандартного раствора титранта должна быть определена перед началом анализа с точностью не менее трех значащих цифр после запятой.
Аликвота — объем раствора, точно отмеренный при помощи калиброванной пипетки.
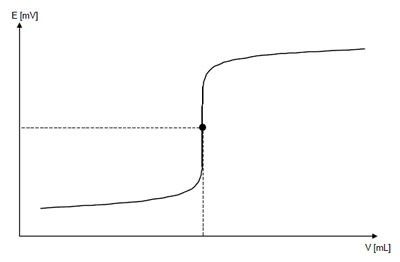
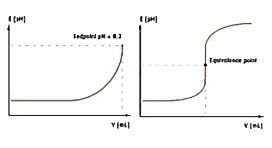
Титрование — прибавление титрованного раствора к анализируемому с целью определения точно эквивалентного его количества. Отсюда ясно, что при титровании необходимо достаточно точно установить момент наступления эквивалентности или, как говорят, фиксировать точку эквивалентности.
Реакция, используемая в титриметрическом анализе, должна протекать количественно, т. е. должны выполняться следующие условия:
Если не выполняется хотя бы одно условие, то метод титриметрии непригоден. Для этого метода необходимо:
В титриметрии концентрации растворов веществ выражают в молях эквивалентов вещества в одном кубическом дециметре или в одном литре раствора. Нормальная концентрация, используемая в аналитической химии, учитывает то, что эквиваленты веществ для разных реакций различаются, поэтому следует указывать (в скобках) фактор эквивалентности. Например, 0,1н КМnО4 (f экв = 1/5).
В полуреакции восстановления участвуют 5 электронов, следовательно, f экв (КМnО4) = 1/5, а эквивалент перманганата калия равен 1/5 молярной массы КМnО4.
Химическая лабораторная посуда и ее назначение
Для точного определения объемов используются бюретки, пипетки и мерные колбы (рис. 3.1).
Рис. 3.1. Мерная посуда а — цилиндры; б — мерные колбы; в — химический стакан; г — бюретки с краном; д — пипетка Мора
Бюретка — цилиндрическая трубка с суженым концом, к которому с помощью резинового шланга присоединена стеклянная трубка с оттянутым кончиком. На резиновый шланг надет зажим, либо вставлен в него стеклянный шарик. Если для титрования применяют агрессивные для резины растворы, то используют полностью стеклянную бюретку (пермангонатометрия). Бюретка градуиронана на миллилитры и десятые их доли. В титриметрии используют бюретки объемами 10, 25 и 50 мл. Заполненная раствором бюретка имеет вогнутую поверхность (мениск). По правилам показания по бюретке берут по нижнему краю мениска; глаз должен находиться на уровне этого нижнего края (рис. 3.2).
Рис. 3.2. Правила определения результатов исследований
Показания по бюретке могут быть с существенными погрешностями. Такие погрешности являются источником ошибок в объемном анализе.
Бюретка должна быть тщательно промыта и обезжирена (хромовой смесью — смесь концентрированной серной кислоты и бихромата калия или смесью раствора перманганата калия со щелочью). Затем бюретку многократно промывают водопроводной водой, 2−3 раза — дистиллированной водой и 2−3 раза — небольшими порциями раствора, которым заполняют бюретку для анализа. Затем заполняют бюретку раствором для титрования через воронку. При промывании бюретки нельзя затыкать ее сверху пальцами, так как пальцы никогда не бывают химически чистыми.
Пипетка используется для измерения точного объема раствора для метода титриметрии. Это стеклянная длинная узкая трубка с расширением или без него в середине. В верхней узкой части пипетки имеется черта, до которой и нужно заполнять пипетку раствором 5, 10, 20, 25, 50, 100 мл. На пипетке указана ее вместимость и температура, при которой градуирована пипетка. При необходимости используют измерительные пипетки (с градуировкой). Такие пипетки особенно необходимы для работы с небольшими объемами растворов (до 5 мл).
Рис. 3.3. Мерные стеклянные колбы
Используют мерные колбы для приготовления титрованных, стандартных растворов, а также для их разбавления. Моют колбы так же, как пипетки и бюретки, но не споласкивают рабочим раствором. Вначале раствор заливают через воронку в колбу, а затем доводят объем до черты прикапыванием воды из пипетки. Правило заполнения — по нижнему мениску.
Калибровка объемов мерной посуды идет при температуре 20–25 о С, точное значение температуры приготовления растворов указано на ней.
Приготовление титрованных растворов
Большая разница значений температур, при которых идет приготовление растворов, недопустима. Есть вещества, которые можно растворить только в горячей воде. Например, бура Na2B4O7 ∙10H2O. Растворение ее ведут в горячей воде, в половине объема, затем охлаждают до комнатной температуры и доводят объем водой до метки.
Существуют два способа приготовления титрованных растворов.
Вещество, удовлетворяющее указанным требованиям, называется первичным стандартом.
Второй способ — с установленным веществом. Если вещество не удовлетворяет требованиям, указанным выше, то используют установочные вещества. Например, для установления точной концентрации раствора NaOH используют в качестве установочного вещества щавелевую кислоту Na2C2O4 ∙2H2O, для соляной кислоты — буру Na2B4O7 ∙10H2O. Очень удобно использовать фиксаналы, выпускаемые промышленностью.
Фиксанал — запаянные ампулы с веществом для приготовления, как правило, 1 л раствора концентрации 0,1 н.
Основные способы и методы титрования
1. Способ прямого титрования. Определяемое вещество непосредственно реагирует с титрантом. Например, для определения концентрации кислоты ее титруют щелочью.
2. Способ обратного титрования (или титрование по остатку). Для этого способа необходимы два рабочих раствора, в раствор определяемого вещества вносят избыток основного рабочего раствора, а остаток оттитровывают вспомогательным рабочим раствором.
Например, в кислый раствор хлорида добавляют
AgNO 3 Ag + + Cl – = AgCl.
Затем избыток серебра оттитровывают роданидом Ag+ + CSN – = AgCSN.
3. Титрование по замещению, или косвенное титрование. К определяемому веществу (например, Cu +2) добавляют специальный реагент (I −) для проведения реакции, образовавшийся йод оттитровывают тиосульфатом натрия. Конец реакции определяют по крахмальному индикатору (исчезновение синей окраски).
Титрование проводят по следующим правилам:
Различают методы титриметрического анализа по типу основной реакции, протекающей при титровании. Выделяют следующие методы титриметрического анализа кислотно-основное взаимодействие, реакция нейтрализации; окисление-восстановление (оксидиметрия); комплексообразование; осаждение.
Расчеты в титриметрии основаны на законе эквивалентов. Вещества реагируют между собой в эквивалентных количествах. Поэтому наиболее удобный способ выражения концентрации — нормальная концентрация. Объемы [V(A) и V(B)] и нормальные концентрации реагирующих веществ [СN(А) и CN(В)] в точке эквивалентности выражается соотношением
СN(А) и V(A) известны, а V(B) был определен после титрования раствором (А). Тогда:
Масса вещества m(B), содержащего в объеме V(B), находится по формуле:
Методы разделения и концентрирования
Процесс разделения состоит в выделении компонентов, составляющих исходную смесь. Процесс концентрирования состоит в увеличении концентрации микрокомпонентов в пробе анализируемого вещества. Концентрирование является частным случаем разделения. Эти методы чрезвычайно многочисленны и разнообразны. Методы разделения гомогенных и гетерогенных систем отличаются друг от друга по своей сущности.
Система — совокупность находящихся во взаимодействии веществ, обособленных мысленно или фактически.
Компонент — составная часть системы.
Фаза — однородная часть системы, отделенная от других частей поверхностью раздела. Гомогенная система состоит из одной фазы (например, истинный раствор). Гетерогенная система состоит из двух и более фаз (например, вода + лед, раствор + осадок).
Разделение гетерогенных систем происходит следующими методами:
Для разделения гомогенных систем используют следующие методы:
Аналитическая химия OLD
12.1. Основные понятия титриметрии
Титрование – это процесс определения вещества, при котором к нему постепенно прибавляют небольшие порции реагирующего с ним другого вещества до того момента, пока всё определяемое вещество не вступит в реакцию.
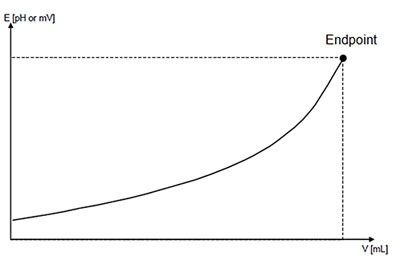
Момент титрования, при котором изменение свойства системы указывает на достижение эквивалент ности, называется конечной точкой титрования (точкой конца титрования ).
12.2. Классификация титриметрических методов анализа и способов титрования
В зависимости от способа выполнения различают:
Если хотя бы одно из перечисленных требований к реакции не выполняется, приходится использовать другие способы титровани я. Так, например, прямое титрование иона NH4 + раствором щёлочи невозможно из-за малой константы равновесия реакции, титрование K2Cr2O7 раствором Na2S2O3 – из-за нестехиометрического протекания реакции и т.д.
Рис. 12.1. Метод отдельных навесок (1) и метод пипетирования (2)
12.3. Стандартные растворы и стандартные вещества
В качестве первичных стандартных веществ используют соединения, обладающие следующими свойствами:
Растворы титрантов можно готовить также из фиксаналов и методом ионного обмена. Фиксаналом (нормадозой, стандарт-титром) называются приготовленные и расфасованные в промышленных условиях порции вещества, содержащие точно известное его количество. Содержимое фиксанала растворяют в указанном объёме растворителя (обычно объём раствора составляет 1 л) и получают раствор с точной концентрацией растворённого вещества.
12.4. Расчёты, связанные с приготовлением растворов титрантов и титрованием
Расчёты, связанные с приготовлением растворов
Количественный состав раствора можно описывать с помощью безразмерных величин и величин, имеющих размерность. Безразмерные величины иначе называются долями.
Из всех видов долей чаще всего, по крайней мере, в аналитической химии, используется массовая доля.
Доли могут выражаться в процентах. Процент – это не единица измерения, а всего лишь синоним величины «одна сотая».
К размерным величинам, используемым для описания количественного состава растворов, относят концентрации вещества в растворе и моляльность растворённого вещества.
Концентрация – это отношение массы или количества растворённого вещества к объёму раствора.
Массовая доля – это, согласно современному подходу, не концентрация и называть её «процентной концентрацией » не следует. Слово « концентрация » переводится на русский язык как «сосредоточение» и относится к растворённому веществу, а не к раствору, т.е. говорят « концентрация растворённого вещества в растворе», а не « концентрация раствора».
Моляльность растворённого вещества представляет собой отношение количества этого вещества, находящегося в растворе, к массе растворителя. Обозначают моляльность как m(В), b(В), Сm(В). Размерность моляльности – моль/кг. Её используют в тех случаях, когда раствор находится в неизотермических условиях.
Для количественной характеристики стандартных растворов обычно используют молярную концентрацию (вещества или эквивалента вещества). Иногда для этой цели пользуются титром раствора.
Титр соответствия рассчитывается заранее для определённой концентрации вещества в стандартном растворе. Представим себе, что в лаборатории закончился 0,1000 М HCl и новый приготовленный раствор HCl оказался немного более концентрированным (или более разбавленным), чем исходный, например 0,1005 М. В таких случаях удобнее не пересчитывать величину титра соответствия, а ввести поправочный коэффициент (k), например, в данном случае он равен 1,005.
Пример 12.1. Какой объём раствора HCl с массовой долей растворённого вещества 16,5% и плотностью 1,08 г/мл необходимо взять для получения 500 мл 0,1 М HCl?
Если объём получаемого раствора брать в мл, а массовую долю вещества в исходном растворе в %, то формула для расчёта будет иметь следующий вид:
Расчёты, связанные с титрованием
В основе всех количественных расчётов в титриметрических методах анализа лежит закономерность: количество эквивалента определяемого вещества равно количеству эквивалента титранта
Согласно ИЮПАК эквивалентом называется реальная или условная частица, которая в конкретной кислотно-основной реакции эквивалент на тем или иным образом одному протону или в конкретной окислительно-восстановительной реакции одному электрону.
Понятие « эквивалент » можно применять только к конкретной реакции. Нельзя говорить об эквивалент е вещества вообще.
Аналогично понятиям «количество вещества» и «молярная масса» существуют понятия «количество эквивалента вещества» и «молярная масса эквивалента вещества». Например, в реакции 2 1 моль молекул серной кислоты соответствует 2 моль «половинок молекул» серной кислоты, а M(1/2 H2SO4) = 49 г/моль.
Понятие « эквивалент » отнюдь не является «священной коровой» в химии, а используется всего лишь для облегчения расчётов, так как позволяет проводить их без использования стехиометрических коэффициентов в уравнении соответствующей реакции. Для веществ, у которых формульная единица и эквивалент равны между собой (например, HCl или NaOH при кислотно-основном взаимодействии), лучше вообще не пользоваться понятием эквивалент а.
Пусть нам необходимо найти массовую долю вещества ω(В),% имеющего молярную массу M(В), г/моль, в некотором анализ ируемом объекте, имеющем массу g, г. Для титрования используют раствор с молярной концентрацией эквивалента титранта C(fэквBT). Для титрования израсходовано V’, мл этого раствора.
Пример 12.2. Навеску массой 1,9500 г образца глазной мази, содержащей HgO, поместили в делительную воронку и растворили мазевую основу в 10 мл диэтилового эфира. К образовавшейся смеси прибавили раствор KI, а затем 10,00 мл 0,1045 М HCl. Для титрования избытка кислоты потребовалось 7,00 мл 0,0998 М NaOH. Рассчитайте массовую долю HgO в анализ ируемом образце.
Часто задаваемые вопросы о титровании и определение титрования — молярное уравнение, кривая титрования, расчеты и т. д.
База знаний по титрованию
Посмотрите видеоролик: Что такое титрование?
Титрование — это аналитический метод, предназначенный для количественного определения отдельного вещества (анализируемого компонента), растворенного в образце. Метод основан на наблюдении полного прохождения химической реакции между анализируемым компонентом и добавляемым к раствору реагентом (титрующим веществом) известной концентрации.
анализируемое вещество + реагент (титрант) → продукты реакции
Найдите все ответы на вопросы о титровании!
Титрование — это аналитический метод, предназначенный для количественного определения отдельного вещества (анализируемого компонента), растворенного в образце. Метод основан на наблюдении полного прохождения химической реакции между анализируемым компонентом и добавляемым к раствору реагентом (титрующим веществом) известной концентрации.
анализируемое вещество + реагент (титрант) = продукты реакции
Хорошо известным примером является титрование уксусной кислоты (CH3COOH) в уксусе гидроксидом натрия NaOH:
Титрант добавляется до тех пор, пока реакция не будет полностью завершена. Реакция пригодна для аналитических целей, если момент ее завершения можно легко наблюдать. Это значит, что полноту протекания реакции нужно контролировать подходящим методом, например, потенциометрическим (измерение потенциала специальным датчиком), или с помощью веществ-цветовых индикаторов. Концентрация анализируемого вещества рассчитывается по израсходованному количеству титранта на основе стехиометрии химической реакции. Реакция, используемая для титрования, должна быть быстрой, однозначной, полной и четко наблюдаемой.
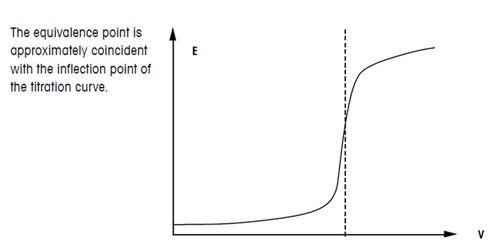
Кривые титрования отображают количественный ход титрования. Они позволяют быстро оценивать метод титрования. Делается различие между логарифмическими и линейными кривыми титрования.
Кривая титрования имеет в своей основе две переменные:
объем титранта как независимая переменная; и отклик раствора, то есть значение pH для кислотно-основного титрования, как зависимая переменная, зависящая от состава двух растворов.
Кривые титрования могут принимать четыре разные формы и должны анализироваться с помощью соответствующих алгоритмов оценки. Этими четырьмя формами являются: симметричная кривая, асимметричная кривая, кривая с минимумами/максимумами и сегментированная кривая.