что такое т клетки иммунной системы своими словами
Что такое Т-клеточный иммунитет и почему у кого-то он имеется без прививки и болезни?
Т-клеточный иммунитет более основательный, остается после болезни (или вакцинации) надолго. К некоторым заболеваниям клеточный иммунитет может держаться всю жизнь. Что касается нового коронавируса SARS-CoV-2, то понимания, сколько будет держаться наш клеточный иммунитет, пока нет, но речь точно идет о периоде свыше 1 года. Есть мнение, что это могут быть годы (пока правда это мнение сложно обосновать). Так что нельзя говорить о «полной беззащитности» людей, у которых исчезли антитела после болезни. Потенциально они могут заболеть, но иммунная система будет точно знать, как бороться с болезнью. А значит, это будет бессимптомное или легкое течение заболевания.
И тут есть любопытная деталь. Любой мегаполис – это скопление всех видов инфекции, которая быстро распространяется в силу кучности нахождения людей. В предыдущие годы были другие разновидности коронавирусов, иммунитет к которым в той или иной степени способен защищать нас и от КОВИД-19.
Российский национальный исследовательский медицинский университета им. Пирогова провел тестирование жителей Москвы на предмет наличия Т-клеточного иммунитета к коронавирусу. Исследование показало, что около 50% жителей столицы обладают данным иммунитетом к SARS-CoV-2. Оказалось, что новый коронавирус узнают Т-клетки памяти, выработанные на прежние виды коронавирусов. Скорее всего, именно этим объясняется тот факт, что значительное число москвичей до сих пор не заболело COVID-19.
Кстати, анонсированная на днях новая вакцина «Мир-19», создаваемая сейчас в ФМБА РФ, как раз будет создавать Т-клеточный иммунитет, а не антитела.
Наивные Т-клетки — ключ к долголетию
Наивные Т-клетки — ключ к долголетию
Автор
Редактор
Статья на конкурс «био/мол/текст»: Наивные Т-лимфоциты могут поведать о том, что вы хотели бы скрыть. Впервые было осуществлено секвенирование профиля Т-клеточных рецепторов периферической крови человека. Успехи в развитии технологий секвенирования нового поколения дают возможность проследить за динамикой колебаний численности и разнообразия наивных Т-клеток по мере старения организма. Вместе с этими знаниями появляется ответ на вопрос, почему женщины живут дольше мужчин, и приходит мысль о том, что увеличить продолжительность жизни можно, используя собственные Т-клетки. «Иммунологические часы» несложно обмануть, пойдя на хитрость.
Обратите внимание!
Эта работа опубликована в номинации «лучшая статья по иммунологии» конкурса «био/мол/текст»-2015.
Спонсором номинации «Лучшая статья о механизмах старения и долголетия» является фонд «Наука за продление жизни». Спонсором приза зрительских симпатий выступила фирма Helicon.
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
Всегда ли можно дать сорокалетнему мужчине его сорок? А пятидесятилетнему? А скольким тридцатилетним женщинам вы бы не дали двадцати? Определять возраст человека по внешней составляющей не самая лёгкая задача. Однако, людям, перешагнувшим определённый порог, различный для мужчин и женщин, когда репродуктивная функция начинает стремительно угасать, становится сложнее скрывать свой возраст.
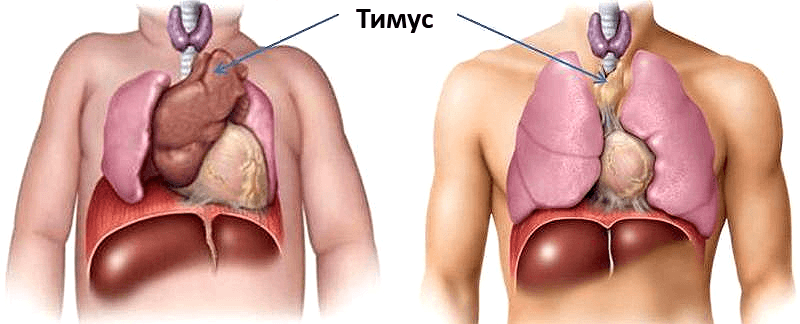
Для внутренних процессов человеческого организма характерны совершенно иные темпы изменений. «Возрастной порог» нашей иммунной системы расположен гораздо ближе к детству, чем к старости. Уже с первого года жизни в тимусе ребёнка начинают происходить драматические изменения: функциональная ткань органа заменяется на соединительную, уменьшаясь каждый год на 3% до 35–45 лет, а после 45 — на 1% (рис. 1). В 70 лет соединительная ткань занимает 90% тимуса [1]. Наиболее активно тимус функционирует в пренатальный период и до наступления половой зрелости. За это время происходит наработка максимальных возможностей Т-клеточного иммунитета, что будет во многом определять эффективность иммунного ответа человека на протяжении всей его жизни.
Рисунок 1. Сравнение размеров тимуса у новорождённого (а) и взрослого (б). К 50 годам тимус уменьшается в 5-7 раз по сравнению с первоначальным размером. Рисунок с сайта my.bpcc.edu.
Тимус — военная база иммунной системы
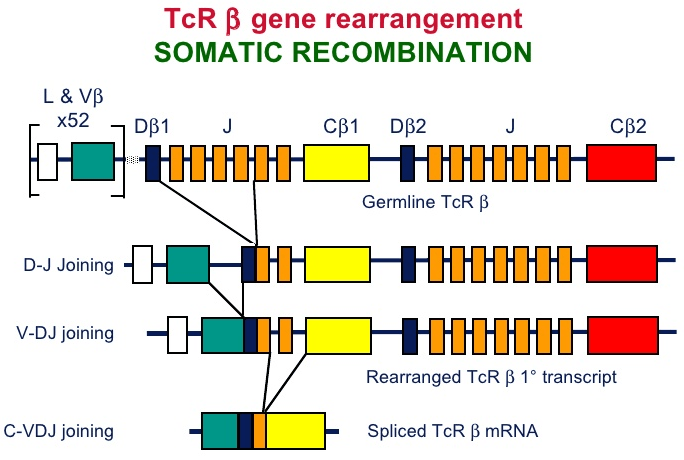
В тимусе иммунная система обучает своих «солдат». Предшественники Т-лимфоцитов размножаются в костном мозге и с кровью попадают в тимус. В нём происходит ключевое событие в жизни Т-клеток, определяющее их специфичность к антигену, с которым они никогда ещё не встречались — соматическая рекомбинация (также V(D)J-рекомбинация, рис. 2). Она заключается в перетасовке участков генов, кодирующих гипервариабельные участки α и β цепей Т-клеточного рецептора (TCR). С помощью TCR Т-клетки распознают «свой» антиген, к которому они специфичны, в составе главного комплекса гистосовместимости (MHC) антиген-презентирующих клеток (рис. 3). Благодаря этому процессу создаётся гигантское разнообразие TCR — около 6 × 10 5 возможных вариантов на каждые 10 6 Т-клеток [2]. В силу такой огромной вариабельности Т-клеточных рецепторов существует высокая вероятность того, что при проникновении в организм какого-либо чужеродного агента найдётся Т-клетка, TCR которой окажется специфичным именно ему. Соматическая рекомбинация происходит в кортикальной части тимуса, из неё клетки мигрируют в медуллярную часть и претерпевают негативный отбор: в экземплярах, реагирующих на собственные антигены, экспрессируемые организмом, запускается апоптоз.
Рисунок 2. Соматическая рекомбинация на примере β цепи TCR. Исходная последовательность в гене, кодирующем β цепь TCR содержит V (variable), D (diversity), J (Joining) и C (constant) сегменты. Сначала один из двух D-сегментов соединятеся с одним из 13 J-сегментов. Получившийся DJ-сегмент присоединяется к одному из 50 V-сегментов. Сегменты выбираются случайным образом, и механизм их сшивки также предполагает случайное варьирование количества пар оснований, это обеспечивает разнообразие TCR. Аналогичный процесс происходит c последовательностью, кодирующей α-цепь только без D-сегмента. Рисунок с сайта Slideshare.
Рисунок 3. Взаимодействие TCR и антиген-презентирующей клетки. а — Т-клетка (фиолетовая) взаимодействует с антиген-презентирующей клеткой (APC, синяя). б — APC презентирует антиген в составе MHC. Гетеродимер TCR состоит из α и β цепей, охватывающих MHC с антигеном. С антигеном главным образом взаимодействуют области CDR3 — это домены, отвечающие за специфичность TCR к данному антигену. Рисунок с сайта Genomemedicine.
После наступления пубертатного периода производство тимусом наивных Т-клеток резко снижается и на протяжении всей взрослой жизни человека активность этого органа остаётся на самом базальном уровне. Чем это грозит? Созданное за такой короткий период огромное разнообразие TCR действительно обеспечивает эффективный иммунный ответ на большинство потенциальных угроз. Но это разнообразие остаётся константным только некоторое время.
Мы теряем наших бойцов!
По результатам последних исследований [2], доля наивных Т-клеток как в CD4 + (Т-хелперы) так и в CD8 + (Т-киллеры) субпопуляциях периферической крови человека линейно уменьшается с возрастом. В детстве она составляет 50–80% от всего Т-клеточного пула и уменьшается на 0,75% каждый год, к 70 годам она составляет одну четверть первоначального изобилия. Авторы исследования [2] создали новый подход к использованию технологии секвенирования нового поколения компании Illumina для получения наиболее точных индивидуальных профилей репертуара TCR у людей различных возрастных групп. Было показано, что разнообразие TCR в периферической крови человека коррелирует с процентным содержанием в ней наивных Т-клеток и почти линейно уменьшается с возрастом — примерно на 5 × 10 3 вариантов TCR в год. Наивные Т-клетки сосуществуют в крови с Т-клетками памяти, клоны которых образуются в результате пролиферации наивных Т-клеток, повстречавших «свой» антиген. Размножившиеся клоны с каждым годом занимают всё большую долю доступного для пролиферации пространства в крови, это отражается на численности наивных Т-клеток, так как общее количество Т-клеток в крови человека относительно стабильно.
* — Но не стоит забывать, что кроме популяций в периферической крови, у человека есть гораздо более мощная локальная армия Т-лимфоцитов «на местах»: «Т-лимфоциты: путешественники и домоседы» [4]. — Ред.
Общее разнообразие TCR определяется количеством редких клонов в пуле Т-клеток, поэтому отсутствие возрастных изменений в разнообразии наиболее многочисленных Т-клеточных клонов указывает на то, что клоны наивных Т-клеток теряются с возрастом. Это связано с тем, что клоны наивных Т-клеток обычно малочисленны, поэтому вероятность того, что ни одна клетка данного клона не сможет поделиться или погибнет в результате каких-то случайных событий гораздо выше, чем для клонов с большим числом клеток.
Старики с высоким разнообразием TCR
Другое объяснение явления увеличения разнообразия TCR после 70 лет заключается в том, что люди этой возрастной группы уже перешагнули определённый возрастной порог, пройдя в некотором смысле проверку на прочность — уникальный набор физиологических параметров, включая особенности иммунной системы, сделал их наиболее приспособленными среди всех особей популяции в данных условиях. Из этого можно заключить, что повышенное содержание наивных Т-клеток в субпопуляции CD4 + периферической крови человека коррелирует с долгожительством. Увеличение доли наивных Т-клеток в пуле CD4+, а значит и увеличение разнообразия TCR обеспечивает лучшую иммунорегуляторную функцию, что снижает общее воспаление, усиливающееся по мере старения организма из-за активации аутоиммунных процессов, увеличивает эффективность распознавания раковых клеток и обеспечивает более сбалансированный иммунный ответ [2].
Долгая, но бездетная жизнь
Рисунок 4. Придворные евнухи в Китае. Некоторые евнухи жили более ста лет. Рисунок с сайта Lacasamundo.
Исследование о придворных евнухах династии Чозунь в Корее 2012 года [6] показало, что продолжительность жизни евнухов составляла на 15–20 лет больше, чем продолжительность жизни мужчин с нормальной репродуктивной функцией, живущих в тех же условиях (рис. 4). Возможно, их продолжительность жизни увеличивалась именно благодаря отсутствию инволюции тимуса под влиянием половых гомонов, а следовательно благодаря большему разнообразию TCR наивных Т-клеток. В пользу этой гипотезы можно привести данные о том, что у женщин производство тимусом наивных Т-клеток происходит более эффективно, чем у мужчин, и уменьшение их содержания в периферической крови у женщин выражено в меньшей степени, чем у мужской части населения [7]. Возможно, лучшая работа иммунной системы у женщин связана с тем, что во время беременности иммунитет женщины необходимо «обуздать», сделав его толерантным к фактически чужеродному телу — плоду, что требует участия сложных регуляторных путей. Высокая точность регуляции иммунного ответа очень важна, так как ошибка приведёт к потере потомства. К этим рассуждениям можно прибавить и тот факт, что у женщин с наступлением менопаузы яичники перестают вырабатывать эстрогены, а у мужчин выработка половых гормонов не прекращается. Это объясняет большую продолжительность жизни у женщин, чем у мужчин, характерную для любых национальностей. В Европе и США женщины живут дольше мужчин на 4,5–5 лет, в России — на 13 [6].
Мальчик, которому сделают орхеэктомию (удаление яичек), может быть, и получит дополнительные 10–15 лет жизни, вместе с тем лишившись возможности иметь детей и получив набор других не совсем приятных последствий. Существуют менее радикальные решения, основанные на приёме определённых препаратов, способствующих восстановлению функции тимуса. Одно из таких веществ — грелин, этот гормон вырабатывается слизистой оболочкой желудка и вызывает чувство голода, действуя на центры гипоталамуса. Оказалось, что грелин участвует в Т-клеточном сигналлинге, способен снижать связанное с возрастными изменениями воспаление, способствует восстановлению структуры тимуса и стимуляции его функций. Ряд цитокинов и факторов роста (интерлейкины 7 и 22, фактор роста кератиноцитов) являются потенциальными кандидатами для решения проблемы восстановления функции тимуса у взрослых людей. Интерлейкины обеспечивают дифференцировку и выживание тимоцитов. Фактор роста кератиноцитов необходим для пролиферации и дифференцировки функциональных тканей тимуса, его использование вызывает пролиферацию тимоцитов и увеличивает размеры органа. Возможно также использование веществ, блокирующих выработку стероидных гормонов, таких как аналоги гонадотропин-релизинг гормона, например, люпрона. Люпрон действует на гипофиз, блокируя рецепторы к гонадотропин-релизинг гормону, из-за чего уменьшается выработка лютеинизирующего и фолликуло-стимулирующего гормонов, что ведёт к снижению продукции эстрогена и тестостерона. И всё же, все вышеперечисленные вещества имеют неоднозначное воздействие на организм, и пока ещё нет данных о долгосрочных последствиях их приёма, поэтому их назначают только в случае восстановления после химиотерапии или при ВИЧ-инфекции, когда стимуляция работы тимуса необходима для реконституции иммунной системы [1].
Хранение наивных Т-клеток — полезная инвестиция в будущее
Есть ли иной способ продлить мужскую жизнь? Авторов статьи [2] посетила смелая идея решения этой проблемы. Кроме того, что редко встречающиеся клоны наивных Т-клеток в результате случайных событий теряются с возрастом, они, как и все клетки организма, могут поделиться лишь ограниченное количество раз (примерно 50 — лимит Хейфлика), что обусловлено укорочением теломерных участков хромосом после каждой репликации ядерной ДНК, а делятся наивные Т-клетки раз в 1–2 года. Значит примерно к 70 годам основная часть Т-клеток выйдет из строя. Решение есть — можно запасать наивные Т-клетки! У молодых людей в возрасте до 15–20 лет, когда процессы формирования основного пула наивных Т-клеток уже заканчиваются, нужно брать образцы крови в таком объёме, чтобы количества наивных Т-клеток в них хватило для полного восстановления их пула уже в пожилом возрасте, и заморозить. Очень важно, чтобы забор произошёл именно в этот промежуток времени. Если брать кровь у более взрослых людей, количества циркулирующих наивных Т-клеток просто не хватит для полной реставрации их пула в будущем. Конечно же, такой подход будет эффективен и для женского пола. Эти образцы крови будут не только средством продления жизни, но ещё и подстраховкой в случае аутоиммунных заболеваний или рака, они помогут восстановить иммунную систему после химиотерапии. Создание подобных банков с замороженными образцами крови стало бы ключевым событием в становлении абсолютно новых подходов к лечению заболеваний иммунной системы. Например, СПИД можно было бы вылечить введением в здоровые размороженные Т-клетки заразившегося СПИДом мутации по гену мембранного рецептора CCR5 (CD195), люди с такой мутацией обладают природной резистентностью к ВИЧ [8], и их пересадкой больному, предварительно прошедшему курс химиотерапии.
Итоги
Как бы молодо не выглядел человек, параметры его иммунной системы будут объективно отражать возраст. Такие параметры как количество наивных Т-клеток и разнообразие TCR практически линейно снижаются по мере старения. Если вы являетесь счастливым обладателем повышенного разнообразия TCR, можете надеяться на несколько бонусных лет жизни. В будущем человечество ожидают новые дерзкие подходы к увеличению продолжительности жизни с использованием собственных наивных Т-лимфоцитов, собранных и замороженных много лет назад.
Т-лимфоциты: путешественники и домоседы
Автор
Редактор
Статья на конкурс «био/мол/текст»: Клетки иммунной системы путешествуют по лимфе и кровотоку в поисках антигена, который можно распознать и начать защитную иммунную реакцию. Но значительная часть Т-лимфоцитов находится не в крови и не в лимфоузлах, а в органах, не относящихся к иммунной системе. Эта статья рассказывает, чем заняты резидентные Т-клетки тканей, как они туда попадают и какие преимущества для медицины может дать их изучение.
Обратите внимание!
Эта работа заняла первое место в номинации «Лучшая статья по иммунологии» конкурса «био/мол/текст»-2015.
Спонсором номинации «Лучшая статья о механизмах старения и долголетия» является фонд «Наука за продление жизни». Спонсором приза зрительских симпатий выступила фирма Helicon.
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
Адекватная защитная реакция при заражении патогенным вирусом — уничтожить зараженные клетки, не допустив распространения инфекции по организму и гибели большего числа клеток. Зараженная вирусом клетка может заметить в себе вирус и начать аутофагию либо апоптоз — или получить инструкцию для программируемой клеточной гибели от Т-киллера.
Цитотоксический Т-лимфоцит, или Т-киллер — вершина эволюции адаптивного иммунитета, ведь для распознавания фрагмента вируса (антигена) на зараженной клетке он использует Т-клеточный рецептор, случайно и независимо собирающийся на каждой Т-клетке в тимусе. Не имеющий аналогов вне адаптивной иммунной системы позвоночных механизм сборки Т-клеточного рецептора использует преимущества, полученные позвоночными при дупликациях генома в процессе эволюции и протекает с участием особых белков-рекомбиназ, когда-то заимствованных у ДНК-транспозонов (см. подробнее в статье Чудакова «Анализ индивидуальных репертуаров Т-клеточных рецепторов»).
Классическая иммунология человека построена на изучении иммунных клеток крови просто в силу того, что анализ крови можно взять у любого пациента, исследовать в норме и в патологии. Именно на клетках крови была выстроена классификация Т-лимфоцитов: деление на Т-киллеры и Т-хелперы, которые проверяют антигенную специфичность Т-киллеров, выдают им «лицензию на убийство» и способны управлять всем ходом иммунного ответа через сигнальные растворимые молекулы — цитокины. А также более позднее выделение из ветви Т-хелперов группы регуляторных Т-клеток, подавляющих избыточный адаптивный иммунитет.
Но как нам напоминает реклама йогурта, значительная часть клеток иммунной системы сосредоточена вокруг слизистой оболочки пищеварительного тракта и в других тканях. В то время как в 5–6 литрах крови взрослого человека находится около 6–15 миллиардов лимфоцитов, то число Т-клеток, находящихся в эпидермисе и коже, оценивают в 20 млрд [1], в печени взрослого мужчины — еще 4 млрд [2]. Достаточно ли изучения клеток крови для полного описания функций Т-клеток, если в периферических органах Т-клеток больше, чем в кровотоке? И достаточно ли классических субпопуляций, чтобы описать все типы Т-клеток, находящихся в организме человека?
Жизненный цикл Т-лимфоцита
Каждая Т-клетка после сборки Т-клеточного рецептора проходит тестирование на функциональность случайно собранного рецептора (положительная селекция) и отсутствие специфичности к собственным антигенам организма (отрицательная селекция), то есть на отсутствие очевидной аутоиммунной угрозы. Этапы селекции происходят в вилочковой железе, тимусе; при этом более 90% клеток-предшественников погибает, не сумев правильно собрать рецептор либо пройти селективный отбор. Выжившие Т-клетки пролиферируют и выходят из тимуса в кровоток — это наивные Т-лимфоциты, не встречавшиеся с антигеном. Наивная Т-клетка циркулирует по крови и периодически заходит в лимфоузлы, где в Т-клеточной зоне контактирует со специализированными антигенпрезентирующими клетками.
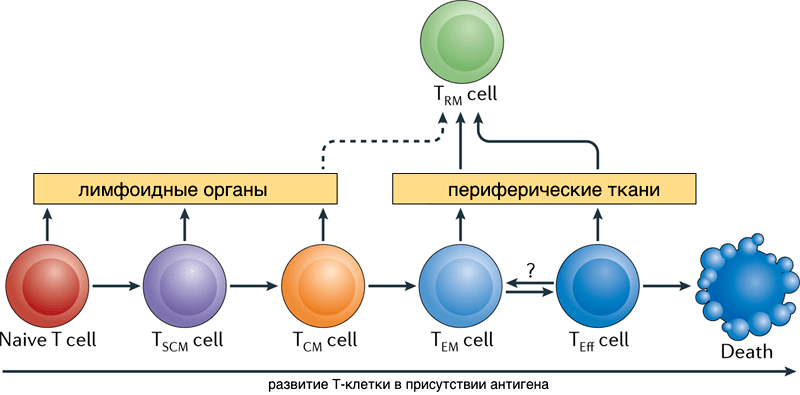
После встречи с антигеном в лимфоузле Т-клетка приобретает способность снова делиться — становится предшественницей Т-клеток памяти (TSCM, stem cell memory T cells). Cреди клона её потомков появляются клетки центральной памяти (TCM), короткоживущие эффекторные клетки, осуществляющие иммунную реакцию (SLEC или TEMRA-клетки), и эффекторные клетки-предшественники памяти TEM, в свою очередь при делении дающие TEMRA [3]. Все эти клетки выходят из лимфоузла и перемещаются по крови. Эффекторные клетки затем могут выйти из кровотока для осуществления иммунной реакции в периферической ткани органа, где находится патоген. Что потом — снова путешествие по крови и лимфоузлам?
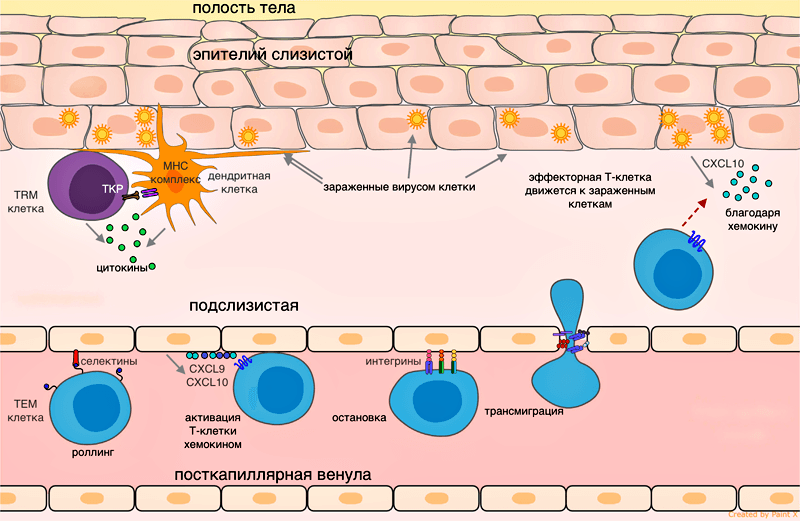
Рисунок 1. Эмиграция эффекторной Т-клетки в ткань при вирусной инфекции. Сигналы воспаления от зараженных эпителиальных клеток при участии резидентных клеток передаются эндотелию сосудов, клетки эндотелия привлекают эффекторные Т-клетки хемокинами CXCL9, CXCL10. Роллинг: при движении по посткапиллярной венуле в ткани эффекторная клетка замедляется, образуя временные контакты между Е-селектинами и P-селектинами на клетках эндотелия. Остановка: эффекторная клетка плотно прикрепляется к эндотелию при взаимодействии LFA-1 и других альфа-интегринов с ICAM-1/VCAM-1/MAdCAM-1 (на эндотелии). Трансмиграция: эффекторная Т-клетка связывает эндотелиальный JAM-1 молекулами PECAM, CD99, LFA-1 и проникает через клетки эндотелия в подслизистую. Рисунок из [3].
Процесс трансмиграции лейкоцита.
Клетки стромы, то есть основы лимфоузла, выделяют сигнальные вещества для того, чтобы позвать Т-клетку в лимфоузел — хемокины. Распознают хемокины лимфоузлов рецепторы хоуминга CCR7 и CD62L. Но на эффекторных клетках отсутствуют оба этих рецептора. Из-за этого долгое время было загадкой, как эффекторные клетки могут попасть из периферической ткани обратно во вторичные лимфоидные органы — селезенку и лимфоузлы.
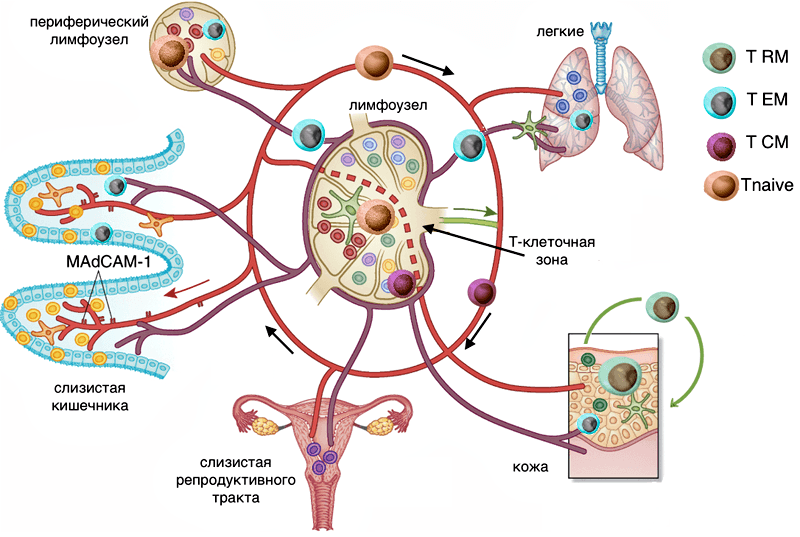
В то же время стали накапливаться данные о различиях в репертуарах мембранных маркеров и профилях транскрипции между Т-клетками памяти в крови (TEM) и Т-клетками памяти в других органах, которые никак не укладывались в концепцию постоянной миграции Т-клеток между тканями и кровью. Решено было выделить новую субпопуляцию: резидентные клетки памяти, которые населяют определенный орган и не рециркулируют — TRM-клетки [4].
Рисунок 2. Схема перехода потомков активированных Т-лимфоцитов между популяциями. Рисунок из [14].
Происхождение резидентных Т-клеток тканей
Откуда впервые появляются резидентные клетки ткани? Это потомки эффекторных клеток, которые потеряли способность рециркулировать. Некоторые периферические для иммунной системы ткани, например, слизистая тонкого кишечника, брюшная полость, — позволяют эффекторным Т-лимфоцитам проникать внутрь свободно; другие — очень ограниченно, большой поток эффекторных Т-клеток в эти ткани наблюдается только при реакции воспаления. К тканям второго типа относятся отделенные барьером от иммунной системы, к примеру, головной и спинной мозг, а также многие другие: периферические ганглии, слизистые половых органов, легкие, эпидермис, глаза. Разница между двумя типами тканей — в экспрессии дополнительных молекул хоуминга для эффекторных Т-клеток, например, молекулы адгезии для проникновения в эпителий MadCAM-1 [3].
Рисунок 3. «To home or not to home?» — сложный выбор эффекторной клетки. To home — процесс хоминга, или миграции Т-клеток, например, в наиболее привычное для наивных клеток место — лимфоузел. Альтернатива — не отправляться в путешествие по организму и превратиться в резидентную клетку ткани.
Резидентные Т-клетки в старении тканей человека
Карта соотношений присутствия отдельных субпопуляций Т-клеток в разных органах человека, как ни странно, была составлена только в 2014 году. Команда Донны Фарбер из медицинского центра Колумбийского Университета Нью-Йорка провела сравнение фенотипов Т-клеток, выделенных из крови и тканей доноров органов всех возрастных групп от 3 до 73 лет, всего по 56 донорам [5]. Анализ субпопуляций Т-клеток при помощи проточной цитофлуориметрии подтвердил многие данные, полученные методами с меньшим разрешением и меньшей статистикой, и некоторые черты описания иммунной системы, перенесенные с иммунологии мыши на человека, к примеру, снижение содержания наивных Т-лимфоцитов при старении во всех органах.
Уменьшение числа наивных Т-клеток с возрастом связано с быстрым старением тимуса (вилочковой железы), в котором будущие Т-клетки проходят этапы сборки Т-клеточного рецептора, проверку работоспособности рецептора и селекцию на отсутствие аутоиммунного потенциала. Важно не только снижение абсолютной численности наивных Т-клеток, но и уменьшение разнообразия репертуара Т-клеточных рецепторов, а значит, и возможности сформировать адаптивный иммунный ответ на ранее незнакомую инфекцию [6]. Для наивных Т-киллеров подтвердилось прогрессирующее падение численности в крови и лимфоузлах, хотя для наивных Т-хелперов отрицательная корреляция численности с возрастом в данном исследовании оказалась значительной только во вторичных лимфоидных органах, но не в крови.
Выделение Т-лимфоцитов памяти, эффекторных клеток памяти и короткоживущих эффекторных клеток из слизистых легких, тонкого и толстого кишечника, паховых и мезентериальных лимфоузлов доноров органов позволило впервые оценить динамику данных популяций в тканях человека при старении. Доля центральных клеток памяти ожидаемо растет с течением жизни, в соответствии с ростом числа инфекций, которые успели встретиться организму и попасть в библиотеку памяти иммунной системы. Растет и процент терминально дифференцированных эффекторных Т-киллеров (TEMRA), но только в лимфоузлах и в селезенке; в нелимфоидных тканях численность TEMRA падает. Эффекторные клетки памяти TEM стремительно заполняют нишу для Т-клеток в тканях ребенка, быстро, примерно к 12 годам вытесняя наивные Т-клетки. Короткоживущие терминально дифференцированные Т-киллеры чаще всего встречаются в крови, селезенке и слизистых легких в любом возрасте, а вот среди Т-хелперов эта субпопуляция представлена исчезающе малым числом клеток. Аналогично мало центральных клеток памяти среди Т-киллеров, преимущественно они находятся в слизистых двух барьерных тканей: легких и кишечника.
Широкими мазками карту распределения Т-лимфоцитов человека можно обрисовать так: наивные Т-клетки путешествуют по крови и периодически заходят во вторичные лимфоидные органы, киллеры-TEMRA находятся в крови, селезенке и легких. Для центральных клеток памяти, судя по всему, характерно более индивидуальное распределение по тканям, чем для других субпопуляций: во всяком случае, закономерностей динамики при старении разных тканей выявить не удалось. Эффекторные клетки памяти, включающие в себя и TRM субпопуляцию, доминируют среди Т-клеток слизистых барьерных тканей. В целом, при старении Т-клеточного иммунитета нелимфоидные ткани большую возрастную динамику типов Т-клеток [5]. Стабильность тканевых клеток проще объяснить, если разобраться, какие из эффекторных клеток TEM остаются в ткани, становятся резидентными TRM, и из каких событий состоит их жизнь после отказа от путешествий по организму.
Рисунок 4. Пути циркуляции Т-лимфоцитов различных субпопуляций. Tnaive — наивные Т-клетки, вместе с субпопуляцией TCM перемещаются по крови и заходят в Т-клеточную зону различных лимфоузлов, в капиллярах тканей встречаются, но в ткань не выходят (красная траектория). Эффекторные Т-клетки (голубой цвет) перемещаются по лимфе и кровотоку, при попадании в лимфоузел не заходят в Т-клеточные зоны (центр лимфоузла) — траектория лилового цвета. Резидентные Т-клетки тканей (показаны зеленым в коже и различными цветами в слизистых) перемещаются только внутри ткани — траектория зеленого цвета. Рисунок из [9], с изменениями.
Как отличить резидентные клетки тканей от примесей клеток крови?
Резидентные Т-клетки корректно, но неудобно каждый раз определять по способности индивидуальной клетки мигрировать в лимфоузлы, поэтому необходимо составить список характерных признаков, по которым можно определить принадлежность к этой субпопуляции. Резидентные Т-лимфоциты в тканях-естественных барьерах организма (например, в легких и слизистой тонкого кишечника) немного похожи на классические эффекторные клетки крови: экспрессируют маркер активированных клеток CD69, причем экспрессия стабильна в течении жизни при взрослении и старении и характерна для всех нелимфоидных тканей. Но вдобавок CD69 колокализуется с маркером CD103, который обозначает группу молекул адгезии — интегринов, способствующих прикреплению резидентной Т-клетки к эпителию и к фибробластам в подслизистой выбранного органа. Для эффекторных Т-клеток во вторичных лимфоидных органах экспрессия CD103-интегринов совершенно нехарактерна: TEM клетки постоянно сохраняют подвижный фенотип.
У карты, составленной коллективом Донны Фарбер, есть крупный недочет: неясно, насколько чисто удается выделить Т-лимфоциты из органа, какую долю анализируемых клеток на самом деле составляют Т-лимфоциты крови из капилляров внутри органа.
Особенно остро вопрос загрязнения клетками крови стоит для легких, не случайно субпопуляционный состав Т-клеток легких неожиданно похож на Т-клетки крови и лимфоузлов. Вопрос загрязнения клетками крови был изящно решен для Т-лимфоцитов мыши: подопытных мышей заражали вирусом лимфоцитарного хориоменингита после пересадки трансгенного клона Т-клеток P14, специфичного к данному вирусу. В результате при инфекции большая часть циркулирующих клеток была представлена вирус-специфичным клоном P14, и его присутствие в тканях можно было отследить иммунофлуоресценцией по P14-специфичному антителу. Перед тем, как мышей убивали, им в кровь вводили антитело к маркеру Т-киллерных клеток анти-CD8, оно быстро распространялось по кровотоку и связывалось со всеми Т-киллерами в крови (но не в тканях). При микроскопии срезов органов легко было отличить резидентные киллерные TRM от только недавно вышедших из крови в орган клеток, помеченных анти-CD8 антителом [7]. Численность резидентных клеток, подсчитанная этим методом, превышала в 70 раз определенные методом проточной цитометрии числа; разница меньше, чем в два раза, наблюдалась только для резидентных клеток лимфоузлов и селезенки: получается, стандартные методики выделения лимфоцитов из органов плохо подходят для анализа киллерных резидентных клеток и существенно занижают размеры популяции.
Работа резидентных Т-клеток: не стоит путать туризм с эмиграцией
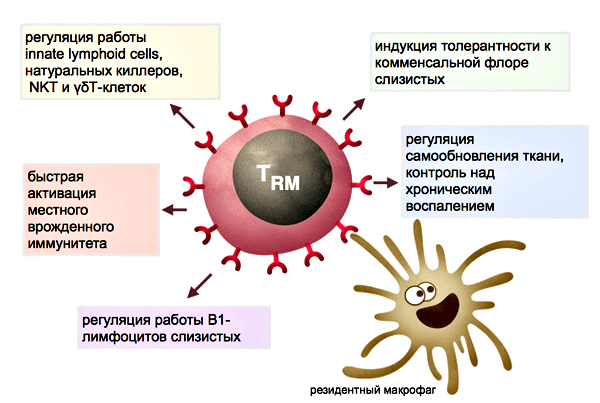
Мышиные резидентные клетки тканей в нормальной ситуации почти не перемещаются внутри нелимфоидной ткани и достаточно прочно прикреплены молекулами адгезии к строме органа. Когда резидентные макрофаги той же ткани секрецией цитокинов инициируют реакцию воспаления, ТRM приобретают большую подвижность и патрулируют близлежащий эпителий в поисках зараженных клеток.
Однако размер популяции Т-клеток зависит не только от специфичности Т-клеточных рецепторов к инфекциям, которые раньше протекали в данном органе, но и от гомеостатической пролиферации Т-клеток — размножения более удачливых клеток для заполнения емкости органа по числу Т-лимфоцитов. По маркерам CD28 и CD127 на поверхности клеток можно отличить недавно и давно активированные через Т-клеточный рецептор клетки от тех, которые получили только гомеостатический сигнал к пролиферации от фактора роста IL-7. При старении ткани гомеостатическое размножение клеток начинает преобладать над пролиферацией активированных через ТКР клеток.
Независимо от Т-клеточных рецепторов часто функционируют NKT-клетки, крупный тип резидентных клеток печени, встречающиеся и в других тканях. Они могут быть активированы NK-клеточными рецепторами через распознавание не индивидуальных антигенов, а общих молекулярных паттернов опасности и тканевого стресса. При активации CD8 + NKT-клетки выделяют цитотоксические гранулы и лизируют подозрительные клетки ткани, к примеру, единичные опухолевые клетки и зараженные вирусами клетки, экспрессирующие и выставляющие на внешней мембране MHC-подобные стрессорные молекулы. При старении тенденция TRM к активации без Т-клеточного рецептора через NK-клеточные рецепторы или цитокиновые сигналы может приводить к ошибочному лизису клеток ткани, недостаточному контролю над хронически зараженными или перерождающимися участками эпителия.
Патологические проявления, связанные с работой резидентных Т-клеток включают в себя органоспецифичные аутоиммунные синдромы и синдромы хронического воспаления в ткани. Примеры хронического воспаления, поддерживаемого резидентными Т-лимфоцитами — контактный дерматит и псориаз, а механизмом служит выделение воспалительных факторов IL-17 резидентными Т-киллерами и IL-22 резидентными Т-хелперами дермы. CD8+ эффекторные Т-киллеры, находящиеся в головном мозге, похожи по совокупности мембранных молекул-маркеров на TRM кожи, кишечника и легких и способны подталкивать развитие перемежающегося рассеянного склероза при периодических выбросах воспалительных цитокинов; неясно, однако, есть ли в норме в головном мозге TRM популяция или же это Т-лимфоциты, оставшиеся в ткани после нейротропной вирусной инфекции [9].
Функции резидентных клеток памяти в норме, при отсутствии инфекции или хронического воспаления, могут включать в себя cross-talk (взаимную регуляцию преимущественно через секрецию цитокинов и костимуляторные молекулы) с неклассическими малоизученными лимфоидными клетками, такими как ассоциированные со слизистыми гамма/дельта Т-клетки, несущие альтернативный вариант сборки Т-клеточного рецептора; или лимфоидные клетки врожденного иммунитета (innate lymphoid cells, ILC), которые делят с Т-и В-лимфоцитами общие черты эпигенетического ландштафта, но не имеют Т-/В- или NK-клеточных рецепторов [10, 11].
TRM клетки контактируют с антигенпрезентирующими клетками тканей — это дендритные клетки кожи и резидентные макрофаги тканей. Резидентные миелоидные клетки в разных тканях дифференцированы и слабо похожи друг на друга. К примеру, макрофаги маргинальной зоны селезенки, макрофаги печени и микроглия (макрофаги мозга) будут сильно отличаться и по морфологии, и по спектру функций. Кроме обнаружения антигенов в ткани, резидентные макрофаги заняты регуляцией процессов старения и самообновления тканей, в частности, выделяют факторы роста и цитокины, стимулирующие деление стволовых клеток тканей. В жировой ткани, к примеру, макрофаги стимулируют дифференцировку новых жировых клеток, но при переходе в активированное M1-состояние, запускают воспаление и вместо дифференцировки заставляют увеличиваться и набухать имеющиеся жировые клетки. Сопутствующие изменения метаболизма жировой ткани приводят к накоплению жировой массы и в последние годы связываются с механизмами развития ожирения и диабета II типа. В коже цитокины, выделяемые макрофагами и резидентными гамма/дельта Т-клетками стимулируют деление стволовых клеток при регенерации эпидермиса и стволовых клеток волосяных фолликулов [12, 13]. Можно предположить, что хелперные TRM клетки при патрулировании эпителия и образовании контактов с тканевыми макрофагами могут модулировать спектр и объем выделяемых последними факторов роста для стволовых клеток, воспалительных цитокинов и факторов ремоделирования эпителия, и тем самым участвовать в обновлении тканей.
Рисунок 5. Предполагаемые функции резидентных Т-лимфоцитов тканей. Часть функций может выполняться во взаимодействии с резидентными макрофагами (см. пояснения в тексте).
Что изучение Trm может дать медицине?
Понимание принципов работы резидентных Т-клеток абсолютно необходимо для борьбы с инфекциями, которые не поступают сразу в кровь, а проникают в организм через барьерные ткани — то есть, для подавляющего большинства инфекций. Рациональный дизайн вакцин для защиты от этой группы инфекций может быть направлен именно на усиление первого этапа защиты с помощью резидентных клеток: ситуация, при которой оптимально активированные специфичные к антигену клетки элиминируют патоген в барьерной ткани куда выгоднее, чем запуск острого воспаления для вызова Т-лимфоцитов из крови, поскольку меньше повреждается ткань.
Репертуар Т-клеточных рецепторов клеток, ассоциированных со слизистыми барьерных тканей, считается частично вырожденным и публичным, то есть идентичным для многих людей в популяции. Тем не менее, искажения при выделении Т-клеток из органов, перекос данных в результате отбора только определенных европеиодных доноров в когорты и общее небольшое количество накопленных данных секвенирования не дают уверенности в публичности репертуаров Т-клеточных рецепторов TRM-клеток. Хотя это было бы удобно, дизайн вакцин мог бы сводиться к поиску и модификации наиболее аффинных и иммуногенных пептидов из патогена, взаимодействующих с одним из публичных вариантов ТКР в барьерной для этого патогена ткани.
Конечно, представления о том, какие Т-клеточные рецепторы несут на своей поверхности TRM-клетки недостаточно для того, чтобы эффективно манипулировать иммунными реакциями в ткани. Предстоит детально изучить факторы, влияющие на заселение тканей определенными клонами Т-клеток и разобраться в механизмах активации местного тканевого иммунитета и индукции толерантности TRM. Как заселяются ниши Т-лимфоцитов в слизистых у ребенка до встречи с большим числом патогенов и, соответственно, до формирования значительного пула эффекторных Т-клеток памяти — предшественников резидентных клеток и клеток центральной памяти? Почему и как вместо классической активации лимфоцитов формируется игнорирование, реакция толерантности к микробам непатогенной флоры слизистых? Эти вопросы стоят на повестке дня в изучении резидентных клеток иммунной системы.
Определение закономерностей хоуминга Т-лимфоцитов в определенные ткани может дать преимущество в клеточной иммунотерапии опухолевых заболеваний. Теоретически, киллерные Т-клетки нужной специфичности к опухолевому антигену, активированные in vitro, должны убивать опухолевые клетки пациента. На практике подобная иммунотерапия осложняется тем, что опухолевые клетки способны подавлять иммунные реакции и приводить в неактивное состояние анергии приближающиеся к опухоли Т-киллеры. Зачастую в массе растущей опухоли и вокруг неё накапливаются анергичные Т-лимфоциты, в первую очередь, TRM данной ткани. Из множества инъецированных пациенту активных опухолеспецифичных Т-клеток до цели дойдут немногие, и даже они могут оказаться практически бесполезными в иммуносупрессивном микроокружении опухоли.
Расшифровка механизмов, которые обеспечивают попадание конкретных клонов Т-клеток в определенные ткани, может позволить более эффективно направлять к опухоли сконструированные в лаборатории Т-лимфоциты и приблизить эру доступной персонализированной иммунотерапии.