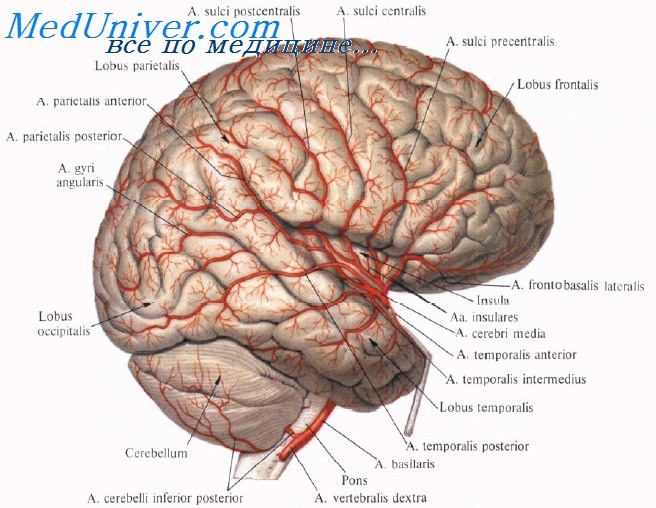
что такое субстрат в медицине
Субстрат (биохимия)
Субстра́т в биохимии — исходный продукт, преобразуемый ферментом в результате специфического фермент-субстратного взаимодействия в один или несколько конечных продуктов. После окончания катализа, и высвобождения продукта реакции, активный центр фермента снова становится вакантным и может связывать другие молекулы субстрата.
Литература
Полезное
Смотреть что такое «Субстрат (биохимия)» в других словарях:
Субстрат — Субстрат: Субстрат (лингвистика) влияние языка коренного населения на чужой язык (завоевателей и т. д.), обычно при переходе населения с первого на второй. Субстрат (биохимия) исходный продукт, преобразуемый ферментом в… … Википедия
Антагонист (биохимия) — У этого термина существуют и другие значения, см. Антагонист. Антагонист блокирует связывание молекулы агониста с рецептором, ингибируя сигнал от взаимодействия рецептор агонист … Википедия
Медицина — I Медицина Медицина система научных знаний и практической деятельности, целями которой являются укрепление и сохранение здоровья, продление жизни людей, предупреждение и лечение болезней человека. Для выполнения этих задач М. изучает строение и… … Медицинская энциклопедия
Супрамолекулярная химия — Пример супрамолекулярного ансамбля, представленного Жан Мари Леном … Википедия
ФЕРМЕНТЫ — органические вещества белковой природы, которые синтезируются в клетках и во много раз ускоряют протекающие в них реакции, не подвергаясь при этом химическим превращениям. Вещества, оказывающие подобное действие, существуют и в неживой природе и… … Энциклопедия Кольера
Печень — крупная железа животного организма, участвующая в процессах пищеварения, обмена веществ, кровообращения и осуществляющая специфические защитные и обезвреживающие, ферментативные и выделительные функции, направленные на поддержание… … Большая советская энциклопедия
Патология — I Патология (греч. pathos страдание, болезнь + logos учение) наука о закономерностях возникновения, течения и исхода болезней, основанная на фактическом материале различных медико биологических дисциплин. Каждая из этих дисциплин фиксирует ту или … Медицинская энциклопедия
ТРИКАРБОНОВЫХ КИСЛОТ ЦИКЛ — (цикл Кребса), цик лич. последовательность ферментативных р ций (схема 1; назв. неионизир. форм к т см. в ст. Обмен веществ), в к рых осуществляются превращения ди и трикарбоновых к т, образующихся как промежут. продукты в организме животных, в… … Химическая энциклопедия
Ферменты — Модель фермента нуклеозидфосфорилазы Ферменты, или энзимы (от лат. f … Википедия
Белки — У этого термина существуют и другие значения, см. Белки (значения). Белки (протеины, полипептиды[1]) высокомолекулярные органические вещества, состоящие из соединённых в цепочку пептидной связью альфа аминокислот. В живых организмах… … Википедия
СУБСТРАТ
Смотреть что такое «СУБСТРАТ» в других словарях:
СУБСТРАТ — (от позднелат. substratum основа, букв. подстилка) общая основа многообразных явлений; основа общности или сходства однородных явлений; совокупность относительно простых, в определенном смысле элементарных оснований, взаимодействие которых… … Философская энциклопедия
СУБСТРАТ — СУБСТРАТ, в биохимии реагент, на который действует ЭНЗИМ или другой КАТАЛИЗАТОР. В биологии питательная среда, служащая для выращивания микроорганизмов, или поверхность, на которой обитает «сидячий» организм (например, моллюск блюдечко). В… … Научно-технический энциклопедический словарь
Субстрат — язык местного населения, вытесненный языком пришельцев, но оказавший влияние на него. По английски: Substrat См. также: Языки Билингвизм Финансовый словарь Финам … Финансовый словарь
субстрат — порода, основа, материя, среда Словарь русских синонимов. субстрат сущ., кол во синонимов: 4 • материя (50) • основ … Словарь синонимов
СУБСТРАТ — (на средневековой латыни substratum подстилка, основа), 1) в биологии основа (предмет или вещество), к которой прикреплены растительные или животные организмы, а также среды обитания и развития организмов, например питательная среда для… … Современная энциклопедия
СУБСТРАТ — (от средневекового лат. substratum подстилка Основа), в биологии,1) химическое вещество, подвергающееся превращению под действием фермента. Концентрация субстрата в клетке оказывает регулирующее влияние на активность фермента.2) Основа (предмет… … Большой Энциклопедический словарь
СУБСТРАТ — в философии общая основа всех процессов и явлений … Большой Энциклопедический словарь
СУБСТРАТ — язык населения, первоначально обитавшего на данной территории; следы влияния этого языка в языке пришельцев (ср. Адстрат, Суперстрат) … Большой Энциклопедический словарь
СУБСТРАТ — СУБСТРАТ, субстрата, муж. (лат. substratum основа, подкладка). 1. То, что лежит в основе чего нибудь, каких нибудь явлений, состояний (филос., научн.). 2. Питательная среда, в которой развиваются микроорганизмы (биол.). Толковый словарь Ушакова.… … Толковый словарь Ушакова
СУБСТРАТ — СУБСТРАТ, а, муж. (спец.). 1. То, что лежит в основе каких н. явлений, состояний. Языковый с. (в системе языка: усвоенные ею элементы языка населения, первонач. жившего на данной территории). 2. Питательная среда для прикреплённых к ней… … Толковый словарь Ожегова
Что такое субстрат в медицине
Основной задачей нейроанестезиолога является поддержание баланса между метаболическими потребностями головного мозга и соответствующими поступлениями, чтобы свести к минимуму риск появления неврологических нарушений. Понимание основ церебрального метаболизма позволяет анестезиологу принимать верные решения при назначении лекарственных препаратов, выборе техники анестезии во время оперативного вмешательства и во время интенсивной терапии.
Физиология метаболизма спинного и головного мозга во многом совпадает. Мозг — орган высокой физиологической активности. На его долю приходится:
• 20% сердечного выброса,
• 25% всего потребления глюкозы,
• 20% общего потребления кислорода. Энергозатраты мозга классически распределяются на:
• Основной обмен (45%)—взаимодействие клеток, синтез белка, ионные градиенты.
• Активный обмен (55%) — генерация нервных импульсов.
Когда ЭЭГ показывает ровную линию, энергозатраты мозга сведены к основному обмену. Дальнейшее углубление седации не дает большего снижения энергозатрат.
Субстраты мозга
• Предпочтительный энергетический субстрат для клеток ЦНС—глюкоза, но возможно также использование кетоновых тел, лактата, аминокислот.
• Аэробный метаболизм осуществляется путем окислительного фосфорилирования.
• В покос путем окислительного фосфорилирования образуется 99% А’ГФ.
• Анаэробный метаболизм происходит путем гликолиза.
• Активация нейронов связана с усилением гликолиза.
• Кетоновые тела в норме обеспечивают менее 1% энергетических потребностей, но в случае продолжительного голодания их доля в энергетическом обеспечении может достигать 60%.
Зависимость метаболизма от кровотока
• В нормальных условиях церебральный метаболизм и кровоток тесно взаимосвязаны.
• При утрате взаимосвязи или сниженном кровотоке компенсаторно может повыситься экстракция кислорода из артериальной крови, что проявляется снижением концентрации кислорода в капиллярной крови.
• Если кровоток недостаточно высок для обеспечения метаболических потребностей, увеличивается доля анаэробного метаболизма.
• Длительная ишемия ведет к дефициту АТФ и нарушению трансмембранных ионных градиентов.
• Критическое снижение кровотока, приводит к необратимому повреждению тканей:
— при травматическом повреждении мозга 15 мл/100 г/мин
— при ишемическом инсульте 5-8,5 мл/100 г/мин.
Энергетические взаимодействия нейрон/глия
• Глиальные клетки—вспомогательные клетки нервной системы, выполняющие опорную и метаболическую функцию.
• Астроциты (тип глиальных клеток)—активные метаболические «партнеры» нервной ткани. Между ними и нейронами идет постоянный обмен субстратами и метаболитами, что ведет к взаимосвязи метаболизма нейронов и глиальных клеток.
• Астроциты осуществляют анаэробный этап метаболизма глюкозы путем гликолиза.
• Лактат поступает из астроцитов в связанные с ними нейроны, где продолжается аэробный этап метаболизма.
• Нейрональная активность приводит к высвобождению калия и глутамата, которые затем поглощаются астроглией.
• Энергия, необходимая для поглощения калия и глутамата, выделяется путем усиленного гликолиза.
Факторы, влияющие на церебральный метаболизм
На церебральный метаболизм могут оказывать влияние физиологические изменения, лекарственные средства, заболевания. Некоторые из этих факторов могут быть искусственно преобразованы для компенсации изменившихся физиологических потребностей.
• Нейрональная активация — процесс, не затрагивающий уровень церебрального метаболизма в целом, а вызывающий регионарные изменения мозгового кровотока и потребления кислорода мозгом:
— бодрствование
— движение
— чувственное восприятие
— боль
— судороги.
• Изменения температуры:
— изменение температуры на 1 °С вызывает изменение потребления кислорода мозгом на 5-10%.
— при низких температурах изменения могут быть более значительными.
— изоэлектрическая ЭЭГ наблюдается при охлаждении головного мозга до 20 С.
• Патологические состояния:
— потребность мозга в кислороде при деменции снижена.
— при травме головного мозга возникают различные изменения метаболизма мозга.
— при субарахноидальном кровоизлиянии метаболическая потребность мозга в кислороде снижается, но может повыситься при возникновении судорог.
• Эндотоксины не оказывают непосредственного воздействия на потребление мозгом кислорода.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Роль микробиоты кишечника в поддержании здоровья
Микрофлора представляет собой метаболически активную и сложную экосистему, состоящую из сотен тысяч микроорганизмов — бактерий, вирусов и некоторых эукариот. Подобно невидимому чулку, биоплёнка покрывает все слизистые нашего организма и кожу. Микробиота объединяет более чем 10 14 (сто биллионов) клеток микроорганизмов, что в 10 раз превышает число клеток самого организма. Микробиота находится в содружественных отношениях с организмом человека: организм хозяина предоставляет среду обитания и питательные вещества, микроорганизмы защищают организм от патогенных возбудителей, способствуют поддержанию нормальных иммунологических, метаболических и моторных функций. Выделяют несколько важных биотопов, которые отличаются плотностью распределения микроорганизмов и составом: кожные покровы, слизистые оболочки ЖКТ, дыхательных путей, урогенитального тракта и проч. Самой многочисленной считается микробиота кишечника, на её долю приходится 60% микроорганизмов, колонизирующих организм человека.
Микрофлора кишечника состоит из группы микроорганизмов, представленных более чем 1000 видами, 99% из которых приходится на 30–40 главных видов. В научных кругах кишечную микрофлору называют также дополнительным органом.
Состояние микробиоты кишечника определяет качество и продолжительность жизни. У каждого человека есть свой индивидуальный характер распределения и состава микробиоты. Частично он определяется генотипом хозяина и первоначальной колонизацией, которая происходит сразу после рождения. Различные факторы, такие как тип родов, кормление грудью, образ жизни, диетарные предпочтения, гигиенические условия и условия окружающей среды, использование антибиотиков и вакцинация, могут определять окончательные изменения в структуре микробиоты.
При изменении состава или функции микробиоты развивается дисбиоз. Дисбиотические состояния изменяют моторику кишечника и его проницаемость, а также искажают иммунный ответ, тем самым создавая предпосылки для развития провоспалительного состояния. Такие изменения, особенно в отношении иммунных и метаболических функций хозяина, могут вызывать или способствовать возникновению ряда заболеваний, например, сахарного диабета, ожирения, неврологических и аутоиммунных заболеваний. Недавние исследования показали, что микробиота участвует в этиопатогенезе многих гастроэнтерологических заболеваний, таких как синдром раздраженного кишечника, воспалительные заболевания кишечника, целиакия, неалкогольный стеатогепатит и новообразования желудочно-кишечного тракта.
Кишечная микрофлора и иммунитет
Кишечная микробиота имеет решающее значение для развития лимфоидных тканей, а также для поддержания и регуляции кишечного иммунитета.
В кишечнике происходит сенсибилизация иммуноцитов, которые затем заселяют другие слизистые оболочки и циркулируют между различными органами. Этот механизм обеспечивает формирование клонов лимфоцитов и образование специфических антител в участках слизистой оболочки, отдалённых от очага первичной сенсибилизации.
Иммунокомпетентные ткани пищеварительного тракта объединены в лимфоидную ткань. Лимфоидная ткань представлена лимфоцитами, расположенными между эпителиальными клетками кишечника, лимфоцитами собственного слоя, пейеровыми бляшками (скопления лимфоидной ткани в тонкой кишке) и лимфоидными фолликулами.
Попавшие в просвет кишечника или на слизистые оболочки антигены распознаются иммуноглобулинами памяти (IgG), после чего информация передаётся в иммунокомпетентные клетки слизистой оболочки, где из сенсибилизированных лимфоцитов клонируются плазматические клетки, ответственные за синтез IgА и IgМ. В результате защитной деятельности этих иммуноглобулинов включаются механизмы иммунореактивности или иммунотолерантности. Благодаря индукции иммунологической толерантности в кишечнике не возникают нежелательные воспалительные реакции против кишечной микробиоты и пищевых белков.
Кишечная микробиота и обмен веществ
Кишечная микробиота вносит непосредственный вклад в метаболизм питательных веществ и витаминов, необходимых для жизнедеятельности организма хозяина, при этом извлекая энергию из пищи. Эта энергия образуется путём реакции сбраживания не усваиваемых углеводов (клетчатки), в результате реакции образуются короткоцепочечные жирные кислоты, водород и углекислый газ.
Короткоцепочные жирные кислоты обеспечивают работу колоноцитов.
Короткоцепочные жирные кислоты считаются тонкими регуляторами иммунитета, энергетического обмена и метаболизма жировой ткани. Например, короткоцепочные жирные кислоты участвуют во взаимодействии бактерий и иммунитета, подавляя сигналы, которые могут привести к развитию аутоиммунных реакций. Пропионовая и масляная жирная кислота положительно влияют на метаболизм глюкозы. Наконец, короткоцепочные жирные кислоты обеспечивают подкисление просвета толстой кишки, предотвращая рост бактериальных патогенов.
Кишечная микробиота принимает непосредственное участие в метаболизме желчных кислот, источником которых является холестерин. В печени из холестерина синтезируются первичные желчные кислоты — холевая и хенодезоксихолевая, которые поступают в кишечник. Бактероиды и лактобациллы далее превращают первичные желчные кислоты во вторичные желчные кислоты — дезоксихолевую и литохолевую. Изменение нормального баланса кишечных бактерий приводит к неадекватному синтезу желчных кислот.
Микробиота и нервная система
Ещё более удивительные данные о взаимосвязи кишечной микробиоты и нервной системы. Микробиота кишечника тесно общается с центральной нервной системой. Микробиота кишечника производит такие нейроактивные молекулы, как ацетилхолин и серотонин, дофамин, которые являются главными медиаторами сигналов в ЦНС, а также регулируют работу мозга через активацию иммунных сигнальных путей. Дополнительно, блуждающий нерв активно участвует в двунаправленных взаимодействиях между кишечной микробиотой и мозгом для поддержания гомеостаза как в головном мозге, так и в кишечнике.
Недавние исследования показали, что микробиом влияет на свойства и функцию микроглии. Микроглия защищает мозг от различных патологических состояний через активацию иммунного ответа, фагоцитоза и продукцию цитокинов. Кроме того, микроглия ответственна за формирование нейронных цепей, которые участвуют в развитии мозга. Различные дисбиотические состояния, в том числе вызванные приёмом антибиотиков приводят к угнетению созревания клеток микроглии. Незрелая микроглия приводит к нарушению иммунной активации.
Астроциты — самая многочисленная клеточная популяция в ЦНС, и они почти в пять раз превосходят численность нейронов. Подобно микроглии, астроциты выполняют несколько важных функций по поддержанию целостности ЦНС, включая контроль кровообращения в головном мозге, поддержание стабильности гематоэнцефалического барьера. Астроциты регулируют баланса ионов и оказывают влияние на передачу сигналов между нейронами. Чрезмерная активация астроцитов является пусковым механизмом в развитии дисфункции ЦНС и неврологических расстройств. Чрезмерная активация происходит под действием метаболитов микрофлоры.
Целостность гематоэнцефалического барьера регулируется также метаболитами микробиоты, которые опосредуют передачу большего количества микробных сигналов между осью кишечник-мозг.
Дисбиоз микробных видов в кишечнике может вызывать атипичные иммунные сигналы, дисбаланс в гомеостазе организме-хозяина и привести к прогрессированию заболеваний ЦНС. Например, рассматривается роль микробиоты в патогенезе рассеянного склероза-заболевания, характеризующимся демиелинизацией аксонов нервных клеток. При болезни Паркинсона, которая проявляется моторными симптомами, включая тремор, мышечную ригидность, медлительность движений и аномалию походки наблюдается накопление α-синуклеина в нейронах. Избыточное отложение α-синуклеина в нервной системе инициируется кишечной микрофлорой до того, как возникают симптомы поражения ЦНС, что связано с некоторыми специфическими пищеварительными симптомами (запоры и нарушение двигательной функции толстой кишки). Бактериальный состав кишечника влияет на болезнь Паркинсона: тяжесть симптомов, в том числе постуральная нестабильность и нарушение походки, связана с изменениями численности некоторых видов Enterobacteriaceae, уменьшение количества Lachnospiraceae приводит к более серьёзному ухудшению моторных и немоторных симптомов у пациентов с болезнью Паркинсона. Болезнь Альцгеймера — ещё одно нейродегенеративное заболевание, которое приводит к серьёзным нарушениям функции ЦНС — обучению, памяти и поведенческим реакциям. Болезнь Альцгеймера характеризуется отложением пептида амилоид-β (Aβ) снаружи и вокруг нейронов, вместе с накоплением белка тау внутри корковых нейронов. Перегрузка амилоидом и агрегация тау нарушают синаптическую передачу. Изменение состава и разнообразия микробиоты вносит определённый вклад в патогенез болезни Альцгеймера. Активированная микроглия способствует развитию заболевания, увеличивая отложение амилоида.
Ожирение и состав микробиоты
При ожирении и сахарном диабете наблюдаются изменения в составе микробиоты кишечника, в частности, снижение популяционного уровня сахаролитических бактероидов, влияющих на интенсивность метаболических процессов, а также увеличение доли бактерий класса Firmicutes (Esherichia coli, Clostridium coccoides, Clostridium leptum). Снижение содержания сахаролитических бактерий уменьшает выработку коротко-цепочных жирных кислот, обеспечивающих трофику и деление эпителия кишечника, его созревание, оказывающих антимикробное действие и регуляторное действие в отношении ионов и липидов.
Дополнительно при ожирении отмечается хроническое системное воспаление, сопровождающееся секрецией провоспалительных цитокинов (интерлейкины — ИЛ, С-реактивный белок, α-фактор некроза опухоли — α-ФНО и др.) в висцеральной жировой ткани. Нарушения в составе кишечной микрофлоры приводят к усилению эффекта системного воспаления за счёт увеличения концентрации бактериальных липополисахаридов, стимулирующих выработку провоспалительных компонентов.
Диагностика состояния кишечной микробиоты
Существует два метода определения микробиоты — стандартный анализ на дисбактериоз и оценка состава микробиоты методом масс-спектрометрии по крови (ГХ-МС). В основе методики масс-спектрометрии лежит определение присутствия микроорганизмов по их клеточным компонентам (высшие жирные кислоты, альдегиды, спирты и стерины). Методика разработана профессором Осиповым Г.А. Метод ГХ-МС позволяет одновременно измерять более сотни микробных маркёров непосредственно в образце, позволяющих сделать заключение о некультивируемых и труднокультивируемых патологических возбудителях. Метод универсален также в отношении грибов и вирусов.
Пребиотики и синобиотики: применение и состав + полезная таблица
В прошлой публикации мы собрали воедино научно-обоснованные факты о пробиотиках и дали таблицу с составом ЛС и БАД. В этой статье разбираемся с местом пре- и синбиотиков в современной медицине
Пребиотики – этот термин используется для обозначения как пребиотиков (содержащих вещества, способствующие росту микроорганизмов), так и метабиотиков (содержащих метаболиты, продукты жизнедеятельности микрорганизмов). Самые распространённые из пребиотических компонентов: олигофруктоза, инулин, галакто-олигосахариды, лактулоза, олигосахариды грудного молока, бутират, молочная кислота и др.
Механизмы действия пребиотиков связаны с взаимодействием между микробиотой и макроорганизмом и разделяются на:
К пребиотикам предъявляются достаточно строгие требования:
Галоктоолигосахариды, олигофруктоза, фруктоолигосахариды (глюкоза, фруктоза, декстроза, мальтоза, мальтотриоза, мальтодекстрин – представлены в составе синбиотиков), лактулоза ( Дюфалак, Нормазе, Портлак, Прелакс и т.д. )
Водный субстрат продуктов обмена веществ Escherichia coli DSM 4087, Enterococcus faecalis DSM 4086, Lactobacillus acidophilus DSM 4149 и Lactobacillus helveticus DSM 4183 ( Хилак Форте )
Кальция бутират + инулин ( Закофальк )
Метаболиты бесклеточной культуральной жидкости бактерий B.subtilis штамм 3 + цеолит + ферментированный гидролизат соевой муки ( Бактистатин )
Секреторные ферменты от 16 штаммов лактобактерий, полученные путем брожения в течение 1 года на сое+лимонная кислота+молочная кислота ( Дайго )
Область применения пребиотиков: коррекция и профилактика дисбиотических состояний. [3,4]. При печеночной энцефалопатии и при функциональном запоре в качестве монотерапии рекомендована лактулоза с высоким уровнем доказательности (A-B, об уровнях доказательности читайте здесь ) [1]. В международных рекомендациях для профилактики (или профилактика рецидива) антибиотик-ассоциированной диареи (в т.ч. вызванной Clostridium difficile ) рекомендованы в комплексной терапии – олигофруктоза 4 г, три раза в день со средним уровнем доказательности [2]. При синдроме раздраженного кишечника назначение пребиотиков влияет на качество жизни (за счёт нормализации стула, уменьшения числа обострений и интенсивности абдоминального болевого синдрома),– короткоцепочечные фруктоолигосахариды 5 г/ежедневно или галакто-олигосахариды 3.5 г/ежедневно – с уровнем доказательности B-C [1].
Отметим, что в РФ фрукто- и олигосахариды представлены в только в виде комбинированных препаратов, а в рекомендуемых количествах только в составе некоторых синбиотиков, н апример, в БАД Энтеролактис, Максилак, РиоФлора. Во многих средствпх количественный состав не уточнен.
Синбиотики
Lactobacillus acidophilus CBT LA1 + Lactobacillus rhamnosus CBT LR5 + Bifidobacterium longum CBT BG7 + Bifidobacterium lactis CBT BL3 + Bifidobacterium bifidum CBT BF3 +Streptococcus thermophilus CBT ST3 + фруктоолигосахариды ( Необиотик Лактобаланс )
Lactobacillus acidophilus CBT LA14 + Lactobacillus rhamnosus CBT LR32 + Bifidobacterium lactis CBT BL4 + инулин + витамины группы В-В1,В6,В12 ( Флориоза )
Lactobacillus rhamnosus + Bifidobacterium bifidum + Lactobacillus acidophilus + Lactobacillus plantarum + Lactobacillus bulgaricus +инулин+псилиум ( Фитомуцил Сорбент форте )
Lactobacillus Acidofilus LA-5 и Bifidobacterium ВВ-12 + фруктоолигосахариды + нутриоза + гидроксипропилметилцеллюлоза ( Флорок форте )
Bifidobacterium animalis subspecies lactis BS01 + инулин, мальтодекстрин ( Пробиолог транзит [H7] )
Bifidobacterium bifidum + Bifidobacterium longum + Bifidobacterium infantis + Lactobacillus rhamnosus+ микрокристаллическая целлюлоза + олигофруктоза ( Флоросан )
L.rhamnosus R049 + L.caseiR215 + L.plantarum R202 + L.acidophilus R053 + B.longum R023 + B.bifidum R071 + B.breve R070 + фруктоолигосахариды ( Флора-Дофилус )
Bifidobacterium bifidum W23 + Bifidobacterium lactis W51 + Lactobacillus acidophilus W37 + Lactobacillus acidophilus W55 + Lactobacillus paracasei W20 + Lactobacillus plantarum W62 + Lactobacillus rhamnosus W71 + Lactobacillus salivarius W24 + инулин + фруктоолигосахариды 1,2% ( РиоФлора )
Bifidobacterium longum + Bifidobacterium breve + Lactobacillus acidophilus + Lactobacillus rhamnosus + Lactobacillus plantarum + Lactobacillus casei + Lactococcus lactis + Streptococcus thermophilus + Фруктоолигосахариды 5 г + микрокристаллическая целлюлоза ( Максилак )
Lactobacillus acidophilus DDS®-1, B.bifidum UABB-10, B.longum UABL-14, B.lactis UABLA-12, рисовый мальтодекстрин, фруктоологосахариды ( ЛББ )
Синбиотики, отличаются от пробиотиков наличием пребиотических компонентов, а также более сбалансированным составом c большим количеством штаммов микроорганизмов в составе препаратов. Обычно комбинацию составляют несколько штаммов бифдо- и лактобактерий. Также синбиотики, зарегистрированные в последние несколько лет, уже имеют в составе пробиотические компоненты в рекомендуемых дозах – около 5 г фрукто-олигосахаридов.
В настоящий момент со средним и низким уровнем доказательности (B-C), ввиду недостаточного количества исследований, рекомендованы следующие комбинации:
Увеличение количества компонентов не сделало синбиотики универсальными препаратами. При разных состояниях показали свою эффективность разные комбинации микроорганизмов.
Подводим итог по всем биотикам
На данный момент все рекомендации по биотикам имеют слабую силу. Для некоторых нозоологий (неспецифический язвенный колит, болезнь Крона, диарея, псевдомембранозный колит) назначение пробиотиков, особенно комбинаций, не рекомендуется из-за недостаточной степени изученности [1,5]. Так же есть вероятность развития сепсиса, вызванного штаммами пробиотических микроорганизмов, у групп риска – наличие иммунного дефицита, ослабленные пациенты, в т.ч. с онкологическими заболеваниями, нарушением кишечного эпителиального барьера. [6]
В настоящий момент основное место применения для про-, пре или синбиотика это профилактика дисбиотических состояний и лечение дисбиоза при конкретной патологии в составе комплексной терапии. В клинической практике продолжают использоваться пробиотики всех поколений. Эффект от пребиотика проявится быстрее, но пробиотик будет работать дольше. Выбор препарата будет обусловлен не только клиническими рекомендациями, безопасностью препарата, но также конкретной клинической ситуацией: при наличии синдрома диареи – препаратом выбора может быть пробиотик 4го поколения или синбиотик, при наличии синдрома избыточного бактериального роста – санирующие пробиотики 2-го поколения, а при запоре – лучше показали себя некоторые пребиотики. Но то, как будет работать про- или пребиотик в каждой конкретной ситуации зависит не только от самого препарата, но и от индивидуальных особенностей микробиоты человека.
Применение пробиотических и пребиотических и синбиотических препаратов продолжает оставаться перспективным для дальнейших клинических исследований. Пробиотические препараты широко используются в медицинской реабилитации и комплексе профилактических мероприятий [2]. Дальнейшие исследования будут способствовать усилению требований к данным препаратам с точки зрения безопасности и доказанной эффективности. Несмотря на большое разнообразие различных штаммов микроорганизмов и их комбинаций, остается нерешенной проблемой индивидуального подбора препаратов. Это связано с тем, что кишечный микробиом у каждого человека индивидуален, а современные методы для оценки состава кишечной микробиоты не применяются широко.