что такое стационарный потенциал
Потенциал стационарный (естественный)
Потенциал стационарный (естественный)
Потенциал стационарный (естественный)
Полезное
Смотреть что такое «Потенциал стационарный (естественный)» в других словарях:
snip-id-5429: Руководство по проектированию и защите от коррозии подземных металлических сооружений связи — Терминология snip id 5429: Руководство по проектированию и защите от коррозии подземных металлических сооружений связи: Анодная зона участок подземного металлического сооружения, на котором это сооружение имеет положительный электрический… … Словарь-справочник терминов нормативно-технической документации
Руководство по проектированию и защите от коррозии подземных металлических сооружений связи — Терминология Руководство по проектированию и защите от коррозии подземных металлических сооружений связи: Анодная зона участок подземного металлического сооружения, на котором это сооружение имеет положительный электрический потенциал по… … Словарь-справочник терминов нормативно-технической документации
ГОСТ 17.2.1.04-77: Охрана природы. Атмосфера. Источники и метеорологические факторы загрязнения, промышленные выбросы. Термины и определения — Терминология ГОСТ 17.2.1.04 77: Охрана природы. Атмосфера. Источники и метеорологические факторы загрязнения, промышленные выбросы. Термины и определения оригинал документа: 5. Антропогенное загрязнение атмосферы Антропогенное загрязнение D.… … Словарь-справочник терминов нормативно-технической документации
Российская Советская Федеративная Социалистическая Республика — РСФСР. I. Общие сведения РСФСР образована 25 октября (7 ноября) 1917. Граничит на С. З. с Норвегией и Финляндией, на З. с Польшей, на Ю. В. с Китаем, МНР и КНДР, а также с союзными республиками, входящими в состав СССР: на З. с… … Большая советская энциклопедия
ЭЛЕКТРОФИЗИОЛОГИЯ — ЭЛЕКТРОФИЗИОЛОГИЯ, учение о происхождении и роли электрической энергии в организме. Исторически Э. теснейшим образом сплетена с развитием учения об электричестве в физике. Начало ей положил итальянский физик Гальвани знаменитым «балконным… … Большая медицинская энциклопедия
Патологическая анатомия твёрдых тканей зуба — Патологические процессы в твёрдых тканях зуба традиционно подразделяются на две группы кариес и некариозные поражения. Содержание 1 Кариес (caries) 1.1 Этимология термина «кариес» … Википедия
Пшеница — (Wheat) Пшеница это широко распространенная зерновая культура Понятие, классификация, ценность и питательные свойства сортов пшеницы Содержание >>>>>>>>>>>>>>> … Энциклопедия инвестора
Китай — Китайская Народная Республика, КНР (кит. Чжунхуа жэньминь гунхэго). I. Общие сведения К. крупнейшее по численности населения и одно из крупнейших по площади государств в мире; расположен в Центральной и Восточной Азии. На востоке … Большая советская энциклопедия
Томск — один из промышленных Западной Сибири. В городе развиты машиностроение и металлообработка (приборостроение, электротехника,… … Города мира
стационарный потенциал
3.53 стационарный потенциал: Потенциал стального трубопровода, измеренный при отсутствии блуждающих токов и воздействия других внешних источников тока.
Смотреть что такое «стационарный потенциал» в других словарях:
стационарный потенциал — nuostovusis potencialas statusas T sritis chemija apibrėžtis Kelių elektrodinių reakcijų elektros srovių kompensavimo potencialas, kurio vertė laikui bėgant nekinta. atitikmenys: angl. compromise potential; mixed potential; stationary potential;… … Chemijos terminų aiškinamasis žodynas
стационарный потенциал — nuostovusis potencialas statusas T sritis Standartizacija ir metrologija apibrėžtis Potencialas, kurio vertė laikui bėgant nekinta. atitikmenys: angl. stationary potential; steady potential; steady state potential vok. stationäres Potential, n… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
стационарный потенциал — nuostovusis potencialas statusas T sritis fizika atitikmenys: angl. stationary potential; steady potential; steady state potential vok. stationäres Potential, n rus. стационарный потенциал, m pranc. potentiel stationnaire, m … Fizikos terminų žodynas
потенциал свободной коррозии (стационарный потенциал) — 3.14 потенциал свободной коррозии (стационарный потенциал): Потенциал коррозии в отсутствие наложенного электрического тока. Источник … Словарь-справочник терминов нормативно-технической документации
стационарный — Режим, который достигается после завершения адаптации активного ила и отображается на зависимости Свых=f(t) выходом на плато Б (рисунок 1 а, в) Источник: ГОСТ Р 50595 93: Вещества поверхностно активные. Метод определения биоразлагаемости в водной … Словарь-справочник терминов нормативно-технической документации
ПОТЕНЦИАЛ ПОКОЯ — ПОТЕНЦИАЛ ПОКОЯ, электрический потенциал между внутренней и наружной средой клетки, возникающий на ее мембране; у нейронов и мышечных клеток достигает величины 0,05 0,09 В; возникает из за неравномерного распределения и накопления ионов по разные … Энциклопедический словарь
потенциал свободной коррозии — 3.18 потенциал свободной коррозии (стационарный потенциал): Потен циан коррозии в отсутствие наложенного электрического тока. Источник: СТО Газпром 9.0 001 2009: Защита от коррозии. Основные положения Смотри также родственные термины: 3.14… … Словарь-справочник терминов нормативно-технической документации
потенциал свободной коррозии (стационарный) — 3.1.20 потенциал свободной коррозии (стационарный): Потенциал сооружения в коррозионной среде при отсутствии внешнего наложенного тока. Источник: СТО Газпром 9.2 002 2009: Защита от коррозии. Проектирование электрохимической защиты подземных… … Словарь-справочник терминов нормативно-технической документации
Потенциал стационарный (естественный) — разность потенциалов между подземным металлическим сооружением связи и неполяризующимся электродом, установившаяся во времени в отсутствие блуждающих токов. Для каждого металла величина стационарного потенциала различна и зависит как от физико… … Словарь-справочник терминов нормативно-технической документации
компромиссный потенциал — nuostovusis potencialas statusas T sritis chemija apibrėžtis Kelių elektrodinių reakcijų elektros srovių kompensavimo potencialas, kurio vertė laikui bėgant nekinta. atitikmenys: angl. compromise potential; mixed potential; stationary potential;… … Chemijos terminų aiškinamasis žodynas
Большая Энциклопедия Нефти и Газа
Стационарный потенциал
Стационарный потенциал может быть близок к равновесному потенциалу металла или окислителя при большом различии в перенапряжении анодного и катодного процессов. [2]
Стационарный потенциал равен 1600 мВ относительно медно-сульфатного электрода. [3]
Стационарный потенциал в таких условиях может, как и равновесный, не зависеть от перемешивания. Если установление стационарного потенциала связано с реакцией восстановления кислорода, обусловленной медленностью его доставки к электроду, то при перемешивании раствора потенциал смещается в положительную сторону. [7]
Стационарный потенциал определяется взаимным расположением поляризационных кривых парциальных процессов. Так как скорости отдельных процессов зависят от состояния поверхности электрода, то Ес также является функцией состояния поверхности металла в отличие от равновесного потенциала. Равновесный потенциал водородного электрода не зависит от природы металла. [9]
Стационарный потенциал определяется взаимным расположением поляризационных кривых парциальных процессов. Так как скорости отдельных процессов зависят от состояния поверхности электродадо Фс также является функцией состояния поверхности металла в отличие от равновесного потенциала. Равновесный потенциал водородного электрода не зависит от природы металла. [11]
Стационарный потенциал определяется взаимным расположением поляризационных кривых парциальных процессов. Так как скорости отдельных процессов зависят от состояния поверхности электрода, то Ес также является функцией состояния поверхности металла в отличие от равновесного потенциала. Равновесный потенциал водородного электрода не зависит от природы металла. [13]
Стационарный потенциал для процесса Pd Pd2 2G равен 0 987 в. Палладий не тускнеет и не окисляется на воздухе. [14]
Стационарный потенциал для процесса Pd tPd2 2 Q равен 0 987 В. Палладий не тускнеет и не окисляется на воздухе. Палладий стоек в горячей НС1, но в присутствии кислорода значительно растворяется. Палладий растворяется при комнатной температуре в царской водке. В кислотах ( хлорной, соляной, бромистоводородной при 100 С), а также в растворах FeCl3, CuClz, NaCIO палладий неустойчив. Хлор, бром сухой и влажный при комнатной температуре растворяют палладий. В уксусной кислоте ( ледяной), в растворах НдС1г, CuSCu, A12 ( 80) 3 при 100 С палладий устойчив. В сероводороде ( влажном), иоде ( сухом) при комнатной температуре палладий также устойчив. [15]
Стационарный потенциал металла
Уравнение Нернста (3.3) позволяет вычислить величину потенциала металла, погруженного в раствор собственных ионов. В этом случае проходит обмен ионами между металлом и раствором (Me – ze 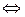
Если металл погружен в раствор собственных ионов, устанавливается обратимое (равновесное) значение потенциала, которое можно вычислить по уравнению Нернста. Такие условия характеризуются уравнением (3.6), когда прямой и обратный процессы обеспечиваются перемещением через границу металл-раствор только одного сорта ионов – ионов металла. В этом случае не наблюдается потерь металла (Δm = 0).
В реальных условиях, когда металл корродирует, процесс обмена ионами не осуществляется только одним сортом ионов. При этом анодный процесс обеспечивается в основном ионами металла, а катодный – ионами водорода (если катодный процесс – водородная деполяризация). Установившийся при этом не изменяющийся во времени потенциал называется необратимым или стационарным. При таком значении потенциала сохраняется равенство суммарного анодного и катодного токов:
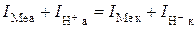
Но в этом случае IMe а > IMe к, и, следовательно, происходит убыль металла (Δm > 0).
Стационарные электродные потенциалы нельзя вычислить с помощью уравнения Нернста, их можно определить только опытным путем. На их величину влияют различные факторы: химическая природа металлов (≤ 4 В), состояние поверхности металла (десятые доли вольта), адсорбция атомов и молекул (сотые и десятые доли вольта), механические напряжения (сотые доли вольта), химическая природа и концентрация раствора (до вольта), изменение температуры (сотые вольта на 10 °С).
В табл. 3.2 приведены значения электродных потенциалов некоторых металлов, полученных в 3 %-ом растворе NaCl.
Значения стационарных потенциалов
Таким образом, реальный коррозионный процесс характеризуется величиной стационарного значения электродного потенциала, при котором одновременно протекают анодная и катодная реакции.
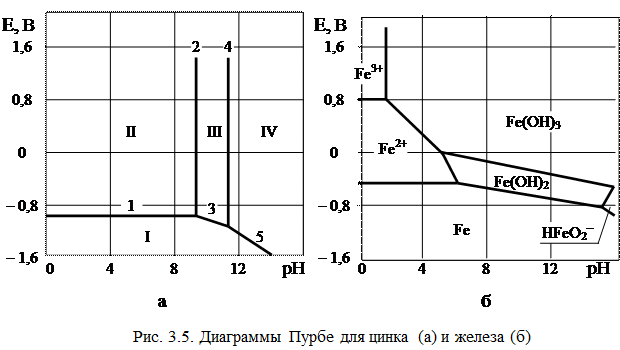
Диаграммы Пурбе
Бельгийский ученый Пурбе по термодинамическим данным построил диаграммы состояния металл-вода. Эти диаграммы позволяют оценить возможность протекания процесса коррозии для всех технически важных металлов. Диаграммы учитывают три возможных типа равновесия в системе металл-вода.
1) Равновесия, связанные с обменом электрическими зарядами:
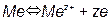
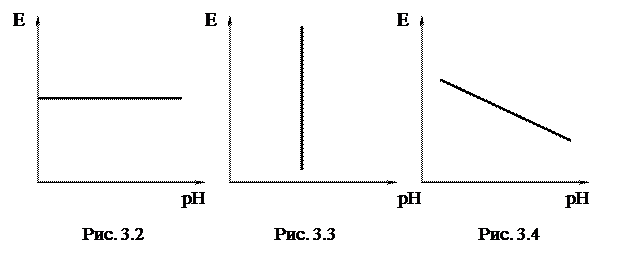
2) Равновесия, не связанные с обменом электрическими зарядами:
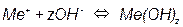
Эти равновесия определяются только величиной pH и не зависят от потенциала. Линии, характеризующие эти равновесия, параллельны оси потенциалов (рис. 3.3).
3) Равновесия, зависящие как от потенциала, так и от pH, например, на металл-оксидных электродах:
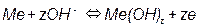
Потенциал такого электрода определяется уравнением:
т.е. линия равновесия имеет наклон (рис. 3.4).
На рис. 3.5, а приведена одна из наиболее простых диаграмм Пурбе – диаграмма для цинка. Она имеет четыре области: I – область термодинамической устойчивости; II, IV – области коррозии; III – область пассивности.
Линии диаграммы отвечают следующим равновесиям:
1 – 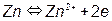
2 – 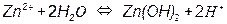
3 – 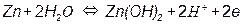
4 – 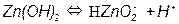
5 – 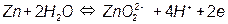
Таким образом, в области II устойчив ион цинка, а в области IV – ион цинката. Пассивность цинка в области III обусловлена образованием пленки малорастворимого гидроксида цинка Zn(OH)2.
На рис. 3.5, б представлена диаграмма для железа. Она имеет две области коррозии: в первой из них стабильны ионы двух- и трехвалентного железа, а во второй – феррат-ион.
Положения областей термодинамической стабильности, коррозии и пассивности существенно зависят от присутствия в растворе различных анионов, например, хлорид, сульфат- и т.п. анионов. Классические диаграммы Пурбе не дают данных о возможности протекания коррозии в присутствии «посторонних» ионов.
Пассивность металлов
Общие положения
Явление пассивации было открыто более 150 лет назад английским физиком М. Фарадеем, хотя первое описание этого явления встречается в трудах М.В. Ломоносова (1738 г).
Пассивность металла – это состояние относительно высокой коррозионной стойкости, вызванное торможением анодной реакции ионизации металла в определенной области потенциалов.

С точки зрения термодинамики смещение потенциала электрода в положительную сторону должно приводить к увеличению вероятности протекания электрохимической реакции растворения металла, но на практике этого не происходит.
При пассивации металла наблюдается существенное отклонение зависимости скорости анодного процесса от сдвига потенциала в электроположительную область: вместо увеличения происходит уменьшение скорости анодного процесса.
Пассивное состояние, как правило, наступает при контакте металлов с сильными окислителями, такими, как O2, H2O2, хромат-ионы (CrO4 2– ), бихромат-ионы (Cr2O7 2– ), перманганат-ионы (MnO4 2– ) и др. Уменьшение скорости коррозии обуславливается образованием на поверхности металла его гидроксида. Многие металлы в той или иной степени в зависимости от условий склонны пассивироваться, но наибольшей склонностью к пассивации обладают Fe, Cr, Ni, Ti, Al. Это их качество обусловлено тем, что образующиеся при их пассивации гидроксиды имеют малую растворимость в коррозионной среде.
Явление пассивности имеет большое практическое значение, т.к. позволяет существенно снизить коррозионные потери металлов.
Основным методом исследования пассивности является метод съемки потенциостатических анодных поляризационных кривых: потенциал анода – плотность тока (либо логарифм плотности тока). Схема типичной анодной потенциостатической поляризационной кривой приведена на рис. 3.6. На этой кривой имеются четыре характерных участка.
1 – область активного состояния металла, когда он ведет себя как растворимый анод, в этой области металл при потенциале, более положительном, чем стационарный Eст, переходит в ионное состояние, например, железо переходит в ионы железа:
2 – область формирования пассивного состояния, которое наступает после достижения потенциала пассивации Eп. и тока пассивации iп.. В этой области скорость растворения металла (анодной реакции) снижается при сдвиге потенциала в область более электроположительных потенциалов. Это явление вызвано образованием на поверхности металла различных пленок оксидов или гидроксидов металла согласно уравнениям реакций:
Me + zOН – – ze → Me(OH)z.
3 – область пассивности, наступающая при достижении потенциала полной пассивации Eп.п.. Область пассивности характерна тем, что в ее пределах скорость растворения металла остается постоянной и соответствует величине плотности тока полной пассивации iп.п.. Металл в пассивном состоянии не является абсолютно инертным. Величина тока полной пассивации, хотя и может быть ничтожно малой, но никогда не достигает нулевого значения. При смещении потенциала, находящегося в пассивном состоянии, в область потенциалов, отрицательнее Eп.п., происходит увеличение тока коррозии. При этом протекают процессы:
Me + zCl – → MeClz + ze.
Если для металла не характерно явление перепассивации, то смещение потенциала в электроположительную область может вызвать или выделение кислорода (разложение воды):
или протекание процесса анодирования – образования толстого слоя оксила, – например, при анодной обработке алюминиевых сплавов. Первый из этих процессов начинается при достижении потенциала начала выделения кислорода EО2, второй – потенциала анодирования Eан. Для практических целей необходимо:
— чтобы область потенциалов, в которой металл находится в пассивном состоянии, была как можно шире, т.е. чтобы Eп.п. был как можно более электроотрицателен, а Eпер. – как можно более электроположителен;
— iп. и iп.п. должны быть минимальными.
Указанные области при изменении состава раствора, состава сплава и температуры могут частично исчезать. Например, при снижении рН и увеличении концентрации хлора пассивная область сокращается; увеличение температуры расширяет участок аномального растворения; уменьшение содержания хрома в легированной стали снижает активное растворение, сокращает пассивную область. Переход металла в пассивное состояние и не зависят от природы окислителя, действующего на металл, а зависит лишь от величины потенциала.
Пассиваторы и депассиваторы
Вещества или процессы, вызывающие в определенных условиях наступление пассивного состояния металлов, называются пассиваторами.
Пассиваторами являются некоторые вещества окислители и процесс анодной поляризации. Вещества-окислители (например, HNO3, NaNO3, NaNO2, Na2NO4, K2CrO4, O2) имеют большое сродство к металлу и высокую энергию образования новых веществ (хемосорбция). Кислород при хемосорбции пассивирует поверхность, в то время как ионы хлора из-за очень низких энергий образования образуют хлориды металла, вытесняя адсорбированные на поверхности металла атомы пассиватора, способствуя растворению пассивирующих пленок и переходу ионов металла в раствор. К пассиваторам относится также процесс анодной поляризации (т.е. окисление соприкасающейся с раствором электролита поверхности металла электрическим током) от внешнего источника постоянного электрического тока или при работе металла в качестве анода в паре с другим металлом, являющимся катодом. Пассивное состояние металла может сохраняться и после изменения внешних пассивных условий.
Железный образец запассивированный в HNO3 (конц.) длительное время сохраняет пассивность в сухом воздухе.
При изменении внешних условий пассивный металл может перейти в активное состояние. Этот процесс называется активацией, или депассивацией. Вещества или процессы, нарушающие пассивное состояние металлов или затрудняющих наступление их пассивности, называются активаторами, или депассиваторами.
Теории пассивности металлов
Согласно пленочной теории пассивность наступает в результате образования на поверхности металла фазовой пленки толщиной в единицы и десятки нанометров. Эта пленка может представлять собой слой оксида или гидроксида металла и может быть гидратирована в различной степени. Пленочная теория, основанная на том, что кислород химически связан с поверхностью металла, не может объяснить все известные факты в области пассивности. Во многих случаях фазовой пленки на поверхности металла не обнаруживается, тем не менее, металл находится в пассивном состоянии.
Согласно адсорбционной теории пассивация металла наступает в результате адсорбции кислорода на поверхности металла. Причем пассивность может наступать даже тогда, когда по расчетам количество адсорбированного кислорода таково, что поверхность металла не может быть полностью покрыта слоем кислорода толщиной в одну молекулу. Часто бывает достаточно, чтобы весьма малая доля поверхности (около 1 %) была закрыта адсорбированными молекулами кислорода. Этот факт объясняется тем, что на поверхности металла имеется небольшое число активных мест, и адсорбция именно на этих местах резко снижает скорость растворения металла. Адсорбированные молекулы кислорода закрывают активные места на металле и тем самым блокируют процесс ионизации металла в этих наиболее активных местах. Считают, что молекулы кислорода, вызывающие пассивацию металла, образуются из молекул воды или ионов гидроксила, адсорбированных на поверхности металла, по уравнениям:
Изучение явления пассивности привело к важным практическим следствиям.
1) Установлена возможность анодной защиты металлов, склонных к пассивации, т.е. внешней анодной поляризацией можно затормозить процесс ионизации металла. Здесь нужно остерегаться «перезащиты» – возможности сдвига потенциала положительнее Eпер., при котором начинается процесс перепассивации.
2) Показана возможность применения окислителей для защиты металлов от коррозии. Например, насыщение коррозионной среды кислородом, являющимся катодным деполяризатором в нейтральных и щелочных средах и ускоряющим процесс на катодных участках металла, способно затормозить процесс коррозии, так как при этом наступает пассивация металла.
3) Найден метод катодного легирования металлов. Он заключается в том, что в металл, склонный к пассивации, добавляют малые количества легирующих металлов, имеющих значительно более электроположительный потенциал, чем защищаемый металл. Легирующим катодным элементом чаще всего бывает медь. На катодном включении катодные реакции протекают с низким перенапряжением и, тем самым, они обеспечивают в условиях низкой катодной поляризации протекание через коррозионную систему значительного коррозионного тока. Это приводит к сдвигу потенциала защищаемого металла (анод) в область пассивности и металл, таким образом, как бы автоматически поддерживается в пассивном состоянии. Любое случайное нарушение этого состояния вновь приводит в действие коррозионную систему «защищаемый металл (анод) – добавка (катод)», в результате чего снова происходит сдвиг потенциала металла в пассивную область.