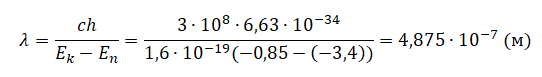что такое стационарное состояние атома
СТАЦИОНАРНОЕ СОСТОЯНИЕ АТОМА
Смотреть что такое «СТАЦИОНАРНОЕ СОСТОЯНИЕ АТОМА» в других словарях:
СТАЦИОНАРНОЕ СОСТОЯНИЕ — состояние тела млн. физ. системы, при котором важные для них характеристики не изменяются со временем. Напр. переход атома из одного С. с. (при котором атом не излучает) в др. происходит скачкообразно, при этом атом излучает или поглощает… … Большая политехническая энциклопедия
Стационарное состояние (квантовая физика) — У этого термина существуют и другие значения, см. Стационарное состояние. Стационарным состоянием (от лат. stationarius стоящий на месте, неподвижный) называется состояние квантовой системы, при котором её энергия и другие динамические … Википедия
Стационарное состояние — В термодинамике стационарным состоянием называют состояние вещества, когда основные его характеристики не изменяются со временем. В квантовой физике стационарным состоянием атома называют состояние, при котором оно имеет постоянную энергию. См.… … Википедия
СОСТОЯНИЕ — (1) аморфное (рентгеноаморфное) состояние твёрдого вещества, в котором нет кристаллической структуры (атомы и молекулы расположены беспорядочно), оно изотропно, т. е. имеет одинаковые физ. свойства по всем направлениям и не имеет чёткой… … Большая политехническая энциклопедия
ОСНОВНОЕ СОСТОЯНИЕ — квантовой системы, состояние атома, молекулы и др. квант. систем с наименьшей возможной внутр. энергией. Является устойчивым. Электроны в атоме, находящемся в О. с., наиб. прочно связаны с ат. ядром. Из О. с. квант. система, поглотив квант… … Физическая энциклопедия
ВОЗБУЖДЕНИЕ АТОМА И МОЛЕКУЛЫ — квантовый переход атома или молекулы с более низкого (напр., основного) уровня энергии на более высокий при поглощении ими фотонов (фотовозбуждение) или при столкновениях с электронами и др. частицами (возбуждение ударом). Под действием света… … Физическая энциклопедия
Атомная физика — раздел физики, в котором изучают строение и состояние атомов. А. ф. возникла в конце 19 начале 20 вв. В 10 х гг. 20 в. было установлено, что атом состоит из ядра и электронов, связанных электрическими силами. На первом этапе своего… … Большая советская энциклопедия
КВАНТОВАЯ МЕХАНИКА — (волновая механика), теория, устанавливающая способ описания и законы движения микрочастиц (элем. ч ц, атомов, молекул, ат. ядер) и их систем (напр., кристаллов), а также связь величин, характеризующих ч цы и системы, с физ. величинами,… … Физическая энциклопедия
АТОМ — (от греч. atomos неделимый), наименьшая частица хим. элемента, носитель его св в. Каждому хим. элементу соответствует совокупность определенных А. Связываясь друг с другом, А. одного или разных элементов образуют более сложные частицы, напр.… … Химическая энциклопедия
Квантовые переходы — скачкообразные переходы квантовой системы (атома, молекулы, атомного ядра, твёрдого тела) из одного состояния в другое. Наиболее важными являются К. п. между стационарными состояниями (См. Стационарное состояние), соответствующими… … Большая советская энциклопедия
Постулаты Бора
теория по физике 🧲 квантовая физика
Планетарная модель атома, предложенная Резерфордом, – это попытка применения классических представлений о движении тел к явлениям атомных масштабов. Она оказалась несостоятельной. Классический атом неустойчив. Электроны, движущиеся по орбите с ускорением, должны неизбежно упасть на
Следующий шаг в развитии представлений об устройстве атома в 1913 году сделал выдающийся датский физик Н. Бор. Проанализировав всю совокупность опытных фактов, Бор пришел к выводу, что при описании поведения атомных систем следует отказаться от многих представлений классической физики. Он сформулировал постулаты, которым должна удовлетворять новая теория о строении атомов.
Квантовые постулаты Бора – предположения (утверждения), сделанные Н. Бором для того, чтобы модель строения атома Резерфорда соответствовала реальному поведению атомов водорода.
Первый постулат Бора
Первый постулат Бора также носит название постулата стационарных состояний:
Атомная система может находиться только в стационарных, или квантовых, состояниях, каждому из которых соответствует определенная энергия En. В стационарном состоянии атом не излучает электромагнитные волны.
Этот постулат находится в явном противоречии с классической механикой, согласно которой энергия движущегося электрона может быть любой. Он находится в противоречии и с электродинамикой, так как допускает возможность ускоренного движения электронов без излучения электромагнитных волн.
Согласно первому постулату Бора, атом характеризуется системой энергетических уровней, каждый из которых соответствует определенному стационарному состоянию (см. рисунок ниже). Механическая энергия электрона, движущегося по замкнутой траектории вокруг положительно заряженного
Внимание! В квантовой физике энергию принято измерять не в Джоулях, а в электрон-вольтах, обозначаемых «эВ». 1 эВ равен энергии, приобретаемой электроном при прохождении разницы потенциалов 1 В. 1 эВ = 1,6∙10 –19 Дж.
Отсюда можно выразить частоту излучения:
Частоту найдем по формуле:
Следовательно, длина волны равна:
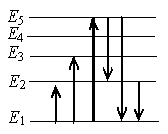
а) с уровня 1 на уровень 5
б) с уровня 5 на уровень 2
в) с уровня 5 на уровень 1
г) с уровня 2 на уровень 1
Алгоритм решения
Решение
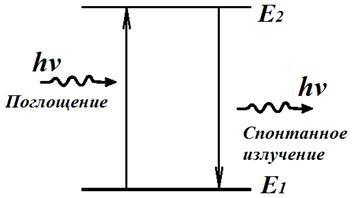
Излучение света происходит при переходе атома из стационарного состояния с большей энергией Ek в стационарное состояние с меньшей энергией En. Энергия излученного фотона равна разности энергий стационарных состояний.
Причем чем на более высоком уровне находится электрон, тем с более высокой энергией фотон он испускает при переходе на 1 уровень. Поэтому на рисунке нам подходит переход с уровня 5 на уровень 1.
pазбирался: Алиса Никитина | обсудить разбор | оценить
В сосуде находится разреженный атомарный водород. Атом водорода в основном состоянии (Е1 = – 13,6 эВ) поглощает фотон частотой 3,7⋅10 15 Гц. С какой скоростью υ движется вдали от ядра электрон, вылетевший из атома в результате ионизации? Энергией теплового движения атомов водорода пренебречь.
Квантовые постулаты Бора
Планетарная модель атома, предложенная Резерфордом, – это попытка применения классических представлений о движении тел к явлениям атомных масштабов. Она оказалась несостоятельной. Классический атом неустойчив. Электроны, движущиеся по орбите с ускорением, должны неизбежно упасть на ядро, растратив всю энергию на излучение электромагнитных волн (рис. 6.2.1).
Неустойчивость классического атома
Следующий шаг в развитии представлений об устройстве атома в 1913 году сделал выдающийся датский физик Н. Бор. Проанализировав всю совокупность опытных фактов, Бор пришел к выводу, что при описании поведения атомных систем следует отказаться от многих представлений классической физики. Он сформулировал постулаты, которым должна удовлетворять новая теория о строении атомов.
Первый постулат Бора (постулат стационарных состояний) гласит: атомная система может находится только в особых стационарных или квантовых состояниях, каждому из которых соответствует определенная энергия En. В стационарных состояниях атом не излучает.
Этот постулат находится в явном противоречии с классической механикой, согласно которой энергия движущегося электрона может быть любой. Он находится в противоречии и с электродинамикой, так как допускает возможность ускоренного движения электронов без излучения электромагнитных волн. Согласно первому постулату Бора, атом характеризуется системой энергетических уровней, каждый из которых соответствует определенному стационарному состоянию (рис. 6.2.2). Механическая энергия электрона, движущегося по замкнутой траектории вокруг положительно заряженного ядра, отрицательна. Поэтому всем стационарным состояниям соответствуют значения энергии En Опубликовано в разделах: Физика атомов и ядра
Стационарное состояние (квантовая физика)
Стационарным состоянием (от лат. stationarius — стоящий на месте, неподвижный) называется состояние квантовой системы, при котором её энергия и другие динамические величины, характеризующие квантовое состояние, не изменяются.
Существование таких состояний для атома было предсказано А. Эйнштейном в 1906 г. и подтверждено Н. Бором в 1916 г. На основе полученных данных, Бор сформулировал свои постулаты. Согласно его выводам, атом может переходить из одного стационарного состояния в другое лишь с помощью поглощения или выделения кванта с энергией, равной разности энергий атома в начальном и конечном стационарных состояниях.
См. также
Ссылки
Полезное
Смотреть что такое «Стационарное состояние (квантовая физика)» в других словарях:
КВАНТОВАЯ МЕХАНИКА — (волновая механика), теория, устанавливающая способ описания и законы движения микрочастиц (элем. ч ц, атомов, молекул, ат. ядер) и их систем (напр., кристаллов), а также связь величин, характеризующих ч цы и системы, с физ. величинами,… … Физическая энциклопедия
Квантовая механика — Квантовая механика … Википедия
Квантовая теория рассеяния — Квантовая механика … Википедия
Квантовая механика — волновая механика, теория устанавливающая способ описания и законы движения микрочастиц (элементарных частиц, атомов, молекул, атомных ядер) и их систем (например, кристаллов) а также связь величин, характеризующих частицы и системы, с… … Большая советская энциклопедия
Атомная физика — раздел физики, в котором изучают строение и состояние атомов. А. ф. возникла в конце 19 начале 20 вв. В 10 х гг. 20 в. было установлено, что атом состоит из ядра и электронов, связанных электрическими силами. На первом этапе своего… … Большая советская энциклопедия
Уравнение Шрёдингера — Квантовая механика … Википедия
Колебания кристаллической решётки — один из основных видов внутренних движений твёрдого тела, при котором составляющие его частицы (атомы или ионы) колеблются около положений равновесия узлов кристаллической решётки. К. к. р., например, в виде стоячих или бегущих звуковых… … Большая советская энциклопедия
Теория функционала плотности — (англ. density functional theory, DFT) метод расчёта электронной структуры систем многих частиц в квантовой физике и квантовой химии. В частности, применяется для расчёта электронной структуры молекул и конденсированного вещества.… … Википедия
Вероятность перехода — Вероятностью перехода называется вероятность квантовой системы перейти из одного стационарного состояния в другое стационарное состояние под воздействием какого либо возмущения. В теории возмущений вероятность перехода даётся формулой: где и… … Википедия
Квантовые постулаты Бора
Квантовые постулаты Бора – это два основных допущения, введённые Н.Бором для объяснения устойчивости атома и спектральных закономерностей (в рамках модели атома Резерфорда).
Планетарная модель атома Резерфорда позволила объяснить результаты опытов по рассеянию α-частиц вещества, но она не способна объяснить факт существования атома и его устойчивость.
В соответствии с планетарной моделью электроны атома должны двигаться вокруг неподвижного ядра. Двигаясь вокруг ядра с центростремительным ускорением под действием силы притяжения к ядру, электрон должен, как и всякий ускоренно движущийся электрический заряд, излучать электромагнитные волны с частотой, равной частоте обращения электрона вокруг ядра.
Энергия электрона в атоме должна при этом непрерывно уменьшаться за счёт излучения. Сам электрон должен с каждым оборотом приближаться по спирали к ядру и упасть на него под действием электрической силы притяжения. При этом атом потеряет всю электронную оболочку, а также присущие ему физические и химические свойства. Кроме того, атом должен потерять спектр излучения частоты, то есть атом должен давать излучение с непрерывным (сплошным) спектром частот.
Эти результаты, полученные с помощью классической механики и электродинамики, находятся в резком противоречии с опытом, который показывает, что
Всё это свидетельствует о том, что законы классический физики применить к электронам в атомах нельзя, поэтому необходимы новые представления о механизме излучения и поглощения атомами электромагнитных волн. В основе современной теории атома лежитквантовая механика – теория, устанавливающая способ описания и законы движения микрочастиц (элементарных частиц, атомов, молекул, атомных ядер) и их систем (например, кристаллов), а также связь величин, которые характеризуют частицы и системы, с физическими величинами, измеряемыми опытным путём.
В 1913 году датский физик Нильс Бор (1885 – 1962) ввёл идеи квантовой теории в ядерную модель атома Резерфорда и разработал теорию атома водорода, которая подтвердилась всеми известными тогда опытами. Бор сформулировал в виде постулатов основные положения новой теории, которые налагали лишь некоторые ограничения на допускаемые классической физикой движения. Однако последовательной теории атома Бор не дал. Впоследствии теория Бора была включена как частный случай в квантовую механику. В основе теории Бора лежат два постулата.
Первый постулат Бора: постулат стационарных состояний
Второй постулат Бора: правило частотe
Частота излучения равна:
Или, длина волны излучения λ равна:
Где h – постоянная Планка, с – скорость света в вакууме.
Правило квантования орбит позволяет определить радиусы стационарных орбит:
где n = 1, 2, 3…, m – масса электрона, rn – радиус n-ой орбиты, vn – скорость электрона на этой орбите.
Число n – положительное число, которое называется главное квантовое число.
Величина (mvn)rn – момент импульса электрона.
h’ – это величина, которая равна:
где h – постоянная Планка.
Главное квантовое число указывает номер орбиты, по которой может обращаться электрон.
Кулоновская сила сообщает электрону на орбите центростремительное ускорение:
Согласно второму закону Ньютона:
rn = 4πε0n 2 h’ / me 2 (так как h’ = h / 2π)
Радиус первой орбиты в атоме водорода носит название первый Боровский радиус и служит единицей длины в атомной физике.
Полная энергия Е электрона в атоме водорода, согласно механике Ньютона, равна сумме кинетической энергии Еk и потенциальной энергии П взаимодействия электрона с ядром:
Потенциальная энергия электрона в атоме отрицательна:
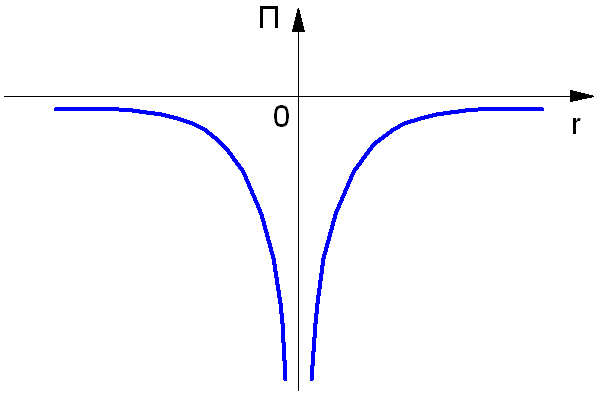
Так как нулевой уровень отсчёта берётся на бесконечности (рис. 1.3), а по мере приближения электрона к ядру его потенциальная энергия уменьшается. Взаимодействующие частицы – ядро и электрон – имеют заряды противоположных знаков.
Рис. 1.3. Потенциальная энергия электрона в атоме.
Подставляя значение скорости
в выражение полной энергии, получим:
Подставляя в эту формулу выражение для радиусов орбит, получим энергетические уровни электрона в атоме водорода (значения энергий стационарных состояний атома):
Значение энергии, соответствующее первому (низшему) энергетическому уровню в атоме водорода равно:
В этом состоянии атом может находиться сколько угодно долго. Для того чтобы ионизировать атом водорода, ему нужно сообщить энергию 13,53 эВ, которая называется энергия ионизации.
Частота излучения атома водорода:
vkn = (1 / (4πε0) 2 ) * (me 4 / h’ 3 ) * [(1 / n 2 ) — (1 / k 2 )] = R[(1 / n 2 ) — (1 / k 2 )]
Постоянная Ридберга определяется через постоянную Планка, массу и заряд электрона.
Длина волны излучения определяется соотношением:
1 / λnk = vnk / c = (me 4 / 8ε0 2 h 3 c) * [(1 / n 2 ) — (1 / k 2 )] = Rc[(1 / n 2 ) — (1 / k 2 )]
с = 3*10 8 м/с – скорость света в вакууме.
Теоретическое значение R совпадает с экспериментальным значением, полученным из спектроскопических измерений.
Энергия обычно измеряется в электронвольтах (эВ). Электронвольт– это значение энергии, которую приобретает электрон, пройдя ускоряющую разность потенциалов в 1 В: