что такое стандартизация раствора
Стандартизация решений в том, что состоит и решаемых упражнений
стандартизация решений это процесс, который позволяет точно определить концентрацию раствора. Вещества, используемые для этой цели, называются первичными стандартами..
Раствор стандартизируют, используя метод объемного титрования (титрование), либо классическими, либо инструментальными методами (потенциометрия, колориметрия и т. Д.)..
Для этого растворенные вещества заранее реагируют с тяжелым первичным стандартом. Поэтому использование объемных баллонов является обязательным условием для этих количественных анализов..
Например, карбонат натрия является основным стандартом, используемым при стандартизации кислот, включая соляную кислоту, которая становится титрантом, поскольку его можно использовать при титровании гидроксида натрия. Таким образом, основность выборки может быть определена.
Объемы титранта добавляются непрерывно, пока он не прореагирует с эквивалентной концентрацией аналита. Это указывает на то, что степень эквивалентности степени была достигнута; другими словами, титрант «нейтрализует» аналит полностью, превращая его в другой химический вид.
Известно, когда добавление титранта должно быть завершено с помощью индикаторов. Момент, в котором индикатор меняет цвет, называется конечной точкой титрования..
Что такое стандартизация?
Когда требуется большая точность в концентрации растворов, раствор для титрования стандартизируется так же, как и раствор, который она собирается назвать.
Реакции, в которых используется метод титрования, включают:
-Кислотно-основные реакции. Концентрация многих кислот и оснований может быть определена объемным методом.
-Реакции восстановления оксида. Химические реакции, включающие окисление, широко используются в объемном анализе; как например, йодометрические определения.
-Реакции осадков. Катион серебра осаждается вместе с анионом группы галогенов, таким как хлор, с получением хлорида серебра, AgCl.
-Реакции комплексообразования, например реакция серебра с цианид-ионом.
Характеристики первичных стандартов
Вещества, используемые в качестве основных стандартов, должны соответствовать ряду требований для выполнения их функции стандартизации:
-Имеют известный состав, так как в противном случае не будет точно известно, сколько следует взвесить из стандарта (не говоря уже о расчете его последующей концентрации).
-Быть стабильным при комнатной температуре и сопротивляться температурам, необходимым для сушки на плите, включая температуру, равную или превышающую температуру кипения воды.
-Имейте большую чистоту. В любом случае содержание примесей не должно превышать 0,01-0,02%. Кроме того, примеси могут быть определены качественно, что облегчит удаление возможных помех в анализах (например, ошибочные объемы используемого титранта).
-Быстро сохнет и не может быть настолько гигроскопичным, то есть удерживать воду во время сушки. И при этом они не должны терять вес при воздействии воздуха.
-Не поглощайте газы, которые могут вызвать помехи, а также вырождение рисунка
-Быстро и стехиометрически реагировать с реагентом-титрантом.
-Имеет высокий эквивалентный вес, который уменьшает ошибки, которые могут быть допущены при взвешивании вещества.
Стандартизация растворов титрантов


Стандартизация растворов титрантов
В таких случаях раствор для титрования готовят и стандартизируют, потому что его концентрация известна только приблизительно. Людмила Фирмаль
То есть концентрация установлена точно. Эти решения называются установленными. Для стандартизации решения используется специальный установочный материал — так называемый первичный стандарт. Эти вещества должны иметь состав, точно соответствующий химической формуле, быть стабильными на воздухе и, если возможно, соответствовать большой молярной массе.
Например, растворы iNaOH и KOH часто (KNS8N4O4) или дигидрат По раствору береновой кислоты НГСГО ^ НгО, HCI и H2SO4 fT ^ V — COOH Bifutaratu Na2CO3 борат или тетрагорат натрия декагидрат Na2B407 ‘• IOH2O, раствор перманганата калия — посредством. Часто для целей стандартизации используется вторичный стандарт, раствор для титрования вещества, которое может взаимодействовать с титром.
Оксалат натрия № 2 Cr04 и др. Людмила Фирмаль
Например, стандартизация раствора HCl может быть проведена с помощью титрованного раствора NaOH. Как правило, старайтесь стандартизировать титрант в тех же условиях, что и при проведении анализа, и, если возможно, использовать то же вещество, которое будет анализироваться в будущем.
Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института
Стандартизация решений: из чего состоит и упражнения
Содержание:
В стандартизация решений Это процесс, позволяющий точно определять концентрацию раствора. Вещества, используемые для этой цели, называются первичными стандартами.
Раствор стандартизируют методом объемного титрования (титрования) классическими или инструментальными методами (потенциометрия, колориметрия и т. Д.).
Для этого растворенные частицы заранее вступают в реакцию с взвешенным первичным стандартом. Таким образом, использование объемных шаров очень важно для проведения количественного анализа.
Например, карбонат натрия является первичным стандартом, который используется при стандартизации кислот, включая соляную кислоту, которая становится титрантом, поскольку ее можно использовать при титровании гидроксида натрия. Таким образом, можно определить основность образца.
Объемы титранта добавляются непрерывно до тех пор, пока он не прореагирует с эквивалентной концентрацией аналита. Это указывает на то, что точка эквивалентности степени была достигнута; Другими словами, титрант полностью «нейтрализует» аналит, превращая его в другой химический состав.
Известно, когда следует завершить добавление титранта с помощью индикаторов.Момент изменения цвета индикатора называется конечной точкой титрования.
Что такое стандартизация?
Когда требуется высокая точность концентрации растворов, стандартизируют как раствор титранта, так и раствор, которым он будет титроваться.
Реакции, в которых используется метод титрования, включают:
-Кислотно-основные реакции. Объемным методом можно определить концентрацию многих кислот и оснований.
-Реакции восстановления оксидов. Химические реакции, включающие окисление, широко используются в волюметрическом анализе; такие как, например, йодиметрические определения.
-Реакции осаждения. Катион серебра осаждается вместе с анионом из группы галогенов, такой как хлор, с получением хлорида серебра AgCl.
-Реакции комплексообразования, например реакция серебра с цианид-ионом.
Характеристики первичных эталонов
Вещества, используемые в качестве первичных стандартов, должны соответствовать ряду требований для выполнения своей функции стандартизации:
-Иметь известный состав, так как иначе не будет известно, сколько именно стандарта следует взвесить (а тем более рассчитать его последующую концентрацию).
-Будьте стабильны при комнатной температуре и выдерживайте температуры, необходимые для сушки в духовке, включая температуры, равные или превышающие температуру кипения воды.
-Имеют большую чистоту. В любом случае содержание примесей не должно превышать 0,01-0,02%. Кроме того, примеси могут быть определены качественно, что облегчит устранение возможных помех в анализе (например, неправильные объемы используемого титранта).
— Легко сохнут и не могут быть такими гигроскопичными, то есть задерживают воду при сушке. Также они не должны терять вес на воздухе.
-Не впитывать газы, которые могут создавать помехи, а также вырождение рисунка
— Быстро и стехиометрически реагировать с титрантным реагентом.
-Иметь высокий эквивалентный вес, что снижает количество ошибок, которые могут быть сделаны при взвешивании вещества.
Примеры первичных стандартов
Стандартизировать основы
-Фталат калия кислоты
Для стандартизации кислот
-Боракс (смесь борной кислоты и бората натрия).
-Три-гидроксиметиламинометан (известный как THAM)
Для стандартизации окислительно-восстановительных реагентов
Упражнения
Упражнение 1
Определенное количество карбоната натрия (первичный эталон кислот) весом 0,3542 г растворяют в воде и титруют раствором соляной кислоты.
Для достижения точки поворота индикатора метилового оранжевого, добавленного к раствору карбоната натрия, было израсходовано 30,23 мл раствора соляной кислоты. Рассчитайте концентрацию HCl.
Это раствор, который будет стандартизирован с использованием карбоната натрия в качестве основного стандарта.
pEq (Na2CO3 = pm / 2) (молекулярная масса Na2CO3 = 106 г / моль)
pEq = (106 г / моль) / (2 экв / моль)
В точке эквивалентности:
30,23 мл x N HCl = 354, мг / (53 мг / мэкв)
А затем очистив нормальность HCl, N:
30,23 мл x N HCl = 6,68 мэкв.
N HCl = 6,68 мэкв / 30,23 мл
N HCl = 0,221 мэкв / мл
Упражнение 2.
Фталат калия (KHP) используется для стандартизации раствора NaOH, первичного стандарта, который представляет собой устойчивое к воздуху твердое вещество, которое легко взвешивать.
1,673 г фталата калия растворяют в 80 мл воды и добавляют 3 капли раствора индикатора фенолфталеина, который приобретает розовый цвет в конечной точке титрования.
Зная, что для титрования KHP требуется 34 мл NaOH, что это нормально?
Эквивалентная масса фталата калия = 204,22 г / экв.
В конечной точке эквивалентности:
Эквиваленты NaOH = эквиваленты KHP
VNaOH x N = 1,673 г / (204,22 г / экв)
И поскольку было использовано 34 мл (0,034 л), он подставляется в уравнение
Упражнение 3.
Образец CaCO3 чистый (первичный стандарт) массой 0,45 г растворяют в объеме воды и после солюбилизации дополняют водой на 500 мл в мерной колбе.
Возьмите 100 мл раствора карбоната кальция и поместите его в колбу Эрленмейера. Раствор титруют 72 мл этилендиаминтетрауксусной кислоты (ЭДТА), используя черный эриохромный индикатор T.
Рассчитайте молярность раствора AEDT
В точке эквивалентности степени:
ммоль AEDT = ммоль CaCO3
V x молярность EDTA = мг CaCO3 / PM CaCO3
Из растворения карбоната кальция в 500 мл на титрование было взято 100 мл, то есть 0,09 г (пятая часть 0,45 г). Таким образом:
0,072 л x M ЭДТА = 0,09 г / 100,09 г / моль
Ссылки
150 красивых фраз на годовщину свадьбы и жениха
Пселисмофобия (боязнь заикания): симптомы, причины и лечение
Стандартизация раствора титранта
Под стандартизацией раствора титранта имеют в виду установление его точной концентрации с относительной погрешностью, обычно не превышающей ± 0,1 %. Обязательным условием этой процедуры является высокая точность определения концентрации титранта.
· приготовленные
· установленные растворы титрантов.
Приготовленные растворы получают путем растворения точной навески тщательно очищенного исходного вещества в определенном объеме воды или другого растворителя (например, раствор NaCl, K2Cr2O7).
Однако многие растворы таким путем приготовить нельзя, в том числе, NaOH, KMnO4. В таких случаях готовят раствор титранта приблизительной концентрации, а потом его стандартизуют, т. е. устанавливают концентрацию с необходимой точностью. Такие растворы называют установленными.
Для стандартизации титрантов применяют специальные установочные вещества, так называемые первичные стандарты. Первичные стандарты – вещества, имеющие состав, точно отвечающий химической формуле. Они должны удовлетворять следующим требованиям:
· быть устойчивы на воздухе и иметь, по возможности, большую молярную массу эквивалента;
· должны быть негигроскопичны;
· быть доступными, иметь высокую чистоту (х.ч. или ч.д.а.), либо легко очищаться от примесей;
· реакция вещества титранта с установочным веществом должна протекать быстро, количественно и стехиометрически.
Растворы NaOH и КОН часто стандартизуют по дифталату калия КНС8Н4О4илидигидрату щавелевой кислоты Н2С2О4 · 2Н2О.
Растворы HCl и H2SO4 стандартизуют по карбонату натрия Na2СО3 или декагидратутетрабората натрия Na2В4О7 ·10 Н2О.
Иногда для стандартизации используют вторичные стандарты. В качестве вторичных стандартов выступают титрованные растворы веществ, способных взаимодействовать с титрантом. Например, стандартизацию раствора HCl можно сделать по титрованному раствору NaOH.
Основное правило, которое необходимо помнить: стандартизация титранта и последующее выполнение анализа необходимо проводить в одних и тех же условиях, а для стандартизации использовать то же вещество, которое будет анализироваться в дальнейшем.
Стандартные растворы готовят в мерных колбах из фиксаналов, которые содержат точно фиксированное количество вещества, обычно 0,1 моль эквивалента.
При стандартизации растворов используют: 1) метод отдельных навесок; 2) метод пипетирования.
1. Метод отдельных навесок.
Рассчитывают массу навески стандартного вещества при условии, что расход титранта на её титрование составляет не более 20 мл. На аналитических весах взвешивают в бюксах три навески, которые могут отличаться от рассчитанной на ± 10 %. Затем их переносят точно в конические колбы для титрования, добавляют индикатор и титруют. Рассчитывают молярную концентрацию титранта для каждой навески стандартного вещества и расхождение между наибольшим и наименьшим результатами. Если расхождение не превышает 0,2 – 0,3 %, то берут среднее значение из всех трех результатов. В случае большего расхождения взвешивают еще одну навеску стандартного вещества, титруют её, находят четвертый результат и снова проверяют сходимость значений молярной концентрации.
2. Метод пипетирования.
При стандартизации растворов этим методом рассчитывают навеску стандартного вещества, необходимую для приготовления заданного объема раствора первичного стандарта с концентрацией, близкой к молярной концентрации титранта. Взвешенную на аналитических весах навеску твердого вещества количественно переносят в мерную колбу, растворяют, тщательно перемешивая. Аликвоту полученного раствора отбирают пипеткой, предварительно промытой этим раствором, в коническую колбу для титрования и титруют стандартизуемым раствором. Аликвота – порция вещества, содержащаяся в растворе, отобранном с помощью пипетки.
При стандартизации раствора титрование проводят не менее трех раз. Если объемы, затраченные на титрование, совпадают между собой в пределах 0,2 – 0,3 %, то берут из них среднее значение и рассчитывают молярную концентрацию титранта. В случае большего расхождения проводят повторное титрование.
Для приготовления стандартных растворов используют также «фиксаналы» (стандарт-титры). Фиксанал представляет собой стеклянную или пластиковую ампулу, содержащую точную навеску стандартного твердого вещества (или определенный объем титрованного раствора), необходимую для приготовления 1 литра точно 0,1 моль/л раствора.
Стандартизация раствора титранта
Под стандартизацией раствора титранта имеют в виду установление его точной концентрации с относительной погрешностью, обычно не превышающей ±0,1%. Высокая точность, с которой определяется концентрация титранта, является обязательным условием, обеспечивающим необходимую точность титриметрического определения.
Различают приготовленные и установленные растворы титрантов. Приготовленные растворы получают путем растворения точной навески тщательно очищенного исходного вещества в определенном объеме воды или другого растворителя. Так готовят, например, титрованный раствор NaCl, K2Cr2O7 и др.
Однако многие растворы приготовить таким путем нельзя, т.к. не всегда можно получить исходное вещество в состоянии, пригодном для этой цели, например NaOH, KMnO4 и др. В таких случаях готовят установленный раствор – это раствор титранта, концентрация которого известна лишь приблизительно, затем его стандартизируют, т. е. устанавливают концентрацию с необходимой точностью. Для стандартизации титрантов применяют специальные установочные вещества, так называемые первичные стандарты.
Эти вещества должны иметь:
– состав, точно отвечающий химической формуле,
– быть устойчивыми на воздухе,
– иметь, по возможности, большую молярную массу эквивалента,
– быть доступными и легко очищаться от примесей.
Реакция вещества титранта с установочным веществом должна отвечать требованиям, которые предъявляются к титриметрическим реакциям, т.е. протекать быстро, количественно и стехиометрически.
– Растворы NaOH и КОН часто стандартизируют по дифталату калия 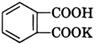
– растворы НСl и H2SО4 по карбонату натрия Na2CO3 или декагидрату тетрабората натрия Na2B4O7 • 10Н2О;
– растворы перманганата калия – по оксалату натрия Na2C2О4 и т.д.
Нередко для целей стандартизации используют вторичные стандарты, в качестве которых выступают титрованные растворы веществ, способных взаимодействовать с титрантом. Например, стандартизацию раствора НСl можно сделать по титрованному раствору гидроксида натрия.
Как правило, стандартизацию титранта и последующее выполнение анализа стремятся проводить в одних и тех же условиях, а для стандартизации использовать то же вещество, которое будет анализироваться в дальнейшем.
Удобным практическим методом приготовления стандартного титрованного раствора является использование фиксаналов. Фиксанал представляет собой ампулу, в которой содержится точно фиксированное количество вещества, обычно 0,1 моль эквивалента. Для получения стандартного титрованного раствора достаточно растворить содержимое фиксанала в определенном объеме воды или другого растворителя, используя мерную колбу.
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет


