что такое сплошной спектр
Линейчатые спектры
теория по физике 🧲 оптика
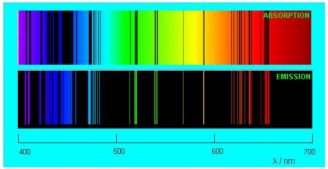
Если пропустить солнечный свет через стеклянную призму или дифракционную решётку, то на экране получится хорошо известный нам спектр. Спектр, который вы видите ниже, называется непрерывным спектром. Он представляет собой сплошную полосу, состоящую из разных цветов, плавно переходящих друг в друга.
Непрерывный (сплошной) спектр — разновидность спектра, в которой присутствуют все длины волн видимого диапазона (от красной границы до фиолетовой).
Излучения, обладающие непрерывным спектром:
Пример №1. Будет ли излучать свет в непрерывном спектре спираль работающей электроплиты?
В данном случае да, поскольку спирать — твердое тело, нагретое до высокой температуры.
Линейчатый спектр и его виды
Картина резко меняется, когда мы наблюдаем свечение, излучаемое разреженными газами. Спектр перестает быть непрерывным: в нём появляются разрывы, которые увеличиваются по мере разрежения газа. В предельном случае чрезвычайно разреженного атомарного газа спектр становится линейчатым.
Линейчатый спектр — спектр, который состоит из отдельных достаточно тонких линий.
Линейчатый спектр бывает двух видов:
Спектр испускания
Предположим, что газ состоит из атомов некоторого химического элемента и разрежен настолько, что атомы почти не взаимодействуют друг с другом. Раскладывая в спектр излучение такого газа (нагретого до очень высокой температуры), мы сможем наблюдать такую картину, как на картинке ниже.
Спектр испускания — линейчатый спектр, который состоит из тонких изолированных разноцветных линий, соответствующих тем длинам волн света, который излучается атомами.
Любой атомарный разреженный газ излучает свет с линейчатым спектром. Но наибольшую важность имеет то, что для любого химического элемента спектр испускания является уникальным. Поэтому по нему можно устанавливать, какой химический элемент находится перед нами. Он является своего рода идентификатором.
Поскольку газ разрежен и атомы мало взаимодействуют друг с другом, мы можем сделать следующий вывод:
Свет излучают атомы сами по себе. Следовательно, каждый атом характеризуется дискретным, строго определённым набором длин волн излучаемого света. У каждого химического элемента этот набор свой.
Спектр поглощения
Атомы излучают свет в процессе перехода из возбуждённого состояния в основное. Но вещество может не только излучать, но и поглощать свет. При поглощении света атом совершает обратный процесс — он переходит из основного состояния в возбуждённое.
Снова рассмотрим разреженный атомарный газ, но теперь в охлажденном состоянии (при довольно низкой температуре). Свечения газа в этом случае мы не увидим. В не нагретом состоянии газ не излучает свечение, так как атомов в возбуждённом состоянии оказывается для этого слишком мало.
Если сквозь охлажденный газ пропустить свет с непрерывным спектром, мы увидим следующую картину (см. рисунок ниже).
Спектр поглощения — темные линии на фоне непрерывного спектра, соответствующие тем длинам волн света, которые поглощаются атомами и излучаются впоследствии при сильном нагревании.
Объясним, откуда берутся темные линии. Под действием падающего света газовые атомы переходят в возбуждённое состояние. При этом оказывается, что для возбуждения атомов нужны не любые длины волн, а лишь некоторые, строго определённые для данного вида газа. Именно эти длины волн газ поглощает из падающего на него света.
Внимание! Газ поглощает те длины волн, которые излучает сам. Поэтому, цветные линии на спектре испускания соответствуют темным линиям на спектре поглощения. Если их сложить, можно получить непрерывный спектр.
На рисунке ниже сопоставлены спектры испускания и поглощения разреженных паров натрия.
Глядя на спектры испускания и поглощения, ученые XIX века пришли к выводу, что атом не является неделимой частицей и обладает некоторой внутренней структурой. Ведь что-то внутри атома должно обеспечивать процессы излучения и поглощения света.
Кроме того, уникальность атомных спектров говорит о том, что этот механизм различен у атомов разных химических элементов. Поэтому атомы разных химических элементов должны отличаться по своему внутреннему устройству.
Спектральный анализ
Использование линейчатых спектров в качестве идентификаторов химических элементов лежит в основе спектрального анализа.
Спектральный анализ — метода исследования химического состава вещества по его спектру.
Идея спектрального анализа заключается в следующем. Спектр излучения исследуемого вещества сопоставляется с эталонными спектрами химических элементов. Затем делается вывод о присутствии или отсутствии различных химических элементов в исследуемом образце. При определённых условиях посредством спектрального анализа можно определить химический состав не только качественно, но и количественно.
В результате наблюдения различных спектров были открыты новые химические элементы. Первыми из таких элементов были цезий и рубидий. Названия эти элементы получили по цвету линий своего спектра. Так, в спектре цезия больше всего выражены две линии небесно-синего цвета, который на латинском языке звучит как caesius. Рубидий же даёт две отчетливые линии рубинового цвета.
В 1868 году в спектре солнечного света были обнаружены линии, не соответствующие ни одному из известных химических элементов. Этот элемент был назван гелием (от греческого гелиос — солнце). Впоследствии гелий был найден в атмосфере нашей планеты. Спектральный анализ излучения Солнца и других звезд показал, что все входящие в их состав входят элементы имеются и на Земле. Таким образом, оказалось, что все объекты Вселенной собраны из одного и того же набора элементов.
Пример №2. Какую картинку можно получить, если провести спектральный анализ вещества, состоящего из двух химических элементов?
Спектры испускания и спектры поглощения будут накладываться друг на друга. В итоге можно будет получить спектр испускания, в котором будут присутствовать все длины волн, соответствующие тем, что испускаются первым и вторым химическим элементом. В спектре поглощения эти же длины волн будут отсутствовать.
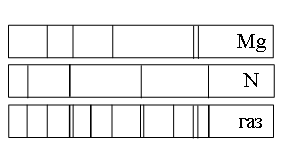
а) азота (N), магния (Mg) и другого неизвестного вещества
в) только магния (Mg)
г) только магния (Mg) и азота (N)
Алгоритм решения
Решение
Если спектр поглощения неизвестного газа содержит все линии, которые есть на спектре известного элемента, то этот газ содержит этот элемент.
Видно, что спектр поглощения неизвестного газа включает в себя все линии, которые есть в спектре поглощения магния. Следовательно, этот газ содержит магний.
Видно, что спектр поглощения неизвестного газа включает в себя все линии, которые есть в спектре поглощения азота. Следовательно, этот газ также содержит азот.
Но кроме линий, соответствующих азоту и магнию, на спектре поглощения газа наблюдаются другие линии. Следовательно, газ содержит как минимум еще один элемент.
pазбирался: Алиса Никитина | обсудить разбор | оценить
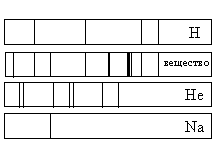
а) только натрий (Na) и водород (Н)
б) только водород (Н) и гелий (Не)
в) водород (Н), гелий (Не) и натрий (Na)
г) натрий (Na), водород (H) и другие элементы, но не гелий (He)
Алгоритм решения
Решение
Если спектр поглощения неизвестного газа содержит все линии, которые есть на спектре известного элемента, то этот газ содержит данный элемент.
Видно, что спектр поглощения неизвестного вещества включает в себя все линии, которые есть в спектре поглощения водорода и натрия. Но линий, соответствующих спектру поглощения гелия, в нем нет. Следовательно, это вещество содержит водород, натрий, но не содержит гелий.
Кроме линий, соответствующих водороду и натрию, на спектре поглощения вещества наблюдаются другие линии. Следовательно, оно содержит как минимум еще один элемент.
pазбирался: Алиса Никитина | обсудить разбор | оценить

Можно утверждать, что в неизвестном образце
а) не содержится стронция
б) не содержится кальция
в) содержатся кальций и ещё какие-то элементы
г) содержится только кальций
Алгоритм решения
Решение
Если спектр излучения неизвестного образца содержит все линии, которые есть на спектре излучения известного элемента, то этот образец содержит данный элемент.
Видно, что спектр излучения неизвестного образца включает в себя все линии, которые есть в спектре излучения стронция. Но линий, соответствующих спектру излучения кальция, в нем нет. Следовательно, этот образец не содержит кальций.
Кроме линий, соответствующих стронцию, на спектре излучения неизвестного образца наблюдаются другие линии. Следовательно, он содержит как минимум еще один элемент.
Из всех перечисленных утверждений верным является только одно — образец не содержит кальция.
pазбирался: Алиса Никитина | обсудить разбор | оценить
Что такое сплошной спектр
1. Как выглядит сплошной спектр?
При пропускании солнечного света через призму получался спектр в виде сплошной полосы.
В ней были представлены все цвета (т. е. волны всех частот) видимого диапазона), плавно переходящие один в другой.
2. Какие тела дают сплошной спектр? Приведите примеры.
Сплошной спектр характерен для твёрдых и жидких излучающих тел, имеющих температуру порядка нескольких тысяч градусов Цельсия. Сплошной спектр дают также светящиеся газы и пары, если они находятся под очень высоким давлением (т. е. если силы взаимодействия между их молекулами достаточно велики).
Свет от раскаленной нити электрической лампы, светящаяся поверхность расплавленного металла, пламя свечи.
3. Как выглядят линейчатые спектры?
Линейчатые спектры представляют собой наборы отдельных линий определенных цветов.
Разные химические элементы дают свои собственные наборы отдельных линий.
5. Каким образом можно получить линейчатый спектр испускания натрия?
Если внести в пламя спиртовки кусочек поваренной соли, то пламя окрасится в жёлтый цвет, а в спектре, наблюдаемом с помощью спектроскопа, будут видны две близко расположенные жёлтые линии, характерные для спектра паров натрия.
Под действием высокой температуры молекулы NaCl распались на атомы натрия и хлора.
Свечение атомов хлора возбудить гораздо труднее, чем атомов натрия, поэтому в данном опыте линии хлора не видны.
6. От каких источников света получаются линейчатые спектры?
Линейчатые спектры получают от газов и паров малой плотности, при которой свет излучается изолированными атомами.
7. Каков механизм получения линейчатых спектров поглощения (т. е. что нужно сделать, чтобы получить их)?
Линейчатые спектры поглощения дают газы малой плотности, состоящие из изолированных атомов, когда сквозь них проходит свет от яркого и более горячего (по сравнению с температурой самих газов) источника, дающего непрерывный спектр.
8. Как получить линейчатый спектр поглощения натрия и как он выглядит?
Линейчатый спектр поглощения натрия можно получить, если пропустить свет от лампы накаливания через сосуд с парами натрия, температура которых ниже температуры нити лампы накаливания.
В этом случае в сплошном спектре света от лампы появится узкая чёрная линия как раз в том месте, где располагается жёлтая линия в спектре испускания натрия.
Это и будет линейчатый спектр поглощения натрия.
Линии поглощения атомов натрия точно соответствуют его линиям испускания.
8. В чем заключается суть закона Кирхгофа, касающегося линейчатых спектров излучения и поглощения?
Общий для всех химических элементов закон был открыт в середине XIX в. немецким физиком Густавом Кирхгофом:
Атомы данного элемента поглощают световые волны тех же самых частот, на которых они излучают.
Спектр атомов каждого химического элемента уникален.
Не существует двух химических элементов, атомы которых излучали бы одинаковый набор спектральных линий.
Что такое сплошной спектр
Тепловое излучение – излучение, при котором потери атомами энергии на излучение света компенсируются за счет энергии теплового движения атомов (или молекул) излучающего тела. Тепловым источником является солнце, лампа накаливания и т. д.
Катодолюминесценция – свечение твердых тел, вызванное бомбардировкой их электронами. Благодаря ей светятся экраны электронно-лучевых трубок телевизоров.
Хемилюминесценция – излучение света в некоторых химических реакциях, идущих с выделением энергии. Ее можно наблюдать на примере светлячка и других живых организмах, обладающих свойством светиться.
Фотолюминесценция – свечение тел непосредственно под действием падающих на них излучений. Примером являются светящиеся краски, которыми покрывают елочные игрушки, они излучают свет после их облучения. Это явление широко используется в лампах дневного света.
Для того чтобы атом начал излучать, ему необходимо передать определенную энергию. Излучая, атом теряет полученную энергию, и для непрерывного свечения вещества необходим приток энергии к его атомам извне.
Полосатый спектр состоит из отдельных полос, разделенных темными промежутками. С помощью очень хорошего спектрального аппарата можно обнаружить, что каждая полоса представляет собой совокупность большого числа очень тесно расположенных линий. В отличие от линейчатых спектров полосатые спектры создаются не атомами, а молекулами, не связанными или слабо связанными друг с другом.
Для наблюдения молекулярных спектров так же, как и для наблюдения линейчатых спектров, обычно используют свечение паров в пламени или свечение газового разряда.
Схема устройства призменного спектрографа
Тёмные линии на спектральных полосках были замечены давно (например, их отметил Волластон), но первое серьёзное исследование этих линий было предпринято только в 1814 году Йозефом Фраунгофером. В его честь эффект получил название «Фраунгоферовы линии». Фраунгофер установил стабильность положения линий, составил их таблицу (всего он насчитал 574 линии), присвоил каждой буквенно-цифровой код. Не менее важным стало его заключение, что линии не связаны ни с оптическим материалом, ни с земной атмосферой, но являются природной характеристикой солнечного света. Аналогичные линии он обнаружил у искусственных источников света, а также в спектрах Венеры и Сириуса.
Для проверки метода в 1868 году Парижская академия наук организовала экспедицию в Индию, где предстояло полное солнечное затмение. Там учёные обнаружили: все тёмные линии в момент затмения, когда спектр излучения сменил спектр поглощения солнечной короны, стали, как и было предсказано, яркими на тёмном фоне.
Природа каждой из линий, их связь с химическими элементами выяснялись постепенно. В 1860 году Кирхгоф и Бунзен при помощи спектрального анализа открыли цезий, а 1861 году — рубидий. А гелий был открыт на Солнце на 27 лет ранее, чем на Земле (1868 и 1895 годы соответственно).
Атомы каждого химического элемента имеют строго определённые резонансные частоты, в результате чего именно на этих частотах они излучают или поглощают свет. Это приводит к тому, что в спектроскопе на спектрах видны линии (тёмные или светлые) в определённых местах, характерных для каждого вещества. Интенсивность линий зависит от количества вещества и его состояния. В количественном спектральном анализе определяют содержание исследуемого вещества по относительной или абсолютной интенсивностям линий или полос в спектрах.
Оптический спектральный анализ характеризуется относительной простотой выполнения, отсутствием сложной подготовки проб к анализу, незначительным количеством вещества (10—30 мг), необходимого для анализа на большое число элементов. Атомарные спектры (поглощения или испускания) получают переведением вещества в парообразное состояние путём нагревания пробы до 1000—10000 °C. В качестве источников возбуждения атомов при эмиссионном анализе токопроводящих материалов применяют искру, дугу переменного тока; при этом пробу помещают в кратер одного из угольных электродов. Для анализа растворов широко используют пламя или плазму различных газов.
Спектр электромагнитных излучений
Свойства электромагнитных излучений. Электромагнитные излучения с различными длинами волн имеют довольно много различий, но все они, от радиоволн и до гамма-излучения, одной физической природы. Все виды электромагнитного излучения в большей или меньшей степени проявляют свойства интерференции, дифракции и поляризации, характерные для волн. Вместе с тем все виды электромагнитного излучения в большей или меньшей мере обнаруживают квантовые свойства.
Общим для всех электромагнитных излучений являются механизмы их возникновения: электромагнитные волны с любой длиной волны могут возникать при ускоренном движении электрических зарядов или при переходах молекул, атомов или атомных ядер из одного квантового состояния в другое. Гармонические колебания электрических зарядов сопровождаются электромагнитным излучением, имеющим частоту, равную частоте колебаний зарядов.
Радиоволны. При колебаниях, происходящих с частотами от 10 5 до 10 12 Гц, возникают электромагнитные излучения, длины волн которых лежат в интервале от нескольких километров до нескольких миллиметров. Этот участок шкалы электромагнитных излучений относится к диапазону радиоволн. Радиоволны применяются для радиосвязи, телевидения, радиолокации.
Инфракрасное излучение испускают любые нагретые тела. Источниками инфракрасного излучения служат печи, батареи водяного отопления, электрические лампы накаливания.
С помощью специальных приборов инфракрасное излучение можно преобразовать в видимый свет и получать изображения нагретых предметов в полной темноте. Инфракрасное излучение применяется для сушки окрашенных изделий, стен зданий, древесины.
Значение этого участка спектра электромагнитных излучений в жизни человека исключительно велико, так как почти все сведения об окружающем мире человек получает с помощью зрения. Свет является обязательным условием развития зеленых растений и, следовательно, необходимым условием для существования жизни на Земле.
В качестве источников ультрафиолетового излучения в медицине используются газоразрядные лампы. Трубки таких ламп изготавливают из кварца, прозрачного для ультрафиолетовых лучей; поэтому эти лампы называют кварцевыми лампами.
Способность рентгеновских лучей проникать через толстые слои вещества используется для диагностики заболеваний внутренних органов человека. В технике рентгеновские лучи применяются для контроля внутренней структуры различных изделий, сварных швов. Рентгеновское излучение обладает сильным биологическим действием и применяется для лечения некоторых заболеваний. Гамма-излучение. Гамма-излучением называют электромагнитное излучение, испускаемое возбужденными атомными ядрами и возникающее при взаимодействии элементарных частиц.
Физика. 11 класс
Электромагнитная природа света
Излучение и спектры
Необходимо запомнить
Тепловое излучение – это излучение нагретых тел.
Электролюминесценция – это свечение, сопровождающее разряд в газе.
Катодолюминесценция – свечение твердых тел, вызванное бомбардировкой их электронами.
Хемилюминесценция – свечение, происходящее за счёт выделения энергии при некоторых химических реакциях.
Фотолюминесценция – свечение тела непосредственно под действием падающего на него излучения.
Спектральные аппараты – оптические приборы, в которых осуществляется разложение электромагнитного излучения оптического диапазона на монохроматические составляющие.
Спектры испускания – это совокупность частот или длин волн, которые содержатся в излучении какого-либо вещества.
Непрерывный (или сплошной) спектр – это спектр, в котором представлены волны всех длин волн в данном диапазоне.
Линейчатый спектр – это спектр, представляющий собой цветные линии различной яркости, разделённые широкими тёмными полосами.
Полосатый спектр – это спектр, состоящий из отдельных полос, разделённых тёмными промежутками.
Тёмные линии на фоне непрерывного спектра – это линии поглощения, образующие в совокупности спектр поглощения.
Спектральный анализ – метод определения химического состава вещества по его спектру.
Низкочастотные волны – электромагнитные волны, с частотой до 100 кГц.
Радиоволны – электромагнитные волны, с длиной волны больше 1 мм и меньше 3 км.
Лабораторная работа «Наблюдение сплошного и линейчатого спектров»
Особенности излучения
А так ли хорошо мы знаем излучение?
Разговор об излучении мы могли бы продолжать долго, т. к. существует очень много его видов. Это световые волны, тормозное излучение заряжённых частиц, вид теплопередачи, лучи из космоса, излучение теле- и радиоантенн и т. д.. Если все эти излучения подвести под одно определение, то можно сказать, что излучение – это распространение энергии в виде волн и частиц. Это необъятная тема!
К концу XIX века в крепком фундаменте здания классической физики возникла небольшая вроде бы трещинка, и её появление было связано с особенностями теплового излучения. Попытки найти им объяснение в рамках сложившихся представлений приводили к невероятным результатам – так называемой ультрафиолетовой катастрофе, когда любое тело из-за теплового излучения должно было остывать до абсолютного нуля! Выход из этого затруднительного положения был найден введением в физику совершенно непривычного, чуждого ей понятия кванта. Вместе с тем, это понятие дало начало новому витку прогресса науки, беспрецедентный вклад в который внесла квантовая механика.
. Уильям Гершель, английский астроном, прославившийся открытием планеты Уран, обнаружив в спектре Солнца невидимые – инфракрасные – лучи, был так поражен, что двадцать лет хранил об этом опыте молчание. А вот в том, что Марс обитаем и населен людьми, он не сомневался.
. профессор Принстонского университета Эрик Роджерс, написавший изданную во многих странах «Физику для любознательных», дал своеобразное «описание» абсолютно чёрного тела: «никакая чёрная краска на собачьей конуре не выглядит чернее открытой для собаки дверцы».
. оказывается так называемые чёрные дыры, которые обладают настолько сильным притяжением, что и частицы света не могут их покинуть, тоже способны излучать. Под воздействием огромного тяготения в окрестностях чёрной дыры рождаются реальные частицы (и фотоны) из вакуума. Английский физик Стивен Хокинг установил, что спектр этого излучения, такой же как у абсолютно чёрного тела.