что такое спинраза болезнь
Спинальная мышечная атрофия 1 типа
Может ли донор банка половых клеток оказаться носителем тяжелого генетического заболевания?
У людей, решивших воспользоваться услугами банка половых клеток, обычно возникает множество вопросов и переживаний. Часто пара беспокоится о том, что донор может оказаться носителем серьезных наследственных болезней. Например, многие слышали, что есть такая тяжелая болезнь, как спинальная мышечная атрофия. Поговорим о том, что это за патология, и как в Репробанке выявляют кандидатов в доноры, являющихся ее носителями.
Спинальная мышечная атрофиия 1 типа, или младенческая форма СМА (англ. SMA), или болезнь Верднига-Гоффмана – тяжелое наследственное заболевание, которое проявляется в нарушении работы мышц, дыхания, глотания.
Заболевание развивается из-за дефекта в гене SMN1, который находится в длинном плече пятой хромосомы. В нём возникает делеция – выпадение участка генетического материала, которая приводит к некорректной работе гена и отсутствию выработки белка, отвечающего за поддержание двигательных нейронов, являющихся нервными клетками головного и спинного мозга, отвечающими за управление движением мышц.
Спинальная мышечная атрофия 1 типа наследуется аутосомно-рецессивно. То есть для того, чтобы родился больной ребенок, он должен получить генетический дефект сразу в двух копиях гена SMN 1, расположенных на сестринских хроматидах, пришедших от обоих родителей.
Если это происходит, то в организме не синтезируется белок SMN, необходимый для нормальной работы двигательных нейронов (нервных клеток), из-за чего возникают мышечные расстройства.
Внимательный читатель тут задаст вопрос: коль скоро существует первый тип спинальной мышечной атрофии, то должен быть второй и т. д.? Действительно, всего существует пять типов заболевания. Они различаются по характеру генетических нарушений, времени возникновения и тяжести симптомов. Первый тип самый распространенный и один из самых тяжелых.
Частота носительства дефектных генов оценивается, по разным данным, от 1:38 до 1:70. Иными словами, каждый 38–70-й человек имеет одну дефектную копию гена SMN1, на одной из дочерних хроматид, но сам при этом здоров. Если два таких человека решат завести ребенка, вероятность того, что малыш получит оба дефектных гена и родится больным, составляет 25%. Но, как считается, такая тяжелая патология нередко приводит к прерыванию беременности на ранних сроках, поэтому распространенность заболевания не так высока, как должна бы получиться по расчетам: в реальности она составляет 1 случай на 11 000 новорожденных.
Как проявляется младенческая форма СМА?
Симптомы спинальной мышечной атрофии возникают с рождения либо до 6 месяцев. У таких детей отмечается гипотония – сильное ослабление мышечного тонуса, особенно в ручках и ножках. Из-за поражения нервных клеток их мышцы ослаблены, поэтому у таких малышей не формируются основные навыки: они не могут держать головку, сидеть, ползать, стоять. У них нарушено дыхание и глотание, утеряна способность самостоятельно принимать пищу, и их приходится кормить через зонд. Такие дети нуждаются в специальном уходе с участием команды врачей-специалистов.
При этом когнитивные (познавательные) способности больного ребенка обычно не нарушены.
Для выявления болезни Верднига-Гоффмана проводят электромиографию (регистрацию электрических импульсов в мышцах), биопсию мышц (получают небольшой образец мышечной ткани и исследуют под микроскопом). Самый точный метод диагностики – исследование структуры ДНК (для анализа берут кровь).
Каков прогноз? Существует ли эффективное лечение?
Прогноз при спинальной мышечной атрофии неблагоприятный. Большинство детей, родившихся с этим заболеванием, не доживает до 2 лет. Средняя продолжительность жизни составляет 1 год.
Лечения, направленного на причину заболевания, на данный момент не существует, хотя предпринимаются попытки его создать. Большинство детей получают лишь соответствующий уход и симптоматическую терапию. Симптомы постепенно нарастают, и ребенок погибает, как правило, от дыхательной недостаточности.
В 2016 году американским Управлением по контролю качества лекарственных препаратов и продуктов питания (FDA) был одобрен препарат Спинраза (Spinraza), модифицирующий течение спинальной мышечной атрофии. Дело в том, что помимо гена SMN1, в клетках человека есть ген SMN2, который тоже кодирует белок SNM, но его вырабатывается меньше, и он быстрее разрушается. Спинраза заставляет ген SMN2 работать активнее, в результате чего улучшается состояние больного ребенка и увеличивается продолжительность жизни.
В 2019 году FDA одобрило инновационный препарат для генной терапии спинальной мышечной атрофии – Золгенсма (Zolgensma). Это лекарство – по сути искусственно созданный «вирус», который доставляет рабочую копию гена SMN1 в нервные клетки.
В августе 2019 года состоялась регистрация препарата Спинраза (Spinraza ) в РФ.
Несмотря на эти достижения, до победы над СМА еще далеко, а инновационные препараты стоят очень дорого, и к сожалению, доступны не многим, болеющим СМА детям. Поэтому врачи Репробанка тщательно обследуют кандидатов в доноры половых клеток и информируют пациентов банка о необходимости уточнения их статуса носительства частых аутосомно-рецессивных заболеваний, к которым относится СМА, что позволяет значительно снизить риски рождения детей с генетической патологией.
Какие меры принимаются в Репробанке?
Репробанк тщательно проверяет всех доноров половых клеток:
Пользуясь услугами Репробанка, вы максимально снижаете риски передачи наследственных заболеваний от доноров репродуктивных клеток.
Существуют некоторые причины для остаточного риска рождения ребенка с заболеванием, но они крайне малы:
Все эти ситуации встречаются достаточно редко. Для того чтобы дополнительно снизить риски, мы рекомендуем провести генетический анализ на данную патологию второму родителю.
Зиновьева Юлия Михайловна
Ведёт генетическое обследование доноров Репробанка, осуществляет подбор доноров для пар, имеющих ранее рождённых детей с установленной генетической патологией.
Спинраза и Золгенсма – лекарства за миллионы: работают ли они?
Деньги огромные, а где гарантия, что будет толк? Так ли нужна нам эта «Спинраза»? Препарат одобрен, но как проводились испытания? Отвечаем на эти вполне закономерные вопросы
Еще совсем недавно от спинальной мышечной атрофии (СМА) – редкого генетического нейромышечного расстройства – не было лекарства. У пациентов была надежда лишь на симптоматической лечение, которое, однако, не могло ни восстановить нарушенные функции нервных клеток спинного мозга, ни остановить прогрессивного развития слабости мышц и их атрофии.
И вот в 2016 году в США и Европейском Союзе, а затем и в других странах мира, включая Россию, был зарегистрирован препарат фирмы Biogen «Спинраза», первое в мире лекарство, способное затормозить развитие недуга и улучшить состояние примерно у половины больных СМА.
Более чем в 40 странах препарат получил статус орфанного и оплачивается государством, у нас в стране он не оплачивается из бюджета. И это огромная проблема для пациентов и их семей, ведь стоимость лекарства невероятно высока.
Одна инъекция «Спинразы» обходится в 125 000 долларов, и только в первый год их потребуется 6, а дальше – несколько меньше, но на протяжении всей жизни.
Разумеется, в такой ситуации раздаются голоса скептиков. Деньги огромные, а где гарантия, что будет толк? Так ли нужна нам эта «Спинраза»? Препарат одобрен, но есть ли реальные доказательства, что он работает?
Попробуем ответить на эти вполне закономерные вопросы.
Как работает «Спинраза»?
СМА вызвана мутацией гена SMN1, кодирующего SMN – белок выживаемости моторных нейронов. В результате мутации SMN1 утрачивает свою функцию, и в нужных количествах белок не производится.
Однако у SMN1 имеется своеобразный ген-дублер, SMN2. Он кодирует тот же белок, столь необходимый организму для развития мышц и формирования двигательных функций, и именно благодаря этому люди со СМА выживают. Тем не менее, SMN2 гораздо менее активен, и продукция важнейшего белка остается недостаточной.
Действующее вещество «Спинразы», нусинерсен, говоря научным языком, модулирует альтернативный сплайсинг гена SMN2. А говоря по-простому, в результате воздействия препарата ген SMN2 на определенном этапе формирования превращается в SMN1, который начинает более активное, чем SMN2, производство нужного белка и тем самым тормозит развитие болезни.
Откуда мы знаем, что лекарство эффективно?
Клинические испытания лекарственного средства проводятся в 3 этапа, причем на все более значительных выборках. Их обеспечить несложно, если речь идет о распространенных хронических заболеваниях, например, о гастритах, сахарном диабете, гипертонии.
Но как проверить орфанный препарат? Тысячи участников исследования не рекрутируешь, тем более, что строгие требования к клиническим испытаниям предполагают наличие контрольной группы, которая для сравнения не получает лечения.
Группы должны быть однородны по возрасту, полу и другим параметрам. Все это в случае с редким заболеванием осуществить довольно непросто, и сертифицирующие агентства в интересах пациентов идут навстречу производителям, смягчая требования.
Клинические испытания третьей фазы нусинерсена были проведены на 121 ребенке. В норме такое количество участников считается недостаточным, но управление по надзору за качеством пищевых продуктов и медицинских препаратов США (FDA) в связи с орфанным статусом СМА признало результаты валидными.
Значимость результатов была усилена тем, что участниками исследования стали совсем маленькие пациенты с самым тяжелым, первым типом СМА, называемым также младенческим.
Все участники исследования были младше 7 месяцев, при этом в группе нусинерсена было в два раза больше участников, чем в контрольной группе.
Малышам экспериментальной группы ввели препарат в спинномозговую жидкость, контрольная группа получила подкожный укол без введения препарата.
Исследователи провели предварительный анализ результатов, когда 82 младенцам исполнилось 6 месяцев. Существенные улучшения наблюдались у 41% детей, получивших лекарство (21 из 51), в то время как в группе плацебо их не было.
21 ребенок после введения нусинерсена смог лучше держать голову, переворачиваться, ползать, а один – даже стоять.
Окончательный анализ показал, что существенные моторные улучшения произошли у 51% детей экспериментальной группы (37 из 73). Риск смерти либо необходимости постоянной искусственной вентиляции легких в этой группе был ниже на 47%. Оказалось также, что чем младше был ребенок при начале лечения, тем лучшие результаты он демонстрировал.
Не очень понятна ситуация с побочными эффектами. Дело в том, что они наблюдались в обеих группах, причем в группе плацебо их было даже больше, поэтому неясно, что было связано непосредственно с болезнью или другими причинами, а что с действием препарата. Не исключено, что часть их вызвана достаточно инвазивным способом его введения – интратекально (под оболочки спинного мозга непосредственно в спинномозговую жидкость).
Тем не менее, в качестве возможных побочных явлений были выделены респираторные инфекции и запор. Врачам, применяющим препарат, рекомендуется держать под контролем уровень тромбоцитов в крови (он может упасть), а также состояние почек (не исключен токсический эффект).
50% – много или мало?
При заболевании, ведущем к ранней смерти или тяжелой инвалидности, это очень много, и, безусловно, любой человек, будь то ребенок или взрослый, заслуживает того, чтобы такой шанс ему дали.
Разработчик «Спинразы», компания Биоген, предоставила бесплатное лечение на год для более 700 детей с первым типом СМА – младенческой формой, самой тяжелой. 40 из них – россияне.
Это благородное начинание, но не решение проблемы даже для этих 40 детей, которым необходимо продолжать терапию.
Пациентские организации и родительские сообщества борются за то, чтобы у российских детей и взрослых с разными формами СМА появился регулярный доступ к препарату. Есть надежда на то, что сдвиги произойдут.
30 января спикер Совета Федерации Валентина Матвиенко поручила сенаторам подготовить предложение правительству РФ включить в список орфанных препаратов, приобретаемых за счет федерального бюджета, лекарства для больных СМА. Поскольку «Спинраза» зарегистрирована в России, у нее есть шанс попасть в этот список.
Иначе обстоит дело с «Золгенсмой», которая была одобрена к применению в мае 2019 года, и в России еще не зарегистрирована.
Стоит, однако, сказать несколько слов и о ней.
Однократное введение, космическая цена
Препарат компании AveXis (дочерняя компания фармагиганта Novartis) «Золгенсма» имеет преимущество: он вводится однократно. Правда, стоимость его запредельно высока – 2 125 000 долларов. Запредельно, потому что до появления «Золгенсмы» предел цены на лекарство составлял 850 000 долларов.
В то же время, пожизненное лечение «Спинразой» все равно обойдется в разы дороже, чем однократное введение «Золгенсмы».
Однократность введения объясняется тем, что препарат меняет дефектный ген SMN1 на его функциональную копию при помощи аденоассоциированного вирусного вектора, и, таким образом, налаживается производство белка SMN.
Еще одно преимущество «Золгенсмы» заключается в том, что препарат пересекает гематоэнцефалический барьер, поэтому маленьким детям он вводится внутривенно – это гораздо более простой и мало травмирующий способ доставки, чем интратекальный.
Что касается взрослых и крупных пациентов с разными типами СМА, интратекальный способ изучается, но окончательных результатов пока нет.
Как и в случае со «Спинразой», испытания «Золгенсмы» проходили на маленьких выборках.
В середине апреля 2019 года была завершена третья фаза испытания под названием STR1VE. Значительные улучшения были зафиксированы у 95% младенцев со СМА 1, и в мае 2019 года препарат был одобрен FDA, однако испытания на этом не закончились.
Новые промежуточные данные из исследования SPR1NT подтверждают, что при раннем выявлении заболевания и введении «Золгенсмы» до появления симптомов СМА весьма вероятно нормальное двигательное развитие ребенка.
Новости обнадеживающие. Быть может, через какое-то время СМА перестанет быть жизнеугрожающим и инвалидизирующим заболеванием.
Спинраза (Spinraza)
Владелец регистрационного удостоверения:
Произведено и расфасовано:
Вторичная упаковка и выпускающий контроль качества:
Лекарственная форма
Форма выпуска, упаковка и состав препарата Спинраза
Раствор для интратекального введения прозрачный, бесцветный, свободный от легко обнаруживаемых нерастворенных частиц.
| 1 мл | |
| нусинерсен натрия | 2.53 мг |
| что соответствует содержанию нусинерсена* | 2.4 мг |
* нусинерсен (свободная кислота)
Вспомогательные вещества: натрия дигидрофосфата дигидрат, динатрия гидрофосфат безводный, натрия хлорид, калия хлорид, кальция хлорида дигидрат, магния хлорида гексагидрат, 1М раствор натрия гидроксида, 1М раствор хлористоводородной кислоты, вода д/и.
× дополнительно могут иметь контроль первого вскрытия в виде стикера.
Фармакологическое действие
Нусинерсен увеличивает долю транскриптов матричной РНК (мРНК) с включением экзона 7 гена SMN2, связываясь с интронным сайленсером сплайсинга (intronic splice silencing site- ISS N1), расположенным в интроне 7 предшественника мРНК (rпре-мРНК) гена SMN2. Связываясь с ним, АСО вытесняет факторы сплайсинга, в норме подавляющие его. Вытеснение этих факторов приводит к сохранению экзона 7 в мРНК SMN2. После синтеза мРНК SMN2 может происходить ее трансляция в белок SMN с полной длиной цепи и сохранённой функциональной активностью.
Фармакодинамические эффекты соответствуют биологическим эффектам нусинерсена.
Фармакокинетика
Интратекальные инъекции нусинерсена в спинномозговую жидкость обеспечивают полное распределение нусинерсена по всей спинномозговой жидкости в ткани ЦНС, являющиеся мишенями его терапевтического действия.
Средние минимальные остаточные концентрации нусинерсена в спинномозговой жидкости увеличивались примерно в 1.4-3 раза после многократного введения, достигая равновесного состояния примерно в течение 24 мес. При дополнительных введениях препарата после достижения равновесного состояния дальнейшего накопления в спинномозговой жидкости или в тканях ЦНС не ожидается.
После интратекального введения нусинерсена минимальные остаточные концентрации в плазме крови были относительно низки, по сравнению с остаточными концентрациями в спинномозговой жидкости. Медиана значений Т mаx в плазме крови составляла от 1.7 до 6 ч. Наблюдалось пропорциональное дозе увеличение средних значений С mах и AUC в плазме в пределах изученного диапазона доз. После многократных введений не наблюдалось признаков кумуляции со стороны показателей, отражающих системные уровни в плазме (С mах и AUC).
Нусинерсен характеризуется широким распределением с достижением терапевтических концентраций в тканях спинного мозга, представляющих собой терапевтическую мишень. Кроме того, продемонстрировано наличие нусинерсена в нейронах и прочих клеточных популяциях спинного и головного мозга, а также в периферических тканях, в частности, в скелетных мышцах, печени и в почках.
Нусинерсен медленно метаболизируется под воздействием гидролиза, опосредованного экзонуклеазами (3’ и 5’); он не является субстратом, ингибитором или индуктором ферментов цитохрома Р450.
Применение Нусинерсен (Спинраза) у взрослых пациентов со СМА
Главная » Лекарства и исследования » Применение Нусинерсен (Спинраза) у взрослых пациентов со СМА
В марте 2020 года в научном журнале The Lancet Neurology была опубликована статья «Применение Нусинерсена для лечения взрослых с проксимальной (5q) спинальной мышечной атрофией: наблюдательное, многоцентровое исследование» (авторский коллектив Hagenacker T, et al). В статье представлены результаты независимого исследования реальной практики применения препарата Нусинерсен (торговое наименование – Спинраза) у подростков и взрослых со СМА в 10 клинических центрах Германии.
Описанные результаты наблюдения за эффективностью и безопасностью применения Спинраза показали значительные клинически значимые улучшения моторной функции у взрослых больных СМА, получавших лечение. Эта публикация вносит значительный вклад в понимание значимости терапии у взрослых пациентов, данные о применении терапии у которых ранее были крайне ограничены. На сегодняшний момент – эта публикация содержит результаты наблюдения за самой большой на сегодня когортой взрослых больных со СМА, получавших лечение и вносит значительный вклад в свидетельства, поддерживающие применение терапии Спинраза для взрослых пациентов.
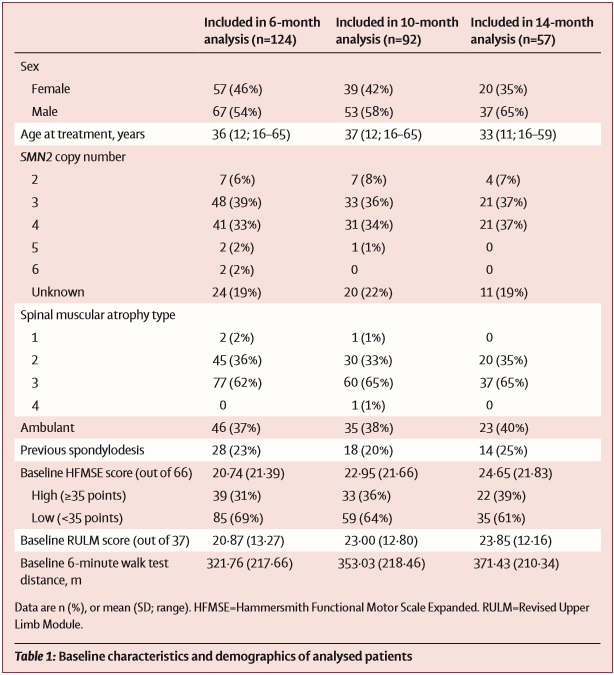
Исследование содержит данные от 124 взрослых больных СМА (в основном, 2 и 3 типов), получавших лечение в 10 нервно-мышечных центрах Германии и основано на оценке двигательных функций с помощью нескольких шкал: Хаммерсмит (HFMSE), RULM и 6-минутного теста ходьбы (6MWT).
Учитывая факт медленного функционального ухудшения состояния у взрослых пациентов со СМА при естественном течение заболевания (без лечения), полученные данные позволяют говорить о том, что лечение взрослых больных со СМА с помощью нусинерсен позволяет достичь значимых клинически улучшений двигательной функции или стабилизации состояния взрослых больных СМА. При этом, не выявлено зависимости и взаимосвязи возраста пациентов и эффективности терапии.
Описание исследования
Несмотря на одобрение применения нусинерсена (Спинраза) для всех групп пациентов, независимо от возраста и типа заболевания большинством регуляторов, однако, данные по эффективности и безопасности применения препарата у взрослых больных со СМА оставались фрагментарными. Единственное ранее опубликованное исследование описывает применение Спинраза у 19 взрослых пациентов со СМА 3 типа и описывает значительное улучшение моторной функции после 300 дней применения нусинерсен.
Исследовательский коллектив поставил целью выяснить безопасность и эффективность применения Спинраза у широкой и разнородной группы взрослых пациентов со СМА. Для этого в наблюдательное исследование были включены 10 нервно-мышечных центров Германии, в которых проходили лечение пациенты от 16 до 65 лет с генетически подтвержденным диагнозом СМА в период с 13 июля 2017 года до 1 мая 2019 года. Все взрослые пациенты, которые получали лечение в этих 10 центрах были включены в исследование. Для оценки результата лечения влючались только пациенты, получавшие лечение в течение, как минимум, 6 месяцев с продолжением наблюдения вплоть до 14 месяцев на терапии.
173 пациента были скринированы для участия в исследовании, из которых 139 (80%) подошли для анализа данных. Из них, 124 пациента (89%) были включены в срез данных 6 месячного интервала получения терапии, 92 пациента (66%) – 10-месячного, и 57 (41%) в 14-месячный анализ. Из анализа были исключены пациенты, для которых отсутствовали данные оценок по шкалам при начале терапии, а также в связи с отказом пациентов от участия (2 человека) и в связи с возникшими побочными реакциями на фоне приема препарата (отказ от продолжения лечения – 2 человека).
Основные результаты:
Основным инструментом оценки была шкала Хаммерсмит (HFMSE), которая состоит из 33 пунктов оценки моторной функции для оценки повседневной активности. По каждому пункту может быть выставлено от 0 до 2 баллов, таким образом, максимальный балл по данной шкале – 66. Уровень в 3 балла по данной шкале считается клинически значимым.
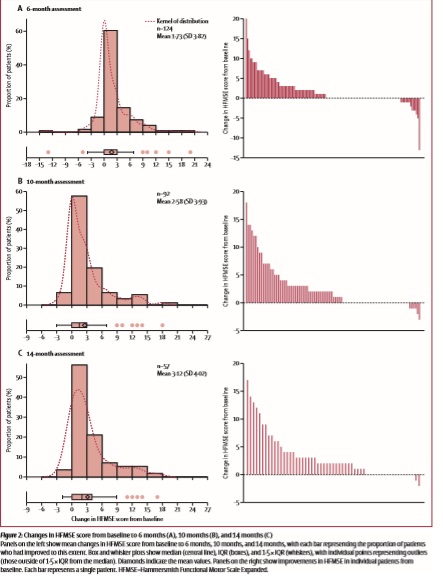
Средние оценки по шкале Хаммерсмит (HFMSE) значительно повысились по сравнению с оценками перед началом терапии, средняя разница в 6-месячный анализ данных составила 1.73 балла, в 10-месячный – 2.58 балла, в 14-месячный – 3.2 балла.
Клинически значимые улучшения моторной функции (по данной шкале служит отметка в более чем 3 балла) наблюдались у 35 (28%) из 124 пациентов через 6 мес после начала лечения, у 33 (35%) из 92 пациентов через 10 мес после начала лечения, и у 23 (40%) из 57 пациентов через 14 мес после начала лечения.
За исключением 2 пациентов, все пациенты, у который отмечались улучшения более чем в 3 балла по HFMSE к 10 мес с начала лечения – сохранили набранные баллы и к 14-месяцам и далее. У 5 пациентов было установлено улучшение в более чем 10 баллов (3 ходящих и 2 неходячих пациентов со СМА 3 типа с 3 или 4 копиями SMN2, возраст пациентов от 48 до 59 лет). 14 пациентов не смогли показать улучшений на терапии, продолжая ухудшаться. При этом, при анализе не было установлено никакой зависимости от улучшений оценки по HFMSE и возрастом пациентов.
Дополнительно оценивалась функция верхних конечностей по шкале RULM, которая включает 20 разделов, максимально возможное количество баллов по этой шкале – 37, при этом уровень в 2 балла по данной шкале считается клинически значимым.
Функция рук также значительно улучшалась по сравнению с состоянием до начала терапии. Так, у 28 (23%) из 120 пациентов через 6 мес после начала лечения отмечено улучшение функции по шкале RULM как минимум на 2 балла (т.е. клинически значимо), в то время как у 74 (61%) пациентов не отмечено улучшений, у 18 (15%) пациентов отмечалось ухудшение на 1 балл или более, а у 10 (8%) пациентов ухудшение составило 2 балла или более. 28 (23%) пациентов сохранили полную функциональность (37 из 37 возможных баллов на протяжении 6 мес после начала лечения. 21 (75%) пациент из 28 сохранили полную функциональность к 14-месячной отметке после начала терапии. При этом, при анализе не было установлено никакой зависимости от улучшений оценки по RULM и возрастом пациентов.
Также производилась оценка (у ходящих пациентов) по 6-минутному тесту ходьбы (измерение дистанции, которую пациент может преодолеть за 6 минут). Значительные улучшения были установлены у пациентов при анализе после 6-ти, 10-ти и 14-ти мес после начала терапии.
Помимо общего анализа был также проведен дополнительный анализ в разных субгруппах пациентов.
Так, при сравнении групп взрослых пациентов со СМА 2 и СМА 3 типов:
— клинически значимые улучшение по шкале HMFSE (более 3 баллов) были установлены:
у 23 (30%) пациентов из 77 после 6 мес. после начала лечения; 18 (32%) из 60 пациентов после 10 мес.; 15 (41%) из 37 пациентов после 14 мес. лечения в группе больных со СМА3 типа.
У 1 (2%) из 45 пациентов после 6 мес. после начала лечения; 2 (7%) из 30 пациентов после 10 мес.; 1 (5%) из 20 пациентов после 14 мес. лечения в группе больных со СМА2 типа.
— клинически значимые улучшения функции рук по шкале RULM были отмечены на всех трех анализируемых интервалах у пациентов со СМА2 типа, а у пациентов со СМА3 типа только после 14-мес периода наблюдения.
При сравнении групп взрослых пациентов из подгруппы неамбулаторных (неходячих) и амбулаторных (ходячих) улучшения были отмечены во всех временных интервалах у обоих групп, при этом более значительные изменения уровня моторной функции наблюдались в группе ходячих по сравнению с неходячими пациентами.
При сравнении между группами пациентов имеющих перед началом терапии высокий балл по HMFSE (более 35) и низкий балл (ниже 35) было отмечено, что улучшения у пациентов с более высокими изначально баллами были значительнее.
При сравнении групп пациентов с неоперированным позвоночником (96 пациентов) и пациентов с металлоконструкцией в позвоночнике(28 пациентов) – не было отмечено значительного различия в улучшениях баллов по HMFSE. Но при этом отмечается, что эффект от лечения нусинерсен у пациентов с металлоконструкцией был несколько ниже, что, вероятно, связано с предшествующей тяжестью состояния и выражается в более низких баллах HMFSE у таких пациентов до начала терапии.
Безопасность
За 14-месячный период наблюдения не было отмечено каких-либо новых, не выявленных ранее побочных эффектов. При этом, у 82 (47%) пациентов отмечались какие-либо побочные реакции. Наиболее частые побочные реакции на лечение: головные боли у 61 (35%) пациентов, боли в спине 38 (22%) пациентов и тошноту у 19 (11%) пациентов, другие встречались более редко.
Выводы исследования:
Данные, полученные в результате этого исследования показывают значительное улучшение двигательной функции у взрослых пациентов со СМА после начала терапии через 6,10 и 14 мес. После начала терапии. Наибольшее улучшение моторной функции коррелирует с меньшей тяжестью состояния пациента до начала терапии.
В целом, пропорция пациетов со значимым улучшением по шкале HMFSE в группе взрослых пациентов со СМА 3 типа, чем в группе СМА2, но не было установлено никакой корреляции между возрастом пациента и уровнем улучшения моторной функции (т.е. не зависит от времени, прошедшего с момента начала заболевания). А также данные указывают, что более высокий результат показывают пациенты с более чем 35 баллами по HMFSE до начала терапии.
Данные естественного течения заболевания свидетельствуют о том, что взрослые со СМА в среднем ежегодно теряют 0,5-1 балл HMFSE. Конечно, с учетом индивидуальных особенностей пациентов, фазы клинических ухудшений сменяются периодами стабилизации, поэтому эта оценка потери функции – усредненная. Тем не менее, учитывая эти факты, результаты полученные в данном исследовании, подтверждают значительный эффект от терапии нусинерсен у взрослых пациентов.
В части безопасности, не было выявлено никаких не описанных ранее осложнений. Примерно у пятой части пациентов возникали боль в спине и пост-пункционные головные боли, это количество совпадает с общим процентом осложнений при проведении люмбальной пункции (8-25%) в целом.
В исследовании не оценивалось влияние терапии на функцию глотания и дыхания, это потребует дополнительных исследований в будущем. Также дополнительных исследований потребует получение данных наблюдения за долгосрочной эффективностью применением нусинерсен, а также индивидуальых схем применения нусинерсен с учетом режима дозирования и перерывов в лечении.
Данный материал носит исключительно информационный характер и не может служить рекламой препарата. Рекомендации относительно индивидуального применения лекарственного препарата следует получать у вашего лечащего врача.
Источник: The Lancet