что такое спайк белок коронавируса
Спайк-белок коронавируса сам по себе вызвал нарушения свертываемости крови
Lize M. Grobbelaar et al. / medRxiv, 2021
Биологи провели микроскопические исследования образцов крови здоровых людей с добавленным спайковым белком коронавируса и без него, а также пациентов, больных ковидом. Исследователи заметили, что добавление в кровь свободного S-белка вызывало формирование амилоидных сгустков и изменения формы клеток крови. Кроме того, ученые смоделировали ток плазмы в сосудах и экспериментально показали, что у пациентов с ковидом он может быть сильно затруднен. Препринт статьи опубликован на портале medRxiv.
Вызываемую SARS-Cov-2 инфекцию можно охарактеризовать беспрецедентными для других респираторных инфекций патологиями. Среди них – нарушения свертываемости крови (коагулопатии), которые могут приводить либо к кровотечениям, либо тромбозам. Связывание спайкового S-белка с рецепторами в момент проникновения вируса в клетку может вызывать клеточные патологии, но само по себе не может объяснить такую распространенность коагулопатии у пациентов. Однако S-белок путешествует в организме и сам по себе отдельно от вируса, высвобождаясь из инфицированных клеток: его, например, находили в мочеиспускательном канале. Частицы этого белка также могут проникать сквозь гематоэнцефалический барьер.
Ученые из Университета Стелленбоша под руководством Итерезии Преториус (Etheresia Pretorius) изучили способность частиц S-белка взаимодействовать напрямую с тромбоцитами и белком фибриногеном, вызывая в нем изменения и, как следствие, нарушения свертываемости крови. Сначала исследователи при помощи флуоресцентной микроскопии проверили, накапливаются ли аномальные амилоидные комплексы в плазме здоровых людей с добавлением частиц S-белка и без них. В образцы с добавлением одного нанограмма на миллилитр S-белка добавляли тромбин (активатор коагуляции) и делали микрофотографии. В тех образцах, куда попал вирусный белок, формировались более плотные фибриновые сгустки. В образцах цельной крови спайковый белок вируса вызывал гиперактивацию тромбоцитов.
Плазма здоровых людей без добавления спайк-белка (А) и с ним (В). После добавления тромбина в образцах с S-белком формируются более плотные сгустки.
В Китае заявили об открытии антитела против всех штаммов SARS-CoV-2
При анализе антител к коронавирусу SARS-CoV-2, которые вырабатывались в людях, тяжело переболевших COVID-19, китайские молекулярные биологи обнаружили универсальное антитело 35B5, которое эффективно действует против всех штаммов этого коронавируса.
Информация об этом открытии была опубликована в электронной библиотеке bioRxiv. На публикацию обратило внимание агентство ТАСС.
«Полученные нами снимки показали, что молекула 35B5 связывается с той частью S-белка коронавируса, которая фактически не меняется по мере эволюции SARS-CoV-2. Это позволяет использовать данный участок не только для создания антител, но и разработки универсальной вакцины от всех штаммов коронавируса», — говорится в публикации.
Антитело 35B5 обнаружили во время масштабного исследования, когда образцы антител брали из организмов тяжело переболевших COVID-19 людей и изучали, какие участки вируса они атакуют.
Опыты показали, что 35B5 с одинаковой эффективностью боролось как с бета-штаммом, так и с дельта-штаммом. Действие антитела уже проверили на мышах: оно защитило всех грызунов от гибели и серьезных повреждений легких. В статье говорится, что антитела других типов, выбранные для эксперимента, не показали такой же эффективности против всех штаммов, их действие ослаблялось после мутации коронавируса.
Снимки, сделанные с помощью электронного микроскопа, показали, что 35B5 соединяется с той частью S-белка коронавируса, которая практически не меняется во всех известных мутациях SARS-CoV-2.
Доцент кафедры инфекционных болезней РУДН Сергей Вознесенский рассказал РБК, что в России в ноябре уже зарегистрирована одна из схем применения препаратов моноклональных антител. В рекомендациях ВОЗ также представлена схема из двух подобных препаратов.
«Но это не вакцины, это средства для лечения больных на ранних этапах. Если в организм человека попадает вирус, прием моноклонального препарата нейтрализующих антител вирусные частицы нейтрализует, они не будут вызывать заболевание», — пояснил он.
Директор Центра Глобальной вирусологической сети Константин Чумаков считает, что «такие лекарства уже существуют с прошлого года, китайцы создали еще одно».
«Они пишут, что, может быть, смогут создать вакцину, которая индуцировала бы у человека такое антитело, но это фантазия. Создавать вакцину, которая бы индуцировала заранее заданное антитело, никто не умеет. Теоретически хорошо бы так сделать, но никто не знает как», — сказал Чумаков РБК.
Он пояснил, что речь идет не о вакцине, а о терапевтическом препарате, который вводится внутривенно. «Просто белок, антитело, иммуноглобулин, которое связывается и убивает вирус. Антител против коронавируса огромное количество, они связываются с разными местами на вирусе. Данное антитело (антитело 35B5. — РБК) связывается с участком связывания с клеточным рецептором. Это важный участок, он является ахиллесовой пятой вируса. Но таких антител известно уже много, тут ничего нового нет, это не революция. Это (выделение антител. — РБК) — столбовое направление в иммунологии. Сенсации нет», — прокомментировал публикацию Чумаков.
Он добавил, что «найти антитело, которое убивает все коронавирусы, не такая большая проблема».
«У всех штаммов коронавируса очень много общего, у них гораздо больше общего, чем разного. Найти такое антитело, которое бы их различало, — вот это было бы сложно. Так что сенсации здесь нет», — сказал Чумаков.
26 ноября Всемирная организация здравоохранения (ВОЗ) присвоила новому штамму коронавируса B.1.1.529, который был выявлен в ЮАР, греческую букву омикрон (O). Эксперты пришли к выводу, что очередная разновидность вируса может угрожать странам, которые и так ведут борьбу с распространением инфекции.
Штамм «омикрон» — не наследник «дельты», которая вызвала новую волну COVID-19 во всем мире. Он развивался по другой линии. Однако количество мутаций, обнаруженных в нем — более 80 по сравнению с исходным вариантом, — отличает его от других вариантов SARS-CoV-2. Причем около 30 мутаций коснулись спайк-белка коронавируса, которым он прикрепляется к здоровой клетке. Именно против этого белка направлено действие большинства вакцин, разработанных против COVID-19.
Ранее об опасности нового штамма предупредил министр здравоохранения ЮАР Джо Фаала. Он заявил, что вариант вируса, который был выявлен 11 ноября, опасен, и сообщил о новых ограничениях при посещении страны.
Что такое спайк белок коронавируса
Количественная оценка антител класса IgG к спайковому (S) белку возбудителя новой коронавирусной инфекции позволяет судить о наличии поствакцинального иммунитета к COVID-19. Можно отслеживать динамику уровня антител и оценить, насколько меняется со временем устойчивость иммунного ответа к COVID-19. «Спутник V» — двухкомпонентная вакцина против COVID-19, содержащая ген S-белка коронавируса, в отношении которого вырабатываются антитела. Оценку поствакцинального иммунитета целесообразно проводить не ранее чем через 21 день после введения второго компонента вакцины.
Коронавирусная инфекция, ковид.
SARS-CoV-2 Spike IgG.
ОЕ/мл (относительная единица на миллилитр), BAU/мл (единиц, связывающих антител, на миллилитр).
Какой биоматериал можно использовать для исследования?
Венозную, капиллярную кровь.
Как правильно подготовиться к исследованию?
Общая информация об исследовании
Данное исследование позволяет определить концентрацию в крови IgG-антител к спайковому (S) белку коронавируса COVID-19.
С момента попадания вируса в организм начинают вырабатываться иммуноглобулины, или антитела, которые распознают и связывают чужеродные антигены. Первыми вырабатываются IgM-антитела, они служат маркером ранней стадии болезни или острого периода. IgG-антитела постепенно вырабатываются через 2-3 недели от начала заболевания и циркулируют в кровеносном русле. После перенесенной инфекции образуются IgG-антитела к нуклеокапсидному белку (N). Антитела к S-белку образуются как после перенесенного заболевания, так и после вакцинации.
Количественное исследование позволяет оценить не только наличие или отсутствие антител к S-белку коронавируса SARS‑CoV‑2, но и также определить их уровень, что дает возможность оценить напряженность иммунитета и динамику роста антител.
Для чего используется исследование?
Когда назначается исследование?
COVID19. Выявлены новые особенности иммунного ответа к коронавирусу
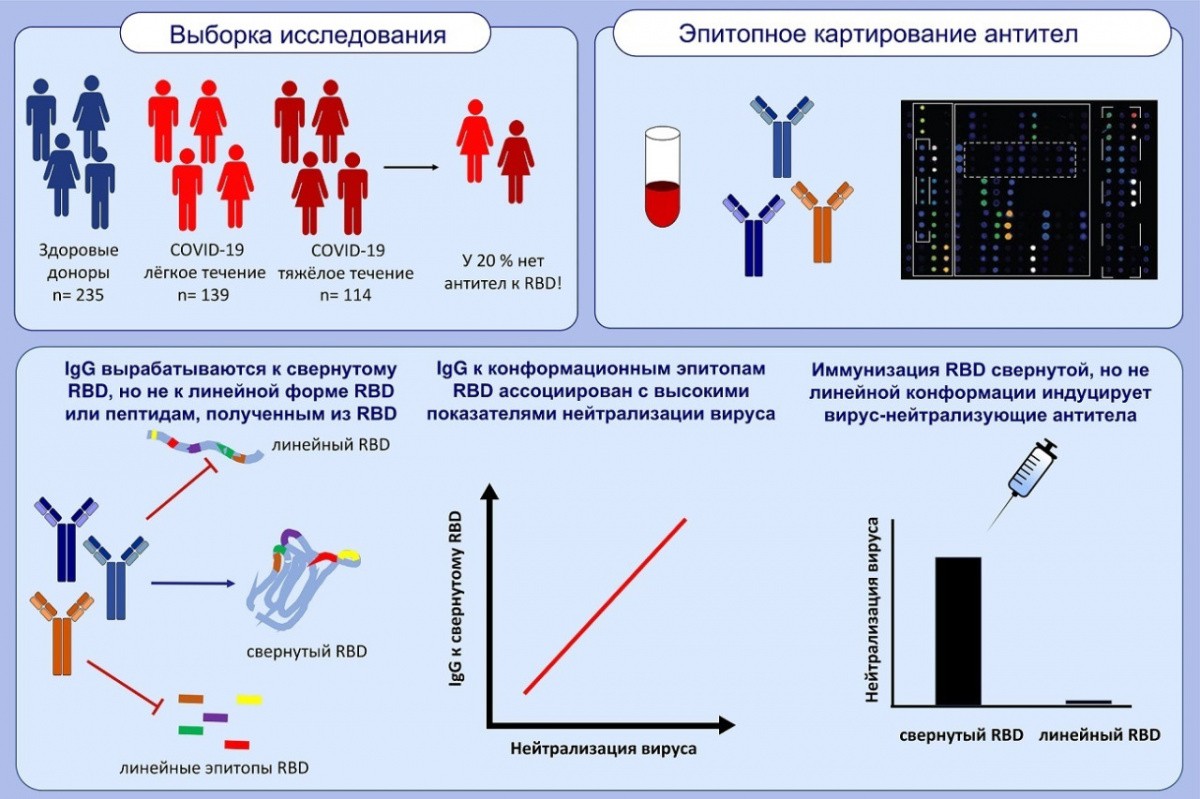
Международная команда ученых-иммунологов, в числе которых ассистент кафедры клинической иммунологии и аллергологии Института клинической медицины имени Н.В. Склифосовского Сеченовского Университета Инна Тулаева, опубликовала данные о свойствах SARS-CoV-2-специфичных антител.
Основной находкой нового ислледования является тот факт, что для успешной нейтрализации вируса необходимы антитела к поверхностному белку правильно свёрнутой конформации.
В исследовании использовалась технология микрочипа, разработанная в Венском медицинском университете, в которой большое количество вирусных антигенов наносится на микроскопический чип с помощью роботизированной установки. Кроме того, перекрывающиеся фрагменты белка (пептиды) этих антигенов были нанесены на чип, покрывая весь «спайк»-белок, на котором расположен рецептор-связывающий домен (RBD). Это участок, с помощью которого коронавирус связывается с рецептором ACE2 клеток человека. Ученые выявили, что антитела перенесших COVID-19 пациентов реагировали только с корректно свернутым белком RBD, что указывает на важность правильной конформации белка для диагностических целей и конструирования вакцин.
Белки приобретают свою трехмерную форму в результате физически индуцированного процесса сворачивания белков. Важнейшее заключение этой работы в том, что белки, использующиеся для диагностики иммунного ответа к коронавирусу, а также для вакцинации, должны находиться в правильной свернутой конформации. Линейные формы белков и пептиды не эффективны в диагностике и конструировании вакцин – этот факт объясняет неуспешность многих проводимых ранее разработок. Также на основании этих данных можно сделать вывод, что люди, которые в достаточной степени вырабатывают антитела против свернутого RBD, защищены от коронавируса.
Напомним, что в прошлом году эта же группа ученых разработала молекулярную тестовую систему на SARS-CoV-2 и исследовала иммунный статус пациентов, выздоровевших после легкого течения COVID-19.
Код вставки на сайт
COVID19. Выявлены новые особенности иммунного ответа к коронавирусу
Международная команда ученых-иммунологов, в числе которых ассистент кафедры клинической иммунологии и аллергологии Института клинической медицины имени Н.В. Склифосовского Сеченовского Университета Инна Тулаева, опубликовала данные о свойствах SARS-CoV-2-специфичных антител.
Основной находкой нового ислледования является тот факт, что для успешной нейтрализации вируса необходимы антитела к поверхностному белку правильно свёрнутой конформации.
В исследовании использовалась технология микрочипа, разработанная в Венском медицинском университете, в которой большое количество вирусных антигенов наносится на микроскопический чип с помощью роботизированной установки. Кроме того, перекрывающиеся фрагменты белка (пептиды) этих антигенов были нанесены на чип, покрывая весь «спайк»-белок, на котором расположен рецептор-связывающий домен (RBD). Это участок, с помощью которого коронавирус связывается с рецептором ACE2 клеток человека. Ученые выявили, что антитела перенесших COVID-19 пациентов реагировали только с корректно свернутым белком RBD, что указывает на важность правильной конформации белка для диагностических целей и конструирования вакцин.
Белки приобретают свою трехмерную форму в результате физически индуцированного процесса сворачивания белков. Важнейшее заключение этой работы в том, что белки, использующиеся для диагностики иммунного ответа к коронавирусу, а также для вакцинации, должны находиться в правильной свернутой конформации. Линейные формы белков и пептиды не эффективны в диагностике и конструировании вакцин – этот факт объясняет неуспешность многих проводимых ранее разработок. Также на основании этих данных можно сделать вывод, что люди, которые в достаточной степени вырабатывают антитела против свернутого RBD, защищены от коронавируса.
Напомним, что в прошлом году эта же группа ученых разработала молекулярную тестовую систему на SARS-CoV-2 и исследовала иммунный статус пациентов, выздоровевших после легкого течения COVID-19.
«ЭпиВакКорона»: что мы знаем и чего не знаем
С декабря 2020 года вне рамок клинических испытаний началась вакцинация «ЭпиВакКороной» — препаратом, разработанным предприятием ГНЦ «Вектор» [1], — а в феврале планируется массовая вакцинация [2]. Сообщается, что у препарата 100-процентная иммунологическая эффективность [3]. Что это значит? Независимым экспертам или врачам про эту вакцину известно мало. Научных публикаций нет никаких. Вместо заявленной 100-процентной эффективности мы пока что имеем большую научную непрозрачность.
Итак, по порядку: что мы все-таки знаем? Роспотребнадзор сообщает [4]: «Вакцина представляет собой химически синтезированные пептидные антигены трех фрагментов S-белка вируса SARS-CoV-2, конъюгированные с белком-носителем и адсорбированные на алюминий-содержащем адъюванте».
S-белок — это шиповидный белок, он же спайк (spike-protein; в разных текстах его называют по-разному). Пептид — это фрагмент белка. В существующем патенте [5] описано семь пептидов шиповидного белка и несколько возможных белков-носителей. В интервью для СМИ разработчики сообщают, что в качестве носителя в вакцинной разработке используется вирусный нуклеокапсидный белок, продукт экспрессии в кишечной палочке [6]. Полный список пептидов шиповидного белка, их координаты, а также названия доменов и субъединиц, в которых они находятся, приведен в таблице ниже.
Пептиды шиповидного белка, представленные в патенте [5]
| ID | Координаты в белке | Аминокислотная последовательность | Домен | Название домена | Субъединица |
|---|---|---|---|---|---|
| NO: 1 | 34–53 | RGVYYPDKVFRSSVLHSTQD | NTD | N-концевой | S1 |
| NO: 2 | 166–187 | CTFEYVSQPFLMDLEGKQGNFK | NTD | ||
| NO: 3 | 403–428 | RGDEVRQIAPGQTGKIADYNYKLPDD | RBD | Рецептор, связывающий домен | |
| NO: 4 | 454–477 | RLFRKSNLKPFERDISTEIYQAGS | RBD | ||
| NO: 5 | 626–644 | DQLTPTWRVYSTGSNVFQTR | SD1 | Субдомен 1 | |
| NO: 6 | 1189–1209 | KNLNESLIDLQELGKYEQYIK | HR2 | Гепта-повтор 2 | S2 |
| NO: 7 | 1179–1209 | KEIDRLNEVAKNLNESLIDLQELGKYEQYIK | HR2 | Гепта-повтор 2 |
Какие три пептида из списка вошли в разработку «ЭпиВакКороны», неизвестно. Как сообщают РИА Новости, цитируя разработчиков, «вакцинные пептиды содержат прежде всего В-клеточные эпитопы, основным источником Т-клеточных эпитопов служит нуклеокапсидный белок» [6].
Что это значит? Попробуем разобраться. Прежде всего стоит объяснить, что эпитоп (он же антигенная детерминанта) — это часть макромолекулы (в нашем случае — вирусного белка или белка из вакцинного материала), которая распознаётся иммунными клетками. То есть это как раз то, что видит иммунная система, и то, что ей помогает понять, какие «приметы» можно различить у «чужеродного агента» (вируса). Не все части макромолекулы «видны» иммунной системе — к каким-то частям макромолекул она «слепа». С этим связана трудность создания пептидных вакцин: пептиды, используемые в качестве антигенных детерминант, не должны располагаться в областях вирусного белка, невидимых иммунному надзору.

Рис. 1. Схема вирусной частицы и вирусных антигенов, которые находятся в «ЭпиВакКороне». В образе трех драконов представлен тример шиповидного белка; только этот белок торчит наружу из вирусной частицы в такой степени, что с ним могут взаимодействовать антитела, которые «цепляют» вирус. Все остальные белки находятся или внутри, полностью под липидной оболочкой вириона, или частично интегрированы в нее. Антитела на эти, другие белки все-таки образуются у переболевших ковидом, но не обладают защитными функциями
Вирус SARS-CoV-2 устроен так, что нейтрализовать его могут только антитела к шиповидному белку. Антитела к нуклеокапсидному белку этого сделать не могут: этот белок находится внутри вирусной частицы, и антитела не могут с ним провзаимодействовать [7]; следовательно, он недоступен для антител в интактном вирусе. Тем не менее нуклеокапсидный белок в качестве антигена (чужеродного вещества) может помочь иммунному ответу (см. ниже). Рис. 1 схематично показывает состав вакцины «ЭпиВакКорона».
Таким образом, первостепенная задача пептидов шиповидного белка из вакцины «ЭпиВакКорона» — стимулировать выработку антител, способных опознать вирус и не дать ему заразить клетку; то есть в пептидах должны находиться видимые для иммунной системы «приметы врага» (вируса) — вирусные антигенные детерминанты. Другие разработчики вакцин решают эту проблему, используя полноразмерный шиповидный белок как антиген: в нем гораздо больше антигенных детерминант [8].
Многочисленные экспериментальные работы [9, 10, 11, 12] показывают, что только небольшая часть пептидов из вирусного шиповидного белка «видна» иммунной системе человека и может вызывать образование нейтрализующих антител. Эти области белка тщательно откартированы.
В интервью СМИ разработчики сообщают, что пептиды «ЭпиВакКороны» содержат В-клеточные эпитопы [6, 13]. Однако вышеописанные работы показывают, что шесть пептидов, описанных в патенте, расположены во фрагментах шиповидного белка, которые практически невидимы для иммунной системы человека, не могут являться В-клеточными эпитопами и не могут провоцировать производство нейтрализующих антител.
Поэтому к разработчикам вакцины возникают следующие вопросы: у какого процента людей каждый конкретный пептид из вакцины «Вектора» вызывает производство не просто антител, а именно нейтрализующих антител? У какого процента волонтеров, участников первой и второй фаз испытаний, возникают нейтрализующие антитела к каждому конкретному пептиду или хотя бы к одному из набора? Все ли пептиды из трех способны провоцировать выработку нейтрализующих антител? Проводились ли такие исследования по индивидуальным пептидам у людей, а не у кроликов? Нет ли среди трех пептидов, выбранных для производства вакцины, таких, которые представляют собой балласт и не работают ни у одного человека?
Согласно данным экспериментов, описанным в патенте [5], иммуногенность каждого отдельного пептида проверялась при иммунизации кроликов конъюгатом индивидуального пептида с белком-носителем. Однако в настоящий момент уже показано, что то, что в вирусном шиповидном белке лучше видно иммунной системе кролика [14], почти не видно иммунной системе человека [9, 10, 11, 12].
На вирусные белки в организме человека вырабатывается масса разных антител, однако лишь небольшая их часть способна нейтрализовать вирус. В то же время некоторые ненейтрализующие антитела всё же полезны в борьбе с инфекцией. Есть разные механизмы их вовлечения в процесс элиминации как вирусов, так и зараженных ими клеток из организма. Тем не менее именно способность вакцины вызывать производство нейтрализующих антител часто используется как первый (хотя и грубый) критерий оценки ее эффективности. Поэтому хотелось бы знать, каковы титры антител на шиповидный белок у добровольцев — участников клинических испытаний. Пока что эти участники жалуются на отсутствие или на очень маленький титр выявляемых антител (см. ниже).
Стоит заметить, что у вируса SARS-CoV-2, как и у многих других вирусов, есть способ защиты от антител — он заключается в использовании гликанового щита, т. е. молекул полисахаридов, присоединенных к шиповидному белку. Такое присоединение называется гликозилированием: антителам трудно подобраться к участкам белка с присоединенными полисахаридами — их просто не пускает гликановый щит. Хочется заметить, что три пептида из описанных в патенте попадают в «опасную зону» гликозилирования [15]. Так, в белке гликозилируется 165-я аминокислота, а пептид ID NO: 2 начинается со 166-й аминокислоты — это рядом! Кроме того, в шиповидном белке гликозилируется 1194-я аминокислота, которая находится прямо в середине пептидов ID NO: 6 и ID NO: 7. Иными словами, даже если пептиды ID NO: 2, ID NO: 6, ID NO: 7 и спровоцируют выработку антител, то эти антитела, скорее всего, «упрутся» в гликановый щит, при этом они вряд ли смогут нейтрализовать вирус или причинить ему вред другим путем.
Кроме пептидов шиповидного белка, в «ЭпиВакКорону» входит химера вирусного нуклеокапсидного и бактериального белка, связывающего сахар мальтозу. По замыслу разработчиков такой химерный белок должен провоцировать Т-клеточный ответ. Действительно, из литературы [16] известно, что вирусный нуклеокапсидный белок способен стимулировать образование Т-лимфоцитов, распознающих в нем многие эпитопы.
Разработчики заявляют: «Через 5–6 недель после вакцинации у большей части добровольцев, привитых вакциной. наблюдалась индукция выраженного специфического Т-клеточного иммунного ответа, что было обнаружено при анализе клеток крови добровольцев при стимуляции вирусными антигенами в экспериментах ex vivo». Будем надеяться, что разработчики не ограничатся заявлениями, а опубликуют соответствующие наблюдения.
Теперь посмотрим, что происходит с преклиническими и клиническими исследованиями. Краткая схема, суммирующая информацию о сроках проведения этих исследований, показана на рис. 2.
Увы, тут можно только посетовать: вакцина уже введена в гражданский оборот, а публикаций нет никаких, первая и вторая фазы испытаний не закончены. В настоящее время идет третья фаза испытаний, планируется участие трех тысяч человек. При этом трудно представить, как на такой небольшой выборке можно будет оценить протективность вакцины, а именно разницу в заболеваемости между теми, кто получил прививку, и теми, кто получил плацебо.
Увы, маленький размер группы добровольцев — это только одна из проблем третьей фазы испытаний «ЭпиВакКороны». Есть и другие. Добровольцы — участники испытаний объединились в группу [17] и написали коллективное открытое письмо, адресованное Минздраву, Роспотребнадзору и другим ведомствам [18]. Я цитирую:
«Мы самостоятельно и за свой счет проверяем у себя уровень антител, однако все полученные результаты ниже референсного значения. „Вектор“ утверждает, что определить нужные антитела можно только их тест-системой, но держит ее в тайне. В такой ситуации возникают сомнения в эффективности вакцины у многих участников исследования и у тех, кто уже успел получить вакцину в рамках гражданской вакцинации. 33% от числа документально подтвердивших свое участие в исследовании сдали такие тесты, и у всех получены отрицательные анализы на антитела (против коронавируса)».
На это письмо уже был получен ответ [19], в котором к использованию рекомендуются тест-системы для иммуноферментного выявления антител к белкам коронавируса SARS-CoV-2 [20]. В письме также говорится: «. проведение. клинических исследований в условиях получения рядом вакцинных препаратов разрешения на применение в Российской Федерации в рамках гражданского оборота создает сложную этическую и научную проблему продолжения контролируемых слепых рандомизированных исследований».
С вышеизложенными утверждениями в ответе Роспотребнадзора трудно не согласиться. У «ЭпиВакКороны» на пути к тому, чтобы стать высококачественным препаратом, хорошо защищающим от вирусной инфекции и вызывающим доверие у специалистов, много серьезных препятствий и проблем, требующих нетривиальных решений. Всё же хотелось бы надеяться, что соответствующая вакцинная разработка станет прозрачнее для общественной и научной экспертизы, а разработчикам удастся в ближайшее время не только опубликовать результаты своих наработок, но и найти надежный способ оценки протективной эффективности этой вакцины против COVID-19 у людей.
Благодарность
Автор выражает глубокую благодарность кандидатам биологических наук Елене Кудрявцевой и Алексею Вольфсону за внимательное прочтение текста и конструктивную критику.