что такое слабое основание
Как залить пол без проблем: опасности «слабого» основания
В большинстве случаев Вы рискуете столкнуться с так называемым «слабым» основанием. Таким образом, первое и самое важное — нужно определить, на какое основание будет заливаться пол.
Что такое «слабое» (низкомарочное) основание?
«Слабое» (низкомарочное) основание — основание, эксплуатирующееся в условиях очень низких механических нагрузок. Марка такого основания не превышает М120 (120 кг/см2). Оно сильно подвержено истираемости и легко разрушается под воздействием механических нагрузок.
Что будет, если Вы неправильно выбрали пол для «слабого» основания?
С вероятностью 99% Вы столкнетесь с трещинами.
Если Вы залили высокомарочный пол (свыше М 150) на слабое основание и еще не приступали к укладке финишных покрытий (плитка, ламинат и т. д.), Вы увидите, что наливной пол «вырвал» основание: по всей площади заливки будет наблюдаться трещинообразование.
Худший для Вас вариант, если Вы уже уложили на залитый пол финишное покрытие (например, керамическую плитку). В этом случае пол не просто порвет основание, он разорвет финишное покрытие (в частности, плитку), любое другое покрытие довольно скоро деформируется и придет в негодность.
Таким образом, если Вы неправильно выбрали пол и все треснуло, Вас ждет демонтаж покрытия, затраты на покупку нового пола, в отдельных случаях демонтаж и повторные затраты не только на пол, но и на финишное покрытие (плитка, ламинат и т. д.).
Где можно встретить такое основание?
Зачастую такое основание ждет Вас в новостройках. Технология устройства полов с новостройках успешно применяется с помощью достаточно дешевых материалов: в помещениях организуется засыпка цемента и песка, после чего производится разравнивание и смачивание получившегося состава, поверхность которого в результате обрабатывается бетонозаглаживающей машиной (» вертолетом»), прочность такого основания получается довольно слабой.
Как распознать такое основание?
На первый взгляд Вы увидите гладкую и относительно ровную поверхность (перепады до 1 см). Однако если попытаться проверить прочность данного основания, то Вы убедитесь, что оно легко разрушается под действием незначительных усилий.
Также в качестве основания пола в большинстве квартир служат старые цементно-песчаные стяжки или строительные плиты, которые зачастую имеют не только неровную поверхность, но и низкую марочную прочность.
Как проверить, что основание «слабое»?
Определить прочность основания можно с помощью измерителя прочности бетона. Если такой прибор отсутствует, достаточно взять обычную монету и попытаться процарапать основание. Для этого проведите две черты крест-накрест под углом друг к другу. Если следа нет или осталась ровная четкая черта, то основание достаточно прочное. Если же осталась глубокая борозда с шероховатыми гранями или неглубокий скол, то основание имеет низкую прочность.
 |  |
Выбор пола для заливки на «слабое» основание
После того как Вы проверили прочность основания, нужно правильно подобрать наливной пол и технологию для его заливки.
Тут возможно 2 варианта:
Если основание «слабое» или в случае, если Вы сомневаетесь в его прочности, то выбирайте продукт по двум критериям:
Внимательно читайте инструкцию на упаковке!
Нередко производители наливных полов указывают, что их продукт подходит или рекомендован для «слабых» оснований. Однако, если внимательно прочитать инструкцию по заливке таких полов на упаковке, то Вы увидите, что в большинстве случаев производитель указывает, что основание должно соответствовать требованиям СНиП и иметь марочную прочность свыше М 120-М 150 (12-15 МПа), а это уже не «слабое» основание.
Компания Bergauf одна из немногих, кто разработал для «слабых» оснований специальный продукт — самонивелирующийся наливной пол для слабых (низкомарочных) оснований Boden Nivelir. За счет сбалансированного состава, включающего в себя специализированные добавки, Boden Nivelir позволяет создавать ровную прочную поверхность на любых основаниях, при этом после его заливки Вы можете с уверенностью приступать к укладке любых финишных покрытий.
Boden Nivelir может быть применен как при устройстве новых полов, так и при восстановлении старых оснований в помещениях, неподверженных деформациям.
Состав:
Цементное вяжущее, фракционный песок, минеральные наполнители, модифицирующие полимерные добавки.
Требования к основанию:
Основание дожно иметь прочность на сжатие не менее 8 МПа
Если Вы убедились в том, что у Вас слабое основание, или Вы сомневаетесь и не уверены в его прочности, то не рискуйте дополнительными тратами времени и денег, выбирайте специально предназначенный для таких оснований продукт — Boden Nivelir, с ним Вы на 100% будете уверены в результате.
Кислоты и основания
После прочтения статьи Вы сможете разделять вещества на соли, кислоты и основания. В статье описано, что такое pH раствора, какими общими свойствами обладают кислоты и основания.
В неорганической химии, как правило, под кислотой имеют ввиду кислоту Бренстеда-Лоури, то есть вещества, способные отдать протон. Если имеют ввиду определение кислоты по Льюису, то в тексте такую кислоту называют кислотой Льюиса. Данные правила справедливы для кислот и оснований.
Диссоциация
Свойства кислот и оснований
Основания, как правило, мыльные на ощупь, кислоты, в большинстве своём, имеют кислый вкус.
При реакции основания со многими катионами формируется осадок. При реакции кислоты с анионами, как правило, выделяется газ.
Сильные и слабые кислоты и основания
Сильные кислоты
Примеры сильных кислот: HCl, HBr, HF, HNO3, H2SO4, HClO4
Список сильных кислот
Слабые кислоты
Растворяются в воде только частично, например, HF:
Сильные основания полностью диссоциируют в воде:
К сильным основаниям относятся гидроксиды металлов первой (алкалины, щелочные металы) и второй (алкалинотеррены, щёлочноземельные металлы) группы.
Список сильных оснований
Слабые основания
Список слабых оснований
Реакции кислот и оснований
Сильная кислота и сильное основание
Такая реакция называется нейтрализацией: при количестве реагентов достаточном для полной диссоциации кислоты и основания, результирующий раствор будет нейтральным.
Слабое основание и слабая кислота
Сильное основание и слабая кислота
Основание полностью диссоциирует, кислота диссоциирует частично, результирующий раствор имеет слабые свойства основания:
Сильная кислота и слабое основание
Кислота полностью диссоциирует, основание диссоциирует не полностью:
Диссоциация воды
Способы определения pH
Инструментальный метод
Индикаторы
Вещество, которое изменяет цвет в некотором интервале значений pH в зависимости от кислотности раствора, используя несколько индикаторов можно добиться достаточно точного результата.
Все катионы кроме металлов первой и второй группы имеют кислотные свойства.
Буфферный раствор
Растворы, которые сохраняют уровень pH при добавлении небольшого количества сильной кислоты или сильного основания, в основном состоят из:
Для подготовки буфферного раствора определённой кислотности необходимо смешать слабую кислоту или основание с соответствующей солью, при этом необходимо учесть:
13 лучших примеров слабых оснований и их использование
Конъюгированная кислота слабого основания всегда является слабой кислотой, а сопряженное основание слабой кислоты всегда является слабым основанием.
Как определить слабое основание?
Кроме того, слабые основания имеют более низкую константу диссоциации основания (K b). Она аналогична константе диссоциации кислоты и представляет собой относительную силу основания. По мере того как основания становятся слабее, их значения Kb становятся меньше.
В этой статье мы использовали значения pK b для обозначения основности соединения. Это просто отрицательный десятичный логарифм Kb раствора.
Теперь, когда у вас есть общее представление о значениях pH и K b, давайте рассмотрим некоторые из наиболее распространенных примеров слабого основания и их важность.
13. Гидроксиламин
Формула: NH2OH
Основность (pK b): 8.05
Гидроксиламин также является промежуточным продуктом в процессе биологической нитрификации микробами, например, бактериями. В полупроводниковой промышленности он часто используется для удаления фоторезистов после литографии.
Поскольку гидроксиламин представляет опасность возгорания при воздействии сильного тепла, его потенциальное использование должно быть тщательно оценено. Природа взрывоопасности до сих пор недостаточно хорошо изучена.
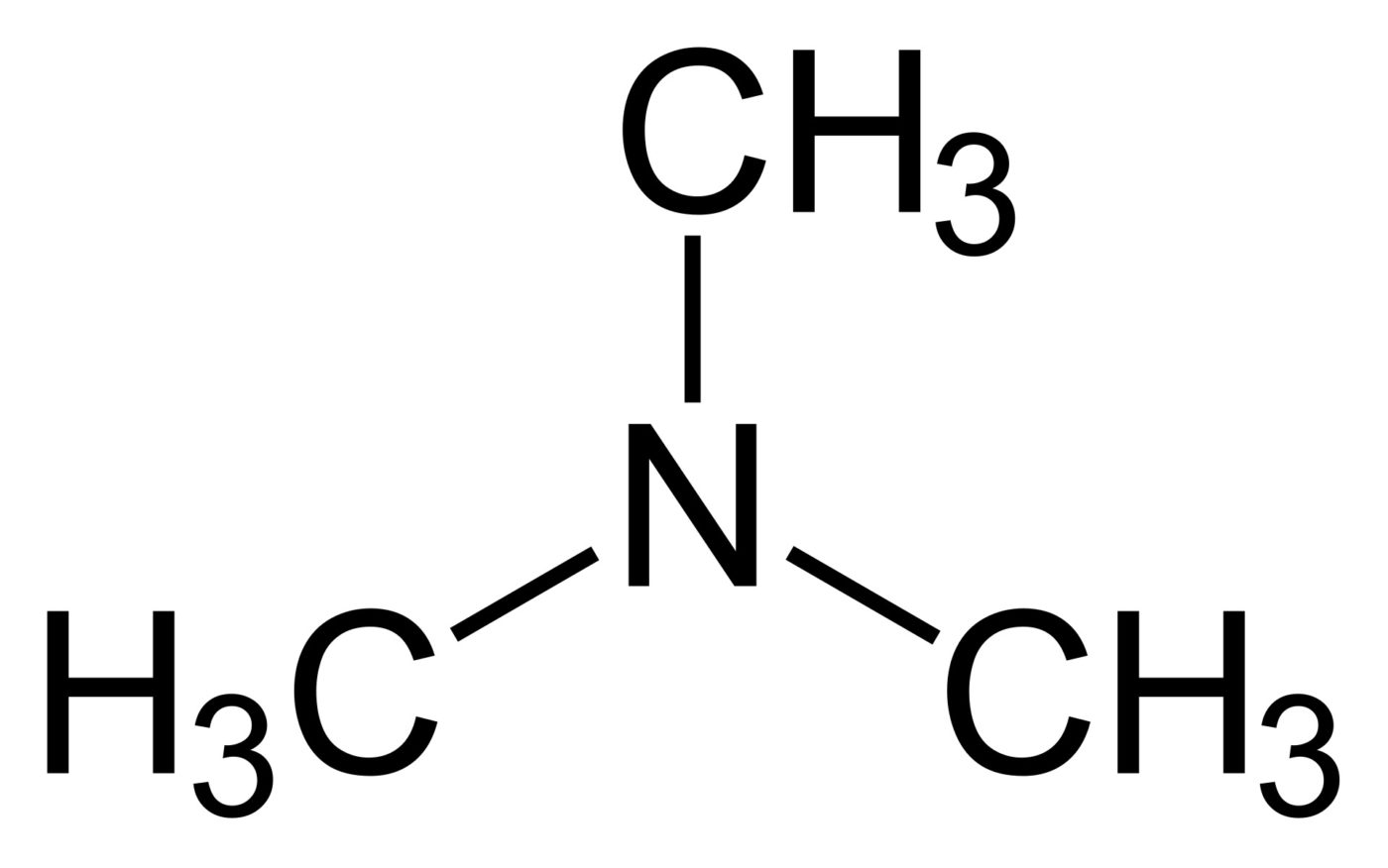
12. Триметиламин
Формула: N(CH3)3
Основность (pK b): 4,20
Триметиламин является газом при комнатной температуре, но хорошо растворяется в воде. Обычно он продается в виде 40% раствора в воде. При более низких концентрациях пахнет гниющей рыбой. При более высоких концентрациях пахнет аммиаком. Кратковременное вдыхание высоких концентраций или длительное вдыхание низких концентраций может вызвать серьезные проблемы со здоровьем.
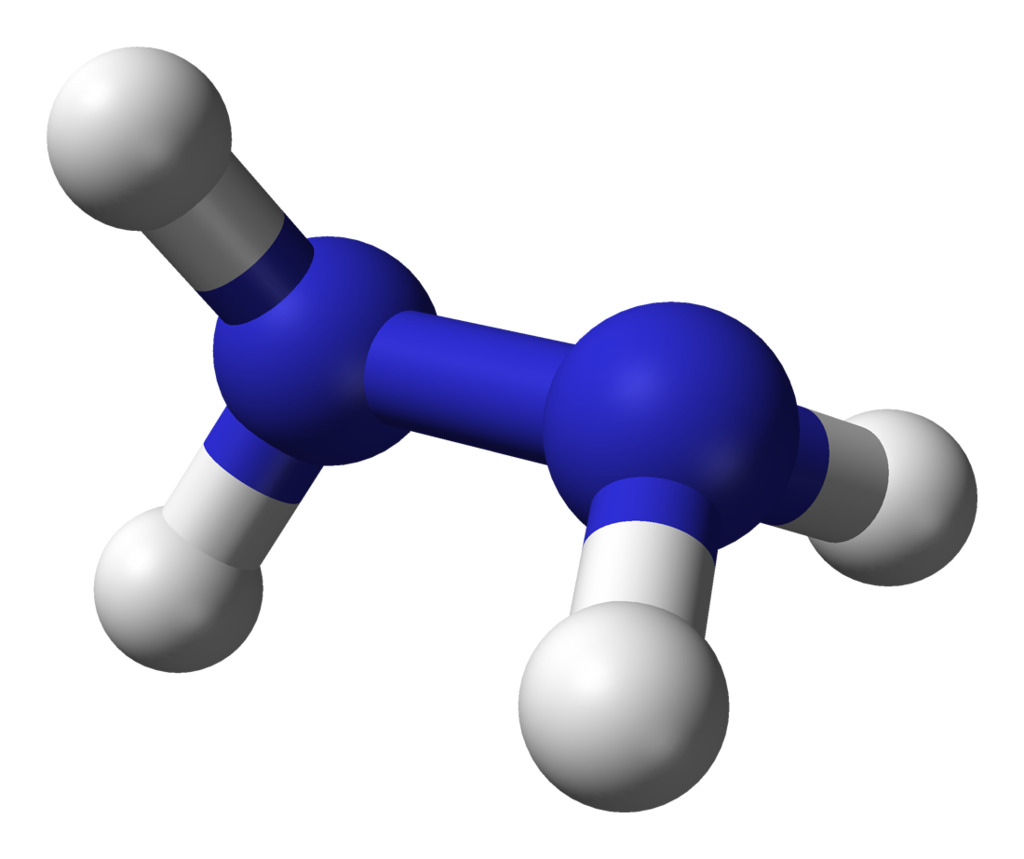
11. Гидразин
Формула: N2H4
Основность (pK b): 8.1
Гидразин представляет собой соединение, содержащее два атома азота с одинарной связью и четыре периферийных атома водорода. Его водный раствор (концентрация более 37%) бесцветен, вызывает коррозию и токсичен при проглатывании и абсорбции через кожу.
Когда гидразин смешивается с водой, он образует более плотный моногидрат (1,032 г/см3), чем безводное вещество.
Как и аммиак, гидразин обладает основными (щелочными) химическими свойствами. Это высокореакционная основа и восстановитель, используемый в широком спектре медицинских и промышленных применений.
Ежегодно во всем мире производится около 100,00 метрических тонн гидразина. В основном он используется как пенообразователь для производства пенопласта.
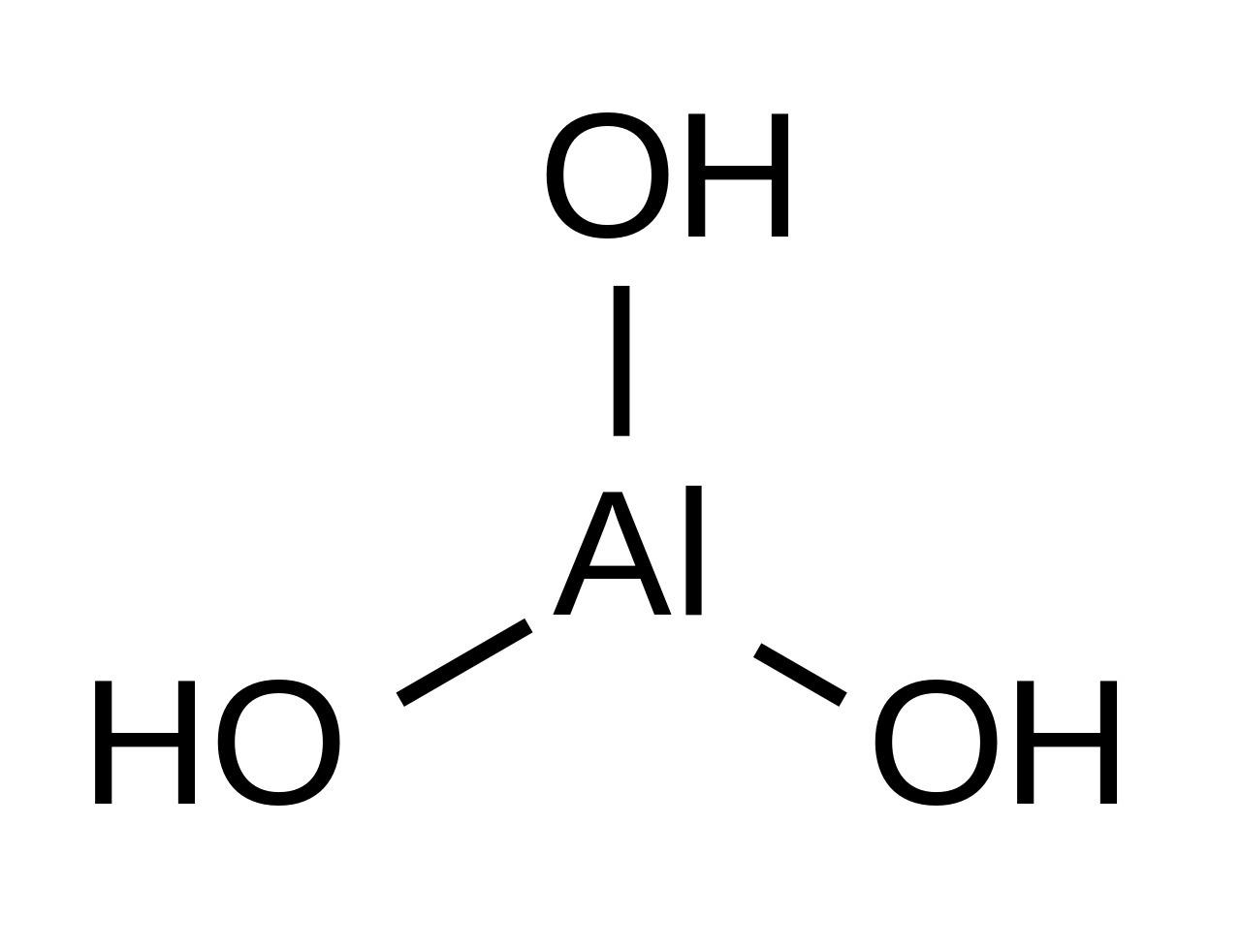
10. Гидроксид алюминия
Формула: Al(OH)3
Основность (pK b): 7,5
В чистом виде гидроксид алюминия представляет собой белые гранулы или порошок плотностью около 2,4 г/мл. Хотя он не растворяется в воде, он быстро растворяется в сильных основаниях и кислотах.
Гидроксид алюминия обладает двумя уникальными свойствами:
Гидроксид алюминия обычно используется в качестве дополнительного ингредиента в антацидных препаратах. Доказано, что он эффективен при лечении изжоги, кислотного расстройства желудка и расстройства желудка. Он также используется в обрабатывающей промышленности и в качестве огнезащитного наполнителя для полимеров.
9. Гидроксид цинка
Формула: Zn(OH)2
Основность (pK b): 8.15
Гидроксид цинка выглядит как белое твердое вещество и имеет плотность 3,05 г / см3. Он встречается в природе в трех редких минералах, а именно ашоверите, сладките и вульфингите. Его также синтезируют в лаборатории путем смешивания раствора гидроксида натрия с раствором любой соли цинка.
Подобно гидроксидам других металлов, таких как хром, олово, бериллий, свинец и алюминий, гидроксид цинка является амфотерным. Это означает, что он может реагировать и как кислота, и как основание. Он легко растворяется в растворе сильного основания (например, гидроксида натрия), а также в растворе сильной кислоты (например, соляной кислоты).
Гидроксид цинка в основном используется в качестве абсорбирующего агента в хирургических повязках. Он также используется в качестве промежуточного продукта при производстве пестицидов и пигментов.
8. Гидрокарбонат натрия
Формула: NaHCO3
Основность (pKb): 3.67
Соединение гидролизуется в воде с образованием катиона натрия и гидроксид-иона. Присутствие гидроксид-ионов делает соединение слегка основным.
Он в основном используется в выпечке как разрыхлитель. При смешивании с водой он действует как антацид, который довольно эффективен при лечении кислотного расстройства желудка и изжоги.
Бикарбонат натрия быстро реагирует с кислотами, образуя углекислый газ. Вот почему он широко используется для нейтрализации разливов кислоты и нежелательных кислотных растворов в химических лабораториях.
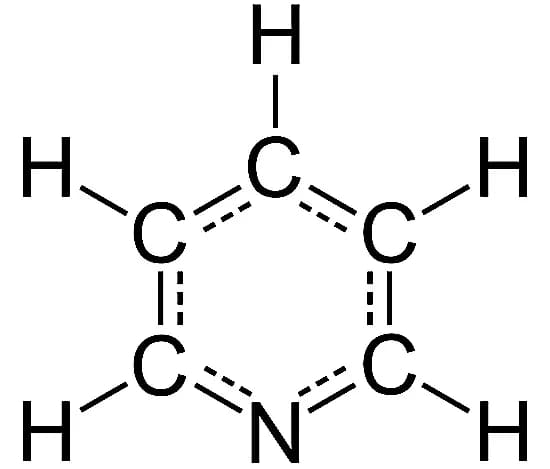
7. Пиридин
Формула: C5H5N
Основность (pKb): 8,75
Структура пиридина очень похожа на структуру бензола, но одна метиновая группа заменена атомом азота. Наличие азота (и его одинокой пары) в бензольном кольце делает пиридин уникальным соединением в химии.
Пиридин является значительно более слабым основанием, чем алкиламины и типичные алифатические третичные амины. Это водорастворимая и легковоспламеняющаяся жидкость с неприятным «рыбоподобным» запахом. Хотя чистый пиридин не имеет цвета, нечистые или старые образцы могут казаться желтыми.
Это основание в основном используется для растворения других соединений и изготовления различных продуктов, включая красители, краски, инсектициды, лекарства, пищевые ароматизаторы, витамины, клеи и резиновые изделия. Оно также содержится во многих природных материалах в окружающей среде.
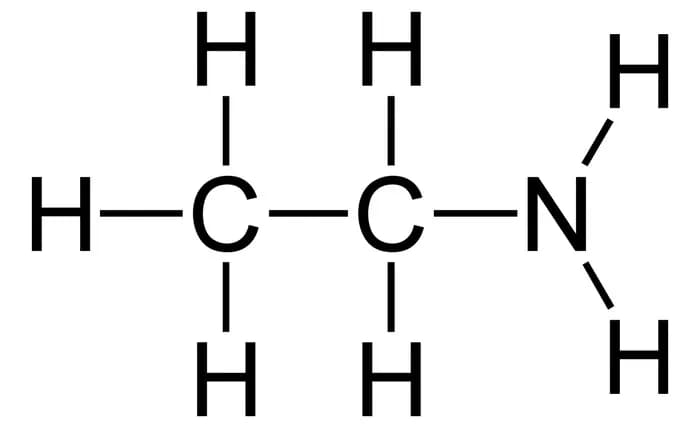
6. Этиламин
Формула: C2H5NH2
Основность (pKb): 3,35
Равновесие устанавливается между неионизированными молекулами этиламина и двумя ионами, которые образуются в результате его ионизации.
Как и другие первичные амины, этиламин является отличным растворителем для металлического лития. Эти растворы используются для восстановления ненасыщенных органических веществ, таких как алкины и нафталины.
Кроме того, этиламин образует токсичные оксиды азота при сгорании. Обычно его хранят в закрытом контейнере; однако длительное воздействие высоких температур может привести к его резкому разрыву.
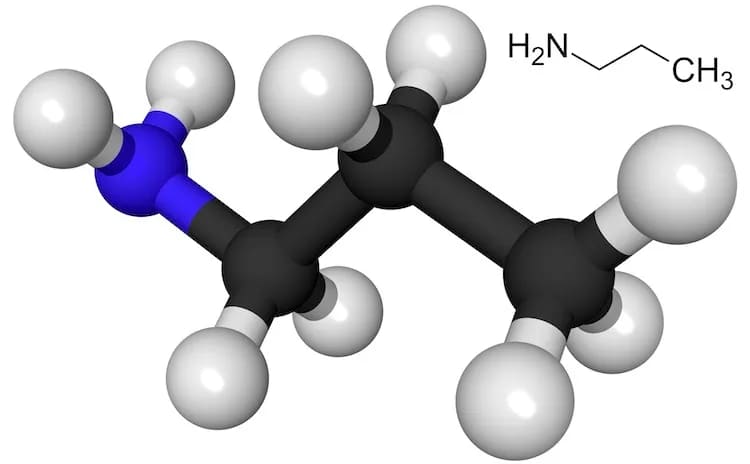
5. Пропиламин
Формула: C3H7NH2
Основность (pKb): 3,45
Пропиламин относится к классу органических соединений, называемых моноалкиламинами. Эти соединения содержат первичную алифатическую аминную группу.
Пропиламин растворим в воде и имеет меньшую плотность, чем вода. Это бесцветная летучая жидкость, а его пары тяжелее воздуха. При сгорании он образует токсичные оксиды азота.
Пропиламин обычно содержится в меньшей концентрации в нескольких различных продуктах питания, таких как зеленый болгарский перец, оранжевый болгарский перец, и в наибольшей концентрации в красном болгарском перце и желтом болгарском перце. Исследователи также обнаружили его в диком сельдерее и обычном винограде.
В лаборатории гидрохлорид пропиламина получают путем смешивания хлорида аммония с 1-пропанолом при высоком давлении и температуре с использованием катализатора кислоты Льюиса, например, хлорида железа.
Пропиламин в основном используется для синтеза и анализа других химических веществ.
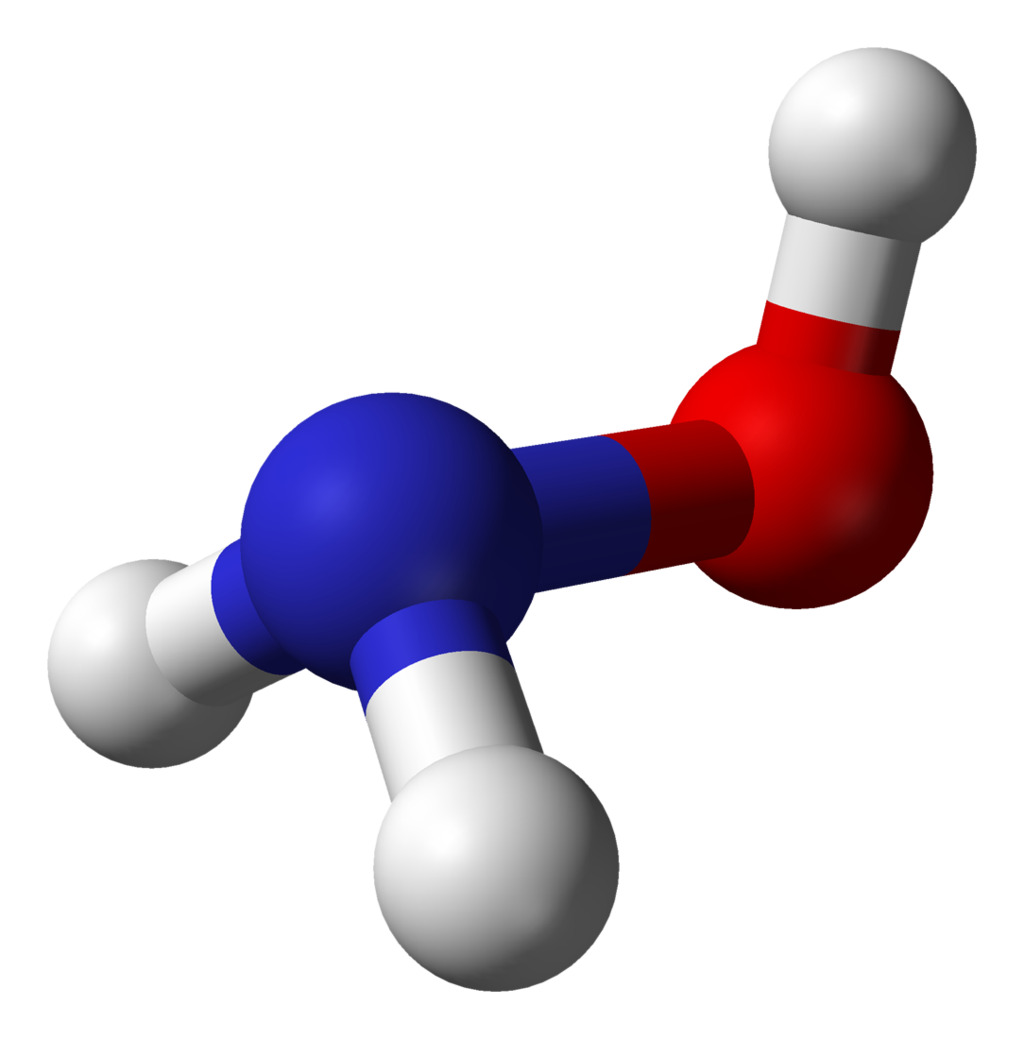
4. Гидроксид аммония
Формула: NH4OH
Основность (pKb): 4,75
Хотя гидроксид аммония является соединением природного происхождения, он также производится человеком по ряду причин. Он изготавливается путем растворения аммиака в воде. Полученная жидкость бесцветна и имеет резкий запах.
Раствор содержит значительное количество воды и аммиака и меньшее количество иона аммония и гидроксид-иона. Поскольку гидроксид аммония не полностью диссоциирован на ионы, он является слабым основанием. Его pH колеблется между 7 и 10.
У этого соединения есть несколько применений. Например, в продуктах питания гидроксид аммония используется в концентрации 0,7%, тогда как бытовые чистящие средства производятся с концентрацией 5-10%. Он также используется в обычном качественном неорганическом анализе в качестве комплексообразователя и основания.
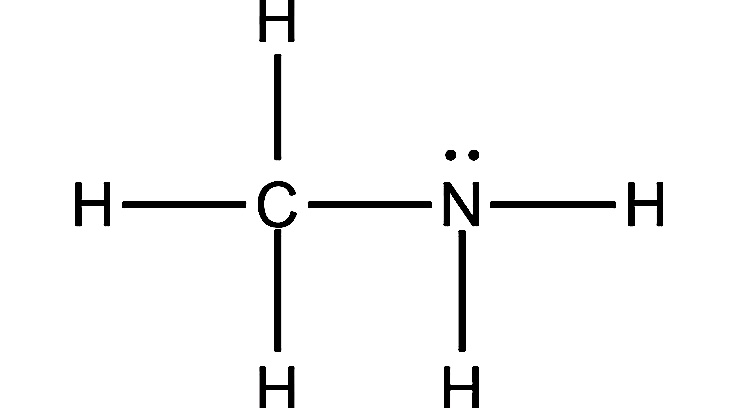
3. Метиламин
Формула: CH3NH2
Основность (pKb): 3,34
Как видно из формулы, основное различие между аммиаком и метиламином заключается в наличии у последнего группы CH3. Поскольку алкильная группа отталкивает электроны от себя, на атоме азота накапливается небольшой отрицательный заряд, что делает его одинокую пару еще более привлекательной для ионов водорода.
А поскольку аммиак не имеет электронодонорной группы, он является более слабым основанием, чем метиламин (в котором азот имеет более отрицательный заряд, поэтому он охотнее принимает H+).
Как и аммиак, метиламин представляет собой бесцветный газ или жидкость с резким запахом. Он может легко загореться. При длительном воздействии высоких температур емкости с метиламином могут разорваться. Поэтому обращаться с ним нужно осторожно.
Метиламин продается в основном в виде раствора в тетрагидрофуране, этаноле, метаноле или в виде безводного газа в контейнерах под давлением. Он широко используется для производства пестицидов, поверхностно-активных веществ, фармацевтических препаратов, растворителей краски и химических веществ для резины.
2. Анилин
Формула: C6H5NH2
Основность (pKb): 9,13
Более конкретно, одинокая пара над атомом азота в группе NH2 находится в сопряжении с электроном Pi бензольного кольца. Поэтому анилин не может легко потерять электронную пару, что делает его слабым основанием.
Он хорошо растворим в спирте и эфире и слабо растворим в воде. При реакции с сильными кислотами он образует ионы анилиния.
Анилин токсичен в природе. Он быстро всасывается в кожу, легкие и желудочно-кишечный тракт подопытных животных. Однако он широко используется для синтеза химических веществ, особенно сельскохозяйственных, фотохимикатов и красителей.
1. Аммиак
Формула: NH3
Основность (pKb): 4,75
Аммиак обладает большой способностью образовывать водородные связи. Когда он растворяется в воде, он получает ионы водорода из воды, образуя ионы аммония и гидроксида.
Эта реакция протекает в обоих направлениях, что означает ее обратимость. В любой момент реакции почти 99% вещества все еще остается в виде молекул аммиака, и только 1% действительно производит гидроксид-ионы. Поскольку лишь небольшая часть аммиака превращается в гидроксид-ионы в растворе, он является слабым основанием.