что такое скорость диффузии
Скорость диффузии
Вы будете перенаправлены на Автор24
Скорость диффузии
Диффузия относится к наиболее простым явлениям, которые изучаются в рамках курса физики. Этот процесс можно представить на бытовом ежедневном уровне.
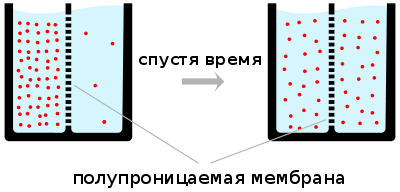
Диффузия представляет собой физический процесс взаимного проникновения атомов и молекул одного вещества между такими же структурными элементами другого вещества. Итогом этого процесса становится выравнивание уровня концентрации в проникающих соединениях. Диффузию или смешивание можно видеть каждое утро на собственной кухне, когда происходит приготовление чая, кофе или иных напитков, в состав которых входит несколько основных компонентов.
Подобный процесс первый раз смог научно описать Адольф Фик в середине 19 века. Он дал ему оригинальное название, которое переводится с латинского языка как взаимодействие или распространение.
Скорость диффузии зависит от нескольких факторов:
В различных газах, где существуют очень большие расстояние между молекулами, скорость диффузии будет самой большой. В жидкостях, где расстояние между молекулами заметно меньше, скорость также уменьшает свои показатели. Самая маленькая скорость диффузии отмечается в твердых телах, поскольку в молекулярных связях наблюдается строгий порядок. Атомы и молекулы сами совершают незначительные колебательные движения на одном месте. Скорость протекания диффузии увеличивается при росте окружающей температуры.
Закон Фика
Скорость диффузии принято измерять количеством вещества, которое переносится за единицу времени. Все взаимодействия должны осуществляться через площадь поперечного сечения раствора.
Основной формулой скорости диффузии является:
Готовые работы на аналогичную тему
Такую формулу представил в виде математического описания Фик.
Согласно ей, скорость диффузии прямо пропорциональна градиенту концентрации и площади, через которую осуществляется процесс диффузии. Коэффициент пропорциональности определяет диффузию вещества.
Известный физик Альберт Эйнштейн вывел уравнения для коэффициента диффузии:
$D=RT/NA \cdot 1/6\pi\etaŋr$, где:
Из этих уравнений следует, что скорость диффузии будет возрастать:
Скорость диффузии уменьшается:
Если молярная масса увеличивается, тогда коэффициент диффузии уменьшается. В этом случае скорость диффузии также уменьшается.
Ускорение диффузии
Существуют различные условия, которые способствуют ускорению протекания диффузии. Быстрота диффузии зависит от агрегатного состояния исследуемого вещества. Большая плотность материала замедляет химическую реакцию. На скорость взаимодействия молекул влияет температурный режим. Количественной характеристикой скорости диффузии является коэффициент. В системе измерений СИ его обозначают в виде латинской большой буквы D. Он измеряется в квадратных сантиметрах или метрах на секунду времени.
Коэффициент диффузии равняется количеству вещества, которое распределяется среди другого вещества через определенную единицу поверхности. Взаимодействие должно осуществляться на протяжении единицы времени. Для эффектного решения задачи необходимо добиться условия, когда разность плотностей на обеих поверхностях будет равна единице.
Также на скорость диффузии в твердых телах, жидкости в газах влияет давление и излучение. Излучение может быть разных видов, в том числе индукционное, а также высокочастотное. Диффузия начинается при воздействии определенного вещества-катализатора. Они часто выступают в роли пускового механизма для возникновения стабильного процесса рассеивания частиц.
При помощи уравнения Аррениуса описывают зависимость коэффициента от температуры. Оно выглядит следующим образом:
Формула позволяет больше понять о характерных чертах всего процесса диффузии и определяет скорость реакции.
Специальные методы диффузии
Сегодня практически нельзя применить обычные методы для определения молекулярного веса белков. Они обычно основаны на измерении:
Для эффективного решения задачи применяются специальные методы, которые разработаны для исследования веществ с высокой молекулярной структурой. Они предполагают определение скорости диффузии или вязкости растворов.
Метод определения ориентации и формы пор по скорости диффузии основан на исследовании скоростей диализа. В мембране должна происходить в этот момент свободная диффузия.
Также для определения скорости диффузии натрия могут применяться различные радиоизотопы. Такой специальный метод применяется для решения поставленных задач в сфере минералогии и геологии.
Активно применяется метод диффузии, который основан на определении диффузии макромолекул в растворе. Он был разработан для полимерных материалов. Согласно методу, идет определение коэффициента диффузии, а затем по этим данным узнают среднемассовую молекулярную массу.
В настоящее время отсутствуют прямые методы определения скорости диффузии водорода в катализаторе. Для этого используется так называемый второй путь активации.
Для определения скорости принято использовать специальные приборы. Они отличаются по виду от поставленных практических и научных задач.
Диффузия
Примером диффузии может служить перемешивание газов (например, распространение запахов) или жидкостей (если в воду капнуть чернил, то жидкость через некоторое время станет равномерно окрашенной). Другой пример связан с твёрдым телом: атомы соприкасающихся металлов перемешиваются на границе соприкосновения. Важную роль диффузия частиц играет в физике плазмы.
Обычно под диффузией понимают процессы, сопровождающиеся переносом материи, однако иногда диффузионными называют также другие процессы переноса: теплопроводность, вязкое трение и т. п.
Скорость протекания диффузии зависит от многих факторов. Так, в случае металлического стержня тепловая диффузия проходит очень быстро. Если же стержень изготовлен из синтетического материала, тепловая диффузия протекает медленно. Диффузия молекул в общем случае протекает ещё медленнее. Например, если кусочек сахара опустить на дно стакана с водой и воду не перемешивать, то пройдёт несколько недель, прежде чем раствор станет однородным. Ещё медленнее происходит диффузия одного твёрдого вещества в другое. Например, если медь покрыть золотом, то будет происходить диффузия золота в медь, но при нормальных условиях (комнатная температура и атмосферное давление) золотосодержащий слой достигнет толщины в несколько микронов только через несколько тысяч лет.
Количественно описание процессов диффузии было дано немецким физиологом А. Фиком (англ.) в 1855 г.
Содержание
Общее описание
Все виды диффузии подчиняются одинаковым законам. Скорость диффузии пропорциональна площади поперечного сечения образца, а также разности концентраций, температур или зарядов (в случае относительно небольших величин этих параметров). Так, тепло будет в четыре раза быстрее распространяться через стержень диаметром в два сантиметра, чем через стержень диаметром в один сантиметр. Это тепло будет распространяться быстрее, если перепад температур на одном сантиметре будет 10 °C вместо 5 °C. Скорость диффузии пропорциональна также параметру, характеризующему конкретный материал. В случае тепловой диффузии этот параметр называется теплопроводность, в случае потока электрических зарядов — электропроводность. Количество вещества, которое диффундирует в течение определённого времени, и расстояние, проходимое диффундирующим веществом, пропорциональны квадратному корню времени диффузии.
Диффузия представляет собой процесс на молекулярном уровне и определяется случайным характером движения отдельных молекул. Скорость диффузии в связи с этим пропорциональна средней скорости молекул. В случае газов средняя скорость малых молекул больше, а именно она обратно пропорциональна квадратному корню из массы молекулы и растёт с повышением температуры. Диффузионные процессы в твёрдых телах при высоких температурах часто находят практическое применение. Например, в определённых типах электронно-лучевых трубок (ЭЛТ) применяется металлический торий, продиффундировавший через металлический вольфрам при 2000 °C.
Если в смеси газов масса одной молекулы в четыре раза больше другой, то такая молекула передвигается в два раза медленнее по сравнению с её движением в чистом газе. Соответственно, скорость диффузии её также ниже. Эта разница в скорости диффузии лёгких и тяжёлых молекул применяется, чтобы разделять субстанции с различными молекулярными весами. В качестве примера можно привести разделение изотопов. Если газ, содержащий два изотопа, пропускать через пористую мембрану, более лёгкие изотопы проникают через мембрану быстрее, чем тяжёлые. Для лучшего разделения процесс производится в несколько этапов. Этот процесс широко применялся для разделения изотопов урана (отделение 235 U от основной массы 238 U). Поскольку такой способ разделения требует больших энергетических затрат, были развиты другие, более экономичные способы разделения. Например, широко развито применение термодиффузии в газовой среде. Газ, содержащий смесь изотопов, помещается в камеру, в которой поддерживается пространственный перепад (градиент) температур. При этом тяжёлые изотопы со временем концентрируются в холодной области.
Уравнения Фика
С точки зрения термодинамики движущим потенциалом любого выравнивающего процесса является рост энтропии. При постоянных давлении и температуре в роли такого потенциала выступает химический потенциал µ, обуславливающий поддержание потоков вещества. Поток частиц вещества пропорционален при этом градиенту потенциала
В большинстве практических случаев вместо химического потенциала применяется концентрация C. Прямая замена µ на C становится некорректной в случае больших концентраций, так как химический потенциал перестаёт быть связан с концентрацией по логарифмическому закону. Если не рассматривать такие случаи, то вышеприведённую формулу можно заменить на следующую:
которая показывает, что плотность потока вещества J [

Коэффициент диффузии D зависит от температуры. В ряде случаев в широком интервале температур эта зависимость представляет собой уравнение Аррениуса.
Дополнительное поле, наложенное параллельно градиенту химического потенциала, нарушает стационарное состояние. В этом случае диффузионные процессы описываются нелинейным уравнением Фоккера—Планка. Процессы диффузии имеют большое значение в природе:
Геометрическое описание уравнения Фика
Во втором уравнении Фика в левой части стоит скорость изменения концентрации во времени, а в правой части уравнения — вторая частная производная, которая выражает пространственное распределение концентрации, в частности, выпуклость функции распределения температур, проецируемую на ось х.
Диффузия
Из Википедии — свободной энциклопедии
Примером диффузии может служить перемешивание газов (например, распространение запахов) или жидкостей (если в воду капнуть чернил, то жидкость через некоторое время станет равномерно окрашенной). Другой пример связан с твёрдым телом: атомы соприкасающихся металлов перемешиваются на границе соприкосновения.
Скорость протекания диффузии зависит от многих факторов. Так, в случае металлического стержня тепловая диффузия проходит с огромной скоростью. Если же стержень изготовлен из материала с низкой теплопроводностью (например, стекла), тепловая диффузия протекает медленно. Диффузия молекул в общем случае протекает ещё медленнее. Например, если кусочек сахара опустить на дно стакана с водой и воду не перемешивать, то пройдёт несколько недель, прежде чем раствор станет однородным. Ещё медленнее происходит диффузия одного твёрдого вещества в другое. Например, Роберт Бойль показал, что если медь покрыть золотом, то будет происходить диффузия золота в медь. При этом при нормальных условиях (комнатная температура и атмосферное давление) золотосодержащий слой достигнет толщины в несколько микронов только через несколько тысяч лет. [3] Другой пример — систематические исследования диффузии свинца в золото, проведенные Уильямом Робертсом-Остеном и опубликованные в 1896 г. Под грузом за пять лет свинцовый слиток проник в золотой слиток на один миллиметр. [4]
Первое систематическое экспериментальное исследование диффузии было выполнено Томасом Грэмом. Он изучал диффузию в газах, и это явление (Закон Грэма) было описано им в 1831—1833 гг. [5]
Большой вклад в теорию и практику исследования дифузионных процессов внес Я. И. Френкель, предложив и развив в 1926 году идею диффузии локальных дефектов (вакансий и межузельных атомов). [7]
Диффузия – определение, примеры и типы
Определение диффузии
Диффузия – это физический процесс, который относится к чистому перемещению молекул из области высокой концентрации в область с более низкой концентрацией. Материал, который диффундирует, может быть твердым, жидким или газообразным. Точно так же среда, в которой происходит диффузия, также может находиться в одном из трех физических состояний.
Одной из основных характеристик диффузии является движение молекул вдоль градиент концентрации, Хотя это может быть облегчено другими молекулами, в нем напрямую не участвуют молекулы высоких энергий, такие как аденозинтрифосфат (АТФ) или гуанозинтрифосфат (ГТФ).
Скорость диффузии зависит от характера взаимодействия среды и материала. Например, газ очень быстро диффундирует в другой газ. Примером этого является то, как вредный запах газообразного аммиака распространяется в воздухе. Аналогичным образом, если емкость с жидким азотом протекает незначительно, выделяющийся азот быстро диффундирует в атмосферу. Тот же газ будет диффундировать немного медленнее в жидкости, такой как вода, и медленнее в твердом.
Аналогично, две смешиваемые жидкости также будут диффундировать друг в друга, образуя однородную решение, Например, когда вода смешивается с глицерин Со временем две жидкости диффундируют в радиальном направлении друг к другу. Это может даже наблюдаться визуально путем добавления красителей разного цвета к каждой из жидкостей. Однако это же явление не наблюдается, когда смешиваются несмешивающиеся жидкости, такие как бензин и вода. Диффузия происходит медленно и только по небольшой поверхности взаимодействия двух жидкостей.
Примеры диффузии
Диффузия является важной частью многих биологических и химических процессов. В биологических системах диффузия происходит в любой момент, через мембраны в каждом клетка а также через тело.
Например, кислород находится в более высокой концентрации внутри артерий и артериол по сравнению с уровнями кислорода в активно дышащих клетках. Тем временем кровь течет в капилляры в мускул или печень например, существует только один слой клеток, отделяющий этот кислород от гепатоцитов или скелетная мышца волокна. Через процесс пассивной диффузии, без активного участия каких-либо других молекула кислород проходит через капиллярную мембрану и проникает в клетки.
Клетки используют кислород в митохондрии за аэробного дыхания, который генерирует углекислый газ в качестве побочного продукта. Еще раз, когда концентрация этого газа увеличивается внутри клетки, он диффундирует наружу в направлении капилляров, где сила текущей крови удаляет избыток газа из ткань область. Таким образом, капилляры остаются с низкой концентрацией углекислого газа, что позволяет постоянное движение молекулы от клеток.
Этот пример также показывает, что диффузия любого одного материала не зависит от диффузии любых других веществ. Когда кислород движется к тканям из капилляров, углекислый газ попадает в кровоток.
В химических процессах диффузия часто является центральным принципом, определяющим многие реакции. В качестве простого примера, несколько кристаллов сахара в стакане воды будут медленно растворяться со временем. Это происходит из-за чистого движения молекул сахара в водной среде. Даже в крупных промышленных реакциях, когда две жидкости смешиваются вместе, диффузия объединяет реагенты и позволяет реакции протекать гладко. Например, одним из способов синтеза полиэфира является смешивание подходящей органической кислоты и спирта в их жидкой форме. Реакция протекает, когда два реагента диффундируют друг к другу и подвергаются химической реакции с образованием сложных эфиров.
Факторы, влияющие на диффузию
На диффузию влияют температура, площадь взаимодействия, крутизна градиента концентрации и размер частиц. Каждый из этих факторов, независимо и совместно, может изменять скорость и степень распространения.
температура
В любой системе молекулы движутся с определенным количеством кинетической энергии. Обычно это не направлено каким-либо особым образом и может показаться случайным. Когда эти молекулы сталкиваются друг с другом, происходит изменение направления движения, а также изменения импульса и скорости. Например, если блок из сухого льда (двуокись углерода в твердой форме) помещен в коробку, молекулы углекислого газа в центре блока в основном сталкиваются друг с другом и задерживаются в твердой массе. Однако для молекул на периферии быстро движущиеся молекулы в воздухе также влияют на их движение, позволяя им диффундировать в воздух. Это создает градиент концентрации, при котором концентрация углекислого газа постепенно уменьшается по мере удаления от комка сухого льда.
С увеличением температуры кинетическая энергия всех частиц в системе увеличивается. Это увеличивает скорость, с которой растворенное вещество а также растворитель молекулы движутся, и увеличивает столкновения. Это означает, что сухой лед (или даже обычный лед) будет испаряться быстрее в более теплый день просто потому, что каждая молекула движется с большей энергией и с большей вероятностью быстро выйдет за пределы твердого состояния.
Область взаимодействия
Чтобы расширить приведенный выше пример, если блок сухого льда разбивается на несколько частей, площадь, которая взаимодействует с атмосферой, немедленно увеличивается. Количество молекул, которые только сталкиваются с другими частицами углекислого газа в сухом льде, уменьшается. Следовательно, скорость диффузии газа в воздух также увеличивается.
Это свойство можно наблюдать даже лучше, если газ имеет запах или цвет. Например, когда йод сублимируется над горячей плитой, начинают появляться фиолетовые пары и смешиваться с воздухом. Если сублимацию проводят в узком тигле, пары медленно диффундируют к устью контейнера, а затем быстро исчезают. Хотя они ограничены меньшей площадью поверхности внутри тигля, скорость диффузии остается низкой.
Это также видно, когда два жидких реагента смешаны друг с другом. Перемешивание увеличивает площадь взаимодействия между двумя химическими веществами и позволяет этим молекулам быстрее диффундировать друг к другу. Реакция идет к завершению с более высокой скоростью. Аналогичным образом, любое растворенное вещество, которое разбивается на мелкие кусочки и смешивается с растворителем, быстро растворяется, что является еще одним показателем того, что молекулы лучше диффундируют при увеличении площади взаимодействия.
Крутизна градиента концентрации
Поскольку диффузия обусловлена, главным образом, вероятностью того, что молекулы отойдут от области с более высоким насыщением, из этого сразу следует, что когда среда (или растворитель) имеет очень низкую концентрацию растворенного вещества, вероятность диффузии молекулы от центральной области выше. Например, в примере с диффузией газообразного йода, если тигель помещают в другой закрытый контейнер и кристаллы йода нагревают в течение продолжительного периода времени, скорость, с которой фиолетовый газ, по-видимому, «исчезает» в устье тигель уменьшится. Это очевидное замедление связано с тем, что со временем в более крупном контейнере начинает появляться достаточное количество йодного газа, и часть его будет перемещаться «назад» к тиглю. Даже при том, что это случайное ненаправленное движение с большим объемом, оно может создать сценарий, в котором нет чистого движения газа из контейнера.
Размер частицы
При любой данной температуре диффузия частицы меньшего размера будет более быстрой, чем диффузия молекулы большего размера. Это связано как с массой молекулы, так и с площадью ее поверхности. Более тяжелая молекула с большей площадью поверхности будет диффундировать медленно, в то время как более мелкие, более легкие частицы будут диффундировать быстрее. Например, в то время как газообразный кислород будет диффундировать немного быстрее, чем диоксид углерода, оба они будут двигаться быстрее, чем газообразный йод.
Функции диффузии
Диффузия в организме человека необходима для поглощения усваиваемых питательных веществ, газообмена, распространения нервных импульсов, движения гормонов и других метаболитов к их цели. орган и почти для каждого события в эмбриональном развитии.
Типы диффузии
Диффузия может быть простая диффузия и быть облегчен другой молекулой
Простая диффузия
Простая диффузия – это просто движение молекул вдоль градиента их концентрации без непосредственного участия каких-либо других молекул. Это может включать в себя либо распространение материала через среду, либо перенос частицы через мембрану. Все приведенные выше примеры были примерами простой диффузии.
Простая диффузия важна в химических реакциях, во многих физических явлениях и может даже влиять на глобальные погодные условия и геологические события. В большинстве биологических систем диффузия происходит через полупроницаемую мембрану из липидный бислой, Мембрана имеет поры и отверстия для прохождения определенных молекул.
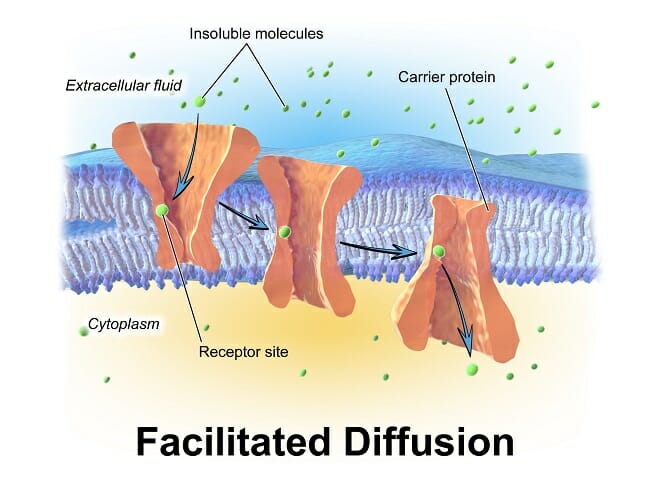
Облегченная диффузия
Поскольку они представляют собой относительно большие отверстия в плазматической мембране, эти интегральные мембранные белки также обладают высокой специфичностью. Например, канальный белок который транспортирует ионы калия, имеет гораздо более высокое сродство к этому иону, чем очень похожий ион натрия, с почти таким же размером и зарядом.
викторина
1. Какое из этих утверждений о диффузии молекул верно?A. Облегченная диффузия полностью обеспечивается гидролизом ГТФB. Никогда не нуждается в присутствии какой-либо другой молекулыC. Диффузия каждой молекулы зависит от градиента ее концентрации и не зависит от концентрации других молекул вид в средеD. Все вышеперечисленное
Ответ на вопрос № 1
С верно. На движение одной молекулы вдоль градиента концентрации не влияют градиенты концентрации любых других веществ в той же среде.
2. Если бы в устье тигля, нагревавшего йод, находилась охлаждающая жидкость, как это повлияло бы на скорость ее диффузии?A. Останется без измененийB. УвеличениеC. УменьшитьD. Это будет зависеть от характера и температуры охлаждающей жидкости
Ответ на вопрос № 2
С верно. Присутствие охлаждающей жидкости в устье тигля понизит температуру газообразного йода. Это уменьшит скорость диффузии.
3. Какое из этих утверждений не соответствует действительности?A. Большие полярные молекулы не могут диффундировать через биологическую мембрануB. Диоксид углерода будет диффундировать быстрее, чем газообразный бромC. Интегральные мембранные белки, которые облегчают диффузию, очень специфичны в отношении своего грузаD. Все вышеперечисленное
Ответ на вопрос № 3
верно. Полярные молекулы могут диффундировать через мембраны, но им необходимо присутствие трансмембранного канала или белка. Углекислый газ легче брома и поэтому быстрее диффундирует.