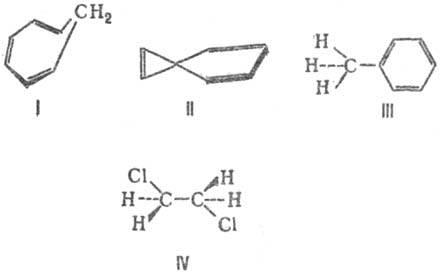
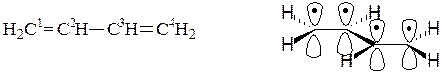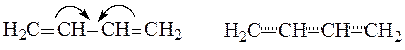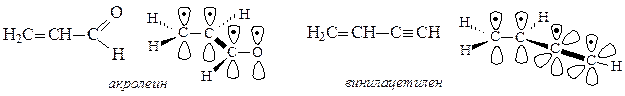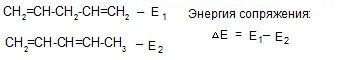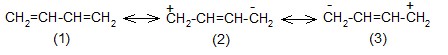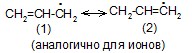что такое система сопряженных связей
СОПРЯЖЕНИЕ СВЯЗЕЙ
В то же время в ароматич. и нек-рых др. системах, к-рые наилучшим образом описываются суперпозицией резонансных структур и где доли локализованных мол. орбиталей имеют большие веса вне связей (напр., в бензоле ок. 13%), сопряжение связей обычно отождествляется с делокализацией связей. Экспериментально наблюдаемые коллективные св-ва таких сопряженных систем в принципе нельзя представить в виде аддитивных ф-ций св-в связей.
Наиб. существенной особенностью сопряженных систем с делокализованными связями является их повыш. термо-динамич. устойчивость. В ароматич. системах теплоты образования значительно выше, чем значения, найденные с учетом аддитивности локальных параметров, а связи характеризуются полной выравненностью длин (см. Ароматичность). Количеств. мера повыш. термодинамич. устойчивости таких систем-энергия резонанса (сопряжения, дело-кализации). В сопряженных системах правилам аддитивности не подчиняются также параметры ЙК спектров, величины дипольных моментов и поляризуемости, диамагнитной восприимчивости и др. В этих случаях при расчете разл. характеристик вводят поправочные члены экзальтации и т.п.
Сопряженные системы с делокализованными связями представляют собой соед. с характсристич. электронными переходами, причем с удлинением цепи сопряжения повышается интенсивность и смещается поглощение в электронных спектрах в сторону больших длин волн (соотв. гипер-хромный эффект и батохромный сдвиг; см. Цветность органических соединений).
Понятие о сопряжении связей используют при рассмотрении реакц. способности. Напр., электроф. присоединение к сопряженным диенам (см. Диеновые углеводороды)приводит к смеси продуктов 1,2- и 1,4-присоединения.
Лит.: Базилевский М. В., Метод молекулярных орбит и реакционная способность органических молекул, М., 1969; Dewar М. I. S., Mc Кее М. L., «J. Amer. Chem. Soc.», 1978, v. 100, № 24, p. 7499-505; Cremer D., «Tetrahedron», 1988, v. 44, № 24, p. 7427-54. М. E. Клецкий.
Сопряженные системы, виды сопряжения



Сопряженными системами называются соединения, в которых есть чередование двойных и ординарных связей. Простейшим примером такой системы является молекула бутадиена-1,3. Из структурной формулы видно, что в молекуле содержатся одна ординарная и две двойные связи углерод-углерод, которые должны иметь длины связей, соответственно, 0,153 нм и 0,132 нм, что характерно для длин ординарной и двойной связей углерод-углерод в алканах и алкенах.
Пространственное строение бутадиена-1,3
Делокализация p-электронной плотности в бутадиене-1,3
В реальной молекуле бутадиена-1,3 нет двойных или ординарных связей, все четыре р-электрона делокализованы по всей системе сопряжения, охватывающей углеродный скелет.
Таким образом, под термином сопряжение понимают делокализацию (перераспределение) p-электронной плотности в молекуле, приводящую к изменению длин связей и увеличению ее устойчивости за счет выделения энергии. Различают два типа сопряжения: p,p- и p,p-сопряжение, которые могут возникать как в циклических, так и ациклических молекулах.
p,p-Сопряжение возникает, если в сопряжении участвуют р-орбитали, образующие p-связи. В рассмотренной выше молекуле бутадиена-1,3 в сопряжении участвовали четыре электрона атомов углерода, расположенные на р-орбиталях, образующих p-связи, таким образом, можно сделать вывод о том, что в этом случае имеет место p,p-сопряжение.
Примеры систем, имеющих p,p-сопряжение
p,p-Сопряжение может быть и в циклических молекулах.
Органическая химия
Информативные ответы на все вопросы курса «Органическая химия» в соответствии с Государственным образовательным стандартом.
Оглавление
Приведённый ознакомительный фрагмент книги Органическая химия предоставлен нашим книжным партнёром — компанией ЛитРес.
3. Сопряженные системы
В простейшем случае сопряженные системы —
это системы с чередующимися двойными и одинарными связями. Они могут быть открытыми и закрытыми. Открытая система имеется в диеновых углеводородах (УВ).
Все атомы С находятся в состоянии sp-гибридиза-ции. Четыре негибридные р-орбитами, перекрываясь между собой, образуют единую электронную систему. Этот вид сопряжения называется p, p-сопряжением.
Происходит сопряжение р-электронов с S-электро-нами. Этот вид сопряжения называется р, р-сопряже-нием. Закрытая система имеется в ароматических УВ.
Сопряжение — процесс энергетически выгодный, энергия (Е) при этом выделяется. Энергия сопряжения бутадиена — 1,3 составляет 15 кДж/моль, энергия сопряжения бензола — 228 кДж/моль.
Это понятие, включающее различные свойства ароматических соединений. Условия ароматичности:
1) плоский замкнутый цикл;
2) все атомы С находятся в sp2-гибридизации;
3) образуется единая сопряженная система всех атомов цикла;
4) выполняется правило Хюккеля: в сопряжении участвуют 4n + 2 р-электронов, где n = 1, 2, 3…
Простейший представитель ароматических углеводородов — бензол. Он соответствует всем четырем условиям ароматичности. Правило Хюккеля: 4n + 2 = 6, n = 1.
Нафталин — ароматическое соединение 4n + 2 = 10, n = 2.
Пиридин — ароматическое гетероциклическое соединение. Взаимное влияние атомов в молекуле
В 1861 г. русский ученый A. M. Бутлеров выдвинул положение: «Атомы в молекулах взаимно влияют друг на друга». В настоящее время это влияние передается двумя путями: индуктивным и мезомерным эффектами.
Индуктивный эффект — это передача электронного влияния по цепи р-связи. Известно, что связь между атомами с различной электроотрицательностью (ЭО) поляризована, смещена к более электроотрицательному атому. Это приводит к появлению на атомах эффективных (реальных) зарядов (d). Такое электронное смещение называется индуктивным и обозначается буквой «I» и стрелкой «→».
Индуктивный эффект может быть положительным или отрицательным. Если заместитель X притягивает электроны химической связи сильнее, чем атом Н, то он проявляет — I.I (H) = 0. В нашем примере X проявляет — I.
Если заместитель X притягивает электроны связи слабее, чем атом Н, то он проявляет +I. Все алкилы (R = СН3-, C2H5 — и т. д.), Меп+ проявляют +I.
Сопряженные системы. Виды сопряжения
Локализованные и делокализованные связи.
Ковалентная связь может быть локализованной и делокализованной. Локализованной называют связь, электроны которой поделены между двумя ядрами связываемых атомов.
В тех случаях, когда электроны связи поделены более чем между двумя ядрами, говорят о делокализованной связи. Делокализованная связь – это ковалентная связь, молекулярная орбиталь которой охватывает более двух атомов. Важнейшим фактором, определяющим химические свойства молекулы, является распределение в ней электронной плотности. Характер распределения зависит от взаимного влияния атомов.
Сопряжение имеется в молекулах многих органических соединений (алкадиены, ароматические углеводороды, карбоновые кислоты, мочевина и др.). Система сопряжения может быть открытой или замкнутой и содержать не только атомы углерода, но и гетероатомы: Cl, O, N, S и др.( акролеин, акрилонитрил,пиридин)
Открытая система сопряжения
Например, простейшим соединением с открытой системой сопряжения, содержащей только атомы углерода является, например, бутадиен-1,3.







Негибридизованные р – орбитали каждого атома углерода расположены перпендикулярно этой плоскости и параллельно друг другу. Это создаёт условия для их взаимного перекрывания. Перекрывание этих орбиталей происходит не только между атомами С-1 и С-2 и С-3 и С-4, но и частично между атомами С-2 и С-3(рис.5б). При перекрывании четырёх рz-орбиталей происходит образование единого π-электронного облака, т.е. сопряжение двух двойных связей. 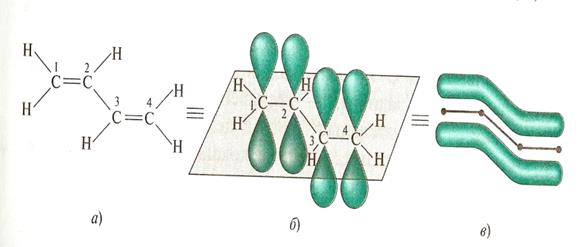
Этот тип сопряжения называется π, π-сопряжением, т. к взаимодействуют орбитали π-связей. Цепь сопряжения может включать большое число двойных связей. Чем она длиннее, тем больше делокализация π-электронов и тем устойчивее молекула. В сопряженной системе π-электроны уже не принадлежат определённым связям, они делокализованы т. е. равномерно распределены по всей молекуле. Делокализация π-электронов в сопряженной системе сопровождается выделением энергии, которая называется энергией сопряжения. Такие молекулы более устойчивы, чем системы с изолированными двойными связями.
Объясняется это тем, что энергия таких молекул ниже. В результате делокализации электронов при образовании сопряженной системы происходит частичное выравнивание длин связей: одинарнаястановится короче,а двойная-длиннее.
Углеводороды с большим числом сопряженных двойных связей распространены в растительном мире. К ним относятся, например, каротины отвечающие за окраску моркови, помидоров, масла и т.д.
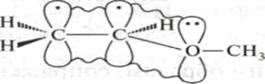
СН2 = СН – :О: – СН3
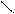
CH2=CH- С = :О:
CH2 = CH–С N:
Это, прежде всего арены и их производные. Первый представитель бензол:
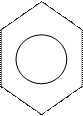 |
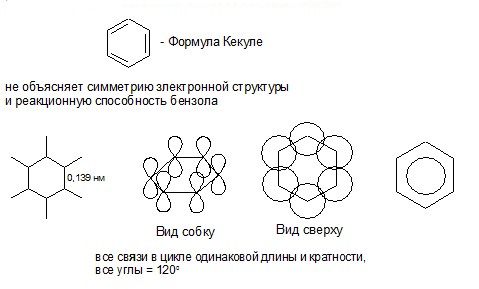
Все σ-связи (С – С и С –Н) лежат в одной плоскости. Шесть негидридизованных р-орбиталей расположены перпендикулярно плоскости молекулы и параллельно друг другу. Каждая р-орбиталь в равной степени может перекрываться с двумя соседними р-орбиталями. В результате такого перекрывания возникает единая делокализованная π-система, наибольшая электронная плотность в которой находится над и под плоскостью σ-скелета и охватывает все атомы углерода цикла. π-Электронная плотность равномерно распределена по всей циклической системе. Все связи между атомами углерода имеют одинаковую длину (0,139 нм), промежуточную между длинами одинарной и двойной связей.
В гетероциклических ароматических соединениях наблюдается оба вида сопряженияπ,π-сопряжение и р,π-сопряжение.
Например
π,π-Сопряжение в гетероциклических ароматических соединениях характерно для шестичленных гетероциклов. Например, в пиридине и пиримидине
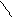

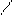
 |  |  |
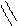 |  |
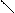
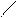

 |  |  |

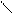
π-Связи в этих соединениях делокализованы между С и N атомами.
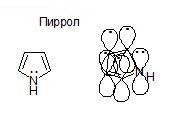
В пятичленных гетероциклических соединениях—пирроле, фуране, тиофене реализуется р,π-сопряжение.
 |  |  |



Пиррол Фуран Тиофен
Ароматичность — это понятие, включающее различные свойства ароматических соединений, ввёл немецкий физик Э. Хюккель (1931).
Особое свойство некоторых химических соединений, благодаря которому сопряженное кольцо ненасыщенных связей проявляет аномально высокую стабильность; большую чем та, которую можно было бы ожидать только при одном сопряжении. Ароматичность не имеет непосредственного отношения к запаху органических соединений, и является понятием, характеризующим совокупность структурных и энергетических свойств некоторых циклических молекул, содержащих систему сопряженных двойных связей. Термин «ароматичность» был предложен потому, что первые представители этого класса веществ обладали приятным запахом. К ароматическим соединениям относят обширную группу молекул и ионов разнообразного строения, которые соответствуют критериям ароматичности.
1. Плоский замкнутый цикл.
2. Все атомы С находятся в sp 2 – гибридизации
3. Подчиняется правилу Хюккеля: содержит в кольце (4n +2) р-электронов, гдеn = 0,1,2,3…
6. Устойчивы к действию окислителей.
7. Обладают термодинамической устойчивостью.
Электронные эффекты
Индуктивный эффект
Молекула органического соединения представляет собой совокупность атомов, связанных в определённом порядке ковалентными связями. При этом связанные атомы могут различаться по величине электроотрицательности (Э.О.).
Электроотрицательность – способность атома притягивать электронную плотность другого атома для осуществления химической связи.
Полярностьковалентной связи – это неравномерное распределение электронной плотности между связанными атомами.
Наличие полярной связи в молекуле сказывается на состоянии соседних связей. Они испытывают влияние полярной связи, и их электронная плотность также смещается в сторону более Э.О. атома, т. е. происходит передача электронного эффекта.
Смещение электронной плотности по цепи σ-связей называется индуктивным эффектом и обозначается I.
Индуктивный эффект передаётся по цепи с затуханием, т. к. при образовании σ-связи выделяется большое количество энергии и она плохо поляризуется и поэтому индуктивный эффект проявляется в большей степени на одну, две связи. Направление смещения электронной плотности всех σ-связей обозначают прямыми стрелками→ ;
Э.О.атома Сl > Э.О. атома С
Э.О. гидроксильной группы ОН > Э.О. атома С
Атом или группа атомов, смещающие электронную плотность σ-связи от атома углерода на себя называются электроноакцепторнымизаместителямии проявляют отрицательный индуктивный эффект (-I-эффект).
Мезомерный эффект. В отличие от несопряженных соединений, в которых электронное влияние заместителей передается по σ-связям (индуктивный эффект), в сопряженных системах в передаче электронного влияния основную роль играют π-электроны делокализованных ковалентных связей. Эффект, проявляющийся в смещении электронной плотности делокализованной (сопряженной) л-системы, называют мезомерным (М-эффект) или эффектом сопряжения.
Мезомерный эффект — передача электронного влияния заместителей по сопряженной системе.
При этом заместитель сам является участником сопряженной системы. Он может вносить в систему сопряжения π-связь (карбонильная, карбоксильная и другие группы), неподеленную пару электронов гетероатома (галогены, амино- и гидроксигруппы), вакантную или заполненную одним или двумя электронами р-АО.
Заместители, повышающие электронную плотность в сопряженной системе, проявляют положительныймезомерный эффект (+М)
+М-эффектом обладают заместители, содержащие атомы с неподеленной парой электронов или целым отрицательным зарядом. Эти заместители способны к передаче пары электронов в общую сопряженную систему, т. е. являются электронодонорными.
Заместители, понижающие электронную плотность в сопряженной системе, проявляют отрицательный мезомерный эффект (-М).
(-М)-эффектом обладают заместители, содержащие двойные связи и положительно заряженные атомы, т. е. электроноакцепторныезаместители.
В приведенных ниже примерах показано проявление —М—эффекта карбонильной группы в акролеине и бензальдегиде (π,π-сопряжение),
а также + М-эффекта аминогруппы в анилине (р,π- сопряжение).
Табл.3 Электронные эффекты заместителей 
Сопряжение. Ароматичность
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
СОПРЯЖЕНИЕ, АРОМАТИЧНОСТЬ
Некоторые свойства органических соединений не могли быть объяснены в рамках классической теории химической связи. Для их объяснения в теоретической химии было выработано понятие сопряжения.
Сопряжение – это образование в молекуле единого делокализованного электронного облака в результате перекрывания негибридизованных р-орбиталей и образования молекулярной орбитали.
π-π – сопряжение: Делокализованная молекулярная орбиталь образуется за счет взаимодействия двух или более двойных связей:
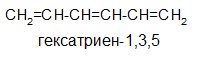
р-π – сопряжение: В сопряжении участвуют соседние с π-связью атомы, имеющие р-орбитали с неподеленной парой электронов:
Энергия сопряжения – это энергия, выделяющаяся в результате сопряжения
– с увеличением цепи сопряжения энергия сопряжения увеличивается.
В результате сопряжения выделяется энергия, внутренняя энергия уменьшается, и молекула становится термодинамически более устойчивой.
Описание сопряженных систем с помощью метода валентных схем
– вклад структур (2) и (3) незначителен из-за уменьшения количества двойных связей и разделения зарядов.
Аллильные частицы – анион, катион, радикал – обладают повышенной устойчивостью в результате следующего сопряжения:
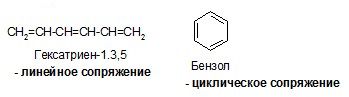
Структуры (1) и (2) идентичны (“вырожденные”), из-за этого энергия сопряжения особенно велика, и аллильные частицы значительно устойчивее, чем соответствующие пропильные. Различаются линейные и циклические сопряженные системы. Циклические сопряженные системы в отличие от линейных имеют замкнутую непрерывную цепь сопряжения, в которой все входящие в неё атомы имеют негибридизованную р-орбиталь.
Ароматичность – это понятие, обозначающее совокупность особых свойств некоторых циклических сопряженных систем.
Ароматические соединения, несмотря на высокую степень ненасыщенности:
1) предпочтительно вступают в реакции замещения, а не присоединения;
2) устойчивы к мягкому окислению.
К ароматическим соединениям относятся, прежде всего, бензол и его производные
ЭЛЕКТРОННОЕ СТРОЕНИЕ МОЛЕКУЛЫ БЕНЗОЛА
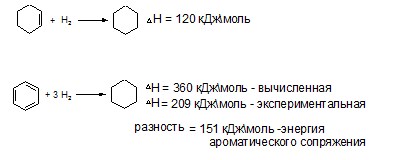
Энергия ароматического сопряжения выше энергии линейного сопряжения:
Признаки ароматичности:
1) Замкнутая цепь сопряжения
2) Правило Хюккеля:
N = 4n + 2, где N – число π- и р-электронов в сопряженной системе; n = 0,1,2,3 …
Ароматическая система – это циклическая сопряженная система, удовлетворяющая правилу Хюккеля.
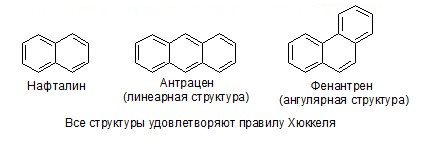
Небензоидные ароматические системы
Ароматические сопряженные системы могут образовываться за счет как π-π – так и р-π-сопряжения, например: