что такое сепарация листков перикарда
Причины и лечение перикардита
Не все случаи перикардита требуют активного медикаментозного вмешательства. В некоторых ситуациях достаточно наблюдения.
Перикард (в переводе с греческого – «вокруг сердца») – двустенная сумка, окружающая сердце и его крупные сосуды.
Перикардиальная жидкость вырабатывается внутренним перикардиальным листком. Любое воздействие на перикард сопровождается усилением продукции жидкости, которая не успевает эвакуироваться из полости и накапливается в ней, что также является проявлением перикардита.
Функция перикарда и перикардиальной полости велика.
Болезни перикарда (перикардиты) встречаются не только в практике кардиолога. С симптомами перикардитов могут столкнуться врачи любых специальностей, поскольку чаще всего поражение листков перикарда является симптомом и даже осложнением других заболеваний.
Мужчины до 65 лет больше женщин подвержены развитию перикардитов.
Основные причины перикардитов можно разделить на 2 большие группы: инфекционные и неинфекционные.
Воздействие специфических агентов зачастую могут спровоцировать чрезмерную выработку перикардиальной жидкости и её избыточное накопление в полости перикарда с различной скоростью. Чем интенсивнее и быстрее происходит увеличение объёма жидкости, тем быстрее развивается ситуация, которая может быть опасна для жизни.
Инфекционные перикардиты могут быть спровоцированы любым вирусным или бактериальным агентом, паразитами или грибками.
Неинфекционные (так называемые «асептические») перикардиты могут развиваться на фоне ревматических и онкологических заболеваний, при хронической почечной и сердечной недостаточности, при гипотиреозе, после лучевой терапии и воздействия радиации, после перенесённого инфаркта миокарда и после открытых операций на сердце, при травмах рядом расположенных органов, при приёме определённых лекарственных средств (особенно, противоопухолевых).
Перикардиты могут быть острыми, хроническими и рецидивирующими, в зависимости от сроков развития и длительности сохранения симптоматики. Отдельная группа заболеваний перикарда – экссудативный перикардит (он же отёчный, выпотной), который характеризуется чрезмерным накоплением жидкости между листками перикарда.
Симптомы перикардита также можно разделить на 2 группы: симптомы основного заболевания и симптомы поражения перикарда.
В зависимости от специфической причины, спровоцировавшей развитие перикардита, симптомы основного заболевания могут варьироваться: от признаков вирусного и бактериального воспаления до эндокринологического дефицита при патологии щитовидной железы.
Всегда нужно выяснять возможную причину перикардита, поскольку симптоматическая терапия оказывает лишь временный эффект, а добиться полного разрешения заболевания можно только, воздействуя на его причину.
Симптомы поражения листков перикарда могут быть следующими.
Как распознать перикардит?
В стандарт обследования пациентов при подозрении на перикардит входят следующие методы диагностики:
Как лечить перикардит?
Не все случаи перикардита требуют активного медикаментозного вмешательства. В некоторых ситуациях достаточно наблюдения. Если же речь идёт о тяжелых острых клинических проявлениях, сопровождающихся системной воспалительной реакцией, выраженным накоплением жидкости в перикардиальной полости, недостаточной эффективностью от приёма противовоспалительных средств и некоторыми другими неблагоприятными признаками, то в таких ситуациях может потребоваться госпитализация.
Как мы уже обсуждали выше, в таких случаях следует искать причину и воздействовать на неё.
Помимо причинно-связанной терапии, используется неспецифическая терапия, эффективная в большинстве случаев перикардитов.
Если речь идёт о наличии большого количества жидкости в перикардиальной полости, то может потребоваться пункция перикарда для её эвакуации. Если же количество жидкости небольшое, то ограничиваются активным наблюдением и лечением основного заболевания.
Иногда в исходе перикардита, особенно при повторяющихся эпизодах воспаления и отсутствии лечения, может происходить «слипание» листков перикарда и их утолщение с формированием так называемого «панцирного сердца». Это тяжелейшая патология с развитием выраженной сердечной недостаточности. Единственным эффективным способом лечения в таком случае является только хирургическое удаление перикарда.
Будьте внимательны к своему сердцу! Берегите его!
Что такое сепарация листков перикарда
а) Клиническая картина. Если у больного, у которого при ЭхоКГ выявлена жидкость в полости перикарда, имеются также клинические симптомы, в частности повышение системного венозного давления, тахикардия, затрудненное учащенное дыхание, олигурия, артериальная гипотензия и парадоксальный пульс, которые трудно объяснить, то следует заподозрить тампонаду сердца. В отличие от остро развившегося кровотечения в полость перикарда, например при травме сердца или разрыве аорты либо коронарной артерии, тампонада сердца при заболеваниях внутренних органов развивается медленно. У больных с тампонадой сердца на рентгенограммах грудной клетки отмечается расширение границ сердца, а АД может быть как нормальным, так и повышенным или пониженным. Чувствительность парадоксального пульса, этого классического признака тампонады сердца, низкая.
Это обусловлено тем, что парадоксальный пульс отсутствует при таких заболеваниях и состояниях, как дисфункция левого желудочка со стойким повышением давления в левом предсердии, региональная тампонада правого предсердия, искусственная вентиляция легких с положительным давлением в конце выдоха, дефект межпредсердной перегородки, обструктивные заболевания легких и тяжелая аортальная недостаточность. Поэтому в клинической практике показания к дренированию полости перикарда зависят от клинической картины, этиологии заболевания и результатов ЭхоКГ.
б) Локализация и эхогенность выпота. Если жидкости в полости перикарда скапливается немного, то она локализуется в заднем и заднебоковом ее отделе, но по мере увеличения ее объема она занимает все пространство вокруг сердца. Поскольку перикард, охватывая устья легочных вен, образует переходную складку на них, выпячивание его в области левого предсердия происходит лишь при значительном скоплении жидкости в полости перикарда. При остром скоплении жидкость в полости перикарда анэхогенна или имеет сниженную эхогенность; эхогенная жидкость говорит о том, что в ней происходит процесс организации и отложения фибрина. После частичного рассасывания жидкости можно выявить утолщение эпи- и перикарда, их фиброз и появление в них очагов обызвествления.
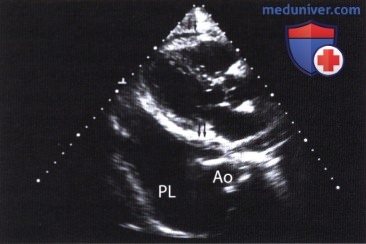
в) Объем скопившейся жидкости. Наружный, или париетальный, листок перикарда от внутреннего, или висцерального, листка (эпикарда) отделен щелевидным пространством, содержащим серозную жидкость. Объем серозной жидкости 25 мл обеспечивает возможность систолической сепарации обоих листков перикарда, при большем объеме жидкости анэхогенное пространство между листками визуализируется в течение всего сердечного цикла, причем подвижность париетального листка перикарда по мере увеличения объема жидкости в нем уменьшается. Абсолютное количество жидкости, скапливающееся в полости перикарда, для развития тампонады сердца не столь существенно, более важное значение имеет скорость, с которой скапливается жидкость. Кроме того, играет роль также исходная функция миокарда: если жидкость в полости перикарда скапливается у больного с недостаточной функцией левого желудочка, то симптомы тампонады сердца проявятся раньше.
г) Гемоперикард. При остром нарушении кровообращения, например после пункции печени, зондирования полостей сердца или интервенционного хирургического вмешательства по поводу расслаивающей аневризмы восходящей аорты, разрыва стенки желудочка при инфаркте миокарда или в результате травмы грудной клетки, а также после кардиохирургических операций, включая шунтирование коронарных артерий и имплантацию электрокардиостимулятора, следует исключить тампонаду сердца, особенно если больной получает антикоагулянтную терапию. Наличие сгустков крови и фибрина в полости перикарда говорит о гемоперикарде. Готовясь к пункции перикарда, следует выполнить ЭхоКГ из субкостальной позиции датчика.
Из редких причин скопления жидкости в полости перикарда следует упомянуть гипотиреоз, локальное облучение грудной полости по поводу рака молочной железы, бронхогенного рака легкого и лимфомы грудной клетки.
е) Лабораторное исследование. Лабораторное исследование больных при скоплении жидкости в полости перикарда включает анализ крови на гемоглобин, триглицериды, глюкозу, белки, в частности альбумин, а также оценку гемограммы. Помимо этих анализов, необходимо бактериологическое, цитологическое, а у отдельных больных и вирусологическое исследование.
Поэтому рекомендуется больным с идиопатическим скоплением жидкости в полости перикарда регулярно выполнять ЭхоКГ и при увеличении количества жидкости удалять ее путем пункции, так как при такой тактике у 41% больных удается достичь длительной ремиссии. С другой стороны, поскольку рецидивы наблюдаются редко, то повторное значительное скопление жидкости в полости перикарда рассматривается как показание к хирургическому вмешательству (перикардэктомии).
з) Определение объема жидкости. Возможности количественной оценки объема жидкости в полости перикарда ограничены (например, при осумкованном или локальном скоплении). В тех случаях, когда необходимо судить о количестве жидкости в полости перикарда в динамике, ЭхоКГ следует выполнять, исследуя больного каждый раз в одном и том же положении тела с учетом фазы дыхания. При исследовании в динамике обращают внимание на то, возросло или уменьшилось количество жидкости. Наиболее простой способ количественной оценки состоит в градации объема скопившейся жидкости на небольшой [скопление жидкости исключительно в задней части полости перикарда в объеме менее 100 мл (расстояние между листками перикарда менее 1 см)], умеренный [жидкость имеется вокруг всего сердца, что соответствует объему 100-500 мл (расстояние между листками перикарда менее 1 см)], большой [объем жидкости превышает 500 мл, расстояние между листками перикарда больше 1 см)].
и) Эхокардиографические критерии тампонады сердца. Предложенные в настоящее время эхокардиографические критерии развития угрожающей жизни тампонады сердца имеют сравнительно небольшую предсказательную ценность. Раннедиастолический коллапс правого желудочка, по данным Merce и соавт., основанным на наблюдении 110 больных в течение 2 лет, характеризовался чувствительностью 60% и специфичностью 90%. Для такого показателя, как компрессия правого предсердия, эти показатели не превышают соответственно 68 и 66%. По данным других авторов, чувствительность компрессии правого предсердия приближалась к 100%, но специфичность была меньше и составила лишь 33%. Эти показатели зависят от объема циркулирующей крови, так что при гиповолемии диастолический коллапс правого желудочка проявляется при более низком давлении в полости перикарда.
Кроме того, признаками угрозы развития тампонады являются также парадоксальные движения межжелудочковой перегородки, разнонаправленные колебания объема желудочков и увеличение кровенаполнения нижней полой вены и уменьшение амплитуды колебаний ее диаметра при дыхательных движениях. При значительном объеме жидкости, скапливающейся в полости перикарда, независимо от степени угрозы развития тампонады сердца движения его приобретают маятникообразный характер («качающееся» сердце). Этот феномен лежит в основе феномена «электрической альтернации», выявляемого при регистрации ЭКГ. «Электрическая альтернация» и низкий вольтаж комплексов QRS наблюдаются далеко не всегда. По данным одного исследования, проведенного на больных, у которых развилась тампонада сердца, высокую диагностическую чувствительность имели такие электрокардиографические признаки, как уплощение зубца Р и динамические изменения высоты зубца Т.
к) Гемодинамические параметры при допплеровском исследовании. Характерные изменения внутригрудной и внутрисердечной гемодинамики обусловливают появление парадоксального пульса. Если в норме при глубоком вдохе давление в полости перикарда снижается в такой же мере, как внутригрудное давление, то при тампонаде сердца в соответствии с моделью Sharp и соавт. давление в полости перикарда снижается в меньшей степени, чем внутригрудное (50). Указанные гемодинамические сдвиги подтверждаются при ЭхоКГ: при вдохе, с одной стороны, снижение внутригрудного давления передается на сосуды малого круга кровообращения, с другой стороны, при значительном скоплении жидкости в полости перикарда передача такого снижения на левый желудочек становится невозможной. В результате давление заклинивания легочных капилляров снижается, в то время как диастолическое давление в левом желудочке остается неизменным.
Дыхательные колебания скорости кровотока отмечаются не только на митральном и трехстворчатом клапанах, но и легочных и печеночных венах. При вдохе происходит уменьшение, а при выдохе увеличение диастолического антероградного кровотока в легочных венах. В печеночных венах, наоборот, при выдохе происходит уменьшение антероградного и одновременное увеличение ретроградного кровотока.
л) Дифференциальный диагноз. Следует помнить о том, что специфичность указанных изменений скорости кровотока, связанных с дыхательными движениями, невысокая, так как подобные изменения наблюдаются и у больных с повышенным давлением в правом предсердии и желудочке. У больных с хроническими обструктивными заболеваниями легких, тромбоэмболией легочной артерии, констриктивным перикардитом, инфарктом миокарда с вовлечением стенки правого желудочка, а также у больных, которым проводится длительная ИВЛ с положительным давлением в конце выдоха, давление наполнения правого желудочка и соответственно давление в полости перикарда повышено, что препятствует наполнению левого желудочка.
м) Дифференциальная диагностика скопления жидкости в полости перикарда и в плевральной полости. Обычно жидкость в полости перикарда окружает все сердце. Если при ЭхоКГ выявляют узкое анэхогенное пространство, расположенное только в переднем отделе полости перикарда, то его следует дифференцировать от эпикардиальной жировой ткани (для нее характерна минимальная систолодиастолическая компрессия при ЭхоКГ в М-режиме).
Скопление жидкости в задней части полости перикарда при ЭхоКГ выявляют кпереди от нисходящей аорты. Скопление жидкости в плевральной полости по отношению к аорте бывает расположено кзади. В дифференциальный диагноз включают также заболевания, проявляющиеся атипичным расположением скопившейся жидкости. Кроме того, УЗИ выполняют и для определения оптимального места пункции перикарда. Отдифференцировать скопление жидкости в полости перикарда от асцита можно с помощью УЗИ из субкостальной позиции датчика.
н) Пункция перикарда. При тампонаде сердца наиболее эффективно дренирование полости перикарда под мечевидным отростком. При дренировании под ультразвуковым или рентгеноскопическим контролем выпота, локализующегося кпереди от правого желудочка, осложнения наблюдаются редко. Эти осложнения включают в себя пневмоторакс, повреждение коронарной артерии, перфорацию желудка или толстой кишки, рефлекторное падение АД, фибрилляцию желудочков, а также перфорацию правого предсердия или желудочка. Летальность, связанная с пункцией перикарда, составляет 0,8%. Зависимость между объемом выпота в полости перикарда перед аспирацией и количеством больных, умирающих в течение года после процедуры, отсутствует; прогностическое значение имеет лишь основное заболевание, которое привело к скоплению жидкости в полости перикарда.
Многократные пункции перикарда. Не всегда полное дренирование массивного выпота в полости перикарда приводит к улучшению гемодинамики. При длительном скоплении выпота рекомендуется постепенное (ступенчатое) или многократное дренирование полости перикарда во избежание развития острого отека легких. При хронической тампонаде недостаточное наполнение сердца вследствие повышенного давления в полости перикарда вызывает увеличение объема циркулирующей крови. Активация адренергических рецепторов, связанная со снижением минутного объема сердца, приводит к повышению периферического сосудистого сопротивления. Быстрое дренирование массивного скопления жидкости из полости перикарда ведет к устранению сдавления правых отделов сердца и внезапному увеличению притока венозной крови к ним. Возрастает преднагрузка, а поскольку повышенное периферическое сосудистое сопротивление нормализуется не сразу, то возрастает и постнагрузка левого желудочка.
В результате возникает несоответствие между пред- и постнагрузкой, которое может стать причиной развития отека легких, особенно у больных со сниженной функцией левого желудочка. Внезапно возросшая преднагрузка левого желудочка вызывает острое повышение напряжения его стенки (в соответствии с законом Лапласа). Особенно значительную угрозу такое состояние представляет для больных с предшествующей митральной недостаточностью, так как расширение митрального клапанного кольца и снижение контрактильности сосочковых мышц и миокарда левого желудочка усугубляет нарушенное смыкание створок митрального клапана в систолу, и митральная недостаточность усиливается. В связи с этим рекомендуется аспирацию жидкости из полости перикарда осуществлять под эхокардиографическим контролем.
— Вернуться в оглавление раздела «Кардиология.»
Редактор: Искандер Милевски. Дата публикации: 10.1.2020
Синдром Дресслера
Используйте навигацию по текущей странице

Частота развития
Первоначально считалось, что синдром Дресслера возникает примерно у 4% больных, перенесших инфаркт миокарда. C учетом атипичных и малосимптомных форм частота его развития значительно выше – 15–23 %, а по некоторым источникам достигает 30 %. Однако в последние годы частота синдрома Дресслера уменьшилась. Причинами могут быть широкое использование нестероидных противовоспалительных средств (ацетилсалициловой кислоты) и распространение реперфузионных методов лечения ИМ, уменьшающих объем повреждения мышцы сердца. Другой причиной снижения частоты развития синдрома Дресслера может быть включение в комплекс терапии инфаркт миокарда ингибиторов ангиотензинпревращающего фермента, антагонистов альдостерона и статинов, вследствие их иммуномодулирующего и противовоспалительного действия. Постинфарктый синдром развивается в подостром периоде (не ранее 10-го дня от момента заболевания) у 3—4 % пациентов, перенёсших инфаркт миокарда.
Причины развития
При постинфарктном синдроме антитела к тканям сердца обнаруживаются постоянно. При анализе субпопуляций лимфоцитов у пациентов с синдром Дресслера было обнаружено увеличение числа активированных CD8-позитивных клеток. При изучении активации комплемента было отмечено, что у пациентов с СД наблюдали повышенный уровень фракции C3d в сочетании с более низкой концентрацией С3. Кардиальные реактивные антитела, связываясь с циркулирующими кардиальными антигенами с формированием растворимых иммунных комплексов, могут фиксироваться в различных местах, приводя к комплементопосредованному повреждению ткани.
При постинфарктном синдроме наблюдаются изменения и в клеточном иммунитете. Так, имеются данные, что при синдроме Дресслера значительно повышен уровень цитотоксических T-клеток. Этиологическим фактором синдрома Дресслера может быть инфекция, в частности вирусная, поскольку у больных, у которых этот синдром развился после кардиохирургических вмешательств, часто регистрируют повышение титра противовирусных антител.
Симптомы и течение
Развивается на 2–4-й неделе инфаркта миокарда, однако эти сроки могут уменьшаться – «ранний синдром Дресслера» и увеличиваться до нескольких месяцев, «поздний синдром Дресслера». Иногда течение синдрома Дресслера принимает агрессивный и затяжной характер, он может длиться месяцы и годы, протекать с ремиссиями и обострениями. Основные клинические проявления синдрома: лихорадка, перикардит, плеврит, пневмонит и поражение суставов. Лихорадка при синдроме Дресслера не имеет какой-либо строгой закономерности. Как правило, она бывает субфебрильной, хотя в отдельных случаях может быть фебрильной или вообще отсутствовать.
Перикардит является обязательным элементом синдрома Дресслера. Клинически он проявляется болью в перикардиальной зоне, которая может иррадиировать в шею, плечо, спину, брюшную полость. Боль может быть острой приступообразной (плевритическая) или давящей, сжимающей (ишемической). Она может усиливаться при дыхании, кашле, глотании и ослабевать в вертикальном положении или лежа на животе. Она длительная и исчезает или ослабевает после появления в полости перикарда воспалительного экссудата. Главный аускультативный признак перикардита – шум трения перикарда: в первый день болезни при внимательной аускультации он определяется у абсолютного большинства (до 85 %) больных. Шум лучше всего выслушивается у левого края грудины, при задержке дыхания и наклоне туловища пациента вперед. В классическом варианте он состоит из трех компонентов – предсердного (определяется в систолу) и желудочкового (систолического и диастолического). Как и боль, шум трения перикарда уменьшается или исчезает вовсе после появления в полости перикарда выпота, раздвигающего трущиеся листки перикарда. Обычно перикардит протекает нетяжело: уже через несколько дней боли стихают, а экссудат в полости перикарда почти никогда не накапливается в таком количестве, чтобы ухудшить кровообращение, хотя иногда могут появиться признаки тяжелой тампонады сердца. Иногда воспалительный процесс в перикарде при синдроме Дресслера принимает затяжной рецидивирующий характер и заканчивается развитием констриктивного перикардита. При применении антикоагулянтов на фоне синдрома Дресслера возможно также развитие геморрагического перикардита, хотя подобное осложнение может быть и при отсутствии антикоагулянтной терапии.
Плеврит. Проявляется болью в боковых отделах грудной клетки, усиливающейся при дыхании, затруднением дыхания, шумом трения плевры, притуплением перкуторного звука. Он может быть сухим и экссудативным, односторонним и двусторонним. Нередко плеврит носит междолевой характер и не сопровождается типичными физикальными симптомами.
Пневмонит. Пневмонит при синдроме Дресслера выявляется реже, чем перикардит и плеврит. Если очаг воспаления достаточно велик, также отмечается притупление перкуторного звука, ослабленное или жесткое дыхание, появление фокуса мелкопузырчатых хрипов. Возможен кашель и выделение мокроты, иногда с примесью крови, что всегда вызывает определенные диагностические трудности.
Поражение суставов. Для синдрома Дресслера характерно появление так называемого «синдрома плеча»: болезненных ощущений в области плечелопаточных суставов, чаще слева, ограничение подвижности этих суставов. Вовлечение в процесс синовиальных оболочек нередко приводит к возникновению болей и в крупных суставах конечностей.
Другие проявления. Проявлением постинфарктного синдрома может быть сердечная недостаточность вследствие диастолической дисфункции, геморрагический васкулит и острый гломерулонефрит.
Методы исследования
Лабораторные данные. Часто отмечается повышение СОЭ и лейкоцитоз, а также эозинофилия. Весьма характерно резкое повышение уровня С-реактивного белка. У больных с синдромом Дресслера регистрируются нормальные уровни маркеров повреждения миокарда (МВ-фракция креатинфосфокиназы (МВ-КФК), миоглобин, тропонины), хотя иногда отмечается их незначительное повышение, что требует проведения дифференциальной диагностики с рецидивом инфаркта миокарда.
Электрокардиография (ЭКГ). При наличии перикардита на ЭКГ определяются диффузный подъем сегмента ST и, периодически, депрессия сегмента PR, за исключением отведения aVR, в котором наблюдаются депрессия ST и подъем PR. По мере накопления экссудата в полости перикарда может снизиться амплитуда комплекса QRS.
Эхокардиография. При накоплении жидкости в полости перикарда выявляется сепарация его листков и могут появиться признаки тампонады сердца. Для синдрома Дресслера не характерен большой объем жидкости в полости перикарда – как правило, сепарация листков перикарда не достигает 10 мм в диастолу.
Рентгенография. Обнаруживают скопление жидкости в плевральной полости, междолевой плеврит, расширение границ сердечной тени, очаговые тени в легких.
Компьютерная или магнитнорезонансная томография также выявляют жидкость в полости плевры или перикарда и легочную инфильтрацию.
Плевральная и перикардиальная пункция. Извлеченный из полости плевры или перикарда экссудат может быть серозным или серозно-геморрагическим. При лабораторном исследовании в нем определяется эозинофилия, лейкоцитоз и высокий уровень С-реактивного белка.
Лечение
Нестероидные противовоспалительные препараты (НПВС). Препаратом выбора при синдроме Дресслера традиционно считается ибупрофен (400– 800 мг/сут). Реже используют аспирин. Хирургическое лечение применяется при констриктивном перикардите.
Осложнения
Тампонада сердца, геморрагический или констриктивный перикардит, окклюзия (сдавление) коронарного шунта и редко – анемия.
Прогноз
Прогноз при синдроме Дресслера, как правило, благоприятный. Вместе с тем его течение иногда принимает затяжной рецидивирующий характер. Кроме того, имеются данные о том, что выживаемость в течение 5 лет среди перенесших этот синдром, хотя и незначительно, но снижается.

