что такое секундарная микрофлора
Микрофлора урогенитального тракта у мужчин, обследованных по поводу хронического простатита
Лечение хронической воспалительной патологии урогенитального тракта у мужчин всегда было непростой задачей в урологии. Лечение по поводу этих заболеваний, особенно осложненных нарушением фертильности, сексуальной дисфункцией, синдромом тазовых болей, может быть успешным, если производится индивидуально и базируется на знании этиологии воспалительного процесса, иммунореактивности на данный воспалительный процесс и морфо-функциональные изменений в тазовых органах.
В широкой врачебной практике в настоящее время при диагностике этиологического фактора воспалительной патологии урогенитального тракта акцент делается на выявление инфекций передаваемых половым путем. Целью данного исследования является демонстрация значимости других, не менее важных, этиологических факторов, а также места ИППП в патогенезе данной группы воспалительных заболеваний. Инфекционный воспалительный процесс в урогенитальном тракте возникает по двум механизмам.
В первом случае вирулентная ИППП вызывает клинически и лабораторно идентифицируемый уретрит, который в дальнейшем приводит к возникновению восходящего воспалительного процесса. Патогенетическая роль инфекции передаваемой половым путем в данном случае очевидна: при исследовании отделяемого из уретры, секрета предстательной железы, семенной жидкости выявляется достоверное увеличение количества лейкоцитов и ИППП; первично воспалительный процесс начинается с клиники уретрита. Пациенты с воспалительным процессом такого характера чаще всего находятся на лечении в кожно-венерологических диспансерах, когда помимо острого венерического заболевания имеется клиника простатита.
Второй механизм более сложный. Возникновению инфекционного воспалительного процесса в урогенитальном тракте в данном случае предшествуют определенные предрасполагающие факторы.
Выделим несколько основных групп:
При развитии инфекционного процесса в урогенитальном тракте по данному механизму отсутствует какая-либо клиника уретрита, в исследованиях отделяемого из уретры будет отсутствовать достоверное увеличение количества лейкоцитов, в соскобах из уретры будет значительно реже выявляться ИППП, однако у пациентов будет присутствовать клинически и лабораторно идентифицируемый воспалительный процесс в простато-везикулярном комплексе или в органах мошонки.
При наличии вышеуказанных предрасполагающих факторов инфицирование урогенитального тракта банальной бактериальной микрофлорой принципиально возможно двумя путями: трансуретральным и гематогенным.
Гематогенным путем инфицирование чаще всего происходит из очагов хронической инфекции при сопутствующей ЛОР- патологии, заболеваниях, имеющих широчайшее распространение у населения; при заболеваниях прямой кишки с хроническими запорами, геморрое ( особенно при частых обострениях). Инфицирование по данному пути чаще всего происходит тогда, когда в предстательной железе уже имеются выраженные структурные изменения ( конгестия, кальцинаты, ДГПЖ ).
Более значим трансуретральный путь инфицирования вторичной бактериальной микрофлорой.Следует выделить 4 основных источника бактериального инфицирования.
Таблица микроорганизмов, наиболее часто встречающихся в половых органах у женщин при воспалительных заболеваниях, вызванных влагалищной гарднареллой и неспорообразующими бактериями. ( сборник трудов УрНИИДВиИ, 1985 год )
Виды микроорганизмов.
Морфологические особенности.
Коккобациллы одиночные, парные, полиморфные
Микрофлора влагалища. Зачем нам нужны бактерии?
Что представляет микрофлора влагалища в норме?
Какие микроорганизмы относятся к условно-патогенным?
Если в массе микрофлоры уменьшается количество лактобацилл, то условно- патогенные микроорганизмы начинают вести себя агрессивно и способны вызвать следующие заболевания в зависимости от того, какие микробы более активны:
Заболевания, ассоциированные с условно-патогенными микроорганизмами – так принято называть данную группу болезней.
Почему нарушается микрофлора влагалища?
Чем опасно нарушение микрофлоры влагалища?
Нарушения микрофлоры могут проявляться выделениями белого или сероватого цвета, иногда с неприятным запахом. Возможны зуд и жжение при мочеиспускании. А могут вообще не проявляться. Но в любом случае нарушение баланса микрофлоры может вызвать следующие состояния:
Как можно выявить нарушения влагалищной микрофлоры?
Самый точный метод – ПЦР. Но здесь присутствует важный момент: для комплексной и полной оценки микрофлоры нужны специальные анализы, определяющие уровень лактобацилл как самых главных и нужных; и уровень условно-патогенных микроорганизмов по отношению к лактобациллам. К таким тестам относят:
Как понять результат исследования?
Рашифровкой занимается врач. Ответ может быть в виде графика (Фемофлор) и заключения (Флороценоз)
Если лактобациллы преобладают – значит, всё хорошо. Если лактобацилл мало или их нет, а преобладает любой тип УПМ – врач сопоставляет данные осмотра, жалоб и лабораторного заключения, ставит диагноз и назначает лечение.
Обследуйтесь своевременно с лабораторией KDL и будьте здоровы!
Что нужно знать о бактериальном вагинозе
Многие женщины сталкиваются с симптомами влагалищного дисбиоза. Обильные выделения, молочно-серого цвета и с неприятным запахом часто путают с «молочницей» и проводят «соответствующее» самолечение.
В большинстве случаев, такая стратегия быстрее навредит, чем поможет, поскольку причиной может быть бактериальный вагиноз (БВ).
Что такое баквагиноз
Согласно официальному определению, это невоспалительное заболевание влагалища, характеризующееся резким снижением или полным отсутствием лактофлоры и её заменой на анаэробные бактерии, среди которых наиболее распространены Gardnerella vaginalis (гарднерелла) и Atopobium vaginae (атопобиум).
У здоровых женщин репродуктивного возраста влагалищный микробиом на 95% представлен лактобактериями. Их способность к кислотообразованию (молочная кислота) и продукции перекиси водорода способствует поддержанию кислого pH и подавлению роста остальных микроорганизмов.
Оставшиеся 5% микрофлоры занимают более 300 видов аэробных и анаэробных микроорганизмов, среди которых:
Факторы риска и симптомы
Колонизация влагалища микрофлорой, связанной с баквагинозом, особенно Gardnerella vaginalis и Atopobium vaginae, сопровождается:
Отека и покраснения обычно не наблюдается, что является отличительным признаком от банального вагинита и кандидоза влагалища («молочницы»).
Диагностика
Самым простым, но косвенным, признаком нарушения влагалищной микрофлоры служит повышение pH >4,5. Для проведения такого «анализа» требуются всего лишь тест-полоски для измерения рН, доступные к покупке в любой аптеке. Однако, чтобы выявить возбудителя и начать адекватную терапию такой диагностики, конечно, недостаточно.
Современным и высокоточным методом диагностики влагалищных дисбиозов служит комплексное исследование «Флороценоз».
Этот тест разработан научными специалистами совместно с практикующими клиницистами. И предназначен для определения состава и соотношения нормальной и условно-патогенной флоры влагалища методом ПЦР.
Исследование представлено в 3-х вариантах для различных клинических ситуаций:
Название теста «говорит само за себя», а в результате будет отражено количество:
2. В случае, когда есть подозрения на нарушения более «широкого спектра», к применению рекомендован «Флороценоз», включающий подсчет:
3. При необходимости в дополнительной диагностике ИППП – подходит «Флороценоз – комплексное исследование», включающий в себя подсчет «классического состава» бактерий + выявление ДНК «виновников» ИППП:
Готовность анализов составляет 4-5 дней, а результат можно получить по электронной почте, в личном кабинете на сайте или в любом удобном отделении KDL.
Роль микробиоты кишечника в поддержании здоровья
Микрофлора представляет собой метаболически активную и сложную экосистему, состоящую из сотен тысяч микроорганизмов — бактерий, вирусов и некоторых эукариот. Подобно невидимому чулку, биоплёнка покрывает все слизистые нашего организма и кожу. Микробиота объединяет более чем 10 14 (сто биллионов) клеток микроорганизмов, что в 10 раз превышает число клеток самого организма. Микробиота находится в содружественных отношениях с организмом человека: организм хозяина предоставляет среду обитания и питательные вещества, микроорганизмы защищают организм от патогенных возбудителей, способствуют поддержанию нормальных иммунологических, метаболических и моторных функций. Выделяют несколько важных биотопов, которые отличаются плотностью распределения микроорганизмов и составом: кожные покровы, слизистые оболочки ЖКТ, дыхательных путей, урогенитального тракта и проч. Самой многочисленной считается микробиота кишечника, на её долю приходится 60% микроорганизмов, колонизирующих организм человека.
Микрофлора кишечника состоит из группы микроорганизмов, представленных более чем 1000 видами, 99% из которых приходится на 30–40 главных видов. В научных кругах кишечную микрофлору называют также дополнительным органом.
Состояние микробиоты кишечника определяет качество и продолжительность жизни. У каждого человека есть свой индивидуальный характер распределения и состава микробиоты. Частично он определяется генотипом хозяина и первоначальной колонизацией, которая происходит сразу после рождения. Различные факторы, такие как тип родов, кормление грудью, образ жизни, диетарные предпочтения, гигиенические условия и условия окружающей среды, использование антибиотиков и вакцинация, могут определять окончательные изменения в структуре микробиоты.
При изменении состава или функции микробиоты развивается дисбиоз. Дисбиотические состояния изменяют моторику кишечника и его проницаемость, а также искажают иммунный ответ, тем самым создавая предпосылки для развития провоспалительного состояния. Такие изменения, особенно в отношении иммунных и метаболических функций хозяина, могут вызывать или способствовать возникновению ряда заболеваний, например, сахарного диабета, ожирения, неврологических и аутоиммунных заболеваний. Недавние исследования показали, что микробиота участвует в этиопатогенезе многих гастроэнтерологических заболеваний, таких как синдром раздраженного кишечника, воспалительные заболевания кишечника, целиакия, неалкогольный стеатогепатит и новообразования желудочно-кишечного тракта.
Кишечная микрофлора и иммунитет
Кишечная микробиота имеет решающее значение для развития лимфоидных тканей, а также для поддержания и регуляции кишечного иммунитета.
В кишечнике происходит сенсибилизация иммуноцитов, которые затем заселяют другие слизистые оболочки и циркулируют между различными органами. Этот механизм обеспечивает формирование клонов лимфоцитов и образование специфических антител в участках слизистой оболочки, отдалённых от очага первичной сенсибилизации.
Иммунокомпетентные ткани пищеварительного тракта объединены в лимфоидную ткань. Лимфоидная ткань представлена лимфоцитами, расположенными между эпителиальными клетками кишечника, лимфоцитами собственного слоя, пейеровыми бляшками (скопления лимфоидной ткани в тонкой кишке) и лимфоидными фолликулами.
Попавшие в просвет кишечника или на слизистые оболочки антигены распознаются иммуноглобулинами памяти (IgG), после чего информация передаётся в иммунокомпетентные клетки слизистой оболочки, где из сенсибилизированных лимфоцитов клонируются плазматические клетки, ответственные за синтез IgА и IgМ. В результате защитной деятельности этих иммуноглобулинов включаются механизмы иммунореактивности или иммунотолерантности. Благодаря индукции иммунологической толерантности в кишечнике не возникают нежелательные воспалительные реакции против кишечной микробиоты и пищевых белков.
Кишечная микробиота и обмен веществ
Кишечная микробиота вносит непосредственный вклад в метаболизм питательных веществ и витаминов, необходимых для жизнедеятельности организма хозяина, при этом извлекая энергию из пищи. Эта энергия образуется путём реакции сбраживания не усваиваемых углеводов (клетчатки), в результате реакции образуются короткоцепочечные жирные кислоты, водород и углекислый газ.
Короткоцепочные жирные кислоты обеспечивают работу колоноцитов.
Короткоцепочные жирные кислоты считаются тонкими регуляторами иммунитета, энергетического обмена и метаболизма жировой ткани. Например, короткоцепочные жирные кислоты участвуют во взаимодействии бактерий и иммунитета, подавляя сигналы, которые могут привести к развитию аутоиммунных реакций. Пропионовая и масляная жирная кислота положительно влияют на метаболизм глюкозы. Наконец, короткоцепочные жирные кислоты обеспечивают подкисление просвета толстой кишки, предотвращая рост бактериальных патогенов.
Кишечная микробиота принимает непосредственное участие в метаболизме желчных кислот, источником которых является холестерин. В печени из холестерина синтезируются первичные желчные кислоты — холевая и хенодезоксихолевая, которые поступают в кишечник. Бактероиды и лактобациллы далее превращают первичные желчные кислоты во вторичные желчные кислоты — дезоксихолевую и литохолевую. Изменение нормального баланса кишечных бактерий приводит к неадекватному синтезу желчных кислот.
Микробиота и нервная система
Ещё более удивительные данные о взаимосвязи кишечной микробиоты и нервной системы. Микробиота кишечника тесно общается с центральной нервной системой. Микробиота кишечника производит такие нейроактивные молекулы, как ацетилхолин и серотонин, дофамин, которые являются главными медиаторами сигналов в ЦНС, а также регулируют работу мозга через активацию иммунных сигнальных путей. Дополнительно, блуждающий нерв активно участвует в двунаправленных взаимодействиях между кишечной микробиотой и мозгом для поддержания гомеостаза как в головном мозге, так и в кишечнике.
Недавние исследования показали, что микробиом влияет на свойства и функцию микроглии. Микроглия защищает мозг от различных патологических состояний через активацию иммунного ответа, фагоцитоза и продукцию цитокинов. Кроме того, микроглия ответственна за формирование нейронных цепей, которые участвуют в развитии мозга. Различные дисбиотические состояния, в том числе вызванные приёмом антибиотиков приводят к угнетению созревания клеток микроглии. Незрелая микроглия приводит к нарушению иммунной активации.
Астроциты — самая многочисленная клеточная популяция в ЦНС, и они почти в пять раз превосходят численность нейронов. Подобно микроглии, астроциты выполняют несколько важных функций по поддержанию целостности ЦНС, включая контроль кровообращения в головном мозге, поддержание стабильности гематоэнцефалического барьера. Астроциты регулируют баланса ионов и оказывают влияние на передачу сигналов между нейронами. Чрезмерная активация астроцитов является пусковым механизмом в развитии дисфункции ЦНС и неврологических расстройств. Чрезмерная активация происходит под действием метаболитов микрофлоры.
Целостность гематоэнцефалического барьера регулируется также метаболитами микробиоты, которые опосредуют передачу большего количества микробных сигналов между осью кишечник-мозг.
Дисбиоз микробных видов в кишечнике может вызывать атипичные иммунные сигналы, дисбаланс в гомеостазе организме-хозяина и привести к прогрессированию заболеваний ЦНС. Например, рассматривается роль микробиоты в патогенезе рассеянного склероза-заболевания, характеризующимся демиелинизацией аксонов нервных клеток. При болезни Паркинсона, которая проявляется моторными симптомами, включая тремор, мышечную ригидность, медлительность движений и аномалию походки наблюдается накопление α-синуклеина в нейронах. Избыточное отложение α-синуклеина в нервной системе инициируется кишечной микрофлорой до того, как возникают симптомы поражения ЦНС, что связано с некоторыми специфическими пищеварительными симптомами (запоры и нарушение двигательной функции толстой кишки). Бактериальный состав кишечника влияет на болезнь Паркинсона: тяжесть симптомов, в том числе постуральная нестабильность и нарушение походки, связана с изменениями численности некоторых видов Enterobacteriaceae, уменьшение количества Lachnospiraceae приводит к более серьёзному ухудшению моторных и немоторных симптомов у пациентов с болезнью Паркинсона. Болезнь Альцгеймера — ещё одно нейродегенеративное заболевание, которое приводит к серьёзным нарушениям функции ЦНС — обучению, памяти и поведенческим реакциям. Болезнь Альцгеймера характеризуется отложением пептида амилоид-β (Aβ) снаружи и вокруг нейронов, вместе с накоплением белка тау внутри корковых нейронов. Перегрузка амилоидом и агрегация тау нарушают синаптическую передачу. Изменение состава и разнообразия микробиоты вносит определённый вклад в патогенез болезни Альцгеймера. Активированная микроглия способствует развитию заболевания, увеличивая отложение амилоида.
Ожирение и состав микробиоты
При ожирении и сахарном диабете наблюдаются изменения в составе микробиоты кишечника, в частности, снижение популяционного уровня сахаролитических бактероидов, влияющих на интенсивность метаболических процессов, а также увеличение доли бактерий класса Firmicutes (Esherichia coli, Clostridium coccoides, Clostridium leptum). Снижение содержания сахаролитических бактерий уменьшает выработку коротко-цепочных жирных кислот, обеспечивающих трофику и деление эпителия кишечника, его созревание, оказывающих антимикробное действие и регуляторное действие в отношении ионов и липидов.
Дополнительно при ожирении отмечается хроническое системное воспаление, сопровождающееся секрецией провоспалительных цитокинов (интерлейкины — ИЛ, С-реактивный белок, α-фактор некроза опухоли — α-ФНО и др.) в висцеральной жировой ткани. Нарушения в составе кишечной микрофлоры приводят к усилению эффекта системного воспаления за счёт увеличения концентрации бактериальных липополисахаридов, стимулирующих выработку провоспалительных компонентов.
Диагностика состояния кишечной микробиоты
Существует два метода определения микробиоты — стандартный анализ на дисбактериоз и оценка состава микробиоты методом масс-спектрометрии по крови (ГХ-МС). В основе методики масс-спектрометрии лежит определение присутствия микроорганизмов по их клеточным компонентам (высшие жирные кислоты, альдегиды, спирты и стерины). Методика разработана профессором Осиповым Г.А. Метод ГХ-МС позволяет одновременно измерять более сотни микробных маркёров непосредственно в образце, позволяющих сделать заключение о некультивируемых и труднокультивируемых патологических возбудителях. Метод универсален также в отношении грибов и вирусов.
Эшерихиоз и сальмонеллез сельскохозяйственных животных
Издание предназначено для врачей ветеринарной медицины, студентов и молодых специалистов, сотрудников ведомственных и частных животноводческих хозяйств.
ВВЕДЕНИЕ
Разведение сельскохозяйственных животных в условиях промышленных комплексов, предполагающих высокую концентрацию поголовья на ограниченных площадях, поставили перед ветеринарной наукой и практикой много проблем, связанных с совершенствованием диагностики болезней, методов и средств профилактики и лечения животных.
У новорождённых телят и поросят желудочно-кишечные нарушения в 90% случаев вызываются патогенными штаммами эшерихий и сальмонелл.
Терапия при инфекционных болезнях является составной частью противоэпизоотических мероприятий. Её задача состоит в том, чтобы устранить этиологию болезни и восстановить продуктивность животного.
Успех лечения зависит от своевременной постановки диагноза, правильного выбора лекарственных средств, методов и времени их применения. Для этого необходимо знать механизм действия лечебных средств на организм, учитывать условия, в которых находятся животные.
При лечении животных необходимо применять комплексно специфические и неспецифические терапевтические средства. К специфическим средствам терапии, в первую очередь, относятся антибиотики. При выборе антибиотика необходимо учитывать спектр его действия, способность проникать в ткани, специфику распределения в организме и выделения из него, а также возможность проникновения в пораженные патологическим процессом органы и ткани, и в места локализации возбудителя болезни.
В комплексном лечении молодняка сельскохозяйственных животных при желудочно-кишечных заболеваниях лучше использовать антибиотики широкого спектра действия. При длительном применении антибиотиков необходимо в схему лечения включать и пробиотики. Использование антитоксических специфических сывороток, обладающих, за счёт наличия в них антител к антигенам эшерихий и сальмонелл, повышает терапевтическую эффективность проводимых мероприятий на животноводческих фермах.
ЭШЕРИХИОЗ
— остро протекающая зоонозная болезнь молодняка животных многих видов, проявляющаяся диареей, септицемией, токсемией и энтеритом, обезвоживанием организма, поражением центральной нервной системы, нарастающей депрессией и слабостью, иногда пневмонией и артритами.
— и Н- антигенам (АГ), однако лишь незначительная часть способна вызывать кишечные инфекции у животных и человека. Ведущая роль в развитии диарей новорожденных поросят, телят, ягнят принадлежит энтеротоксигенным штаммам эшерихий с адгезивными АГ: К88, К99, 987Р, F 41, F18, A20, AГ 25 различных О- серогрупп.
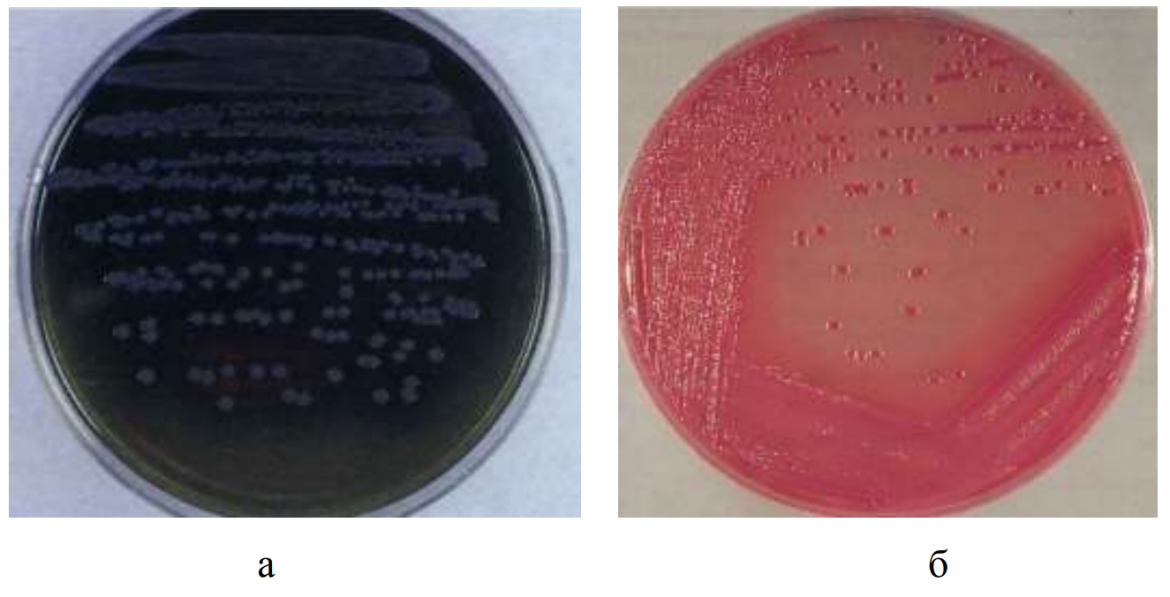
Рис. 1 – а) колонии E. coli на агаре Левина; б) колонии E. coli на агаре Эндо
Репродукция гемолитических штаммов кишечной палочки в полости кишечника приводит к возникновению в тканях воспалительных процессов и накоплению избыточного количества гистамина, что вызывает развитие токсикоза, появление отеков, нервных расстройств, возможны коллапс и шок. У больных телят резко увеличивается количество кишечной палочки и уменьшается содержание молочнокислых бактерий (3:1), оказывающих антагонистическое действие, что имеет значение в патогенезе эшерихиоза. На патогенез эшерихиозной инфекции влияет широкое использование в ветеринарии различных антибактериальных препаратов.
Патологоанатомические изменения. У телят при сверхостром течении типичные для данной болезни изменения не успевают развиться. При наружном осмотре трупа в случаях острого течения отмечают сильное истощение, анемичность слизистых оболочек. Хвост, задние конечности и кожа вокруг анального отверстия испачканы жидкими каловыми массами.
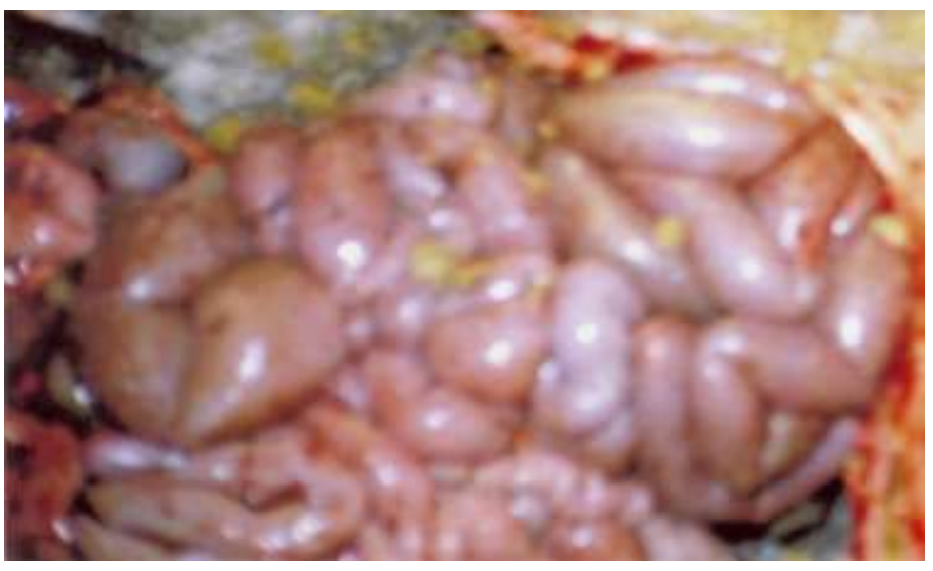
В сычуге створоженное молозиво, в кишечнике много газов и желто- белого цвета жидкая масса, иногда с примесью крови. Со стороны серозной оболочки хорошо просматриваются признаки геморрагического воспаления кишечника (Рис. 2).
Рис. 2 – Геморрагическое воспаление кишечника телёнка
Слизистая оболочка сычуга и кишечника покрыта слизью, утолщена, особенно в пилорической части. Нередко на ней видны точечные кровоизлияния. Особенно резко выражены изменения в прямой кишке (точечные или полосчатые кровоизлияния). Солитарные фолликулы и пейеровы бляшки набухшие. Лимфатические узлы, набухшие и сочные на разрезе, иногда усеяны кровоизлияниями. Селезенка несколько увеличена. В печени, почках, сердце, а также в мышцах выражены дегенеративные процессы. Как правило, обнаруживается жировое перерождение печени. Желчный пузырь большей частью наполнен и растянут. Иногда отмечаются кровоизлияния под эпикардом и на эндокарде, а также на других серозных покровах. В отдельных случаях возможны отек легких, катаральное воспаление легких, воспаление суставов и пупка.
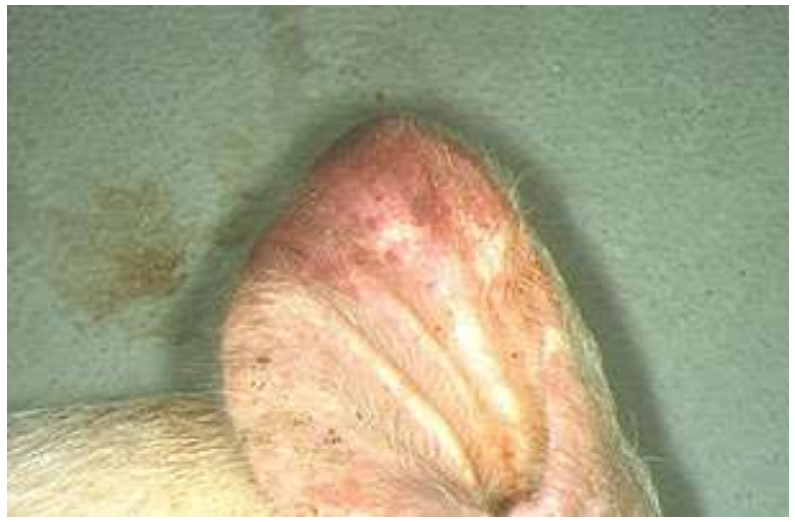
У трупов поросят кожный покров цианотичен (Рис. 3), у некоторых выделяется экссудат из носовых ходов, характерны конъюнктивит, отек век, подкожной клетчатки в области затылка, шеи, подчелюстного пространства, у основания ушей, реже в области паха, живота и конечностей.
Рис. 3 – Цианоз кожного покрова
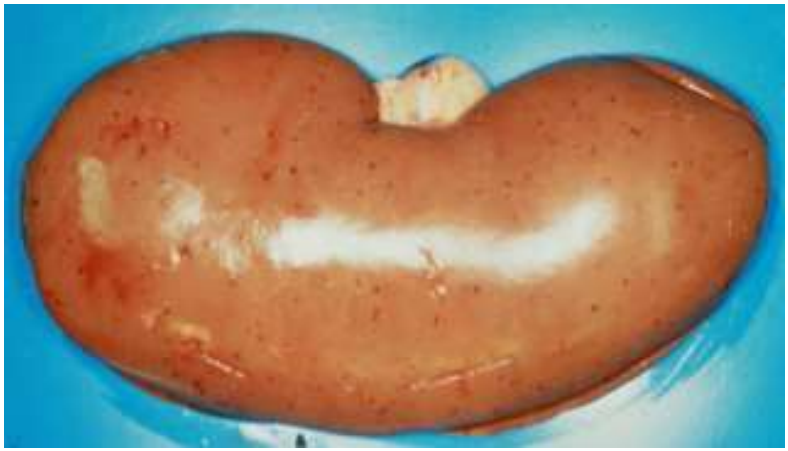
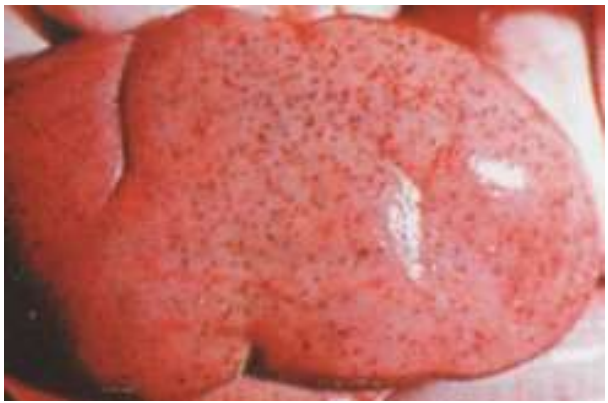
Рис. 4 – Точечные кровоизлияния и жировая дистрофия почки поросёнка
Сосуды твердой и мягкой мозговых оболочек кровенаполнены, иногда заметны кровоизлияния. Мышца сердца дряблая, скелетные мышцы бледные, заметны распространенные отеки подкожной клетчатки. Селезенка без видимых изменений.
Диагностика. Эшерихиоз в хозяйстве устанавливают на основании эпизоотологических, клинических, патологоанатомических данных и результатов бактериологического исследования материала от павших животных.
При подозрении на эшерихиоз в ветеринарную лабораторию направляют трупы некрупных животных или патологический материал. Бактериологическое исследование включает выделение и идентификацию эшерихий, определение в реакции агглютинации (РА) или реакции коагглютинации (РКоА) серологической группы культуры и патогенности ее для белых мышей и цыплят.
Диагноз считают установленным:
1) при выделении культур эшерихий из селезенки, костного или головного мозга без определения их серогруппы и патогенности;
2) при выделении из двух и более органов патогенных для белых мышей культур или культур, отнесенных по реакции агглютинации или коагглютинации к энтеропатогенным серогруппам.
САЛЬМОНЕЛЛЕЗ
Рис. 5 – Колонии сальмонелл на висмут-сульфитном агаре
Поросята при остром течении болезни лежат, температуры тела повышена до 42 о С, развивается диарея, наблюдается очаговое покраснение или посинение кожи в области живота, ушей, паха (Рис. 6). При подостром течении отмечают ремитирующий тип лихорадки, признаки поражения лёгких, при хроническом – истощение, отставание в росте и развитии. У взрослых свиней болезнь протекает бессимптомно.

Рис. 6 – Признаки угнетения и истощения при сальмонеллёзе поросят
Патологоанатомические изменения. У поросят при остром течении болезни выражены кровоизлияния в селезёнке, почках, на слизистой оболочке мочевого пузыря, на эпикарде, слизистой оболочке желудка и кишечника, под лёгочной плеврой (Рис. 7, 8).
Рис. 7 – Кровоизлияния под капсулой почек
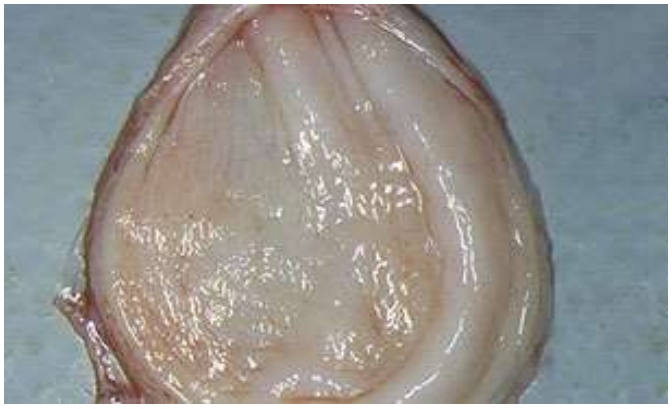
Рис. 8 – Кровоизлияния на слизистой оболочке мочевого пузыря
Дифференциальная диагностика. Следует исключить колибактериоз, анаэробные инфекции, классическую и африканскую чуму свиней, энзоотическую бронхопневмонию, дизентерию, пастереллёз, токсическую диспепсию.
ТЕРАПИЯ
В лечении эшерихиоза и сальмонеллеза много общего. Больных животных изолируют, организуют диетическое кормление и комплексное лечение. В качестве специфической терапии используют поливалентную антитоксическую сыворотку против сальмонеллеза и эшерихиоза телят, поросят, ягнят, овец и птиц, а также применяют бивалентную антитоксическую сыворотку против сальмонеллеза и колибактериоза телят. Используют в лечении также бактериофаг против сальмонеллеза и эшерихиоза телят и поросят.
Полезно давать препараты, содержащие ацидофильные культуры и лактобактерии.
После лечения антибиотиками животным целесообразно давать препараты, восстанавливающие нормальную микрофлору, в частности пробиотики.
Компания «Нита-Фарм» (Саратов, Россия) производит современное лекарственное средство «Доксилокс» широкого спектра действия в форме раствора для инъекций, предназначенный для лечения крупного рогатого скота, овец и свиней при заболеваниях бактериальной и микоплазменной этиологии. В 1 мл препарата содержится 200 мг доксициклина гиклата, а также вспомогательные компоненты, обеспечивающие пролонгированное действие.
Преимуществом препарата «Доксилокс» является:
— Доксициклин, по своей химической модификации, позволяет существенно повысить терапевтическую эффективность по сравнению с природными тетрациклинами;
— Особая технология производства, а также пролонгированные свойства доксициклина обеспечивают длительное нахождение доксициклина в организме в течение 48-72 часов, то есть полный курс антибиотикотерапии;
— Риск возникновения аллергических реакций существенно понижен за счёт химической структуры доксициклина;
— Растворимость в жирах обеспечивает хорошее проникновение в различные ткани;
— Отсутствие аккумуляции препарата в крови обуславливает хорошую переносимость животным;
— Экономичный расход препарата.
«Доксилокс» назначают крупному рогатому скоту, овцам и свиньям с лечебной целью при колибактериозе, сальмонеллезе и других инфекциях, вызванных чувствительными к доксициклину микроорганизмами, в том числе, пастереллезе, энзоотической пневмонии свиней, хламидиозе, а также при некоторых других заболеваниях бактериальной и микоплазменной этиологии.
Препарат применяют внутримышечно однократно в следующих дозах:
— свиньи – 0,5 мл на 10 кг массы животного (10 мг д.в. / кг).
При необходимости инъекцию лекарственного средства Доксилокс можно повторить через 48 часов.
ПРОФИЛАКТИКА
Одним из надежных средств профилактики эшерихиоза и сальмонеллеза является иммунизация стельных коров и супоросных свиноматок вакцинами против данных болезней.
Важный момент в профилактике сальмонеллеза и эшерихиоза – это вакцинация животных. Кроме парентерального введения вакцин, в последние годы широко применяют метод групповой аэрозольной иммунизации свиней против эшерихиоза, сальмонеллеза и рожи.
Мероприятий по специфической профилактике эшерихиоза и сальмонеллеза недостаточно для высокоэффективной борьбы с инфекциями.
Новорождённому молодняку рекомендуется применять колипротектант (протективный антиген из эшерихий). Препарат дают телятам перорально в первые 20- 30 мин. после рождения по 20- 40 мл, затем в той же дозе 5 раз с молозивом в течение 2 дней. В качестве профилактического средства можно использовать лактобревиколибактерин.
Корма, контаминированные возбудителями эшерихиоза и сальмонеллёза обеззараживают или уничтожают. Для дезинфекции помещений рекомендуется применять дезинфицирующее средство ГАН (производство ЗАО «Нита-Фарм» г. Саратов, Россия), предназначенное для дезинфекции объектов ветнадзора и профилактики инфекционных болезней животных. А также такие средства как горячий раствор гидроксида натрия; растворы хлорамина или гипохлора и другие.
Только комплекс мер, включая зоотехнический контроль и ветеринарно-санитарные мероприятия, позволит эффективно профилактировать заболевания, вызываемые E. coli и Salmonella.