что такое рнк препарат
Виды вакцин от COVID-19: какую выбрать
Оглавление
Сегодня поставить прививку от можно с использованием нескольких препаратов. Какие виды вакцин от ковида применяются в нашей стране? Чем они отличаются друг от друга? Какие прививки ставят в других странах? Давайте разберемся в этих вопросах.
Российские типы вакцин от ковида
В нашей стране в настоящий момент используются исключительно отечественные препараты.
Они разделяются на несколько групп:
Рассмотрим все вакцины от коронавируса более внимательно, определим их виды и отличия.
«Спутник V» (от Исследовательского центра имени )
Препарат создан на основе аденовируса (вируса, вызывающего ОРВИ) человека. Для разработки вакцины вирус лишили гена размножения. Благодаря этому он стал так называемым вектором (транспортным средством для доставки груза в клетки организма). В качестве груза в данном конкретном случае выступает генетический материал заболевания, против которого и работает препарат. Поступая в клетку, груз стимулирует выработку антител.
Важно! После введения первой дозы препарата организм человека от заражения еще не защищен. Это обусловлено тем, что антитела вырабатываются постепенно. Максимальный их уровень обеспечивается примерно через 2–3 недели после постановки второй прививки.
Иммунитет после вакцинации сохраняется примерно 2 года. При этом важно понимать, что антитела в крови присутствуют определенное количество времени, которое во многом зависит от индивидуальных особенностей пациента. В настоящий момент говорят о том, что хватает их примерно на год. При этом клеточный иммунитет сохраняется. Он защищает организм и после исчезновения антител.
«Спутник Лайт» (однокомпонентный вариант вакцины «Спутник V»)
Этот препарат отличается от исходного тем, что достаточно введения одной его дозы.
«ЭпиВакКорона» (от Центра «Вектор»)
Данная вакцина разработана на основе искусственно созданных фрагментов белков вируса. Благодаря этому она дает минимальное количество побочных эффектов. К основным относят возможную болезненность в месте инъекции и незначительное повышение температуры тела на короткое время. При этом и эффективность препарата является более низкой, чем у вакцины «Спутник V». Для повышения данного показателя проводится двукратная вакцинация с интервалом в 2–3 недели. На формирование иммунитета уходит около 30 дней. Ревакцинация по предварительным оценкам требуется примерно через 6–9 месяцев.
Разработчики уверяют, что препарат может обеспечить защиту организма от различных штаммов коронавируса. Но существует и другое мнение. Некоторые специалисты утверждают, что вакцина уязвима при мутациях вируса.
Иностранные виды вакцин от коронавируса
К ним относят: Pfizer/BioNTech и Moderna. Вирусные белки для производства препаратов синтезируются непосредственно в организме человека. Матричная РНК представляет собой своеобразную инструкцию. Прочитав ее, клетка начинает самостоятельно вырабатывать закодированный белок (фрагмент коронавируса). Препараты Pfizer/BioNTech и Moderna сегодня применяются для вакцинации в Великобритании, Израиле, странах Евросоюза, на Украине, в США и в других государствах. Прививки демонстрируют хорошую защиту от тяжелого течения заболевания. Это обусловлено тем, что вакцины проникают вглубь клеток, что имитирует инфицирование и приводит к формированию полноценного иммунитета. Недостатком препаратов является их недостаточная изученность.
Таким средством является вакцина AstraZeneca. Изготовлена она по принципу препарата «Спутник V». В качестве вектора в AstraZeneca выступает модифицированный вирус шимпанзе. Эффективность этой вакцины составляет 79%. При этом препарат на 100% защищает от тяжелого течения вирусной инфекции. Он используется в странах Евросоюза.
К ним относят Sinopharm и Sinovac.
Основными крупными поставщиками вакцин стали биофармацевтические компании из Китая. Они разработали препараты по принципу российского препарата «КовиВак». Вакцинация Sinopharm и Sinovac проводится не только в КНР, но и в Турции, ОАЭ, Чили, Аргентине и ряде других стран. Во время третьей фазы исследований определена общая эффективность препаратов, которая варьируется от 50% до 84%. При этом от тяжелого течения заболевания средства защищают на 100%.
Сравнение российских препаратов
Для правильного выбора прививки от коронавируса нужно сравнить между собой представленные препараты. Мы провели такое сравнение и оформили его в виде таблицы для вашего удобства.
| «Спутник V» | «Спутник Лайт» | «Кови Вак» | «Эпи Вак Корона» | |
|---|---|---|---|---|
| Срок формирования иммунитета (в днях) | 42 | 28 | Исследуется | 35-40 |
| Формирование антител (в процентах от вакцинированных) | У 98% | Почти у 97% | Исследуется | Более чем у 82% |
| Эффективность | Более 91% (в том числе для пациентов старше 65 лет) | Почти 80% | На стадии исследований | В настоящий момент не установлена |
Побочные эффекты вакцин
Необходимо сразу уточнить, что все побочные эффекты легкого и умеренного типов являются вариантом нормы.
В некоторых случаях также возможно развитие диареи.
После введения препарата пациент на 20–30 минут остается в медицинском учреждении. Это необходимо по причине риска развития аллергической реакции.
Преимущества обращения в МЕДСИ
Что необходимо знать о мРНК-вакцинах: 5 позиций
В результате беспрецедентной скорости в разработке новых вакцин, миру были представлены первые клинически одобренные мРНК-вакцины
В результате беспрецедентной скорости в разработке новых вакцин, миру были представлены первые клинически одобренные мРНК-вакцины для борьбы с пандемией Covid-19 – одна из них произведена Pfizer и BioNTech, другая – компанией Moderna. Испытания показали эффективность этих вакцин на уровне не менее чем 94%.
1. Технология мРНК вакцин не так молода, как кажется
Классический механизм работы вакцин (например, против полиомиелита и гриппа) заключается в презентации иммунной системе инактивированных частиц вируса. Другие вакцины (например, против гепатита B) используют отдельно взятый белок, являющийся частью инфекционного агента, чтобы вызвать схожий иммунный ответ.
мРНК-вакцины работают по другому принципу, «обманывая» иммунную систему таким образом, что РНК (в основном матричная мРНК) кодирует белок, который продуцируется в клетке путем трансляции и представляется иммунной системе; он действует как антиген. Иммунная система учится избирательно бороться с клетками, экспрессирующими такие антигены, такими как клетки-хозяева, инфицированные вирусами, или опухолевые клетки.
Хотя вакцины от Pfizer/BioNTech и Moderna – первые препараты, одобренные в клинической практике, сама технология мРНК-вакцин существует относительно давно. Первые испытания в онкологии с использованием схожих технологий берут свое начало еще в 2011 году.
2. мРНК-вакцины не изменяют ДНК
Существуют абсолютно необоснованные опасения, что мРНК-вакцины способны изменять ДНК. На самом же деле мРНК не входит в ядро клетки, а после своего введения биодеградирует в течение нескольких дней. Именно поэтому для формирования полноценного иммунного ответа необходимо 2 инъекции препарата.
3. мРНК-вакцины имеют высокую специфичность
Вирус SARS-CoV-2 имеет достаточно сложную структуру и его различные части стимулируют иммунную систему на образование нейтрализующих антител, которые не всегда способны эффективно элиминировать инфекцию. мРНК-вакцины стимулируют иммунный ответ к спайк-белку вируса, являющегося только частью вирусной мембраны.
4. Разработчики и эксперты не «срезали углы» во время клинических испытаний
Испытания вакцин начались с доклинической фазы, проводимой на животных, а затем постепенно переходили на 1-ую, 2-ую и 3-ю фазы. Например, 3-я фаза вакцины от Pfizer/BioNTech включает более 40 000 человек, исследования эффективности и безопасности будут продлжаться следующие 2 года.
Основные проблемы, связанные с использованием вакцины, обычно возникают в первые 2 месяца. Тем не менее, не исключены редкие побочные эффекты на больших выборках в миллионы людей, поэтому за вакцинированными необходимо пристальное наблюдение, особенно с учетом инновационной природы технологии.
5. Вакцина запускает воспалительные реакции
Частично вакцина работает путем индуцирования локальных иммунных реакций, поэтому воспалительные признаки в месте инъекции и небольшой дискомфорт в первые дни – вполне нормальное явление.
Что отличает вакцины против COVID-19 на основе информационной РНК (иРНК)?
Специалист по инфекционным заболеваниям Тобиас Холь объясняет, что вакцина на основе информационной РНК побуждает собственные клетки организма вырабатывать фрагмент белка, обнаруженный в возбудителе COVID-19, и это вызывает защитную иммунную реакцию.
В вакцинах Pfizer-BioNTech (Comirnaty®) и Moderna против COVID-19 использована информационная рибонуклеиновая кислота (иРНК), вызывающая иммунную реакцию, которая может защитить от заражения в будущем. Специалист центра Memorial Sloan Kettering по инфекционным заболеваниям Тобиас Холь рассказывает о технологии изготовления вакцин на основе иРНК и о том, как они могут изменить дальнейший ход развития пандемии.
Каков механизм действия вакцин против COVID-19 на основе информационной РНК (иРНК)?
Традиционные вакцины предполагают введение в организм ослабленного или инактивированного возбудителя инфекции. Вакцины на основе информационной РНК (иРНК), например вакцины против COVID-19 Pfizer и Moderna, учат клетки вырабатывать белок, который запускает иммунную реакцию в случае заражения. После введения вакцины в плечо иРНК попадает в клетки вблизи места инъекции и побуждает их начать выработку того же белка, который обнаружен в возбудителе COVID-19. Иммунная система распознает этот белок и начинает вырабатывать антитела, которые могут бороться с вирусом в случае последующего заражения вакцинированного человека.
Правда: ни одна из вакцин никоим образом не взаимодействует с ДНК и не изменяет ее и, следовательно, не может вызывать рак. Информационная РНК — это не то же самое, что ДНК, поэтому она не может объединяться с ДНК и изменять генетический код. Информационная РНК хрупкая — передав инструкции вашим клеткам, она разрушается и выводится из организма (примерно через 72 часа). Информационная РНК даже не попадает в ядро клетки — ту часть, где содержится ДНК. Следовательно, миф о том, что вакцина на основе иРНК может каким-то образом блокировать активность генов, подавляющих раковые опухоли, не соответствует действительности.
Вакцина против COVID-19 не подвергает вас воздействию вируса, вызывающего COVID-19.
Есть ли другие вакцины на основе иРНК?
Это первые вакцины на основе иРНК, которые будут выпущены и испытаны в ходе крупномасштабных клинических исследований 3 фазы с участием человека. Преимущество технологии использования иРНК в сравнении с традиционными подходами состоит в том, что она обеспечивает более быструю разработку и расширение производства. Разработка вакцин традиционно длилась десятилетиями. То, что мы имеем на сегодняшний день, — невероятное научное достижение. Год назад большинство людей даже не слышали об этом заболевании, а сейчас уже началась вакцинация против него среди работников сферы здравоохранения.
Почему вакцины на основе иРНК необходимо хранить при такой низкой температуре?
Если иРНК не хранится при низкой температуре, она легко и быстро распадается. После введения в организм это не представляет проблемы, так как иРНК не нужно много времени, чтобы выполнить свою функцию. Однако может возникнуть необходимость сохранять вакцины в стабильном состоянии в течение нескольких дней или даже недель, прежде чем они будут введены. С традиционными вакцинами это практически не имело значения. Ослабленные или инактивированные версии вируса могут оставаться стабильными в течение более длительного времени без низких температур.
В ходе клинических исследований вакцина Pfizer хранилась при –70 градусах Цельсия (–94 градуса по Фаренгейту), что предполагает использование сухого льда. Вакцина Moderna хранилась при –20 градусах Цельсия (–4 градуса по Фаренгейту), что ближе к температуре в обычном холодильнике. Обе вакцины по-прежнему следует хранить замороженными — одобрение вакцины происходит на основании данных, полученных в ходе клинических исследований, поэтому необходимо, чтобы условия оставались такими же.
Почему вакцины вводятся двумя дозами с интервалом в несколько недель?
Двухдозовый подход распространен в случае многих вакцин для детей. Идея в том, что первая прививка подготавливает иммунную систему, помогая ей распознать вирус, а вторая усиливает иммунную реакцию. Вторая прививка вакциной Pfizer проводится через три недели после первой; для вакцины Moderna этот интервал составляет четыре недели. Важно, чтобы обе прививки были сделаны одной и той же вакциной, и чтобы были соблюдены те же процедуры, которые обеспечили такие успешные результаты в ходе клинических исследований.
Как люди могут быть уверены в том, что эти вакцины на основе иРНК эффективны и безопасны?
Сейчас мы располагаем данными в отношении десятков тысяч людей, которые свидетельствуют о более чем 90%-ной эффективности этих вакцин в том, что касается предотвращения инфекции.
У некоторых людей возникают легкие или умеренные побочные эффекты, но длятся они недолго — около одного–трех дней. Наиболее распространенные побочные эффекты включают боль в месте инъекции, слабость (чувство усталости), головную боль, ломоту и повышенную температуру. Чаще они возникают после второй прививки, и вам, возможно, придется больше отдыхать. Серьезные побочные эффекты возникают редко и поддаются лечению. Специалисты Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США (US Food and Drug Administration) и Центра контроля и профилактики заболеваний (Centers for Disease Control and Prevention) до сих пор наблюдают — и будут продолжать наблюдать — за состоянием участников клинических исследований, а также граждан, которые прошли вакцинацию.
Людям важно понимать, что эти данные проверяются независимыми группами специалистов, не связанными с фармацевтическими компаниями, производящими препараты. Это специалисты, которые не имеют никакой заинтересованности в разработке или коммерческой реализации вакцин. Лично я без колебаний пройду вакцинацию любой из этих вакцин. Я собираюсь рекомендовать своим родственникам и коллегам сделать то же самое.
Вакцины являются среднесрочным или долгосрочным решением проблемы пандемии. Однако мы не можем отказаться от краткосрочных мер, об эффективности которых нам уже известно, таких как ношение маски, социальное дистанцирование и мытье рук. Мы уже видим свет в конце тоннеля.
Подавление экспрессии мутантного гена TTR, вызывающего семейную амилоидную полинейропатию: РНК-индуцируемый комплекс выключения гена (RISC) совместно с интерферирующей РНК (siRNA) бесстрашно летит навстречу злобной патогенной мРНК-мишени, предвкушая расправу.
иллюстрация авторов статьи
Авторы
Редакторы
Статья на конкурс «био/мол/текст»: Патисиран — первый препарат на основе РНК-интерференции, одобренный FDA, — не только спасает жизни людей, страдающих амилоидной полинейропатией. Он начинает писать новую страницу в терапии, о которой мечтали с момента открытия этого механизма подавления экспрессии генов, то есть уже более 20 лет. С какими сложностями сталкивались ученые и как их преодолели? Об этом вы можете узнать в нашей статье.
Конкурс «био/мол/текст»-2018
Эта работа опубликована в номинации «Биофармацевтика» конкурса «био/мол/текст»-2018.
Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Спонсором приза зрительских симпатий выступил медико-генетический центр Genotek.
Амилоиды в первую очередь ассоциируются с болезнью Альцгеймера. Однако амилоидозы — это целая группа заболеваний, связанная с неправильным сворачиванием белка, приводящим к накоплению в тканях нерастворимых фибрилл. Подробнее об этом написано в статье «На руинах памяти: настоящее и будущее болезни Альцгеймера» [1].
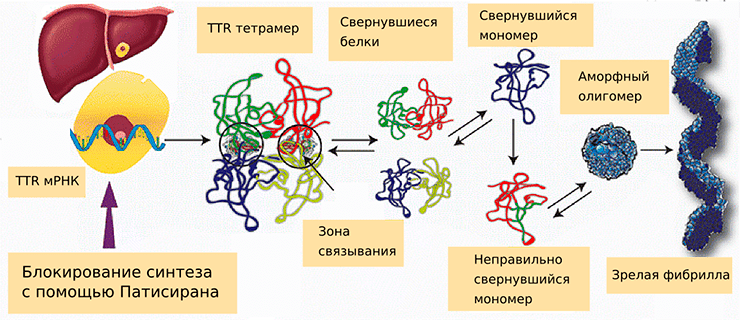
Семейная амилоидная полинейропатия (FAP), или наследственный транстиретиновый амилоидоз (hATTR), связана с различными точечными мутациями в гене, кодирующем транстиретин (TTR). В норме он вырабатывается гепатоцитами и осуществляет транспорт витамина А вместе с тиреоидными гормонами к периферическим тканям. Определенные мутации способствуют тому, что мономеры этого белка неправильно сворачиваются и образуют аморфные олигомеры, которые сливаются в фибриллы (рис. 1). По некоторым данным, именно небольшие олигомеры обладают наибольшей токсичностью в клетках [2].
Рисунок 1. Синтез мутантного варианта транстиретина и влияние на этот процесс патисирана. Без лечения мРНК TTR транслируется в белок, который в норме состоит из четырех субъединиц. Мутантные мономеры белка сворачиваются неправильным образом и образуют аморфные олигомеры, кластеры нефиксированного размера, сливающиеся в фибриллы. Образование фибрилл может привести к развитию нейродегенеративных заболеваний и проблемам с сердечно-сосудистой системой.
Рисунок 2. Связь генотипа с клиническими проявлениями при транстиретиновом амилоидозе (hATTR). До появления патисирана спасением для таких пациентов являлась трансплантация печени. В Европе также используют препарат тафамидис, который стабилизирует транстиретин. Он связывается с тетрамером и не дает ему диссоциировать на мономеры. Однако в США он так и не смог получить одобрение [5].
Человечество стремится познать природу, которая порой нашептывает удивительные решения многих наших задач. Приоткрывая завесу тайны жизни организмов, мы видим изумительные механизмы, созданные эволюцией. Так, например, система CRISPR/Cas, обеспечивающая адаптивный иммунитет прокариот, уже не один год вдохновляет ученых на создание генной терапии с ее помощью. О системе можно почитать в статьях «Просто о сложном: CRISPR/ Cas» [6] и «Когда ослепшие прозреют?» [7].
А вот один из молекулярных механизмов эукариот уже подарил нам первое лекарство и надежду на лечение огромного спектра заболеваний. Попробуем разобраться в тернистом двадцатилетнем пути с момента открытия РНК-интерференции до первого официально одобренного FDA (Food and Drug Administration, Управление США по контролю за лекарствами и пищевыми продуктами) препарата.
Итак, как же эукариоты «выключают» гены и зачем?
Воздействовать на белок мы можем принципиально тремя способами. Можно придумать молекулу, которая будет связываться с уже синтезированным белком, препятствуя его работе, или, напротив, побуждая его к действию. Так работает большинство лекарств, например, известный анальгетик и жаропонижающее средство ибупрофен ингибирует фермент циклооксигеназу (ЦОГ), уменьшая выработку простагландинов — веществ, ответственных за воспаление [20].
Но ученые мечтают о новых возможностях: о выключении таргетного гена, вызывающего генетическое заболевание, на уровне ДНК (нокаут) и о выключении без затрагивания самой последовательности ДНК на уровне РНК (нокдаун).
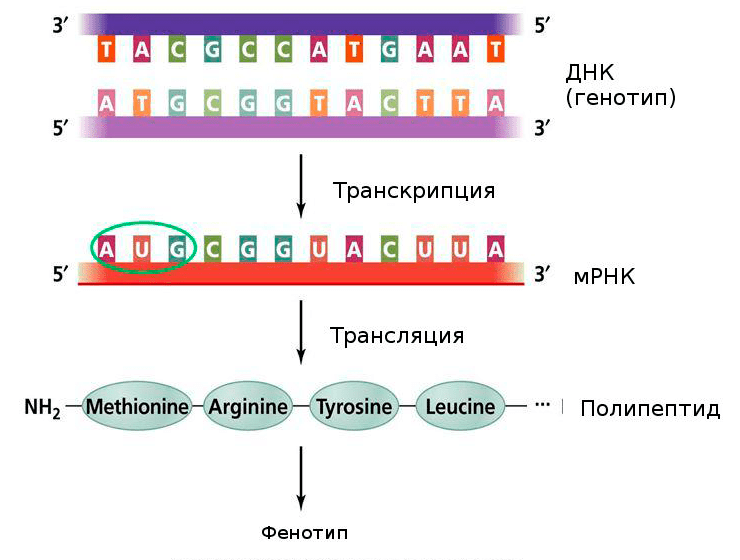
Рисунок 3. Центральная догма молекулярной биологии. Генетическая информация, закодированная в ДНК, переходит в мРНК, и уже с нее синтезируется полипептидная последовательность. Нуклеотиды одной цепочки нуклеиновой кислоты могут быть соединены с нуклеотидами другой по правилу комплементарности. В процессе транскрипции синтезируется смысловая цепь мРНК, и, зная ее последовательность, мы можем синтезировать комплементарную ей цепочку, или антисмысловую цепь.
Pearson Education, Inc., publishing as Benjamin Cummings
В своей работе 1996 года Эндрю Файр (Andrew Fire) и Крейг Мело (Craig Mello) на модельном объекте Caenorhabditis elegans (нематоде) показали, что при внесении двухцепочечной РНК можно полностью «выключить» ген. Как оказалось, происходит это от того, что антисмысловая цепь РНК, комплементарная гену-мишени, вместо ожидаемого повышения экспрессии гена (ведь мы вносим матрицу для трансляции белка) блокирует его синтез. Немногим позже, в 2006 году, за первое применение РНК-интерференции (RNAi) ученые получили Нобелевскую премию [8].
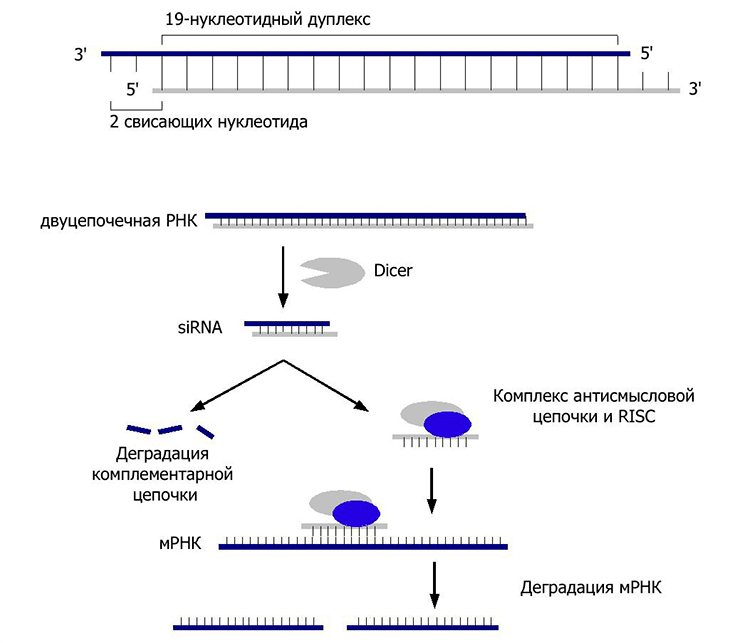
Процесс начинается с того, что поступившая в клетку экзогенная двухцепочечная РНК связывается с рибонуклеазой Dicer (да-да, как та самая овощерезка), которая нарезает ее на небольшие фрагменты длиной 20–25 пар нуклеотидов, с двумя неспаренными основаниями на каждом конце. Такая длина, видимо, оказалась оптимальной для специфического связывания с мишенью. Эти фрагменты взаимодействуют с белковым комплексом RISC, который отщепляет одну из цепей РНК, оставляя вторую на съедение нуклеазам (ферментам, расщепляющим нуклеиновые кислоты), и путешествует с ней по клетке в поисках таргетной мРНК. Обнаружив ее, белок Аргонавт из комплекса RISC разрезает свою мишень (рис. 1 и 4).
Рисунок 4. РНК-интерференция. Сверху представлена схема строения малой интерферирующей РНК (siRNA). Экзогенная двухцепочечная РНК разрезается ферментом Dicer и встраивается, расплетаясь, в белковый комплекс RISC. Готовый к работе, совместно с siRNA, он путешествует по клетке. При встрече с комплементарной мРНК комплекс индуцирует ее деградацию. Таким образом, клетка уничтожает потенциально вирусную РНК, препятствуя синтезу вирусных белков, а также борется с транспозонами.
Этот механизм выполняет защитную функцию против вирусов, которые стремятся заполучить контроль над клеткой, предоставляя ее белковой машинерии инструкции по производству вирусных агентов. Также интерферирующие РНК могут быть полезны клетке в борьбе с мобильными генетическими элементами, которые активируются при делении клетки и нарушают нормальную работу ее генетического аппарата.
Также стоит отметить, что РНК-интерференция является не единственным механизмом регуляции экспрессии генов. Для трансляции необходимо, чтобы мРНК была одноцепочечной, поэтому при попадании одноцепочечной антисмысловой РНК в клетку блокируется процесс синтеза белка, а также активируется РНКаза H, разрушающая транскрипт.
В каких случаях мы можем использовать этот изящный механизм?
Нокаут генов активно применяется в лабораторной практике, в биоинженерии и биотехнологии. Геном можно редактировать с помощью рестриктаз с последующим сшиванием лигазами, воздействовать ретровирусами, несущими правильную копию поврежденного гена, а также использовать уже упоминавшийся метод геномного редактирования с помощью CRISPR-Cas9 — системы белков и РНК. Смотрите подробнее в статьях «12 методов в картинках: генная инженерия. Часть II: инструменты и техники» [11] и «Человек генномодифицированный / Homo genere mutatio» [12].
Проблема с применением большинства таких методов для лечения человека заключается в низкой селективности редактирования, что может вносить дополнительные мутации в геном. Клетки могут перерождаться в раковые, уходить в апоптоз. Данные побочные действия затрудняют применение описанных подходов для лечения генетических заболеваний человека.
Всего этого можно избежать, выключая гены с помощью РНК-интерференции. Очень перспективна разработка антивирусных лекарств, препятствующих связыванию вирусных белков с таргетной клеткой, а также противоопухолевых препаратов.
Так что же останавливало ученых в реализации этой простой идеи?
Все, кто работал в лаборатории с РНК, знают ее коварство: она быстро деградирует под действием РНКаз, находящихся на поверхности кожи, в слюне, и в большом количестве в кровяном русле. Получается, что препарат просто не успевает добраться до нужных клеток, гены которых необходимо выключить с помощью RNAi.
После долгих и дорогостоящих попыток фармкомпании практически потеряли надежду на терапевтическое применение этого механизма. Однако решение было найдено [13]. Сегодня у одной только компании Alnylam известно семь препаратов на основе РНК-интерференции, находящихся на разных стадиях клинических испытаний (табл. 1).
Мишенями таких лекарств являются не только заболевания, связанные с образованием амилоидных бляшек, но и широкий спектр системных дисфункций. Примеры лекарств, разрабатываемых для лечения таких заболеваний, можно найти в статье «Есть ли смысл в антисенсах?» [10].
| Лекарство | Заболевание | Стадия клинических испытаний |
|---|---|---|
| Patisiran | Наследственный АТТР амилоидоз | Одобрен |
| Givosiran | Острые печеночные порфирии | Поздняя стадия (фаза 2–3) |
| Fitusiran | Гемофилия и редкие кровотечения | Поздняя стадия (фаза 2–3) |
| Inclisiran | Гиперхолестеринемия | Поздняя стадия (фаза 2–3) |
| ALNTTRsc02 | АТТR амилоидоз | Ранняя стадия (фаза 1–2) |
| Lumasiran | Первичная гипероксалурия типа 1 | Ранняя стадия (фаза 1–2) |
| Cemdisiran | Болезни, связанные с системой комплемента | Ранняя стадия (фаза 1–2) |
| * Интересно, что некоторые препараты несут в себе название siRNA, например, Givosiran, Inclisiran; а некоторые препараты, являющиеся антисмысловыми цепочками РНК — Alicaforsen, Inotersen. | ||
Патисиран — первый олигонуклеотидный препарат на основе РНК-интерференции
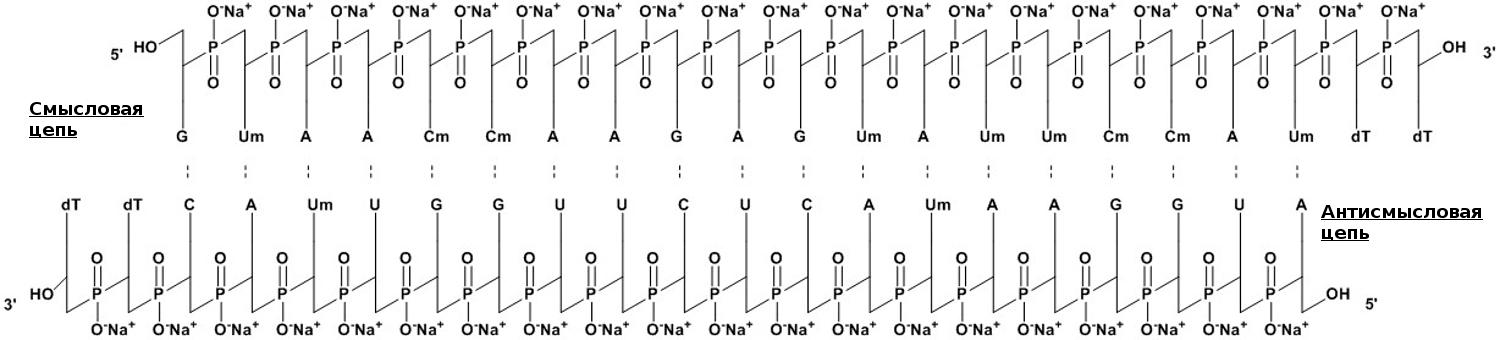
Лекарственная форма патисирана (коммерческое название — Onpattro, «Онпаттро») состоит из РНК, завернутой в липидные наночастицы (LNPs). При создании действующего вещества разработчики использовали короткие, по 21 паре нуклеотидов, двухцепочечные РНК, которые предварительно модифицировали метильной группой, присоединяемой к атомам кислорода (О-метилировали) [15], и защищали с 3′ конца для увеличения стабильности молекулы (рис. 5).
Как вообще можно увеличить стабильность РНК?
Этого можно добиться разными способами. Например, на практике используют комбинации метилирования, блокирования конца или «слабых» мест молекулы с помощью специальных белков и реагентов, а также формирование вокруг лекарственной молекулы защитной оболочки.
Рисунок 5. Нуклеотидная составляющая патисирана представляет собой короткую 21-буквенную двуцепочечную РНК из смысловой и антисмысловой цепей, которая комплементарна таргетному гену транстиретина (TTR). Для бóльшей устойчивости, некоторые из нуклеотидов О-метилированы (Um, Cm), а на 3′ концах пришиты два тимидина (dT). Молекулярная формула лекарства — C412H480N148Na40O290P40. Молекулярный вес составляет 14 304 Да.
Впервые система доставки малых двухцепочных РНК была предложена в 2010 году и после развивалась вплоть до первого успешного клинического испытания в 2016, которое показало возможность применения РНК-интерференции для лечения генетических заболеваний человека [13].
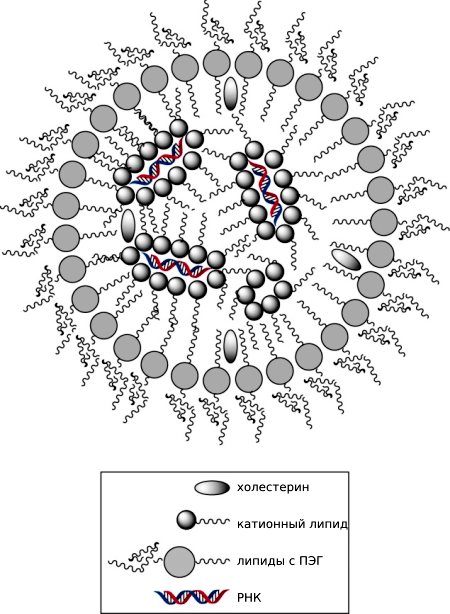
Липидные наночастицы, защищающие РНК, состоят из внешнего слоя, образованного липидами с полиэтиленгликолем и холестерином, и внутренней полости, заполненной буфером, в которой находятся окруженные катионными частицами интерферирующие агенты (рис. 6).
Рисунок 6. Строение липидных наночастиц. Для создания липидных наночастиц эмпирически был разработан специальный протокол, сочетающий различные буферы и типы липидов: смешиваются ионизированные катионные липиды с siRNA в буфере с низкой ионной силой, за счет чего РНК сближаются с липидами и собираются в наночастицы (разноименные заряды катионных липидов и РНК притягиваются). Далее собранные структуры покрываются вспомогательными липидами, холестерином и липидами с полиэтиленгликолем (ПЭГ).
Таким образом, препарат таргетно доставляется в гепатоциты — клетки, продуцирующие амилоидный транстиретин.
Клинические испытания
Любое лекарство проходит через несколько так называемых фаз клинических испытаний перед тем, как будет допущено к продаже и широкому клиническому применению. Узнать больше можно из статей спецпроекта «Клинические испытания».
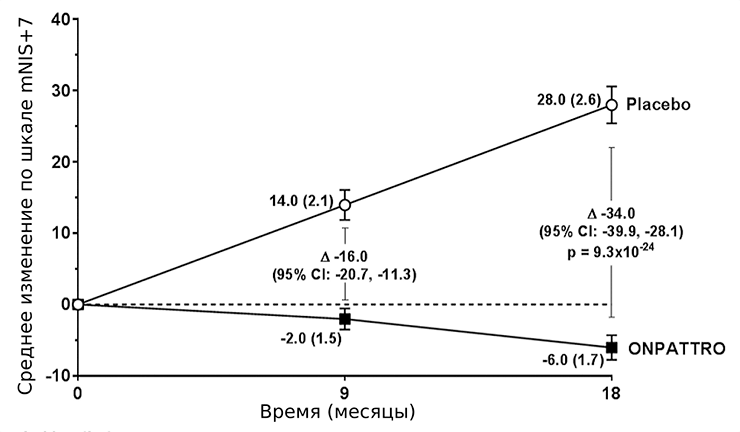
Для патисирана все клинические испытания прошли успешно. В последней, третьей фазе участвовало 225 пациентов с наследственным транстиретиновым амилоидозом (hATTR), из которых 77 получали плацебо. Ключевым показателем оценки состояния пациентов являлась модифицированная шкала ухудшения нейропатии (mNIS+7). Также использовали тест на ходьбу на расстояние 10 м, оценку индекса массы тела и опрос о качестве жизни. Наблюдение продолжалось в течение 18 месяцев. mNIS+7 ранжируется от 0 до 304 баллов: чем больше, тем хуже состояние пациента (рис. 7). По всем показателям выявили значимое улучшение состояния пациентов по сравнению с группой, принимавшей плацебо [16].
Рисунок 7. Динамика изменений средних значений модифицированной шкалы ухудшения нейропатии (mNIS+7). Разница между группами составляет 34,0 пунктов при p
Во время клинических испытаний возникли побочные эффекты: у 10% пациентов, принимавших лекарство, и 3%, принимавших плацебо, выявили инфекции верхних дыхательных путей. У всех пациентов наблюдали падение концентрации витамина А в крови (вспомним функции транстиретина).
FDA одобрило лекарство для всех стадий заболевания 10 августа 2018 года — так, патисиран стал не только первым одобренным препаратом для лечения наследственного транстиретинового амилоидоза, но и первым одобренным средством, в механизме работы которого лежит РНК-интерференция [17].
Комитет по лекарственным средствам для человека (CHMP), входящий в Европейское агентство лекарственных средств (EMA), рекомендовал предоставить разрешение на применение патисирана для лечения наследственного транстиретин-опосредованного амилоидоза у взрослых пациентов с полинейропатией 1 или 2 стадий. Значимого улучшения состояния пациентов с 3 стадией заболевания, по результатам клинических тестов и судя по комментариям представителя компании, достичь не удалось.
Лекарство будет доступно в виде раствора для внутривенного введения с концентрацией активного компонента 2 мг/мл. Примечательна периодичность инъекций: один раз в три недели.
Компания Alnylam предоставляет несколько типов финансовых тарифов для пациентов разных категорий. Рассмотрим два из них:
Нам удалось узнать подробнее о планах компании Alnylam на расширение рынка препарата. На данный момент патисиран доступен на территории США, о продаже на территории России речи пока не идет. Авторы надеются, что с течением времени терапия станет ближе для бóльшего числа больных.
Кто нас ждет теперь?
Как мы смогли убедиться, создание RNAi-препаратов сопряжено с огромными трудностями, связанными с доставкой хрупких РНК к клеткам. Сегодня остается еще много вопросов касательно дизайна и применения липидных наночастиц.
Это перспективное направление открывает, в первую очередь, невероятные возможности для лечения генетических заболеваний человека. Доказанная эффективность патисирана способствует дальнейшему исследованию РНК-интерферирующих агентов, их применению в клинической практике и еще большему накоплению багажа знаний. Возможно, когда-нибудь, мы увидим в аптеках волшебные лекарства против всего, а, может быть, приблизимся к «Дивному новому миру» Олдоса Хаксли. Время покажет.