что такое резус система d гемагглютинация rh положительная
Что такое резус система d гемагглютинация rh положительная
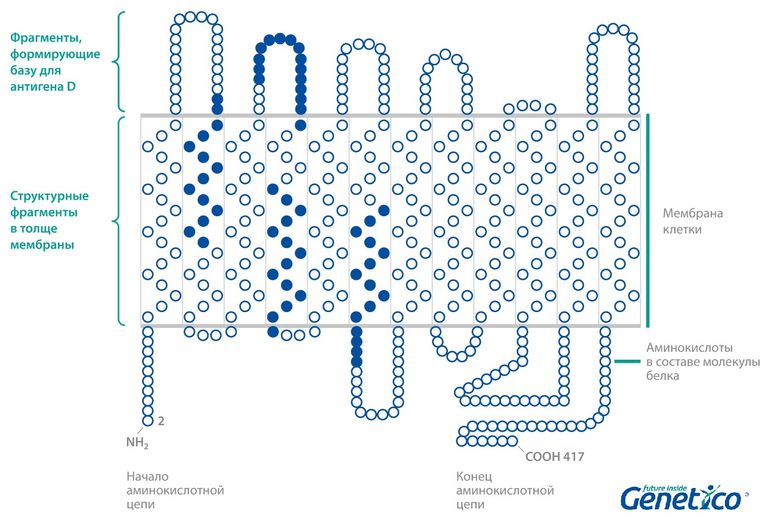
В этой статье мы расскажем о редких вариантах гена RHD и особенностях оценки риска возникновения резус-конфликта. Гены RHD и RhCE у человека работают вместе: они кодируют белки, которые формируют в мембране комплекс, образовывающий базу для антигенов D (резус-фактор), C, c, E, e. Эти белки представляют собой как бы нитки, прошивающие мембрану петлями: их небольшие фрагменты торчат из мембраны, а основная часть находится в ее толще. То есть какие-то аминокислоты белка выполняют строительную функцию – держат белок в мембране, а другие основную – формируют площадку для антигена.
Если гена RHD нет из-за делеции этого участка хромосомы, то и белка на мембране нет. В таком случается получается истинный Rh- фенотип. Однако в редких случаях ген RHD не полностью отсутствует, а несет в себе мутацию. Тогда структура соответствующего белка может нарушаться и приводить не к полному отсутствию антигена D, а к разным промежуточным состояниям. Например, мутации, приводящие к изменению в тех частях белка, которые находятся в толще мембраны, могут влиять на способность белка держаться на поверхности клетки: то есть и ген RHD на месте, и белок нормально синтезируется, однако он с трудом встраивается в мембрану и потому его может быть настолько мало на поверхностях клеток, что иммунная система человека будет их замечать, а вот биохимические методы анализ на резус-фактор – не будут. В случае такого рода мутаций в гене RDH генотип называется Weak D или DEL вместо Rh-. Также при мутациях, затрагивающих выступающие из мембраны участки, антиген D будет неполноценным, так как площадка для его формирования будет неполная или не совсем верная, что тоже может привести к ложным результатам при биохимическом анализе крови. Такой генотип носит название Partial D.
Почему все это важно? Дело в том, что чаще всего статус резус-фактора определяют биохимически по анализу крови. Это значит, что в лаборатории есть антитела к антигену D, эти антитела капают на специально подготовленный препарат крови и смотрят, насколько сильно будет светиться специфическая метка. Если она светится слабо или сигнала нет совсем – это означает, что антителам не с чем было связываться, то есть антигена D на поверхности клеток в анализируемой крови не было. Для обычной ситуации – присутствие или отсутствие гена RHD – этот способ прекрасно работает, но он не позволяет отличить Rh+ гомо- и гетерозигот, поэтому его используют как скрининговый – простой и недорогой метод для первичного обследования. Однако в случае частичной делеции RHD или различных мутаций он срабатывает неправильно. При проверке работы четырех разных наборов реагентов для биохимического анализа крови на резус на 500 образцах для 2% образцов были получены неоднозначные результаты. После генетического тестирования оказалось, что именно эти образцы имели генотип Partial D или Weak D.
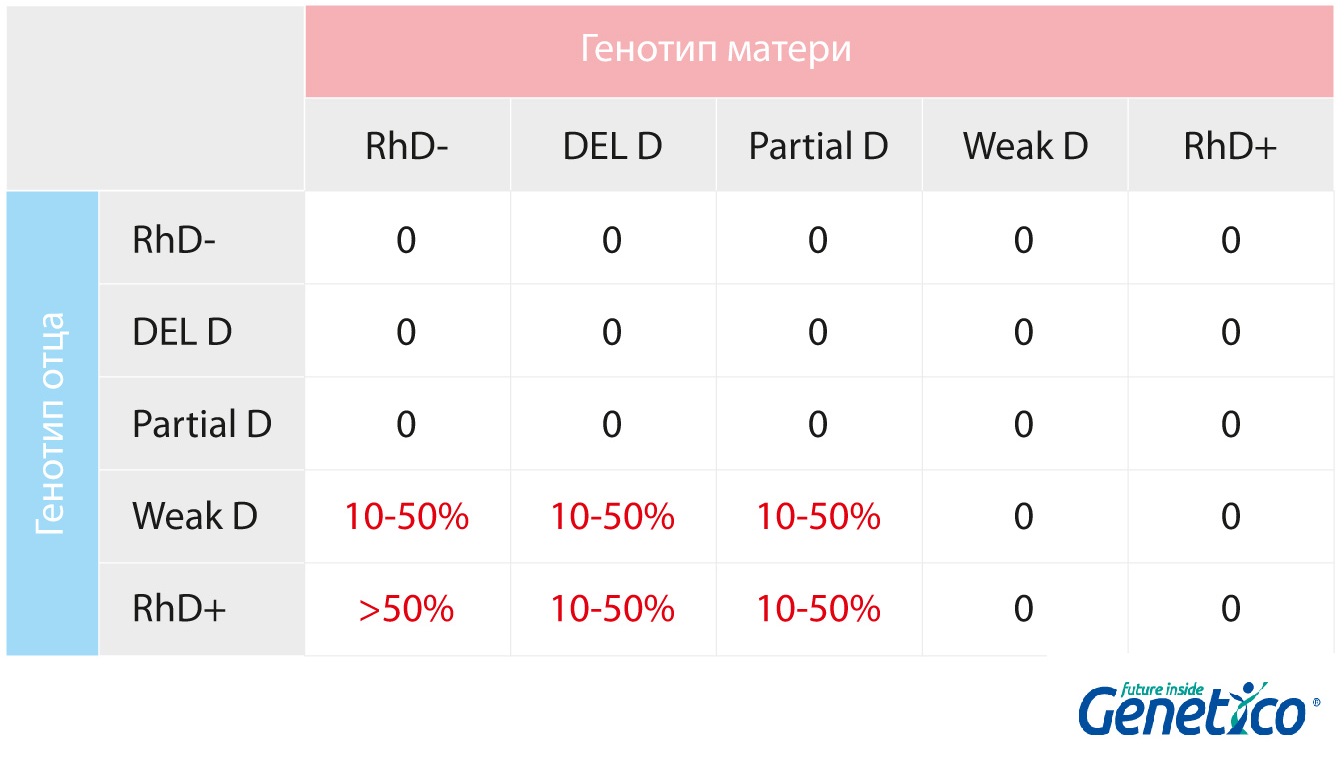
Примерные оценки вероятности развития резус-конфликта при разных сочетаниях генотипов родителей:
Опасность неправильного определения резус-статуса в сложных ситуациях заключается в том, что пара не будет подозревать о рисках, пока не возникнет опасная для жизни и здоровья малыша ситуация. Важно понимать, что главной проблемой при резус-конфликте является то, что организм матери не знаком с антигеном D как с нормальным, «своим», поэтому клетки, отмеченные этим антигеном, начинают отторгаться. При этом иммунная система может познакомиться с этим антигеном как со «своим» даже если этого антигена на поверхности клеток совсем немного, настолько немного, что биохимические методы ставят статус Rh-. В таком случае тревога о возможности развития резус-конфликта у женщины с таким неверным биохимическим анализом будет ложной. С другой стороны, если такой неверный результат будет выдан будущему отцу, то это может привести к развитию резус-конфликта, так как несмотря на биохимически отрицательный резус, ген RHD у отца присутствует и антиген D на поверхности клеток тоже есть. Таким образом, наиболее точный результат получается в результате генетического анализа гена RHD и гена RHCE, методом MLPA. Он позволит идентифицировать наличие/отсутствие гена RHD у будущих родителей, идентифицировать особые состояния этого гена, выявить гомо/гетерозиготность каждого партнера по этим показателям и более эффективно оценить не только вероятность развития резус-конфликта, но и целесообразность различных превентивных или терапевтических мер по устранению этого осложнения при беременности.
Важно помнить, что эти необычные ситуации все же редкость, и в большинстве случаев простой биохимический анализ крови дает верный результат. То есть после него резус-положительные женщины чаще всего спокойно беременеют вне зависимости от генотипа мужа по гену RHD, у резус-отрицательных женщин с резус-отрицательным партнером в большинстве случаев также нет проблем, а резус-отрицательные будущие мамы с резус-положительным отцом отправляются на дополнительные анализы для оценки рисков. Однако, к сожалению, вероятность несовпадения биохимического результата и истинного фенотипа, хоть и мала, но присутствует и может привести к катастрофическим для семьи результатам. Самое безопасное решение – узнать свой генотип по этим генам, который позволит совершенно точно узнать о том, есть ли повод для беспокойства.
Определение основных групп по системе AB0 и антигена D системы Резус (резус фактор)
Подобрать анализы
Комплексное исследование, позволяющее оценить принадлежность крови пациента к одной из групп по системе ABO и определить наличие/отсутствие Rh-антигена.
Система АВO – основная система совместимости крови. Она представлена агглютиногенами A и B, являющимися гликопротеинами и расположенными на поверхности эритроцитов, и агглютининами альфа и бета, относящимися к классу иммуноглобулинов IgM и циркулирующих в плазме крови. В зависимости от комбинации этих агглютиногенов и агглютининов, выделяют 4 группы крови по системе АВО.
Первая (I) группа крови (самая распространенная в европейской популяции, 42 % населения) также называется O-группа, при ней на поверхности эритроцитов агглютиногены A или B отсутствуют, в плазме выявляются агглютинины альфа и бета.
Вторая (II) группа крови (37 %) также называется A-группа, на поверхности эритроцитов присутствует агглютиноген A, в плазме выявляется агглютинин бета.
Третья (III) группа крови (13 % населения) также называется B-группа крови, на поверхности эритроцитов присутствует агглютиноген B, в плазме выявляется агглютинин альфа.
Четвертая (IV) группа крови (самая редкая, всего 8 % населения) также называется AB-группа крови, на поверхности эритроцитов присутствуют агглютиногены обоих типов A и B, в плазме агглютинины альфа и бета отсутствуют.
Система резус также состоит из нескольких антигенов, главный из которых называется антиген D, или резус-фактор. Примерно у 85 % людей на поверхности эритроцитов можно выявить резус-фактор (резус-положительная кровь). Принадлежность крови человека к определенной группе по системе АВО и системе резус является генетически обусловленной и не меняется в течение всей жизни.
Определение группы и резус-фактора крови имеет наибольшее значение при подготовке к переливанию крови. Такая необходимость может возникнуть при тяжелой кровопотере, тяжелых формах гемолитических анемий, заболеваниях костного мозга с нарушением нормальной продукции эритроцитов, а также при проведении объемных хирургических операций. Группу крови по системе ABO и системе резус учитывают не только при переливании эритроцитарной массы, но также и при переливании других компонентов крови (тромбоцитарная масса, лейкоцитарная взвесь и др.). Определение группы крови является обязательным тестом при беременности. В этом случае данные о группе крови пациентки и в некоторых случаях о группе крови отца ребенка учитываются для своевременной диагностики и лечения иммунологического конфликта (обусловленного несовместимостью крови плода и матери) и возникающего при этом гемолиза эритроцитов плода. Обязательному обследованию на группу крови и резус-фактор также подлежат военнослужащие, бойцы МЧС и других силовых структур.
Так как в основе лабораторного метода определения групп крови лежит реакция агглютинации, то наличие в сыворотке больного специфических белков (М-протеина, холодовых антител) или некоторых бактерий, препятствующих этой реакции, может приводить к получению ложноположительных или ложноотрицательных результатов. Также прием некоторых лекарственных препаратов может отражаться на результатах определения резус-фактора. Поэтому особое внимание следует уделить подготовке к тесту.
Резус (Rh) – одна из важнейших систем эритроцитарных антигенов (наряду с системой АВ0), клинически значимая не только для безопасного переливания крови, но и при ведении беременности (при оценке возможности возникновения резус-конфликта и риска развития гемолитической болезни плода и новорожденного).
Антиген RhD является наиболее иммуногенным (т.е. способным вызывать иммунный ответ (образование антител) у лиц, не имеющих этого антигена) из антигенов системы резус, его наличие на поверхности эритроцитов обуславливает положительную резус-принадлежность. Наличие этого структурного белка мембраны эритроцитов является генетически наследуемым признаком. В составе антигена RhD выделяют структурные единицы – эпитопы (в настоящий момент определены 36 структурных единиц). Резус-отрицательные пациенты развивают иммунный ответ, сопровождаемый выработкой антирезусных антител, при переливании им резус-положительной крови. Наличие анти-резус антител ведет к разрушению эритроцитов, несущих резус-антиген, и к тяжелым пост-гемотрансфузионным реакциям при повторных переливаниях резус-положительной крови резус-отрицательным реципиентам.
Аналогичный иммунный ответ может развивать резус-отрицательная женщина при беременности резус-положительным плодом. Несмотря на то, что обычно при беременности кровь плода не смешивается с кровью матери, в некоторых ситуациях (не первая по счету беременность, патологические состояния, связанные с изменением проницаемости плаценты, сенсибилизация после предшествующего переливания резус-положительной крови) иммунная система матери вырабатывает антитела к антигенам эритроцитов плода. Антитела разрушают резус-положительные эритроциты, что приводит к различным клиническим проявлениям (ранней потере плода, хроническому невынашиванию беременности) и к гемолитической болезни плода и новорожденных.
У беременных женщин, имеющих резус-положительную принадлежность, проблем совместимости по резус-фактору с ребенком не возникает.
Оценка резус-принадлежности при беременности или подготовке к беременности, а также контроль наличия аллоиммунных антиэритроцитарных антител, включая антитела к RhD-антигену, важны для правильного ведения беременности резус-отрицательных женщин. Риск развития гемолитической болезни плода и новорожденного при повторных беременностях можно предотвратить своевременным введением Rh-иммуноглобулина.
Наследование резус-фактора:
Генотип индивида состоит из двух гаплотипов, полученных по наследству: один от отца, другой от матери. Каждый гаплотип может обуславливать наличие антигенной детерминаты (D) или ее отсутствие (d). Доминантным является наличие антигенной детерминанты, следовательно:
Таким образом, у родителей с положительной резус-принадлежностью могут рождаться дети с отрицательной резус-принадлежностью.
Проблемы в определении резус-принадлежности: Большая часть резус-положительных лиц экспрессируют достаточное количество антигенных детерминант, содержащих все эпитопы. В этом случае при определении резус-принадлежности, вне зависимости от используемых тест-систем, проблем не возникает, и резус-принадлежность четко определяется как положительная.
Однако у ряда лиц (не более 1% в европейской популяции) при определении резус-принадлежности могут возникать сложности по следующим причинам:
1. Количество антигенных детерминант снижено в 3-10 раз, но структурно они не изменены. Такой вариант антигена называется слабым, D weak. Степень снижения количества детерминант разная, поэтому реакция агглютинации у таких пациентов может проходить с разной степенью выраженности.
2. Количество антигенных детерминант может быть обычным, но они структурно изменены. На детерминантах антигена D отсутствуют некоторые эпитопы (одновременно может отсутствовать до 5 эпитопов). Такой вариант антигена называется неполным, вариантным или частичным, D partial. У человека выявлено более 10 таких форм антигена D. Наиболее часто встречаемым является вариант антигена DVI (встречаемость не более 0,1% в европейской популяции).
3. Вариант резус-антигена D el характерен для азиатской популяции, встречаемость составляет до 30%. Проявляется очень низкой экспрессией антигена D на поверхности эритроцитов. Чаще всего обычными методами определяется как резус-отрицательный.
С клинической точки зрения эти варианты важно отличать, особенно у женщин детородного возраста и при планировании переливания крови. При «неполном» варианте (D partial) возможно формирование антител к «полному» D антигену при переливании резус-положительной крови или гемокомпонентов. При «слабом» варианте (D weak) образование резус-антител маловероятно. Подход к выполнению исследования и к интерпретации результатов резус-принадлежности потенциальных реципиентов и потенциальных доноров отличается.
| Вариант антигена | Интерпретация для реципиента | Интерпретация для донора |
| D weak (D слабый) | Резус-принадлежность положительная, но при гемотрансфузии рекомендуется использовать резус-отрицательные эритроциты | Резус-принадлежность положительная |
| D partial, в том числе D VI (D частичный) | Резус-принадлежность отрицательная | Резус-принадлежность положительная |
| D el | Резус-принадлежность отрицательная | Резус-принадлежность положительная |
Для чего используется исследование?
— Для определения принадлежности группы крови человека к одной из групп по системе АВО и системе резус.
Когда назначается исследование?
— При переливании компонентов крови реципиенту;
— при сдаче крови донором;
— при подготовке к хирургическим операциям;
— при планировании беременности или во время беременности;
— Гемолитическая болезнь новорожденных (выявление несовместимости крови матери и плода по резус-фактору);
— при подготовке к трансплантации костного мозга, почки, печени и других органов и тканей;
— при поступлении на военную службу, в ряды МЧС и другие силовые структуры.
Определение группы крови
В 1901 году выдающийся ученый Карл Ландштейнер открыл группы крови и заложил основы современной трансфузиологии. Исследователь выявил три группы на основании различных вариантов реакции агглютинации эритроцитов и сывороток крови. Материал для исследования был взят у сотрудников собственной лаборатории. Ученики Ландштейнера Декастелло и Стюрли несколькими годами позже открыли четвертую группу, но посчитали ее сомнительной и исключили из результатов исследований. В 1906 году психиатр из Праги Ян Янский подтвердил существование группы AB (IV). Публикация исследования в местном издании оказалась практически незамеченной. В 1910 году после повторного обнаружения четвертой группы Моссом Ян Янский был вынужден доказывать первенство открытия. Чешский ученый предложил цифровое обозначение групп крови: I, II, III, IV.
В трансфузиологии группами крови называют различные сочетания антигенов эритроцитов. Антигены являются генетическими признаками: наследуются от родителей и остаются неизменными на протяжении жизни. В 1980 году Международное сообщество переливания крови разработало числовую терминологию для антигенов эритроцитов. Выделены 23 системы группы крови, включающие 194 антигена. Нумерация в большинстве случаев соответствует порядку обнаружения. Входящие в каждую из 23 систем антигены кодируются шестизначным номером: первые три цифры являются номером системы, оставшиеся три – указывают на специфичность антигена внутри системы.
| № системы | Наименование | Обозначение | Наименование генов | Хромосомная локализация |
|---|---|---|---|---|
| 001 | AB0 | AB0 | AB0 | 9q34.1—q34.2 |
| 002 | MNS | MNS | GYPA, GYPB, GYPE | 4q28—q31 |
| 003 | P | P1 | P1 | 22q11.2—qter |
| 004 | Rh | RH | RHD, RHCE | 1p36.2—p34 |
| 005 | Lutheran | LU | LU | 19q12—q13 |
| 006 | Kell | KEL | KEL | 7q33 |
| 007 | Lewis | LE | FUT3 | 19p33 |
| 008 | Duffy | FY | FY | 1q22—q23 |
| 009 | Kidd | JK | JK | 18q11—q12 |
| 010 | Diego | DI | AE1 | 17q12—q21 |
| 011 | Yt | YT | ACHE | 7q22 |
| 012 | Xg | XG | XG | Xp22.32 |
| 013 | Scianna | SC | SC | 1p36.2—p22 |
| 014 | Dombrock | DO | DO | неизвестна |
| 015 | Colton | CO | AQP1 | 7p14 |
| 016 | Landsteiner-Wiener | LW | LW | 19p13.2—cen |
| 017 | Chido/Rogers | CH/RG | C4A, C4B | 6p21.3 |
| 018 | Hh | H | FUT1 | 19q13 |
| 019 | Kx | XK | XK | Xp21.1 |
| 020 | Gerbich | GE | GYPC | 2q14—q21 |
| 021 | Cromer | CROM | DAF | 1q32 |
| 022 | Knops | KN | CR1 | 1q32 |
| 023 | Indian | IN | CD44 | 11p13 |
Система группы крови AB0
Групповая принадлежность по системе AB0
По мере движения с запада на восток Евразии частота обнаружения антигена A падает, а антигена B возрастает. Антиген 0 редко встречается в Азии, но имеет широкое распространение у коренных народов Южной Америки, Полинезии и Австралии. Причина – эпидемии инфекционных заболеваний.
Результат типирования крови записывают в историю болезни или в карту донора. Врач-трансфузиолог указывает дату и ставит подпись.
В отдельных случаях во время типирования наблюдается слабовыраженная агглютинация эритроцитов. Недостаточно выраженная реакция объясняется наличием слабых вариантов антигенов A и B. Наибольшее клиническое значение представляют подгруппы A1 и A2. Впервые слабые варианты были обнаружены в 1911 году учеными Dungern и Hirszeld. Позднее в 1930 году Landsteiner и Levine предложили названия подгруппы – A1 и A2. A2 встречается до 20 % в группе A и до 35 % в группе AB. Сыворотка лиц из образцов крови A2 может содержать анти-A1-антитела: в 2 % случаев в группе A2 и в 30 % в A2B. Антитела анти-A1 представляют опасность ввиду агглютинации эритроцитов группы A.
Методика определения групп крови A2 и A2B
Частота выявления эритроцитов A2 существенно варьируется в зависимости от применяемых реагентов. Приводим сравнение результатов исследования при использовании различных методик типирования групп крови A2 и A2B.
| Число проанализированных образцов | Группа крови A (II) | Группа крови AB (IV) | ||
|---|---|---|---|---|
| Число проанализированных образцов | Группа A2 (II) в % | Число проанализированных образцов | Группа A2B (IV) в % | |
| Анти-A1 (лектин, фитогемагглютинин) | 1592 | 14,7 | 357 | 23,5 |
| Цоликлоны: анти-A, анти-AB | 3599 | 2,1* | 357 | 7,03* |
| Цоликлон анти-А — слабый | 3587 | 4,5* | 357 | 11,2* |
| Стандартные изогемагглютинирующие сыворотки | 1592 | 17,4 | 344 | 34,2 |
Примечание: * — агглютинация выражена слабо, присутствуют мелкие агглютинаты на розовом фоне.
Наибольшую точность исследования обеспечивает Анти-A1 (лектин, фитогемагглютинин). Тест рекомендован для выявления подгрупп антигена A у детей младше двух лет. Причина – физиологическая незрелость эритроцитов новорожденных, влекущая ошибочные результаты исследования со стандартными изогемагглютинирующими сыворотками.
В 1930 году Landsteiner и Levine обнаружили подтип Aint: промежуточный вариант между A1 и A2. Данный антиген характерен для негроидов и достигает 8,5 % у лиц с группой крови A. У европеоидов Aint наблюдался лишь у 1 % людей со второй группой крови. В крайне редких случаях у человека отсутствуют все антигены системы AB0. Фенотип «Бомбей» обусловлен генотипом hh. При отсутствии антигена H у лиц данной категории обнаруживаются анти-A и анти-B антитела.
Методика определения групп крови
Алгоритм выявления группы крови гемагглютинирующими сыворотоками
Для определения группы крови AB0 прямым методом используют две серии стандартных изогемагглютинирующих сывороток. Подготовьте две серии сывороток трех групп с титром 1:32 или выше. Для забора каждой сыворотки используйте отдельную маркированную пипетку. Подготовьте сыворотку AB(IV) для контроля.
В последнем случае следует удостовериться в отсутствии неспецифической реакции: нанесите на планшет 2 – 3 капли соответствующей группе AB(IV) сыворотки и добавьте одну каплю анализируемых эритроцитов. Перемешайте жидкости и оцените результат спустя пять минут. Отсутствие агглютинации свидетельствует о принадлежности к группе AB(IV), наличие – признак неспецифической реакции. В этом случае, а также при слабовыраженной агглютинации повторите исследование с другими сериями сывороток.
Техника определения группы крови цоликлонами
Моноклональные антитела к антигенам эритроцитов пришли на смену изогемагглютинирующих сывороток. Для каждого типирования достаточно одной серии реагентов анти-A, анти-B, анти-AB. Внедрение моноклональных реагентов позволило значительно упростить и стандартизировать методику типирования по системе AB0. Приводим краткое пошаговое руководство проведения исследования на планшете.
Обычно реакция обнаруживается уже в первые секунды после смешивания. При этом слабые варианты антигенов A и B могут давать более позднюю агглютинацию.
Непрямой метод типирования: алгоритм действий
Методика определения основана на взаимодействии эритроцитов от предварительно типированных лиц групп 0, A, B или смеси эритроцитов от нескольких одногруппных доноров с изогемагглютининами α и β в исследуемой сыворотке.
При работе с каждым типирующим реагентом используйте сухие чистые пипетки. Промывание палочек для перемешивания и пипеток осуществляйте в 0,9 % растворе NaCl.
Заключение о групповой принадлежности
| Результаты анализа плазмы со стандартными эритроцитами | Групповая принадлежность | ||
|---|---|---|---|
| 0(I) | A(II) | B(III) | |
| — | + | + | 0(I) |
| — | — | + | A(II) |
| — | + | — | B(III) |
| — | — | — | AB(IV) |
Система Резус
Levine и Stetson обнаружили антигены системы Резус в 1939 году. Ученые изучали причины развития гемолитических реакций у рожениц при трансфузиях женщинам идентичных по системам AB0, MN и P. эритроцитов мужей. Годом позже Landsteiner и Wiener продуцировали выработку антител посредством иммунизации кроликов эритроцитами обезьян макака-резус. Антитела получили название анти-RH антитела. Полученные агглютинины вступали в реакцию агглютинации с эритроцитами макак-резус и с эритроцитами 85 % граждан Нью-Йорка белой расы. Вызвавший образование антител антиген получил название RH-фактор (D-фактор).
В редких случаях эритроциты людей не содержат ни одного антигена резус. Фенотип обозначают Rhnull. Ген Xro в этом случае представлен в гомозиготной форме и подавляет продуцирование всех антигенов. Обладатели фенотипа Rhnull не проявляют агглютиногеной активности, но имеют возможность передавать антигены по наследству.
Среди европейцев частота резус-положительных по антигену D лиц составляет 85 %. На мембране красных кровяных телец обычно расположено около 10 000 – 30 000 молекул D. При этом существуют два особых типа D-положительных лиц: D u (слабый) и D partial (частичный). Иммунная система D u и D partial способна вырабатывать анти-D-антитела.
Слабый антиген встречается у 1,5 % резус-положительных лиц и характеризуется низким числом (100 – 500) молекул D на мембране. Является иммуногенным для резус-отрицательных лиц. При этом переливание D-положительных эритроцитов больным со слабым D может вызвать сенсибилизацию кровяных телец донора. Эритроциты с D u слабо агглютинируются или совсем не вступают в прямую реакцию агглютинации с полными анти-резус антителами. Определение резус-принадлежности производят в непрямом антиглобулиновом тесте. Носителей D u считают резус-положительными донорами и резус-отрицательными реципиентами.
Антитела против антигенов резус являются иммунными. Возникают вследствие изосенсибилизации. Специфичность определяется спровоцировавшими образование антител антигенами. Выделяют полные и неполные антитела.
Полные являются IgM антителами. Отличаются большим молекулярным весом, обнаруживаются реже по сравнению с неполными антителами. Способны агглютинировать резус-положительные эритроциты. Имеют меньшее значение при трансфузиях.
Неполные преимущественно относятся к классу IgG. Закрепляются на поверхности резус-положительных эритроцитов без образования агглютинатов. Склеивание кровяных телец осуществляется при наличии коллоидных растворов и протеолитических ферментов или после обработки антиглобулиновой сывороткой. Обладают меньшим в сравнении с полными антителами молекулярным весом. Способны проходить через плаценту. Во время сенсибилизации сперва продуцируются полные антитела, далее в большей мере вырабатываются неполные (иммуноглобулины IgG) антитела.
Техника выявления резус-фактора с использованием цоликлона Анти-D-Супер
В случае наступления реакции кровь оценивается как резус-положительная (Rh+), при отсутствии реакции – как резус-отрицательная (Rh-). При отрицательной либо слабо выраженной агглютинации необходимо повторно провести исследование с неполными анти-D IgG антителами с целью выявления слабого или частичного антигена D.
Методика определения резус-фактора D u в пробирочном тесте
Параллельно с анализом выполняют постановку трех контрольных проб: реагента цоликлон Анти-D (анти-D IgG) со стандартными резус-положительными и резус-отрицательными эритроцитами, анализируемых эритроцитов с раствором желатина без диагностикума анти-D IgG.
Отсутствие результатов реакции с анти-D IgM и выраженная агглютинация с анти-D IgG свидетельствуют об обнаружении слабых форм антигена D. При слабо выраженной агглютинации следует повторить исследование в непрямой пробе Кумбса.
Определение резус-принадлежности стандартным универсальным реагентом
Стандартный реагент антирезус Rh0D содержит поликлональные неполные анти-D-антитела. Параллельно с анализом образца осуществляется контрольное исследование реагента Rh0D со стандартными резус-положительными (одногруппными или группы 0) и резус-отрицательными (одногруппными) эритроцитами.
Результат считается достоверным только после проверки контрольных образцов: наступлении реакции со стандартными резус-положительными и отсутствии реакции – с резус-отрицательными эритроцитами.
Информацию о пошаговой постановке непрямого теста Кумбса с использованием неполных анти-D-антител читайте в разделе сайта «Реакция Кумбса».