что такое рецидив болезни после операции в гинекологии
Лечение рецидива рака
Даже после успешно проведенного лечения злокачественных новообразований остается риск, что болезнь вернется, потому что в организме остались раковые клетки. По статистике, в ¾ случаев в течение 5 лет после лечения случаются рецидивы рака — именно поэтому врачи говорят о ремиссии, а не о выздоровлении. Наиболее опасны ранние, возникающие в течение нескольких месяцев после терапии, — они агрессивны и часто ведут к гибели пациента. Поэтому наблюдение у врача после операции и/или курса химио- и лучевой терапии является обязательным — оно позволяет своевременно заметить ухудшение ситуации и принять меры.
Затрудняет ситуацию то, что при рецидивах рака симптомы могут отличаться от тех, которые были ранее, — только в трети всех случаев обнаруживаются в той же локализации, гораздо чаще страдают соседние органы и ткани. Отличаются и сами симптомы, и их интенсивность. Поэтому необходимы регулярные осмотры, анализы крови для определения уровня РЭА и других онкомаркеров, при подозрении на возвращение проблемы — МРТ, КТ и другие исследования. Они позволяют своевременно принять меры, не давая процессу зайти слишком далеко.
Нам доверяют 9500 пациентов ежегодно.
Какие виды рака повторно выявляются чаще других
На риск возврата болезни влияет не только локализация на момент лечения — большое значение имеет то, из каких клеток развивалась опухоль, стадия, на которой проводилось лечение, степень дифференциации раковых клеток, а также образ жизни пациента.
Врачи и пациенты сталкиваются с рецидивами рака желудка, легкого, щитовидной или молочной железы, мужчины — простаты, женщины — матки и яичников и др. Общие рекомендации для всех пациентов относятся к образу жизни:
Кроме того, есть и специфические рекомендации, связанные с прооперированным органом, которые помогут при раке снизить риск рецидива после операции — в основном они касаются специфических исследований и приема необходимых препаратов.
Рецидивы рака: лечение и прогноз
При повторном выявлении злокачественных опухолей проводятся диагностические мероприятия, чтобы уточнить, они единичные или множественные, это новый первичный очаг или он развился из остатков ранее удаленного, те же ткани стали основой для новообразования или они отличаются от предыдущего случая, в каких органах расположены, объем метастазирования, если он есть и т.д.
Все это влияет на выбор лечебной тактики — если ранее применяемые методики не дали результата, их заменяют другими. Как правило, лечение проводят комплексно, сочетая хирургию, радиотерапию и химиопрепараты, также их могут дополнять иммуно-, гормонотерапия и другие вспомогательные инструменты.
При ранних рецидивах после рака прогноз менее благоприятен, чем при возвращении болезни через год или более — это говорит о более агрессивном течении недуга. Повысить свои шансы на долгую жизнь можно, изменив образ жизни: отказавшись от курения, нормализовав питание и снизив массу тела при ожирении, регулярно давая телу умеренные нагрузки.
Чтобы своевременно среагировать на ухудшение состояния, необходимо регулярно проводить обследование. Все диагностические процедуры и, при необходимости, лечение вы можете получить в Клинике НАКФФ. Телефон для записи +7(495) 023-56-96.
Последние новости
Последние статьи
Рейтинг: 4.9/5 Голосов: 110
Рецедивы после операции. Все что нужно знать
Одно из главных опасений, заставляющих человека воздерживаться от артроскопии — боязнь рецидива после операции. Но если попытаться всерьез разобраться, чего именно опасается пациент, выясняется, что боится он совсем другого.
Что такое рецидив?
Если следовать словарю, то рецидив — это возобновление болезни после периода мнимого выздоровления. То есть, именно той патологии, которую должна была устранить операция. Вероятность подобного события не слишком велика.
Чаще всего проблемы возникают с коррекцией нестабильности плечевого сустава (проще говоря, хирургическим лечением привычного вывиха). По данным разных авторов, вероятность рецидива здесь от 2 до 10 процентов. Но основной фактор риска в подобной ситуации не «плохая» работа хирурга, а продолжающаяся активная нагрузка на сустав. Проще говоря, риску рецидива больше всего подвержены профессиональные спортсмены. Похожая ситуация и с разрывом трансплантата крестообразной связки — вероятность возникновения этой проблемы до трех процентов и чаще всего рецидив вызван повторной травмой из-за активной спортивной жизни.
При других патологиях, требующих артроскопического вмешательства, вероятность рецидива исчезающе мала, так что большинство научных публикаций даже не уделяют внимания этому вопросу.
В любом случае, если рецидив возникает, нужно обратиться к оперировавшему врачу. Он изучит ситуацию и порекомендует лечение — консервативное или хирургическое, в зависимости от ситуации. Что бы ни произошло, пациент не останется один на один со своими проблемами.
Возникает резонный вопрос — если вероятность рецидива настолько невелика, откуда жалобы на «плохую работу хирурга», которыми переполнен интернет?
Рецидив или недостаточное восстановление функций?
На самом деле под «рецидивом» большинство пациентов понимает недостаточное восстановление функций сустава. И тут, опять же, можно выделить два блока проблем.
Завышенные ожидания. Человеческий организм — не автомобиль или компьютер, в нем нельзя просто заменить вышедшую из строя деталь на новую, чтобы «все стало как было». Поэтому не стоит ожидать, что прооперированный сустав «будет как новенький» и его снова можно будет беспощадно эксплуатировать, не задумываясь о последствиях. Поврежденный из-за травмы или болезни сустав после артроскопии перестанет болеть (по окончании реабилитационного периода), в большинстве случаев будет функционировать в полном объеме и нормально справляться с повседневными нагрузками. Но при повышенных нагрузках, особенно в первый год после вмешательства может появиться дискомфорт, что некоторые пациенты принимают за «некачественный результат» или «рецидив».
Недостаточная реабилитация. Да, артроскопия — малотравматичная операция, восстановление после которой происходит гораздо быстрее, чем после классических открытых вмешательств. Но это все же операция, и после нее нужно дать организму время и возможность восстановиться. Причем для восстановления недостаточно просто обеспечить конечности покой. Напротив, после артроскопии суставу просто необходимы активные, но дозированные движения и физиотерапия.
Вопросами реабилитации после артроскопии занимается не оперировавший хирург, а врач ЛФК (или врач — кинезитерапевт) вместе с врачом-физиотерапевтом. Нередко бывает, что пациент уделяет много внимания подготовке к операции и самой артроскопии, но совершенно упускает из виду необходимость реабилитации, или стремится сэкономить на этой «мелочи». Результат — медленное восстановление функции конечности, неполное восстановление объема движений в суставе и разочарование «безруким хирургом», хотя проблема вовсе не в качестве проведенной операции.
Рецидивы после артроскопии возможны, хоть и крайне редки. При подозрении на рецидив нужно немедленно обратиться к оперировавшему врачу и обсудить с ним дальнейшую тактику. Но чаще за «рецидивом» скрывается недостаточное восстановление функции из-за того, что после операции пациент не уделял должного внимания реабилитации.
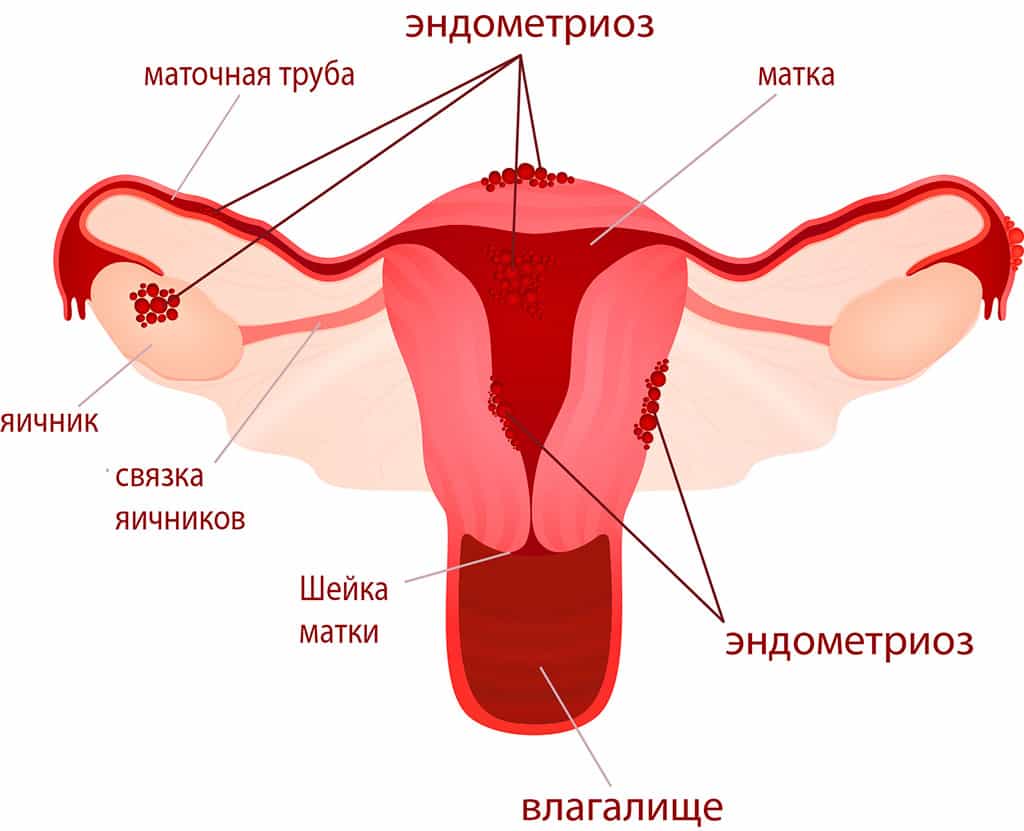
Эндометриоз
Тел.: 8-800-25-03-03-2
(бесплатно для звонков из регионов России)
Санкт-Петербург, наб. реки Фонтанки, д. 154
Тел.: +7 (812) 676-25-25
Санкт-Петербург, В.О., Кадетская линия, д. 13-15
Тел.: +7 (812) 676-25-25
Санкт-Петербург, ул. Циолковского, д.3
Тел.: +7 (812) 676-25-10
Эндометриоз обнаруживается не только отделах репродуктивной системы, но и вне ее (брюшная стенка, мочевыделительная система, пищеварительный тракт, брюшина, легкие и пр.). Клинические проявления разнообразны и зависеть от расположения патологического процесса. Могут выражаться: болью, нарушениями менструального цикла (кровянистых выделений перед началом менструации, контактных кровянистых выделений).
Причины эндометриоза
Единой версии причин возникновения эндометриоза на сегодняшний день нет.
1 теория: «Ретроградная менструация или имплантационная теория»
У некоторых женщин имеется склонность к такой особенности как ретроградная менструация (когда мышечный слой матки сокращается в обратном направлении от шейки матки). В период месячных (регул) кровь с элементами эндометрия за счет перистальтических движений гладкомышечной мускулатуры матки заносится в брюшную полость и фаллопиевы трубы, где эндометрий имплантируется в ткани различных органов. В течение обычного менструального цикла внутренний слой матки (эндометрий) отделяется и выводится из полости матки, в то время как в других органах, пораженных эндометриозными очагами, происходят микрокровоизлияния и возникает асептическое воспаление. Вероятность появления эндометриоза может увеличиться от таких причин как: особенности строения маточных придатков, иммунные патологические процессы, аборты, операции на матке, кесарево сечение, оперативное лечение заболеваний шейки матки, наследственная предрасположенность.
Особенно высока роль наследственности при рассматриваемой патологии и предполагает весьма высокую возможность возникновения болезни у дочери, если её мать ранее перенесла такое заболевание. Зная о предрасположенности к данной патологии, женщина, соблюдая меры профилактики, может предотвратить возникновение болезни. Так, например, после оперативных вмешательств на органах репродуктивной системы женщине необходим систематический контроль состояния здоровья для предотвращения возможных осложнений.
2 теория: «Генные мутации»
3 теория: «Отклонения в функции клеточных ферментов и реакции рецепторов к гормонам»
Однако, последние две теории не получили повсеместной популяризации в связи с малой базой доказательности. Классификация эндометриоза разделяется по локализации.
Классификация эндометриоза
Генитальный. Из самого названия следует, что при течении болезни в этой форме эндометриозные очаги располагаются в тканях детородных органов пациентки.
Экстраперитонеальный (внебрюшинный) эндометриоз возникает в органах не покрытых брюшиной: в нижних частях половых органов, вульве, в шейке матки (ее влагалищном сегменте), позадивагинальной перегородке и пр. В мускульном слое матки может сформироваться внутренний эндометриоз (аденомиоз), при этом матка обретает шаровидную форму и достигает величины до 5-6 недели беременности.
Экстрагенитальный эндометриоз. При этой форме эндометриозные очаги находятся за пределами репродуктивной системы (пищеварительный тракт, дыхательная система, мочевыделительная система, послеоперационные рубцы).
При серьезных, осложненных случаях болезни эндометриоз бывает смешанный.
В зависимости от глубины и распространения очагов эндометриоза различают 4 степени:
В зависимости от цикличности регул эндометриозные очаги большей частью проявляются в преддверии месячных. Очаги имеют самую различную локализацию и обнаруживаются не только на поверхности органов, но и проявляют тенденцию к глубокой инвазии в ткани. При вовлечении яичников в процесс эндометриоза кисты сгруппированы и наполнены кровянистым содержимым. Исходя из размеров и глубины эндометриозных поражений, а также локализации образований, степень эндометриоза определяют по бальной системе.
Симптомы эндометриоза
Тазовая боль. Возникает у 16-24% пациенток. Может иметь как точечную, так и разлитую локализацию, возникает и усиливается в корреляции от менструального цикла, может быть и постоянной. Зачастую она вызвана с воспалением и спаечным процессом, развивающимися при поражении эндометриозом.
Постгеморрагическая анемия. У 25-40% пациенток из-за значительной хронической кровопотери во время менструаций может возникнуть состояние малокровия. Постепенно нарастает слабость, бледность или желтушность кожных и слизистых покровов, головокружение, утомляемость, сонливостью раздражительность и психической возбудимостью.
Бесплодие. Точно дать оценку тому, как и почему возникает бесплодие при поражении эндометриозом, ученые и врачи сегодня не в силах. Связывают это с процессами в придатках матки при эндометриозе, с перебоями в функционировании общего и местного иммунного статуса организма в целом, и как итог- сбои в овуляторных процессах. Не абсолютна, но достаточно высока при эндометриозе возможность не наступления беременности. Эндометриоз и сопутствующие ему процессы могут провоцировать самопроизвольные аборты, которые в свою очередь, кардинально и значительно сокращают шансы не только на наступление беременности, но и на нормальное её течение. Поэтому беременные с эндометриозом в анамнезе должны постоянно наблюдаться у врача.15- 56% пролеченных от эндометриоза пациенток беременеют в течение 6-12 месяцев.
Диагностика эндометриоза
С внедрением малоинвазивных методов диагностики и лечения (гистероскопии и лапароскопии) выявляемость эндометриоза значительно увеличилась.
В силу своей схожести протекания данного заболевания с другими, похожими по симптоматике, заболеваниями половых органов, на всех этапах постановки диагноза очень важное значение имеет дифференциальная диагностика. Врач тщательно собирает жалобы и анамнез, информацию о перенесенных заболеваниях, в том числе репродуктивной системы, хирургических операциях, наличии гинекологического и акушерского отягощённого анамнеза у родственников по женской линии.
Дальнейшее обследование включает в себя:
Комплекс всех методов позволяет выявить эндометриозные очаги до 96% случаев.
Заключительный диагноз можно поставить только в том случае, если произведено гистологическое исследование биоптата из очагов эндометриоза, взятых при проведении гистероскопии (лапароскопии).
Лечение эндометриоза
Очень важно в определении тактики терапии эндометриоза учитывать следующие факторы:
к какой возрастной категории относится пациентка,
количество беременностей, в том числе окончившихся родоразрешениями,
важно знать, как протекали роды и не было-ли в послеродовом периоде каких-либо осложнений,
учитывается тяжесть патологического процесса, его местонахождение, глубина, сопутствующие патологии, желание родить ребенка.
При терапии эндометриоза действия врача направлены не просто на устранение проявлений рассматриваемой болезни, но и её последствий (спаечные и кистозные образования, психоневрологические проявления, пр.).
Оперативное лечение эндометриоза
При средней и тяжелой стадиях эндометриоза рекомендуется прибегать к органосохраняющему хирургическому лечению с удалением очагов. Лечение всесторонне нацелено на резекцию гетеротопий в пораженных органокомплексах, резекцию эндометриоидных кист в яичниках, а также рассекание спаек. Как правило, оно применяется, если эффект от медикаментозного лечения отсутствует, имеются различные противопоказания, например непереносимость препаратов или их компонентов, при обнаружении эндометриоидных новообразований размером более 3-4 сантиметров, дисфункции мочевыделения, проблемах с желудочно-кишечным трактом. Зачастую оперативное лечение совмещают с лекарственным. Вмешательство осуществляют лапароскопическим или лапаротомным доступами.
Если у пациентки в возрасте после 40 лет активно прогрессирует заболевание и консервативно-хирургические мероприятия не дают должного эффекта, то прибегают к радикальному хирургическому удалению эндометриоза (экстирпация матки с придатками). Такие мероприятия применяются не часто и встречаются у 12% пациенток.
Основные принципы хирургического лечения эндометриоза с позиций доказательной медицины
Независимо от того, насколько далеко и глубоко распространился патологический процесс, лапароскопия является предпочтительным хирургическим доступом («золотой стандарт») при лечении эндометриоза. Она способствует лучшей визуализации очагов, благодаря их оптическому увеличению, минимальной травматизации тканей и более быстрой реабилитации пациенток, чем после лапаротомии. Лечебно-диагностическая лапароскопия с удалением эндометриозных новообразований обеспечивает значительное уменьшение интенсивности ассоциированных с эндометриозом болей.
Эндометриомы яичников у женщин с тазовой болью должны быть удалены хирургическим путем при лапароскопии.
Женщинам в детородном возрасте принципиально важно излечиться от эндометриоза яичников без риска рецидивирования с максимальным сохранением не поражённой ткани овоцитов. Для этого выполняют пункцию, дренирование кисты, алкоголизацию и уничтожение капсулы путем воздействия энергии различных видов. Однако, все эти методы не позволяют полностью удалить капсулу кисты, что может привести к рецидиву болезни.
У женщин, незаинтересованных в беременности эндометриозные очаги могут быть удалены лапароскопическим или комбинированным лапароскопически-влагалищным доступом, при необходимости в сочетании с одновременной резекцией пораженного участка стенки прямой кишки или в едином блоке с маткой.
Радикальным методом лечения аденомиоза можно считать лишь удаление матки (экстирпация матки). Данная операция, как правило, производится лапароскопическим путем. При выполнении операции по удалению матки очень важно удалить все видимые эндометриоидные очаги, при этом двухстороннее удаление яичников может способствовать более эффективному исчезновению боли и уменьшению вероятности рецидива заболевания.
С каждой пациенткой индивидуально должен обсуждаться вопрос об удалении яичников.
Консервативное лечение применяется, если эндометриоз имеет скрытое латентное течение, возраст пациентки до 45 лет, во время пременопаузы, и имеется потребность сохранения репродуктивной функции.
Гормонотерапия при лечении эндометриоза
Полная реконвалесценция при эндометриозе наступает только при его раннем выявлении и качественной последующей терапии.
Оценочными показателями выздоровления от эндометриоза являются: хорошее самочувствие, отсутствие жалоб на тазовые боли, непоявление рецидивов в течение 5 лет после терапии, восстановление или сохранение функции деторождения.
При современном уровне развитости хирургической гинекологии с обширным использованием органосохраняющих методов лечения, всего вышеперечисленного можно добиться у 60% женщин возрасте от 20 до 36 лет. Если пациентка была оказана помощь в виде радикальной операции, то заболевание не рецидивирует.
1. Эндометриоидные кисты яичников («шоколадные» кисты), заполненные старой менструальной кровью.
2. Кровоизлияния и рубцовые изменения.
Эти два осложнения с большой долей вероятности могут привести к состоянию бесплодия. Обширные и распространенные эндометриозные очаги оказывают давление на нервные стволы и окончания, что приводит к разнообразным неврологическим нарушениям. Редко встречается озлокачествление перерожденных очагов эндометриоза. По данным ученых, у женщин с эндометриозом риск развития онкологических перерождений на 50% выше среднестатистических.
Профилактика эндометриоза
Чем раньше при появлении первых симптомов эндометриоза женщина приходит на консультацию к гинекологу, тем выше шанс на полное избавление необходимости оперативного лечения. Попытки самостоятельной терапии или отсрочка обращения за помощью совершенно не оправданы: с очередным менструальным циклом появляются новые эндометриозные очаги, возникают кисты, усиливаются рубцовые и спаечные процессы, усугубляется состояние фаллопиевых труб.
Для профилактики эндометриоза, необходимо:
обследование девочек-подростков и женщин с жалобами на боли во время месячных;
курирование пациенток после абортов и других иных манипуляций на матке для ликвидации возможных последствий;
своевременная и полная элиминация острых и хронических патологий гениталий;
прием оральных гормональных контрацептивов.
Риск возникновения эндометриоза выше у курящих женщин в возрасте после 30-35 лет с коротким менструальным циклом, страдающих нарушениями метаболизма, ожирением, излишним весом; имеющих внутриматочные контрацептивы; с повышенным уровнем эстрогенов; страдающих иммунодепрессией; имеющих наследственную предрасположенность и перенесших операции на матке.
Что такое рецидив болезни после операции в гинекологии
Московский научно-исследовательский онкологический институт им. П.А. Герцена
ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздрава России
Причины, диагностика и лечение рецидивов рака яичников. Обзор литературы и анализ собственных данных
Журнал: Онкология. Журнал им. П.А. Герцена. 2015;4(3): 59-67
Новикова Е. Г., Московская Е. Ю. Причины, диагностика и лечение рецидивов рака яичников. Обзор литературы и анализ собственных данных. Онкология. Журнал им. П.А. Герцена. 2015;4(3):59-67.
Novikova E G, Moskovskaja E Ju. The causes, diagnosis, and treatment of recurrent ovarian cancer. A literature review and analysis of the authors’ data. P.A. Herzen Journal of Oncology. 2015;4(3):59-67.
https://doi.org/10.17116/onkolog20154359-67
Московский научно-исследовательский онкологический институт им. П.А. Герцена
Обсуждаются причины возникновения рецидивов рака яичников, методы диагностики и необходимость комплексного подхода к ведению данной когорты пациенток. Рассмотрена роль хирургического и химиотерапевтического компонента комбинированного лечения. Оценено место лучевой терапии при распространенном раке яичников.
Московский научно-исследовательский онкологический институт им. П.А. Герцена
ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздрава России
Известно, что рак яичников на ранних стадиях протекает асимптомно. В связи с этим, а также отсутствием эффективных скрининговых программ, более чем у 70% больных выявляется распространенный процесс (III—IV стадия) [1]. После завершения первичного комбинированного лечения у 80% больных с распространенным процессом развивается рецидив. В то же время даже при ранних стадиях заболевания с наличием неблагоприятных факторов прогноза очень часто возникают рецидивы [2, 3].
Совокупность ряда причин является предпосылкой к тому, что рецидивный рак яичников встречается у 50% больных и характеризуется возвратом заболевания после достижения полной ремиссии и при ее сохранении длительное время [4, 5].
К причинам возникновения рецидивов рака яичников относятся: выявление заболевания в распространенной форме, гистотип опухоли, прогностически неблагоприятные факторы, неадекватное первичное лечение, ошибки в наблюдении за больными в процессе и после окончания первичного лечения [6, 7].
На вероятность возникновения рецидива заболевания влияет интраоперационное выявление макроскопических изменений: прорастание опухоли в капсулу кистомы или наличие опухолевых клеток в асците, нарушение целостности капсулы опухоли при хирургических манипуляциях, массивные сращения и спайки опухоли с окружающими тканями [8, 9].
К неблагоприятным факторам прогноза относят гистотип опухоли (в частности, светлоклеточную аденокарциному), низкую дифференцировку, невыраженность лекарственного патоморфоза (в случае неоадъювантного лекарственного лечения). Отмечено существование влияния степени лекарственного патоморфоза на частоту возникновения рецидивов рака яичников и, следовательно, на выработку дальнейшего лечения. Таким образом, лекарственный патоморфоз является одним из предикторных факторов развития рецидива. Чем выше градация изменений в опухоли после проведенного лечения, тем более длительным предполагается безрецидивный промежуток [10].
Возникновение рецидива рака яичников зависит не только от стадии процесса, но и от адекватности первичного лечения. По данным Американской коллегии хирургов, почти в 75% первичные хирургические вмешательства по поводу опухолей яичников проводятся без участия онкогинеколога, что часто приводит к выбору неадекватного оперативного доступа, объема вмешательства, неправильной оценке стадии заболевания, соответственно значительно ухудшает прогноз [11, 12].
В 2007 г. В. Goff и соавт. [13], анализируя результаты мультицентрового исследования, получили данные, подтверждающие, что специалисты онкогинекологи почти в 2 раза чаще выполняют полноценные хирургические вмешательства, чем акушеры-гинекологи и общие хирурги (табл. 1).

Для большинства пациенток с карциномой яичников хирургическое лечение не является окончательным из-за распространения опухолевых клеток в различные отделы брюшной полости, в связи с чем прогноз заболевания зависит от дополнительной терапии [14].
При проведении химиотерапии специалистами могут быть допущены ошибки, связанные с нарушением определения дозы химиопрепаратов. Расчет необходимо проводить для каждого курса химиотерапии на основании изменения массы тела, роста, возраста и креатинина сыворотки крови пациентки. Однако зачастую дозировка препарата рассчитывается однократно перед началом лечения и не подлежит пересчету при последующих курсах терапии. Обращает на себя внимание несоблюдение сроков проведения курсов лечения, неаргументированная и несвоевременная смена схем, в том числе при прогрессировании заболевания на фоне лечения [15].
Диагностика рецидивов рака яичников
Рецидив, характеризующийся изолированным подъемом уровня СА125, без клинических проявлений заболевания, называется «маркерным». По данным G. Rustin и соавт. [18], рост уровня СА125 — эквивалент прогрессирования заболевания, доказанного стандартными клиническими или визуализирующими методами диагностики.
В каждом клиническом случае имеется индивидуальный базовый уровень маркера, зафиксированный после окончания лечения, изменения которого для конкретной больной используются как для оценки эффективности проводимого лечения, так и для определения сроков выявления рецидива. При отсутствии клинических данных, свидетельствующих о прогрессировании заболевания и низком уровне CA125, риск рецидива низкий, при выраженном повышении маркера значительно увеличивается возможность возврата заболевания.
Современный стандарт клинической трактовки маркера сводится к следующему: если после комбинированного лечения уровень СА125 ниже дискретного, а в процессе последующего наблюдения повышается, то необходимо углубленное обследование для выявления локализации и распространенности заболевания. Рекомендации GOG (Gynecologic Oncology Group Study), сформулированные в 2001 г., подчеркивали необходимость лечения больных раком яичников даже при бессимптомном стойком повышении уровня СА125 выше 100 Ед/мл [16, 17].
Однако имеется мнение и о том, что при выявлении повышения уровня маркера без выраженной клинической картины нет выигрыша в отдаленных результатах лечения. Это было подтверждено данными проспективного рандомизированного исследования (MRC OV05/EORTC 55955), в котором пациенток с повышением уровня маркера без признаков рецидива при физикальном или инструментальном обследовании оставляли под наблюдение до появления объективных признаков рецидива (263 пациентки). В другой группе начинали терапию второй линии немедленно, после 2-кратного повышения уровня СА125 (264 больные). При наблюдении в течение 49 мес от рандомизации различий в медиане выживаемости в группах не было зафиксировано [18]. Следует отметить, что в группе пациенток, где лечение начинали по результатам повышения уровня СА125, происходило это в среднем на 5 мес раньше, чем в группе с отложенным проведением химиотерапии.
В отделении гинекологии отдела опухолей репродуктивных и мочевыводящих органов ФГБУ «ФМИЦ им. П.А. Герцена» наблюдалась пациентка Ф. 1960 г. р. по поводу маркерного рецидива рака яичников IIIС стадии (T3сN0M0).
Первичное лечение было проведено в 2009 г.: выполнена экстирпация матки с придатками, резекция большого сальника, с последующим проведением 6 курсов ПХТ (доцетаксел + карбоплатин), лечение закончено в феврале 2009 г. Первый безрецидивный интервал составил 2 года. В феврале 2011 г. при комплексном обследовании (СА125, УЗИ, МРТ) выявлен маркерный рецидив. Проведено 6 курсов ПХТ по схеме ТС с хорошим клиническим эффектом, заключавшимся в выраженном снижении уровня СА125. Пациентка оставалась под строгим динамическим наблюдением. Через 8 мес выявлен рост уровня СА125 до 90 Ед/мл, другой очаговой патологии не выявлено. Пациентка обратилась в ФГБУ «ФМИЦ им. П.А. Герцена», где с учетом стадии и распространенности опухолевого процесса, длительности бесплатинового интервала сочли целесообразным провести 6 курсов МХТ топотеканом. На фоне противорецидивного лечения была отмечена тенденция к снижению уровня СА125 до 50 Ед/мл (рис. 1). Через 1 мес после окончания противорецидивного лечения выполнено комплексное обследование: отмечен рост уровня СА125 до 91,3 Ед/мл; УЗ- и МР-картина рецидива в полости малого таза (рис. 2, 3).



Учитывая прогрессирование заболевания, солитарный характер поражения, объем проведенного лечения, решено было выполнить оперативное вмешательство типа second-look и удаление рецидивной опухоли из полости малого таза. В ноябре 2013 г. выполнена ревизионная лапаротомия, подвздошно-обтураторная лимфаденэктомия слева. По вскрытии брюшной полости свободной жидкости в брюшной полости и полости малого таза не выявлено. При ревизии органов брюшной полости без видимой патологии, печень и диафрагмальная поверхность над печенью, селезенка и диафрагмальная поверхность над ней — без диссеминации, парааортальные лимфатические узлы незначительно увеличены. При ревизии малого таза культя влагалища не изменена. Сигмовидная кишка находится в спайках с левым латеральным каналом. В подвздошной области слева определяется невыраженный инфильтрат протяженностью до 1 см, расположенный над подвздошной веной. Широко раскрыт левый параметрий, произведено удаление клетчатки из области над и под наружными подвздошными сосудами и из обтураторной ямки, с удалением вышеописанного инфильтрата с участком брюшины малого таза.
При гистологическом исследовании в удаленных лимфатических узлах метастазов не обнаружено.
Принимая во внимание данные комплексного обследования, несмотря на рост уровня СА125, данные интраоперационной ревизии и гистологического исследования, в настоящее время клинических проявлений (гистологически верифицированных) рака яичников нет. В связи с объемом противорецидивного лечения (6 курсов МХТ топотеканом + оперативное вмешательство в объеме подвздошно-обтураторной лимфаденэктомии слева), проводить профилактическую химиотерапию не представляется целесообразным. Решено оставить пациентку под динамическим наблюдением. В случае возникновения клинических проявлений заболевания будет решен вопрос о возможности возобновления и характере цитостатической терапии.
До настоящего времени пациентка находится под строгим динамическим наблюдением без признаков рецидива, маркер СА125 за время наблюдения не превышал 100 Ед/мл.
Таким образом, в настоящее время не существует однозначной позиции в отношении сроков начала химиотерапии второй линии. Неоспоримым остается, что эффективность лекарственного воздействия тем выше, чем меньше объем опухоли, однако более раннее начало терапии (лечение маркерного рецидива) достоверно не улучшает выживаемость больных.
Физические методы диагностики
В стандарт комплексного обследования пациенток с рецидивом рака яичников входит оценка динамики уровня опухолевого маркера СА125, УЗИ, рентгенография, КТ и МРТ, в редких случаях используется ПЭТ-КТ [19].
Целью наблюдения за пациентами является возможность достоверно и объективно определять степень ответа существующих опухолевых поражений на проводимую терапию и своевременно выявлять появление новых очагов опухоли.
Ультрасонография в серой шкале и с использованием допплеровского сканирования в настоящее время является одним из самых распространенных методов лучевой диагностики. УЗИ является субъективным методом, что не всегда позволяет провести измерение опухолевого очага в одних и тех же проекциях перед началом лечения, в мониторинге или при контрольном исследовании. Ультрасонография обладает рядом преимуществ: простотой, быстротой исследования, безвредностью для пациентки и врача, возможностью многократного применения не только в госпитальных, но и в амбулаторных условиях, поэтому этот метод целесообразно применять при мониторинге. В случае возникновения рецидива заболевания для детализации опухолевых очагов целесообразно использовать КТ и МРТ [20].
Оценка ответа опухоли на лечение по критериям RESICT
Для оценки эффективности проводимой терапии и объективного сравнения полученных результатов в различных клиниках недостаточно было унификации диагностических мероприятий, требовалось создание единой терминологии. В конце 70-х годов Международным противораковым союзом (International Union Against Cancer) и ВОЗ (World Health Organization) были введены, а с 1994 г., после многочисленных переработок, приняты и используются онкологами всего мира специальные критерии для оценки ответа на лечение и определения прогрессии солидных опухолей. Впоследствии они получили название критериев RECIST (Responce Evaluation Criteria in Solid Tumors) [21]. Данная система периодически пересматривается и обновляется специалистами из Responce Evaluation Criteria in Solid Tumors Groups на основании данных, получаемых в результате многоцентровых рандомизированных исследований.
В настоящее время к использованию приняты критерии RECIST 1.1. Основу классификации составляет измерение размера опухоли при помощи методов лучевой диагностики (рентгенография, КТ, МРТ, УЗИ) и эндоскопических методов. В соответствии с критериями RECIST опухолевые очаги подразделяются на два типа: измеряемые — объемное образование, выявляемое и составляющее по наибольшему диаметру при шаговом КТ ≥20 мм, а при СКТ ≥10 мм; не измеряемые — объемное образование, выявляемое и составляющее по наибольшему диаметру при шаговом КТ 
Чем дольше период после первичного лечения до прогрессирования заболевания, и чем меньше остаточная опухоль после первичной операции и химиотерапии, тем больше вероятность успеха повторной циторедуктивной операции.
В ряде случаев при распространенных опухолях возможны только паллиативные вмешательства (эвакуация асцита или жидкости из плевральной полости, наложение кишечных анастомозов из-за кишечной непроходимости и т. д.), цель которых заключается в улучшении качества жизни больных, даже если ее ожидаемая продолжительность невелика.
Лучевая терапия
Несмотря на длительный период использования лучевой терапии для лечения карциномы яичников, мнения об ее эффективности весьма неоднозначны. Вероятнее всего, противоречивость взглядов связана с небольшим количеством исследований, невысокой чувствительностью опухоли к лучевой терапии и, соответственно, с невозможностью адекватной оценки накопленных данных при сравнении режимов облучения с химиотерапией. Сходное отношение к радиотерапии в составе современных химиотерапевтических протоколов прослеживается и применительно к паллиативной терапии при неэффективности химиотерапии рака яичников.
R. Hepp и соавт. [31] провели оценку адъювантной терапии у пациенток после оперативного лечения. В исследование были включены 60 пациенток, 5-летняя выживаемость которых составляла 55%, а средний период наблюдения — 96,5 мес. В группе, где выполнялась лучевая терапия, выживаемость оказалась сравнимой с таковой при химиотерапевтическом лечении.
Кафедрой акушерства и гинекологии медицинского колледжа Университета Ульсан был выполнен ретроспективный анализ (с 1997 по 2007 г.) историй болезни 38 пациенток с рецидивирующим раком яичников, получавших в плане комбинированного лечения лучевую терапию. У большинства пациенток был впервые выявлен рак яичников III стадии (27 пациенток). Преобладающий гистотип в исследованной группе был представлен серозной аденокарциномой (n=26). Все пациентки получили не менее одной линии химиотерапии по поводу рецидива, при этом у 24 возникший рецидив рака яичников относился к платиночувствительному типу. Наиболее распространенным объектом облучения были лимфатических узлы. Ответ на терапию составил 65%. Медиана выживаемости без прогрессирования — 7,2 мес. Выраженной гематологической и диспепсической токсичности не наблюдалось [32].
Следует отметить, что проведение лучевой терапии оправдано только в случае локального характера и небольшого размера рецидива, отсутствия диссеминации и отдаленных метастазов [33].
Принимая во внимание вышеизложенное можно считать, что лучевая терапия в индивидуальных случаях имеет ряд преимуществ, в частности при терапии рецидивов рака яичников: гомогенность радиационной дозы, прицельное воздействие на тазовые, парааортальные или лимфатические узлы надключичной зоны. Однако в настоящее время лучевая терапия остается скорее методом исключения при исчерпывании резервов других методов лечения рецидива рака яичников.
Лекарственное лечение
Эффективность противорецидивного лекарственного лечения в значительной мере зависит от гистотипа и степени дифференцировки, объема остаточной опухоли, характера неоадъювантного лечения, сроках констатации рецидива.
Согласно современным представлениям GOG, «оптимальной» считается циторедукция, после которой максимальный размер каждой остаточной опухоли не превышает 1 см. Субоптимальной циторедукции соответствует размер оставшейся опухоли 1—2 см. При размерах оставшихся опухолевых масс более 2 см объем операции считается неоптимальным.
R. Bristow и соавт. [34] провели метаанализ 81 исследования, включающего 6885 пациенток, и продемонстрировали, что увеличение числа пациенток (которым была выполнена максимальная циторедукция) на каждые 10% коррелировало с удлинением медианы продолжительности жизни на 5,5%.
Зависимость медианы общей выживаемости от объема резидуальной опухоли нашла отражение и в другом исследовании, выполненном четырьмя годами позже. D. Chi в 2006 г. продемонстрировала, что при оптимальном объеме операции более высока вероятность достижения полной ремиссии после химиотерапии, а результаты общей и безрецидивной выживаемости выше как в случае первичного, так и противорецидивного лечения (табл. 3).

В 2012 г. S. Chang и R. Bristow [35] опубликовали обзор исследований, посвященных значению максимальной циторедукции, и вновь подтвердили ведущую роль оптимального объема оперативного вмешательства для общей выживаемости пациенток с рецидивирующим раком яичников.
В случае если на первом этапе противорецидивного комбинированного лечения выполнение оптимальной или субоптимальной циторедуктивной операции маловероятно, следует начинать лечение с химиотерапии.
В настоящее время стандартом лекарственного лечения является использование комбинации таксанов и платиновых производных в первой линии химиотерапии. Такой подход привел к увеличению частоты ответа на лечение (по сравнению со схемами САР и СР) и, в конечном итоге, к пролонгации как безрецидивной, так и общей выживаемости.
Однако, несмотря на появление новых химиопрепаратов и схем, а также существенные разногласия в тактике лечения больных с рецидивами рака яичников, следует констатировать весьма скромные показатели эффективности последующей противорецидивной терапии — от 14 до 22%. При этом частота ответа на последующее лечение находится в прямой зависимости от длительности безрецидивного и бесплатинового интервала [37].
На основании накопленных данных в последние годы наметилась тенденция к изменению традиционного алгоритма лечения рецидивов рака яичников, что нашло отражение в новой классификации. Если ранее все пациенты делились на две большие группы: с рецидивом, выявленным более 6 мес после первой линии терапии, — платиночувствительные или поздние, и платинорезистентные, с интервалом менее 6 мес, которые относились к ранним рецидивам, то в настоящее время используется более детальная характеристика. В последние 5 лет, в зависимости от времени констатации рецидива, различают: платиночувствительные, потенциально (частично) платиночувствительные, платинорезистентные и рефрактерные формы заболевания (табл. 4).

Доказательством влияния длительности бесплатинового промежутка на общую и безрецидивную выживаемость явился мультивариантный анализ результатов лечения рецидивов у 92 пациенток с предшествующим платиновым режимом. Продемонстрировано, что в 10% случаев ответ на лечение был отмечен при безрецидивном промежутке менее 6 мес, у 29% — в интервале от 6 до 12 мес и 84% составила группа пациенток, у которых время без прогрессирования было более 12 мес [16].
Е. Pujade-Lauraine и соавт. [38], изучая результаты терапии 583 больных с распространенными стадиями рака яичников, показали, что независимыми предикторными факторами при терапии рецидивов являются длительность безрецидивного промежутка и ответ на терапию первой линии. Уровень ответа у пациенток со стабилизацией заболевания и безрецидивным интервалом менее 12 мес колебался от 24 до 35%. При интервале более 12 мес ответ на лечение был у 52—62% пациенток.
Ретроспективный анализ 178 историй болезни женщин с рецидивами рака яичников продемонстрировал высокие цифры ответа на лечение (55—75%) в тех случаях, когда бесплатиновый интервал составлял от 12 до 17 мес, в то же время для промежутка менее 12 мес он не превышал 33% [39].
Таким образом, деление рецидивов в зависимости от длительности бесплатинового интервала полностью оправдано и является ориентиром для выбора противорецидивной терапии.
При развитии рецидива опухоль чаще всего уже резистентна к использованным ранее химиопрепаратам, а больная страдает от проявлений разных видов токсичности после перенесенной ранее терапии. В связи с этим, для достижения объективного ответа следует использовать моноагенты или комбинации с учетом разных механизмов действия, профилей токсичности полученного первичного и предполагаемого противорецидивного лечения, а также соматического статуса пациентки. Своевременный переход с одной линии терапии на другую, вследствие низкой эффективности или неэффективности проводимого лечения из-за приобретенной резистентности, является основным из факторов, влияющих на показатели общей выживаемости.
Следует отметить, что когорта пациенток с платиночувствительной формой рака яичников всегда имеет более благоприятный прогноз для химиотерапевтического лечения. При терапии пациенток с платинорезистентным и рефрактерным раком яичников, а также больных с платиночувствительной формой заболевания, у которых рецидив констатирован менее чем через 12 мес после окончания предыдущего лечения, основной задачей терапии является разработка путей удлинения бесплатинового интервала с целью последующей платиновой реиндукции.
При лечении платинорезистентных форм необходимо использовать цитостатики, активные в отношении резистентного заболевания, отдавать предпочтение монотерапии, продолжать лечение до прогрессирования или неприемлемой токсичности. Следует помнить, что профиль токсичности применяемого режима должен отличаться от токсичности предыдущей терапии, на что указывают большинство исследователей.
Среди большого количества препаратов, использующихся в клинической практике в качестве второй линии терапии резистентного рака яичников, в настоящее время активно изучаются пегилированный липосомальный доксорубицин, пероральный этопозид, винорельбин, гемцитабин, доцетаксел, топотекан, в том числе большой спектр препаратов таргетной терапии.
Одним из наиболее перспективных препаратов второй линии в лечении рецидивов рака яичников является топотекан. Его механизм заключается в цитотоксическом действии. Топотекан связывается с комплексом топоизомераза I-ДНК и предотвращает повторное сшивание нитей ДНК. Полагают, что цитотоксичность топотекана обусловлена повреждением удвоенной нити ДНК, образующейся в процессе ее синтеза. При этом ферменты, участвующие в репликации, взаимодействуют с тройным комплексом, сформированным топотеканом, топоизомеразой I и ДНК опухолевой клетки [40, 41].
В отделении гинекологии отдела опухолей репродуктивных и мочевыводящих органов ФГБУ «ФМИЦ им. П.А. Герцена» с целью изучения целесообразности использования топотекана в качестве агента для пролонгации бесплатинового интервала были проанализированы результаты проведенной монохимиотерапии топотеканом в еженедельном режиме и мониторинга 63 пациенток с рецидивом рака яичников. Топотекан был использован в еженедельной схеме введения по 4 мг/м 2 в 1, 8 и 15-й дни с длительностью курса 28 дней.
Всем пациенткам перед началом лечения рецидива проводилось комплексное обследование в том же объеме, что и перед началом первичного лечения. У 60 (95%) пациенток факт развития рецидива был верифицирован морфологически, у 3 (5%) лечение топотеканом начато по поводу маркерного рецидива.
Средний возраст больных составил 55 лет при колебаниях от 32 до 74 лет. Оцениваемая группа в 92% (58 случаев) состояла из пациенток в III—IV стадии заболевания и более чем 50% (33 пациентки) относились к группе платинорезистентного и платинорефрактерного рака яичников, что определяло неблагоприятный прогноз заболевания и низкую эффективность противорецидивной терапии.
В качестве второй линии терапии топотекан использовался у 77,7% (49 пациенток), третьей и четвертой — у 17,5% (11 больных) и у 3,22% (2 случая) соответственно. У одной пациентки (1,58%) топотекан применялся в качестве шестой линии лечения. У 63 пациенток было проведено 257 курсов, медиана составила 4 курса.
В зависимости от результатов проведенного комплексного обследования оценивались эффективность и токсичность проведенного лечения, а также принималось решение о возможности и целесообразности дальнейшей терапии топотеканом.
Оценка эффективности по критериям RECIST проводилась в межкурсовых интервалах каждые 2 курса химиотерапии и через 4 нед после окончания противорецидивного лечения.
Общий ответ (сумма полного и частичного ответов) был достигнут в 23,8% (в 15 из 63) случаев для всей исследуемой группы больных, в то время как для платинорезистентных — 12,1% (4/33), для потенциально платиночувствительных (безрецидивный интервал 6—12 мес) — в 31,7% (7/22), для чувствительных (более 12 мес) — в 50% (4/8) (табл. 5).

При анализе длительности времени до прогрессирования оказалось, что в группах платинорезистентного и потенциально платиночувствительного рака яичников показатели средних значений различаются на 3 нед (16,7 и 13,7 нед соответственно, в то время как для группы больных с первым безрецидивным интервалом более 12 мес этот показатель составил 58,8 нед. Полученные данные еще раз доказывают, что на прогноз заболевания, а также эффективность последующих линий терапии, существенное влияние оказывает продолжительность первого безрецидивного интервала.
Более чем у половины (40 больных, 63,5%) на фоне проводимого лечения или сразу после его окончания было отмечено прогрессирование заболевания, однако у 23 (57,5%) пациенток, учитывая достаточную пролонгацию бесплатинового интервала (12 мес и более), появилась возможность платиновой реиндукции, что нашло отражение в показателях общей выживаемости.
У 9 (14,3%) пациенток прогрессирование заболевания было отмечено на фоне лечения топотеканом (после 2-го курса), у 3 (4,8%) — при первом комплексном обследовании после окончания противорецидивного лечения. Однако у большинства — 51 (80,9%) пациентка, была достигнута ремиссия, позволяющая при дальнейшем прогрессировании заболевания осуществить платиновую реиндукцию.
Именно когорта пациенток с распространенным раком яичников, вынужденная получать неоднократное лечение и находиться в паритетных отношениях с лечащим врачом, требует пристального внимания. Только при должном внимании к больной, не только в момент введения цитостатика, но и в межкурсовых интервалах, тщательном анализе анамнестических данных и особенностей течения заболевания у конкретной женщины возможно персонализировать противорецидивную терапию и добиться более высоких результатов выживаемости.
Заключение
Таким образом, проведение данного исследования позволило установить неоспоримые преимущества применения топотекана: возможность удлинения бесплатинового интервала с целью последующей платиновой реиндукции и увеличение общей выживаемости за счет чередования платиновых и бесплатиновых режимов.
В ведении клиницистом пациентки с рецидивом распространенного рака яичников есть следующие особенности: врач не может быть до конца убежден, что больная получит 6—8 курсов запланированной терапии (в отличие от стандарта первичного лечения). Также нельзя исключать тот факт, что проведение более 6 курсов химиотерапии одним цитостатиком приведет к возникновению вторичной резистентности и окажет скорее отрицательное, нежели иное воздействие на результаты лечения. При терапии рецидивов ориентируются на результаты обследования после каждых 2 курсов терапии, чтобы вовремя определить ответ опухоли на лечение, а в случае его отсутствия осуществить замену схемы лечения.
Несмотря на длительный период изучения проблемы диссеминированных процессов в яичниках и очевидные достижения в лечении данной патологии, по-прежнему невысокими остаются показатели общей выживаемости у таких больных. К сожалению, рецидивы при данной патологии неизбежны. И, несмотря на появление новых химиопрепаратов и схем, эффективность последующей противорецидивной терапии невелика.