что такое пролиферация гепатоцитов
Регенерация печени – это несложно!
Результаты недавно проведенного исследования указывают на то, что регенерация печени происходит не под действием факторов транскрипции, как считалось, а благодаря активации обычного деления клеток.
Печень является одним из немногих органов, способных восстанавливать первоначальный размер даже при сохранении всего лишь 25% нормальной ткани. Механизмы, лежащие в основе регенерации ее ткани, изучены не до конца. Полученные ранее результаты указывали на то, что клетки, обеспечивающие регенерацию тканей, ведут себя подобно клеткам развивающегося эмбриона.
Многие белки, участвующие в регенерации органов, известны, и ученые активно изучают возможности их стимуляции для восстановления утраченных органов. Исследователи Гарвардской медицинской школы, работающие под руководством доцента Сета Карпа (Seth Karp), сконцентрировали свое внимание на поиске белков, участвующих в регенерации печени, восстановление которой спасло бы жизни многих пациентов с неоперабельными из-за большого объема опухолями печени.
С помощью ДНК-микрочипов и специального программного обеспечения авторы проанализировали активность генов в клетках регенерирующей печени взрослых мышей (которым предварительно удаляли две трети органа) и развивающейся печени мышиных эмбрионов, находящихся на разных этапах развития.
К удивлению ученых оказалось, что совпадают только несколько белков, участвующих в процессах эмбриональной и взрослой регенерации. Факторы транскрипции – белки, влияющие на содержащуюся в ядрах клеток ДНК, – высокоактивны только при регенерации эмбриональной печени, а стимулирующие деление клеток белки активны как в развивающейся, так и в регенерирующей печени.
Таким образом, регенерирующая печень ведет себя не как развивающийся эмбриональный орган, а увеличивается в размерах за счет обычной пролиферации клеток. Манипуляции c факторами транскрипции гораздо сложнее, чем изменение активности других белков, и полученные результаты указывают на то, что, стимулировать регенерацию печени – реальная задача.
В ближайшем будущем ученые планируют заняться идентификацией клеток, обеспечивающих регенерацию печени. Известно, что восстановление многих органов и тканей происходит за счет взрослых стволовых клеток, однако в случае печени в процесс вполне могут быть вовлечены обычные гепатоциты.
Статья Hasan H. Otu et al. «Restoration of Liver Mass after Injury Requires Proliferative and Not Embryonic Transcriptional Patterns» опубликована в Journal of Biological Chemistry от 13 апреля 2007 года.
NAME] => URL исходной статьи [
Ссылка на публикацию: Cbio
Код вставки на сайт
Регенерация печени – это несложно!
Результаты недавно проведенного исследования указывают на то, что регенерация печени происходит не под действием факторов транскрипции, как считалось, а благодаря активации обычного деления клеток.
Печень является одним из немногих органов, способных восстанавливать первоначальный размер даже при сохранении всего лишь 25% нормальной ткани. Механизмы, лежащие в основе регенерации ее ткани, изучены не до конца. Полученные ранее результаты указывали на то, что клетки, обеспечивающие регенерацию тканей, ведут себя подобно клеткам развивающегося эмбриона.
Многие белки, участвующие в регенерации органов, известны, и ученые активно изучают возможности их стимуляции для восстановления утраченных органов. Исследователи Гарвардской медицинской школы, работающие под руководством доцента Сета Карпа (Seth Karp), сконцентрировали свое внимание на поиске белков, участвующих в регенерации печени, восстановление которой спасло бы жизни многих пациентов с неоперабельными из-за большого объема опухолями печени.
С помощью ДНК-микрочипов и специального программного обеспечения авторы проанализировали активность генов в клетках регенерирующей печени взрослых мышей (которым предварительно удаляли две трети органа) и развивающейся печени мышиных эмбрионов, находящихся на разных этапах развития.
К удивлению ученых оказалось, что совпадают только несколько белков, участвующих в процессах эмбриональной и взрослой регенерации. Факторы транскрипции – белки, влияющие на содержащуюся в ядрах клеток ДНК, – высокоактивны только при регенерации эмбриональной печени, а стимулирующие деление клеток белки активны как в развивающейся, так и в регенерирующей печени.
Таким образом, регенерирующая печень ведет себя не как развивающийся эмбриональный орган, а увеличивается в размерах за счет обычной пролиферации клеток. Манипуляции c факторами транскрипции гораздо сложнее, чем изменение активности других белков, и полученные результаты указывают на то, что, стимулировать регенерацию печени – реальная задача.
В ближайшем будущем ученые планируют заняться идентификацией клеток, обеспечивающих регенерацию печени. Известно, что восстановление многих органов и тканей происходит за счет взрослых стволовых клеток, однако в случае печени в процесс вполне могут быть вовлечены обычные гепатоциты.
Статья Hasan H. Otu et al. «Restoration of Liver Mass after Injury Requires Proliferative and Not Embryonic Transcriptional Patterns» опубликована в Journal of Biological Chemistry от 13 апреля 2007 года.
«Резервный» механизм восстановления печени
«Резервный» механизм восстановления печени
Слева — ладонь здорового человека; справа — ладонь человека, больного желтухой.
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Быстрая утомляемость, потеря аппетита, тошнота, пожелтение кожных покровов и даже частые головные боли — все эти симптомы могут быть косвенными свидетельствами патологий печени. Несмотря на высокую способность клеток печени к восстановлению, в некоторых тяжелых случаях они просто не справляются с болезнью. Новое исследование команды ученых из Центра регенеративной медицины в Эдинбурге, Массачусетского технологического института и Сколковского института науки и технологий показывает, как с помощью блокирования основного пути восстановления клеток печени удалось открыть резервных «ремонтников».
Конкурс «био/мол/текст»-2017

Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Спонсором приза зрительских симпатий и партнером номинации «Биомедицина сегодня и завтра» выступила фирма «Инвитро».
Открытие, предсказанное мифами: регенерация у рептилий
Способность организмов к регенерации, то есть восстановлению структуры и функций органов, является одной из важных загадок медицины, которую человек давно пытается разгадать. Наблюдения за животным миром позволили сформулировать следующую закономерность: чем проще устроено животное, тем легче ему восстановить утраченные органы. И если дождевой червь способен «достроить» половину собственного тела, а ящерица — отрастить новый хвост, то у человека способности к регенерации представлены в более узком диапазоне [1], [2].
Сказочных существ, способных отрастить себе новую голову или хвост, довольно много. Но и Лернейская гидра (рис. 1), и горгона Медуза, и даже Змей Горыныч имеют вполне реального «родственника» — тритона. Этот представитель хвостатых амфибий считается одним из древнейших видов фауны на Земле. Тритоны успешно восстанавливают не только хвост и лапы, но даже поврежденные сердце и спинной мозг. Однако амфибии — далеко не единственные существа, которым доступна функция «саморемонта». Например, рыбок данио рерио используют не только в аквариумистике, но и для изучения регенерации тканей сердца. А первым животным, благодаря которому появился термин «регенерация», стал речной рак. Изучением восстановления утраченных ног у раков занимался французский ученый Рене Реомюр, предложивший новый термин еще в 1712 году.
Рисунок 1. «Сражение Геракла с Лернейской гидрой» Антонио дель Поллайоло (1475 г.).
Неудивительно, что ученым хочется понять, почему ящерица, например, может восстановить утерянный хвост, а человек отрастить новую руку не может. Изучение структуры и состава тканей сразу после потери ящерицей хвоста позволило обнаружить модель регенерации у рептилий. В период заживления базальные клетки эпидермиса активно делятся, постепенно «закрывая» собой рану. Дополнительная агрегация делящихся клеток на дистальном конце позвоночника способствует разрастанию бластемы — скоплению неспециализированных клеток. В этот момент запускаются процессы образования новых кровеносных сосудов, а следом — и новых периферических аксонов. Наиболее поздно в дело вступают новообразования костной ткани и мышц. Однако точный механизм регенерации хвоста у ящериц не изучен до конца. Недавнее исследование Университета штата Аризона и Института геномных исследований позволило обнаружить молекулы микро-РНК, способствующие регенерации мышц, хрящей и позвоночника [3]. Возможно, эта работа позволит разработать методы лечения, основанные на управлении экспрессией генов с помощью микро-РНК.
Открытие, сделанное случайно: регенерация у мышей
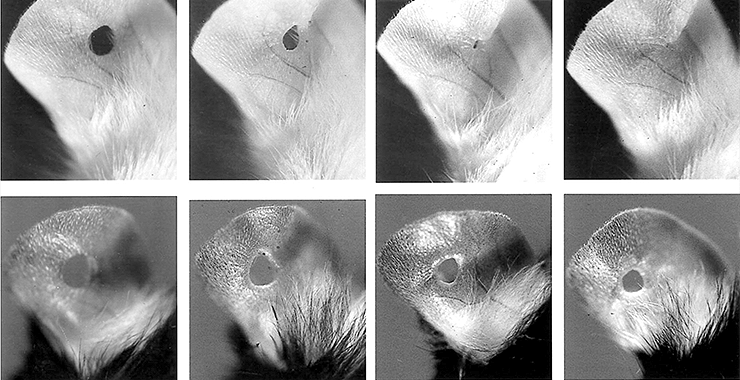
Но как обстоят дела с возможностями регенерации на уровне целых органов у более высокоорганизованных, чем ящерицы, организмов? Еще недавно ученые были уверены, что млекопитающие не способны восстанавливать утраченные органы. Но это убеждение пошатнуло открытие, сделанное в лаборатории иммунолога Эллен Хебер-Кац из исследовательского центра в Филадельфии. Там проводили различные эксперименты на особых «пациентах» — генетически модифицированных мышах линии Murphy Roth Large (MRL). Такие особи отличались от обычных тем, что у них не работали Т-клетки иммунной системы. Однажды доктор Хебер-Кац дала своему лаборанту несложное задание: пометить выбранных для очередного эксперимента мышей, сделав у них небольшие двухмиллиметровые отверстия в ушах. Через несколько недель выяснилось, что дырочек в ушах подопытных нет. Структура кровеносных сосудов, хрящей, тканей выглядела неповрежденной. Однако лаборант заверил доктора, что задача по «мечению» мышей была своевременно выполнена. После повторения эксперимента с ушной раковиной эффект был таким же: уже через четыре недели на «проколотых» участках ушей образовалась бластема (рис. 2) [4]. Следующим «опытным» объектом стал хвост — и вновь удалось продемонстрировать частичную регенерацию тканей. Однако восстановительные способности MRL мышей не безграничны: например, вырастить новую лапку такая мышь, увы, не смогла. Причина заключается в различном расположении и количестве кровеносных сосудов в органах и тканях животного. Без прижигания мышь просто погибнет от большой потери крови — задолго до запуска регенерационных процессов. А прижигание на месте ампутированной конечности исключает появление бластемы.
Рисунок 2. Этапы восстановления ткани уха у обычной лабораторной мыши (снизу) и трансформированной линии MRL (сверху).
В результате серии наблюдений за трансгенными мышами удалось показать, что секрет их успеха — в определенном белке. Так, у мышей линии MRL заблокирована экспрессия гена, кодирующего белок р21 (ингибитор циклинзависимой киназы 1А), который регулирует процесс нормального деления клеток. Подавление активности этого гена у нормальных мышей показывает аналогичную способность к регенерации повреждений [5]. Но проводить подобные манипуляции следует с большой аккуратностью: «отключение» гена р21 может привести к нарушению нормального размножения клеток, что способно привести к катастрофическому делению всех клеток тела.
Повседневная реальность: возможности регенерации у человека
А как обстоят дела с регенерацией у людей? Даже без «выключения» гена, кодирующего белок р21, организм человека может восстанавливать некоторые органы. Например, кожу, чья регенерирующая способность привычна для нас так же, как и воздух. Самый большой по площади орган нашего тела постоянно обновляет собственную структуру за счет омертвения и отторжения клеток эпидермиса с последующей заменой их новыми клетками. Сходным образом происходит процесс восстановления других эпителиальных тканей — например, слизистых оболочек дыхательных путей, а также желудка и кишечника. На втором месте в иерархии регенерирующих способностей находится костная ткань. Известно, что переломы довольно успешно заживляются в течение определенного периода неподвижности.
А среди внутренних органов заслуженным лидером по регенерации является печень. Легенда о титане Прометее, у которого всего за одну ночь выклеванная печень вырастала вновь (рис. 3), имеет в себе рациональное зерно.
Рисунок 3. «Прикованный Прометей». Скульптура Никола-Себастьяна Адама, 1762 г. (Лувр).
Действительно, печень обладает уникальным свойством восстанавливаться до своего первоначального объема, даже если разрушено более 70% печеночной ткани. Подобный процесс происходит за счет работы клеток печени — гепатоцитов. Эти клетки играют ключевую роль в модификации и выводе из организма токсичных веществ. В здоровом органе, не тронутом патологическими процессами, эти клетки обычно находятся в состоянии покоя. Но при необходимости восстановления целостности органа, например, после частичной резекции (удаления части органа), почти все гепатоциты активируются и приступают к делению. Причем делятся они 1–2 раза, а затем снова возвращаются в покоящееся состояние. Это свойство лежит в основе лечения некоторых заболеваний, например, цирроза печени или гепатита, когда пациенту пересаживают часть здоровой печени от донора. Однако такие манипуляции могут привести к ряду проблем со здоровьем, в том числе расширению вен пищевода и желудка, почечной недостаточности и желтухе. Более того, появление в печени пациента быстро делящихся клеток донора может привести к возникновению ракового заболевания. Справиться же своими силами при прогрессирующей болезни гепатоциты уже не могут, ведь к делению способны лишь здоровые клетки, которых в организме больного остается все меньше и меньше.
Получается, что, несмотря на мощный регенеративный потенциал, восстановительные способности печени имеют предел. В случаях, когда патологический процесс заходит слишком далеко, эффект от работы гепатоцитов оказывается недостаточным. Например, когда здоровая печень поражается в результате токсических или вирусных воздействий, что провоцирует разрастание соединительной ткани (фиброз). Существуют ли другие способы восстановления структуры этого жизненно важного органа без участия гепатоцитов? На этот вопрос позволяет ответить совместное исследование команды ученых из Эдинбургского университета, Массачусетского технологического института и Сколковского института науки и технологий [6].
Перспективная реальность: ускоренная регенерация печени
Для изучения процессов регенерации печени использовали трансгенных мышей линии tdTomato (tdTom). Эта линия модифицирована красными флуоресцентными белками, что позволяет визуализировать клетки печени [7]. Однако поиск других «спасательных» клеток осложняет то, что гепатоциты в пораженном организме продолжают работать. Для идентификации «не-гепатоцитов» исследователи использовали технологию нокдауна генов у мышей. Эффект нокдауна заключается в том, что позволяет временно снижать активность конкретных генов, не внося изменения в структуру хромосом и последовательность ДНК. Для «выключения» генов, ответственных за деление и миграцию гепатоцитов, создали особые липидные наночастицы с короткими интерферирующими РНК (siRNA) [8], [9]. С их помощью удалось заблокировать экспрессию необходимых генов.
Снижение пролиферации гепатоцитов за счет «выключения» интересующих ученых генов проводили на двух моделях. В первом случае временно блокировали ген ITGB1, который кодирует β1-интегрин. Вторая модель — одновременное блокирование β1-интегрина и стимуляция избыточной экспрессии белка р21. Обе модели обладали сходным эффектом, однако их механизмы отличались: β1-интегрин вызывает некроз гепатоцитов, а избыточная экспрессия р21 подавляет их пролиферацию.
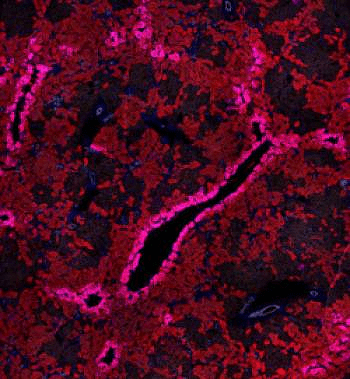
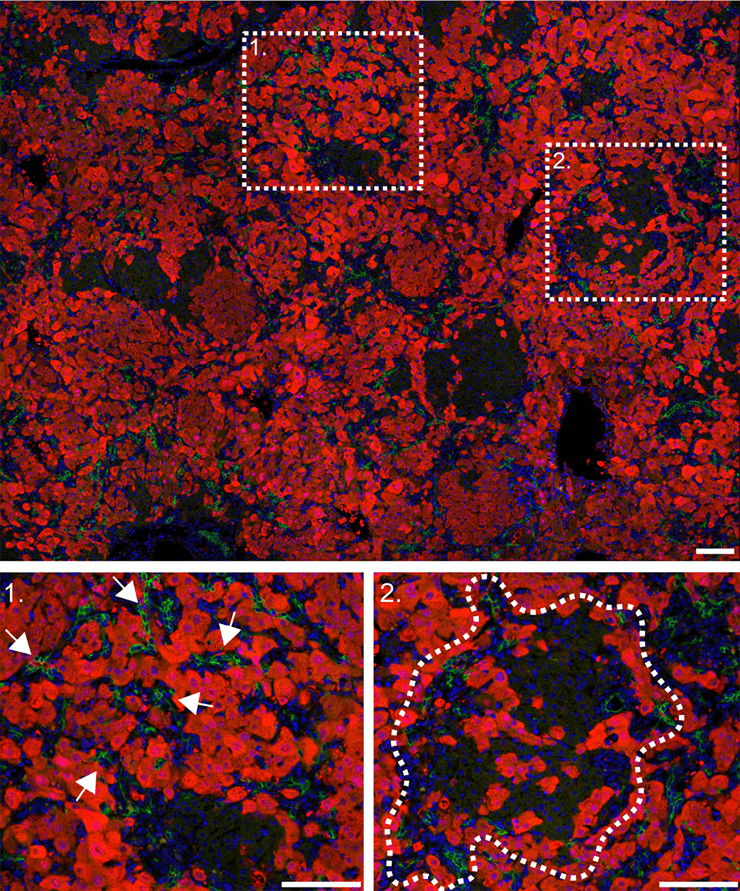
Рисунок 4. Регенерация печени с помощью клеток желчных протоков (выделены белым цветом).
Подобная «блокада» основных функциональных клеток печени привела к необычному эффекту: при выключении главного механизма регенерации запускался резервный способ с участием клеток желчных протоков. Так, потеря β1-интегрина и повышение уровня белка р21 привели к значительному увеличению численности гепатоцитов, полученных из холангиоцитов. Эти эпителиальные клетки внутрипеченочных желчных протоков составляют всего 2–3% от общей популяции, однако дальнейшие наблюдения показали, что именно они способны «перепрограммироваться» и превращаться в гепатоциты, тем самым восстанавливая печень (рис. 4). Более того, холангиоциты показали лучшую, чем гепатоциты, способность к делению. Ранее обнаружили, что они близки к овальным клеткам печени — своеобразным «стволовым» агентам данного органа [10].
Для того чтобы отследить регенеративные способности холангиоцитов, использовали три независимых пути:
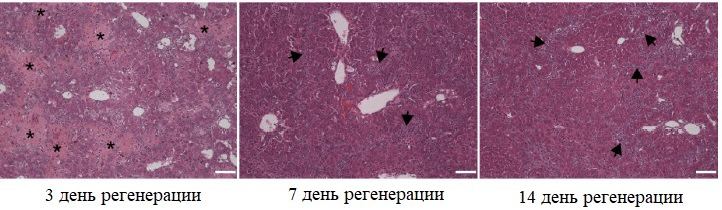
Для изучения регенерации печени за счет не-гепатоцитов по всем трем путям визуализировали отдельные участки печени. Оказалось, что за счет холангиоцитов восстанавливается примерно 20–30% гепатоцитов, причем малые пролиферативные гепатоциты идентифицировали уже с 7 дня, а к 14 дню регенерации их количество значительно увеличивалось (рис. 4–6).
Рисунок 5. Динамика восстановления печеночной ткани с помощью холангиоцитов (на примере модели холестатической болезни печени). Звездочками показаны некротические области; стрелками обозначены области с клеточным инфильтратом.
Рисунок 6. Клетки печени мыши, трансформированной по гену ITGB1 (14 день регенерации). Визуализация с помощью красных флуоресцентных белков. 1 — стрелками показаны инвазивные клетки; 2 — пунктиром обведена область регенеративного узла.
Получается, что в печени существует резервный механизм регенерации: трансформация клеток желчных протоков в функциональные гепатоциты при блокировании β1-интегрина. Возможно, в организме существуют и другие гены-мишени, «выключение» которых стабилизирует процессы, связанные с развитием фиброза и дальнейшего цирроза печени. Ученым еще предстоит раскрыть механизмы сигналов, побуждающих желчные клетки запускать процессы «перепрограммирования». Однако результаты исследования уже сегодня открывают новое направление клеточной регенеративной медицины: разработку препаратов, стимулирующих холангиоциты. Возможно, в будущем медицина избавится от необходимости проводить сложные и дорогостоящие операции по пересадке печени. Взамен этого распространится более доступная технология: «включение» сигналов о необходимости регенерации, когда с помощью наиболее активных холангиоцитов будут запускаться процессы активного деления клеток печени.
Что такое пролиферация гепатоцитов
Пролиферативную активность гепатоцитов связывают с уровнем в крови органоспецифических факторов роста [5, 30], ведущая роль среди которых принадлежит фактору роста гепатоцитов (HGF) [28, 37].
Фактор роста гепатоцитов относится к цитокинам HGF/SF – «рассеивающий фактор» (scatter factor, SF). Это гликопротеин, являющийся сильным митогеном для гепатоцитов и участвующий в регенерации печени. Он стимулирует пролиферацию некоторых типов эпителиоцитов, а также клеток сосудистого эндотелия и меланоцитов. HGF/SF участвует в регенерации печени in vivo [30], является митогеном для гепатоцитов [33]. Известно, что фактор роста гепатоцитов вырабатывается непаренхиматозными клетками печени (клетки Купфера, клетки Ито), макрофагами, клетками селезенки [11, 50]. Установлено, что при культивировании эмбриональные клетки печени вырабатывают фактор роста гепатоцитов (HGF) с максимальной концентрацией на 5-е сутки и увеличением в 3,5 раза по сравнению с начальной концентрацией, что по времени совпадает с пиком митотической активности [3].
Фактор роста гепатоцитов, очищенный из сыворотки или плазмы человека, является гепарин-связывающим гетеродимерным гликопротеином, по структуре состоящим из тяжелой цепи α и легкой цепи β, с молекулярной массой 58–69 и 30–34 кДа соответственно, что показано с помощью электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия [19, 46].
Показано, что фактор роста гепатоцитов, выделенный из среды культивирования клеточной линии фибробластов эмбрионального легкого человека или плаценты человека, представляет собой необработанный про-HGF полипептид с одной цепью с молекулярной массой 87–92 кДа. Анализ последовательности нуклеотидов кДНК фактора роста гепатоцитов показал, что обе полипептидные цепи HGF закодированы в единственной открытой рамке считывания, кодирующей молекулу пре-про-HGF длиной 728 аминокислот. Сигнальный пептид 31 аминокислоты по завершении пре-про- HGF удаляется в эндоплазматическую сеть, чтобы уступить место предшественнику про-HGF [15, 19, 30].
Исследования in vitro, в которых аминокислота в месте протеолиза между α- и β-цепями была изменена путем введения нуклеотидной замены в область к ДНК HGF, четко продемонстрировали, что про-HGF с одной цепью связывается с рецептором HGF, но не вызывает митогенного стимула. Это демонстрирует механизм активации HGF, посредством которого фактор роста гепатоцитов расщепляется протеолизом до зрелой гетеродимерной формы [14].
Ген Met экспрессируется во многих типах клеток, но с высокой интенсивностью в клетках эпителиального происхождения [8, 10].
Известно, что уникальные фосфотирозиновые остатки трансмембранных тирозин-киназ обладают высоким сродством к Src-гомологичным доменам SH2 цитоплазматических эффекторов [15]. Благодаря подобному сродству активированный рецептор приобретает способность удерживать у мембраны ряд цитоплазматических белков – трансдукторов, посредством их собственных SH2 доменов или SH2 доменов молекул-адапторов. После воздействия HGF, при активации рецептора c-Met аутофосфорилирует остаток тирозина 1235, а киназная активность c-Met положительно регулируется аутофосфорилированием тирозина и отрицательно модулируется активацией протеинкиназы С. Также известно, что аутофосфорилированный рецептор HGF соединяется с фосфатидилинозитол 3-киназой, которая фосфорилирует фосфолипиды инозитола и, как предполагается, является ключевым ферментом в пути сигнальной передачи, индуцированном активацией рецептора фактора роста [8, 16].
На С-конце рецептора HGF/SF имеется участок, содержащий два фосфотирозиновых остатка, локализованных в последовательности YVH/NV. Одновременное фосфорилирование этих фосфотирозиновых остатков способствует связыванию рецептора HGF/SF с SH2 доменами фосфолипазы С, что ведет к активации протеинкиназы С и мобилизации внутриклеточного кальция; с SH2 доменами белка-активатора ras GTP-азы, фосфатидилинозитол-3-киназы [38].
Рецепторы к фактору роста гепатоцитов обнаружены на гепатоцитах, эпителиальных клетках, тучных клетках, микроглии головного мозга, на клетках пищевода, двенадцатиперстной и толстой кишки, панкреатических эндокринных клетках, Т- и В-лимфоцитах. При отделении Т-клеток от стромы селезенки синтез HGF уменьшается [21, 45].
Следует отметить, что HGF человека гомологичен кошачьему, мышиному, крысиному (93,2–93,3 %) и свиному фактору роста гепатоцитов [21, 49].
Интересные результаты по механизмам синтеза факторов роста получены при совместном культивировании непаренхиматозных клеток печени с гепатоцитами и стволовыми клетками. Гепатоциты активно пролиферировали, а стволовые клетки дифференцировались при добавлении к культуре непаренхиматозных клеток или фактора роста гепатоцитов [26, 44]. Мотогенное воздействие HGF на эпителий вызывает нарушение межклеточных контактов в эпителиальном пласте, изменение дисковидной формы эпителиоцитов на фибробластоподобную с активной миграцией клеток из эпителиального пласта. Приобретение эпителиоцитами под влиянием HGF/SF поляризованной фибробластоподобной формы контролируется цитоскелетной системой микротрубочек, которые подавляют поляризацию клеток, хотя при этом сохраняют миграционную активность [12, 39, 43].
Видимо, мотогенный эффект рассеивающего фактора обусловлен не только его поляризующим действием на эпителиальные клетки, но также, возможно, стимулирующим влиянием на формирование клетками псевдоподий и их адгезию к внеклеточному матриксу. Кроме того, HGF обладает морфогенным действием [16, 24, 40].
Реакция клеток в культуре на HGF/SF инициируется связыванием с его специфическим рецептором – трансмембранной тирозинкиназой, продуктом протоонкогена c-met. Связывание вызывает в клетке сложный каскад сигналов, ведущих в конечном счете к ее пролиферации (митогенный эффект) или к приобретению «локомоторного» фенотипа (мотогенный эффект) [16, 24, 40].
Дополнительным свойством фактора роста гепатоцитов является защита гепатоцитов при холодовом повреждении [25].
Роль непаренхиматозных клеток печени и микроциркуляторного компонента подчеркивается в литературе как важнейший фактор устойчивости печени к температурному повреждению при криоконсервации [22].
Меченный с помощью радиоактивного йода HGF использовали для исследования кинетики плазменного клиренса и тканевого поглощения фактора роста гепатоцитов у крыс. После внутривенной инъекции фактор роста гепатоцитов исчезает из крови в двухфазном режиме, состоящем из быстрой фазы (период полувыведения равен 4 минутам) и последующей медленной фазы, при которой высокие уровни фактора роста гепатоцитов остаются в периферической крови (окончательный период полувыведения равен 85 минутам). Было выявлено, что основной орган поглощения фактора роста гепатоцитов у крыс – печень и, в меньшей степени, почки. В противоположность большому количеству HGF в периферической крови после системной инъекции, введение фактора роста гепатоцитов, меченного радиоактивным изотопом, в портальную вену привело к возникновению гораздо меньшей радиоактивности в периферической крови (более 70 % введенного фактора роста гепатоцитов осталось в печени). Это свидетельствует о том, что печень является главным местом поглощения фактора роста гепатоцитов [28, 31].
Количество фактора роста гепатоцитов увеличивается в организме при повреждении печени. У пациентов, страдающих различными заболеваниями печени (цирроз, хронический или острый гепатит, резекция печени) количество фактора роста гепатоцитов в сыворотке крови значительно возрастает [5, 48].
В эксперименте c моделированной острой печеночной недостаточностью различного генеза (токсическое повреждение печени четыреххлористым углеродом, резекция печени, ишемия) было показано быстрое увеличение уровня фактора роста гепатоцитов в плазме крови во время ранней фазы регенерации печени [18, 27, 37].
Продукция фактора роста гепатоцитов, активизируясь после повреждения гепатоцитов, индуцирует ангиогенез, стимулирует пролиферацию и миграцию клеток, ингибирует Fas-индуцированный апоптоз и тормозит развитие фиброза после воспаления [11, 27, 41].
Каковы эффекты фактора роста гепатоцитов при токсическом повреждении печени четыреххлористым углеродом? Рассмотрим известные результаты.
Существуют прямые указания на протекторное воздействие фактора роста гепатоцитов на клетки печени при остром токсическом повреждении, индуцированном четыреххлористым углеродом, а также улучшение конъюгации билирубина и транспорта желчи [4, 20, 35, 36].
Фактор роста гепатоцитов, повышая внутриклеточную концентрацию глутатиона и ферментов антиоксидантной защиты, защищает гепатоциты от продуктов перекисного окисления липидов, предотвращает образование жировых вакуолей в гепатоцитах [4, 11, 35].
Ингибирование Fas-индуцированного апоптоза связано с активацией экспрессии генов Bcl-xL. Фактор роста гепатоцитов снижает и тормозит реакции острого и хронического отторжения аллогенного трансплантанта, ингибируя экспрессию ТФР-β1 и повышая экспрессию ИЛ-10. Снижение экспрессии ТФР-β1 ингибирует фиброгенез и апоптоз гепатоцитов и вызывает полное разрешение фиброза печени при циррозе [27, 29].
С другой стороны, важным промежуточным событием при повреждении гепатоцитов четыреххлористым углеродом является нарастание концентрации Са 2+ в цитозоле, предшествующее активации фосфолипазы А2 с последующей деструкцией клеточной мембраны, а защитное воздействие HGF может быть реализовано на уровне перераспределения маршрутов Ca 2+ в цитозоле, что препятствует разрушению клеточных мембран при активации перекисного окисления липидов [6, 50].
Таким образом, фактор роста гепатоцитов, согласно данным литературы, играет ведущую роль в регенерации печени, поврежденной четыреххлористым углеродом, и таким образом, увеличивает выживаемость животных при токсическом повреждении печени [11, 27, 36]. Активизирует белково-синтетическую функцию поврежденной печени, увеличивается синтез альбумина, повышается концентрация глутатиона, повышается активность ферментов супероксиддисмутазы, каталазы, глутатионпероксидазы в гепатоцитах (активирует ферменты антиоксидантной защиты и инактивации токсических метаболитов (CCl3‒ и CCl3OO‒)) [2, 17, 18, 41, 42].
Известно, что HGF, ограничивая цитолиз гепатоцитов, способствует нормализации уровня цитолитических ферментов, восстанавливает секрецию триацилглицеролов из гепатоцитов [18, 41, 42].
После обширных резекций фактор роста гепатоцитов способствует регенерации поврежденной печени, снижает уровень летальности, активизирует белково-синтетическую функцию печени и вызывает обратное развитие цирроза [34, 35, 37, 47]. Установлена нормализация показателей неспецифической резистентности при токсическом повреждении печени в условия трансплантации клеток печени, продуцирующих фактор роста гепатоцитов [1, 2].
Известны последствия введения HGF при трансплантации гепатоцитов. Оказывается, этот регуляторный пептид стимулирует пролиферацию аллогенных гепатоцитов, обеспечивая замещение поврежденных клеток реципиента [9]. Установлено повышение уровня фактора роста гепатоцитов в крови после включения донорских клеток в процессы метаболизма, обнаружена стимуляция функций трансплантированных гепатоцитов при введении фактора роста гепатоцитов [32, 40].
Рецензенты:
Власов Б.Я., д.м.н., профессор кафедры органической и биологической химии, ФГОУ ВПО ИрГСХА, Иркутский р-он, п. Молодежный;
Пивоваров Ю.И., д.м.н., профессор, ведущий научный сотрудник ФГБУ «Научный центр реконструктивной и восстановительной хирургии», г. Иркутск.