что такое пролапс хиазмальной цистерны
«Пустое» турецкое седло: этиология, патогенез, нейроэндокринные и зрительные нарушения
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
«Empty» turkish saddle: etiology, pathogenesis, neuroendocrinous and visual infringements
L.N. Samsonova, A.V. Svirin
In article authors cite the literature devoted to the analysis of etiology, diagnostics, pathogenesis and visual infringements of suprasellar cistern invading into the cavity of a turkish saddle.
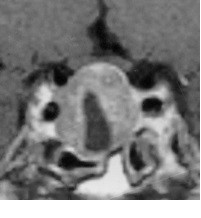
Под термином синдром «пустого» турецкого седла (ПТС) следует понимать пролабирование супраселлярной цистерны в полость турецкого седла, сопровождающееся клинической картиной головной боли, нейроэндокринных и зрительных расстройств [3,13,22].
Единство нейрогуморальной регуляции в организме человека обеспечивается гипоталамо–гипофизарой системой, в тесной анатомической связи с которой находятся зрительные нервы и хиазма. Развитие конфликта в хиазмально–гипоталамо–гипофизарной области приводит к нарушениям зрения [21,36].
Словосочетание «пустое» турецкое седло ввел в медицину W. Busch в 1951 году. Он был первым, кто связал частично «пустое» турецкое седло с недостаточностью диафрагмы, и им же была предложена классификация форм турецкого седла в зависимости от объема интраселлярных цистерн и типа строения диафрагмы [11,20,22,25].
По данным Busch, у 40–50% людей имеет место недоразвитие или отсутствие диафрагмы турецкого седла. Клинические симптомы, ассоциированные с «пустым» седлом, впервые описал в 1968 г. N Guiot [36]. Встречаются они значительно реже (по данным различных авторов, от 10 до 23% от группы нейроэндокринных больных) [3, 19].
Weiss и Raskin указали на необходимость разграничения первичного (идиопатического) ПТС и вторичного (после лучевого и хирургического лечения) [20,21,22].
Анатомия турецкого седла
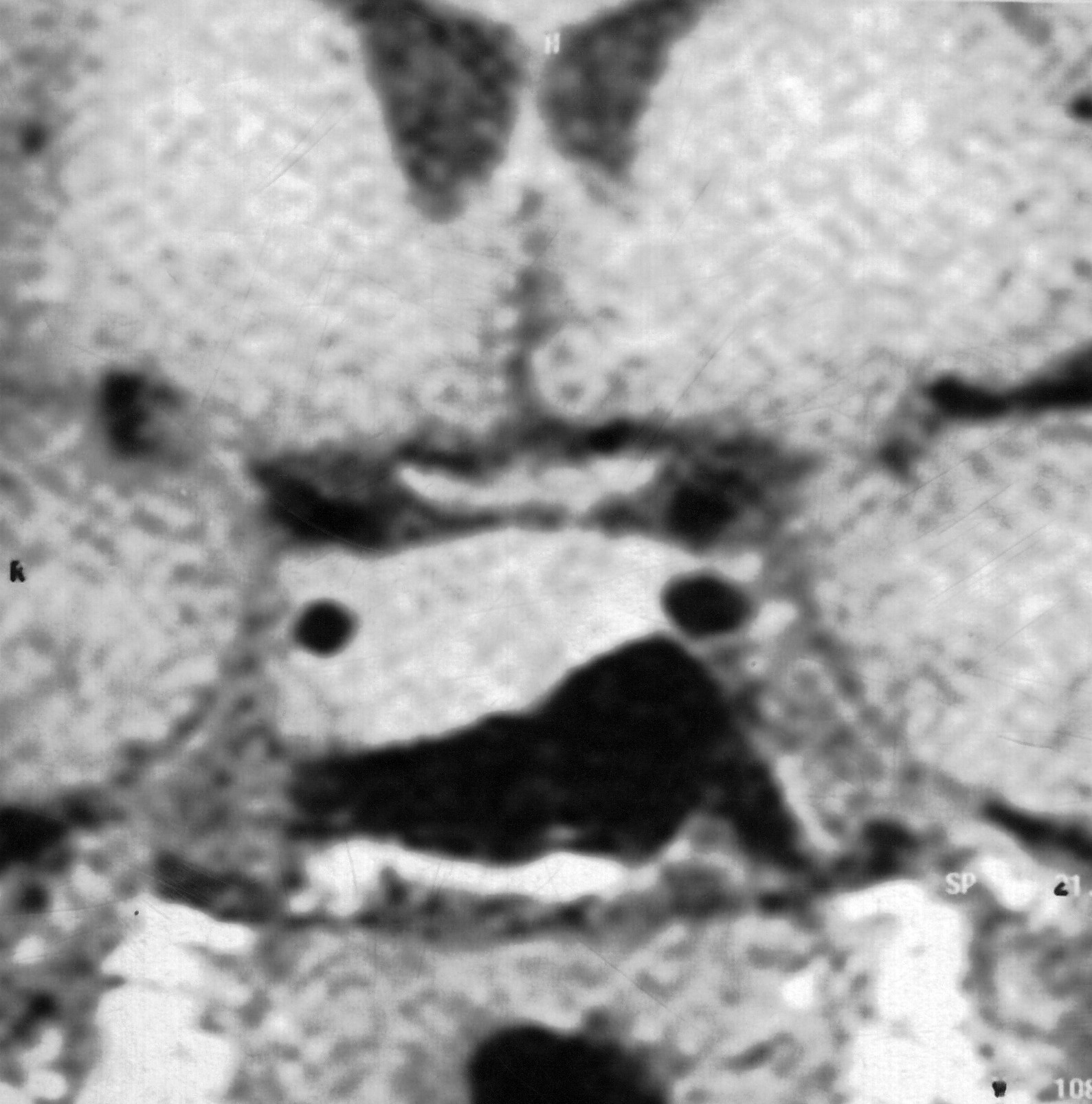
Вход в турецкое седло прикрывает твердая мозговая оболочка, называемая диафрагмой седла (рис. 1). Диафрагма отделяет полость турецкого седла и гипофиз от субарахноидального пространства, исключая лишь отверстие, через которое проходит ножка (воронка) гипофиза. Прикрепление диафрагмы, ее толщина и характер отверстия подвержены значительным анатомическим вариациям [6,20,22, 23,37]. Диафрагма может быть недоразвитой, с резко увеличенным отверстием, через которое в полость седла в разной степени внедряется супраселлярная цистерна [3,7,12,20,38,41]. «Пустое» турецкое седло не следует понимать буквально: оно заполнено ликвором, гипофизарной тканью, иногда в него могут «провисать» хиазма и зрительные нервы [6,41].
В 80% случаев встречается переднее пролабирование супраселлярной цистерны [7,41] (рис. 2).
Этиология и патогенез ПТС
Паутинная оболочка пролабирует в полость турецкого седла через отверстие в диафрагме в том случае, если размер последнего превышает 5 мм [22,25,34,41]. Недостаточность диафрагмы является обязательным условием формирования ПТС.
В настоящее время известен широкий спектр патологических и физиологических факторов, способствующих развитию «пустого» турецкого седла:
– повышение внутричерепного давления вследствие легочно–сердечной недостаточности, артериальной гипертензии, черепно–мозговой травмы;
– локальное повышение давления в желудочках при опухолях головного мозга, тромбозе синусов;
– физиологические процессы (беременность, роды, климакс);
– первичная гипофункция периферических эндокринных желез, длительный прием оральных контрацептивов;
– арахноидальные кисты, развившиеся в результате оптико–хиазмального арахноидита;
– спонтанный некроз аденомы гипофиза, инфаркт гипофиза;
– инфекционные заболевания с тяжелым течением (менингит, геморрагическая лихорадка);
– аутоиммунные заболевания (аутоиммунный тиреоидит, болезнь Шегрена, лимфоцитарный аденогипофизит);
– наследственная неполноценность соединительной ткани (наличие ПТС у родителей и детей).
Таким образом, установлено, что для формирования «пустого» турецкого седла необходимо два условия: недостаточность диафрагмы и внутричерепная гипертензия, остальные факторы лишь способствуют его развитию [1,20,22,29,34].
Клиника синдрома ПТС
Клиническая картина отличается динамичностью, сменяемостью одного синдрома другим, спонтанными ремиссиями [2,3,22,].
Чаще болеют женщины (4/5) в возрасте от 35 до 55 лет. Около 75% больных страдают ожирением [13,22,29,36].
Самым частым симптомом является головная боль (80–90%), не имеющая четкой локализации и варьирующая от легкой до нестерпимой, почти постоянной [2,13,8,22,26]. Дисфункция гипоталамуса выражается вегетативными синдромами и вегетативными кризами с ознобом, резким подъемом артериального давления, кардиалгиями, одышкой, чувством страха, болями в животе, в конечностях, подъемом температуры, нередко синкопальными состояниями [2,8,22,32]. Наряду с вегетативными нарушениями больные с синдромом ПТС подвержены эмоционально–личностным и мотивационным расстройствам. Клиническая симптоматика и течение болезни усугубляются в связи с острой или хронической стрессовой ситуацией [3,5].
Эндокринные симптомы при ПТС обусловлены нарушением тропной функции гипофиза, проявляются в виде гипо– или гиперсекреции и варьируют по степени тяжести: от субклинических форм до тяжелых. [1,12,13, 20,22, 24,33]. Per Bjerre отмечает, что гипофизарные нарушения при синдроме ПТС аналогичны изменениям при аденоме гипофиза и часто имеет место сочетание ПТС с микроаденомами [22]. Гипотиреоз, гиперпролактинемия и половые нарушения (снижении потенции, либидо, олиго– и аменорея) наиболее характерны для больных этой группы [21,31,37]. Brismar обнаружил ПТС у больных с болезнью Иценко–Кушинга, Dominique сообщил о наличии ПТС у 10% больных акромегалией [7,13,22,37].
Причиной эндокринных расстройств при ПТС принято считать не компрессию секреторных клеток гипофиза, которые продолжают функционировать даже при значительной гипоплазии, а нарушение гипоталамического контроля над гипофизом в результате затруднения поступления нейрогормонов гипоталамуса [3,6,29,35,36,39].
Зрительные нарушения при синдроме ПТС
Изменения со стороны зрительной системы различны по характеру и степени выраженности [1,5,8,19,20,22,32]. Чаще всего больных беспокоят ретробульбарные боли, сопровождаемые слезотечением, хемозом, диплопией, фотопсиями, «затуманиванием» [32,38].
Снижение остроты зрения, изменения полей зрения, отек и гиперемия диска зрительного нерва (ДЗН), выявляемые при обследовании, подвержены колебаниям и зависят от ликвороциркуляции в арахноидальных пространствах и кровоснабжения хиазмально–зрительного пути [5,8,38].
По данным Obrador S., из 19 пациентов с синдромом ПТС у 7 зрительные расстройства выражались только субъективными симптомами (неясное зрение, диплопии, фотопсии), у 3 офтальмоскопически определялся двусторонний отек ДЗН, у 2 при периметрии выявлены гемианопсии без очевидной причины. 7 пациентов с ПТС не имели зрительных нарушений [38].
Для синдрома ПТС характерны дефекты полей зрения. Чаще встречаются битемпоральные гемианопсии, центральные и парацентральные скотомы, реже – квадрантные и биназальные гемианопсии [1,19,20,27,29,36].
Bosman and Bergstrand обнаружили дефекты полей зрения у 10 из 48 пациентов с ПТС, Jaja–Albarran у 6 из 41, Per Bjerre у 3 из 20, Mortara and Non–ell у 4 из 7 [22,24,33].
Сформированы две патогенетические концепции нарушения полей зрения при ПТС: тракционная и ишемическая. Согласно первой концепции, к дефектам в полях зрения может привести натяжение между хиазмой и передним краем диафрагмы (при смещении последней в полость турецкого седла) а также натяжение между хиазмой и ножкой гипофиза (при смещении ножки назад и в сторону). В качестве второй – ишемической–теории рассматриваются варианты сдавления глазничной артерии в субарахноидальном пространстве, окружающем зрительный нерв, и ухудшения кровоснабжения самой хиазмы и зрительного нерва при удалении их от каротидного бассейна [27,29,36].
Биназальные и квадрантные гемианопсии подобны изменениям полей зрения при первичной открытоугольной глаукоме. Дифференциальная диагностика в этих случаях трудна, но имеет важное значение, т.к. глаукома с низким давлением не является редкостью и требует особого внимания офтальмолога [1,20,40,43]. Имеются данные о нередком сочетании ПТС с глаукомой.
Beattie у 8 пациентов с глаукомой обнаружила синдром ПТС: 3 имели глаукому с низким давлением, 4– типичную открытоугольную глаукому и 1– неоваскулярную глаукому. Глаукоматозная экскавация ДЗН была выявлена стереоскопической дискоскопией и подтверждена стереофотографией. Больные в течение 5 лет получали местную гипотензивную терапию с положительным эффектом: глаукома имела стабильное течение без прогрессирования дефектов полей зрения [20].
Существует иная точка зрения на эту проблему. Berke, Neelon, Yamayashi также описывают случаи глаукомы с низким давлением в сочетании с ПТС и высказывают предположение о наличии у этих больных «псевдоглаукомы» [20,37,43]. Однако Rouhiainen, исследуя 15 пациентов с глаукомой низкого давления, имеющих синдром ПТС, пришел к выводу, что все же более правильным следует считать совпадение синдрома ПТС с глаукомой [40].
Вегетативные кризы, характерные для синдрома ПТС, усугубляют ситуацию и могут привести к нарушению кровообращения в центральной артерии сетчатки (ЦАС). Как правило, эти нарушения встречаются у молодых женщин, страдающих ожирением и эндокринными расстройствами [19,29].
Синдром ПТС выявляется у 10% больных с доброкачественной внутричерепной гипертензией (ДВГ), главными клиническими симптомами которой также являются головная боль и отек зрительного нерва [5,8,22,23]. Причина ДВГ остается неясной. Наиболее частым этиологическим фактором считают эндокринные нарушения: ожирение, гипо– и гипертиреоз, галакторея–аменорея, беременность, климакс. Per Bjerre сообщает о случаях внезапной потери зрения у пациентов с ДВГ, причиной которой является усиление отека зрительных нервов и сдавление их в оптическом канале [22,23]. Взаимосвязь ПТС и доброкачественной внутричерепной гипертензии, вероятно, бывает двоякой [22].
Офтальмологическое обследование у пациентов с синдромом ПТС имеет исключительную важность для диагностики заболевания и выбора тактики лечения. Угроза потери зрения является показанием для хирургического вмешательства [3 6].
Инструментальная диагностика ПТС
До последнего времени в диагностике «пустого» турецкого седла использовались лучевые методы исследования: краниография, пневмоцистернография и компьютерная томография, которые были недостаточно информативны и безопасны [22,24,33].
Безопасным и высокочувствительным методом визуализации хиазмально–селлярной области в настоящее время является магнитно–резонансная томография (МРТ) [6,38,41].
МРТ позволяет проводить исследования в любой плоскости тонкими срезами в 1–1,5 мм, обладает высоким тканевым контрастом, отсутствием артефактов от костных структур черепа.
Для ПТС характерна триада симптомов:
• первый симптом – наличие цереброспинальной жидкости в полости турецкого седла, о чем свидетельствуют зоны однородного низкоинтенсивного сигнала в режиме T1W и высокоинтенсивного сигнала в режиме T2W, гипофиз при этом деформирован, имеет форму серпа или полулуния толщиной до 2–4 мм, ткань его изоинтенсивна белому веществу мозга, воронка, как правило, расположена центрально;
• второй – асимметричное пролабирование супраселлярной цистерны в полость седла, смещении воронки кпереди, кзади или латерально;
• третий – истончение и удлинение воронки гипофиза.
Помимо основных изменений в параселлярной области МРТ позволяет выявить косвенные признаки внутричерепной гипертензии (расширение желудочков и ликворосодержащих пространств), сопутствующие этой патологии.
Имеются данные о почти 100% чувствительности МРТ в диагностике синдрома ПТС [7,10,38,41].
Лабораторная диагностика
Основана на определении тропных гормонов гипофиза, но нет определенности и стабильности в этих показателях, что также характерно для ПТС [1,13,20,33].
Таким образом, синдром ПТС представляет собой симптомокомплекс нейроэндокринных и зрительных расстройств, по клинической картине схожий с аденомой гипофиза. Этиологию и патогенез синдрома определяют врожденная недостаточность диафрагмы, повышенное внутричерепное давление и ряд сопутствующих факторов. Причиной нейроэндокринных расстройств принято считать не компрессию секреторных клеток гипофиза, а сдавление его ножки, что приводит к нарушению гипоталамического контроля над гипофизом.
Зрительные расстройства представлены субъективными жалобами, дефектами в полях зрения и ухудшением остроты зрения, обусловлены они как повышенным давлением в субарахноидальном пространстве, окружающем зрительный нерв, так и ишемией хиазмально–зрительной системы. Офтальмоскопические изменения при синдроме ПТС выражаются гиперемией и отеком зрительного нерва, но могут быть представлены атрофией ДЗН с типичной глаукоматозной экскавацией. Отмечено сочетание синдрома ПТС с глаукомой.
Клиническое течение синдрома рецидивирующее, обусловлено степенью эндокринных, неврологических и зрительных нарушений. Как правило, болезнь протекает благоприятно при ранней диагностике и адекватной симптоматической терапии. Тяжелые прогрессирующие зрительные нарушения являются показаниями для хирургического лечения.
Синдром «пустого турецкого седла» — что это за болезнь и чем опасна?
Термин «пустое турецкое седло» предложил патологоанатом В. Буш в 1951 году, из-за внешней формы клиновидной кости, которая напоминает реквизит для верховой езды. Это заболевание означает нарушение в области головного мозга, а конкретней, где располагается гипофиз, мешая ему функционировать. В последнее время диагноз стал очень распространенным, ввиду приобретения большой популярности магнитно-резонансной томографии. И многие люди, услышав диагноз, пребывают в полном недоумении: что это такое турецкое седло и чем оно опасно?
Что это такое?
При нормальном функционировании гипофиз заполняет все пространство седла. А если произошли какие-либо сбои, то оболочка головного мозга, опускаясь, начинает давить на содержимое полости. Например, если по каким-то причинам диафрагма недоразвита или истончена, или имеет слишком широкий диаметр отверстия для ножки, тогда спинномозговая жидкость и мягкая мозговая оболочка беспрепятственно попадают в полость турецкого седла, и осуществляют давление непосредственно на гипофиз. В результате он как бы распластан по дну седла, таким образом, формируется пустое турецкое седло.
Иногда в медицинской практике встречается, что диафрагма турецкого седла недоразвита, а синдрома турецкого седла нет. Поэтому ученые пришли к выводу, что для возникновения синдрома необходима внутричерепная гипертензия. В этом случае, ликвор заполняет не только все пространство седла, оказывая давление на гипофиз, но и на его ножку. Все это вызывает сбои регуляции гипоталамуса и вызывает проблемы с эндокринной системой.
Виды патологии
По статистическим данным синдром пустого турецкого седла диагностируется у каждого десятого. Чаще всего этим недугом страдают женщины после 35 лет с лишним весом. Это связано с более активным функционированием гипофиза в некоторых периодах их жизни (беременность, климакс).
Синдром пустого турецкого седла классифицируют по двум видам:
Предрасположенность к данному заболеванию может быть как наследственная, так и по ряду других причин.
Записаться на МРТ
Запишитесь на приём и получите качественное обследование головы в нашем центре
Причины пустого турецкого седла
Симптомы пустого турецкого седла
Синдром пустого турецкого седла проявляется сбоями в эндокринной и нервной системе, нарушениями в функционировании органов зрения.
Во время стрессовых ситуаций повсеместно проявляются неврологические симптомы:
Пустое турецкое седло головного мозга способно проявлять себя нарушениями в эндокринной системе, а именно:
Турецкое седло находится вблизи зрительных нервов. При наличии синдрома они сдавливаются, тем самым нарушается их кровообращение. Поэтому зрительные симптомы встречаются почти абсолютно во всех случаях заболевания. Симптомы в этой ситуации:
В большинстве случаев вышеперечисленные симптомы имеют много других заболеваний. Выявить турецкое седло в головном мозге можно только после консультации со специалистом и после обследования.
Получить бесплатную консультацию
Консультация по услуге ни к чему Вас не обязывает
Диагностика синдрома
Процедура постановки диагноза проходит в три этапа:
Очень часто пустое турецкое седло обнаруживают совершенно случайно, в целях выявления синуситов или форм черепно-мозговых повреждений.
К какому врачу идти?
Если наблюдаются продолжительные головные боли, набор лишнего веса, гипертония следует обратиться к неврологу.
Если заметили ухудшение зрения, нужна консультация офтальмолога, чтобы он исключил или подтвердил поражение зрительных нервов.
И обязательна консультация эндокринолога, и в дальнейшем исследование гормонального фона.
Получить бесплатную консультацию
Консультация по услуге ни к чему Вас не обязывает
Лечение
Для тех, кого тревожат боли и плохое самочувствие назначают лечение, которое снижает симптоматические последствия:
Хирургическое лечение требуется редко. И тогда не обойтись без нейрохирурга. Показания к оперативному вмешательству:
Лечение народными средствами крайне неэффективно. Зачастую необходимо просто устранить некоторые факторы риска: ожирение, прием гормональных контрацептивов. Самая лучшая профилактика заболевания — здоровый образ жизни.
Прогноз
Спрогнозировать течение болезни невозможно. Все зависит от течения СПТС, сопутствующих заболеваний и самого состояния железы. Постоянный контроль уровня гормонов, чтобы вовремя исключить осложнения. Заниматься укреплением здоровья, чтобы помочь организму бороться с болезнями.
Синдром пустого турецкого седла – патология с непредсказуемым течением. Она может на протяжении всей жизни никак себя не проявить, а может стать причиной множества серьезных эндокринных расстройств. Подбор терапии также может быть абсолютно разный: либо принцип невмешательства с обычным наблюдением, либо хирургическое вмешательство с непредвиденными последствиями.
Магнитно-резонансная томография (МРТ) в Санкт-Петербурге
Запишитесь на МРТ по телефону (812) 493-39-22 или заполните форму
Расписание приема МРТ:
ЦМРТ «Нарвский»
(812) 493-39-22
в четверг прием с 8-00 до 23-00
и воскресенье прием с 8-00 до 23-00
ул. Ивана Черных,29
МРТ аппарат 1,5 Тл
суббота :
ЦМРТ «Старая деревня»
(812) 493-39-22
прием 8-00 до 23-00
ул. Дибуновская,45
МРТ аппарат 1,5 Тл
Прием в “РНХИ им. проф. А.Л. Поленова” прекращен по техническим причинам и
перенесен в ЦМРТ
Опухоли области турецкого седла
Область турецкого седла представляет сложный комплекс тесно соседствующих анатомических образований, расположенных в головном мозге. Исследование турецкого седла может быть частью МРТ головного мозга, либо МРТ турецкого седла можно делать прицельно.
Гипофиз – эндокринный орган, расположенный в турецком седле. Его масса всего 0,5-1,0 г. Гипофиз вырабатывает целый ряд гормонов, поступление которых в кровяное русло контролируется релизинг-факторами гипоталамуса. По рентгенограммам черепа переднее-заднее измерение турецкого седла всегда больше истинных размеров гипофиза. На МРТ в норме размеры гипофиза не превышают следующие: высота 8 мм, передне-заднее измерение 12 мм, латеральные размеры – 14 мм. Возрастные и половые колебания очень существенны. Важным ориентиром является диафрагма седла. В норме она должна быть слегка вогнутой или плоской. Исключение составляют женщины пубертантном периоде и репродуктивном возраста. У них диафрагма чуть приподнята и высота гипофиза может быть 9-10 мм. Во время беременности диафрагма может быть приподнята, а высота гипофиза достигать 10-12 мм. Размеры гипофиза также нередко увеличиваются на фоне кортикостероидной терапии. Отчётливой корреляции между размерами гипофиза и турецкого седла нет. Внутренняя структура гипофиза неоднородная. В заднем отделе в 80-90% наблюдений визуализируется яркий участок. Между долями гипофиза интенсивность сигнала чуть ниже, что важно не путать с кистой кармана Ратке.
МРТ головного мозга. Срединные структуры мозга в норме. Сагиттальная Т1-зависимая МРТ. Обозначения: Hyp – гипофиз, I – воронка (ножка) гипофиза, CHO – перекрест зрительных нервов, CM – сосочковые тела, P – Варолиев мост, LQ – пластина четверохолмия, OS – клиновидная кость
МРТ головного мозга. Срединные структуры области турецкого седла в норме. Корональная Т1-зависимая МРТ. Обозначения: Hyp – гипофиз, V3 – III желудочек, CHO – перекрест зрительных нервов, ACsup – супраклиноидный отрезок ВСА, ACint – внутрикавернозный отрезок ВСА. Показана линия, соединяющая супраклиноидный и внутрикавернозный отрезки ВСА.
Опухоли могут происходить из любой ткани и быстро вовлекают соседние структуры. Поэтому клинические проявления очень часто затрагивают и нервную, и эндокринную системы. По классификации ВОЗ собственно к опухолям ЦНС области турецкого седла относятся краниофарингиомы и некоторые другие редкие опухоли. Аденомы гипофиза относятся к опухолям эндокринной системы. В селлярно-параселлярной области у взрослых на первом месте по частоте стоит аденома гипофиза, затем менингиома и метастаз, реже встречаются аневризма и краниофарингиома, очень редко встречается невринома, воспалительная псевдоопухоль, хордома, мукоцеле, лимфома Мекелевой полости, гипофизит и киста кармана Ратке. У детей первое место по частоте занимает краниофарингиома, затем идёт глиома зрительного тракта и гипоталамуса, редко встречается невринома, арахноидальная киста, герминома, эпидермоидная киста, киста кармана Ратке, очень редко гамартома, тератома, гистиоцитоз и менингит.
Методика МРТ обязательно должна включать Т1-зависимые и Т2-зависимые сагиттальные и корональные томограммы. При интраселлярной патологии выполняют корональные Т1-взвешенные томограммы с контрастированием. Толщина среза выбирается 3 мм или меньше.
В дифференциальной диагностике образований области турецкого седла надо учитывать его локализацию. Если оно только интраселлярное, то вероятнее всего это аденома гипофиза. Если оно только супраселлярное, то это может быть краниофарингиома, астроцитома, менингиома, аневризма или метастаз. Параселлярно располагаются менингиома, метастазы или аневризма. Почти любая опухоль может иметь сочетание и интра-, и супра-, и параселлярного компонентов.
Аденома гипофиза – составляет от 10 до 15% от всех внутричерепных опухолей. Происходит аденома из передней доли, то есть аденогипофиза. Аденома гипофиза – доброкачественная опухоль, злокачественные формы – аденокарциномы – исключительно редки. Встречается аденома в любом возрасте, но редко до 10 лет и старше 60 лет. Пик частоты приходится на 45-50 лет. Наблюдаются одинаково часто у мужчин и женщин. По размерам их разделяют на макроаденомы (более 10 мм) и микроаденомы (до 10 мм). Клинические проявления состоят из эндокринных нарушений и проявлений масс-эффекта – головные боли, зрительные нарушения в связи с компрессией перекреста зрительных нервов, гипоталамические синдромы. Редко встречается гидроцефалия. 10% аденом гипофиза клинически не проявляются, их называют «инсидентиномы». Это почти всегда микроаденомы. По микроскопическому типу аденомы делятся на:
• ацидофильные (эозинофильные), они продуцируют гормон роста или пролактин,
• базофильные – продуцируют АКТГ, редко, тиреотропный гормон или гонадотропин
• хромофобные – продуцируют пролактин или гормонально неактивны.
Пролактин-продуцирующие аденомы (30% случаев) вызывают у мужчин импотенцию и снижение либидо, у женщин аменорею, галакторею, инфертильность, и у всех – тучность. Аденомы, продуцирующие гормон роста (15%), вызывают гигантизм у детей, а у взрослых акромегалию. АКТГ-продуцирующие гормоны составляют около 10% случаев, остальное приходится на аденомы, избыточно продуцирующие сочетание гормонов.
Макроаденомы обычно гормонально активны, чаще это пролактиномы. При МРТ головного мозга они выходят за пределы нормальных размеров седла, обычно округлой формы, имеют плотную капсулу. Макроаденома обычно изоинтенсивна или чуть гипоинтенсивна на Т1-взвешенных МРТ. Т2-зависимые МРТ плохо дают представление о ее размерах, так как она сливается с хиазмальной цистерной. Лучше делать МРТ, отражающие протонную плотность, так как на них аденома умеренно гиперинтенсивна, а ликвор гипоинтенсивен. Внутри аденомы на МРТ нередко встречаются участки кровоизлияний и кисты, достигающие иногда больших размеров, описаны амилоиды внутри опухоли. Опухоль хорошо усиливается на контрастных МРТ.
МРТ головного мозга. Макроаденома гипофиза с супра- и ретроселлярным типами роста. Внутриопухолевая киста. Сагиттальная и корональная Т1-зависимые МРТ с контрастированием.
МРТ головного мозга. Макроаденома гипофиза с супраселлярным типом роста. Сагиттальная и корональная Т1-зависимые МРТ, поперечная Т2-зависимая МРТ, МРА с частичной реконструкцией в аксиальную плоскость. Компрессия перекреста зрительных нервов и III желудочка, раздвинуты А1 сегменты ПМА.
МРТ головного мозга. Макроаденома гипофиза с субфронтальным типом роста. Сагиттальная Т1-зависимая МРТ.
МРТ головного мозга. Несекретирующая макроаденома. Некротический центр. Распространение на кавернозный синус справа без инвазии ВСА. Т1- зависимая МРТ с контрастированием.
Вопрос об инвазии кавернозного синуса чрезвычайно важен для планирования операции. Горизонтальная часть внутренней сонной артерии (интракавернозный сегмент) на корональных МРТ головного мозга видна в виде черного круга, что отражает быстро движущуюся кровь. Смещение ВСА по данным МРТ не говорит об инвазии синуса. Считается, что вероятность инвазии очень высока при охвате свыше 70% диаметра ВСА или при пересечении линии, соединяющей на корональных срезах середины диаметров интракавернозного и супраклиноидного сегментов ВСА. Распространение опухоли на кости основания черепа хорошо прослеживается по снижению сигнала от губчатого вещества на Т1-зависимых МРТ.

МРТ головного мозга. Макроаденома гипофиза с инфра- и параселлярным типами роста. Прорастание ВСА. Корональная Т1-зависимая МРТ.
МРТ головного мозга. Макроаденома гипофиза с параселлярным типом роста справа. Прорастание ВСА. Корональная Т1-зависимая МРТ.
Весьма целесообразно делать МРТ для прослеживания реакции пролактиномы на лечение ингибиторами его секреции (бромкриптин, дестинекс). При эффективном лечении размеры опухоли при МРТ уменьшаются, а ее структура переживает кистозное перерождение.
Макроаденомы могут подвергаться апоплексии – острому нарушению кровоснабжения гипофиза с некрозом или кровоизлиянием. Частота апоплексии составляет около 10%. Наблюдается в возрасте 37-57 лет, в 2 раза чаще у мужчин. Клинически апоплексия представляет собой острое состояние в виде головной боли, рвоты и зрительных нарушений. При МРТ в аденоме появляются участки неоднородности в виде кровоизлияния или кисты. Особым вариантом является некроз нейрогипофиза у беременных – синдром Шихана. МРТ турецкого седла позволяет выявлять и дифференцировать это состояние.
МРТ головного мозга. Макроаденома гипофиза с супраселлярным типом роста. Кровоизлияние в опухоль. Корональная Т1-зависимая МРТ.

МРТ головного мозга. Типичная микроаденома гипофиза. Часть стандартного протокола исследования: Т1-зависимая, Т2-зависимая и Т1-зависимая с контрастированием корональные МРТ.
Повысить чувствительность метода иногда удается динамическим методом МРТ контрастирования. Быстро болюсно вводят 0.1 мМ/кг массы контрастного вещества и сразу начинают томографию. Оптимальны МРТ корональные срезы и ускоренная методика, например 3D turbo SE. Контрастное усиление при МРТ нормальной ткани гипофиза начинается с задней доли и быстро распространяется на переднюю. Как правило, при МРТ контрастирование нормальных тканей наступает быстрее, чем опухолевой. Оптимальное время выявления микроаденомы около 90 с. от инъекции. Интерпретация изображений должна быть осторожной, так как есть опасность принять за аденому промежуточную часть между долями гипофиза или кисту кармана Ратке.

МРТ головного мозга. Микроаденома гипофиза (стрелка). Т1-зависимая томограмма с обычным и болюсным контрастированием.
По данным МРТ, супраселлярное расположение наблюдается в 75% случаев, супраинтраселлярное – 21% и изолированное интраселлярное – 4%.
По характеру роста, видимого на МРТ головного мозга, выделяют следующие типы:
Тип А – опухоль почти вся интраселлярная, ПСоА и А1 сегмент ПМА не смещены;
Тип B – опухоль растёт кпереди от перекреста зрительных нервов и смещает его кзади. ПСоА и А1 сегмент ПМА приподняты, ОА не смещена
Тип C – опухоль растёт кзади от перекреста зрительных нервов и смещает его кпереди. Наблюдается обструкция III желудочка и гидроцефалия. ПСоА и А1 сегмент ПМА.
Краниофарингиома долго течёт бессимптомно, затем проявляется тошнотой, рвотой, головными болями и нарушением зрения – битемпоральной гемианопсией, отёком сосков и атрофией зрительных нервов, а также эндокринными нарушениями – замедлением роста, ожирением, гипотиреоидизмом, изредка сахарным диабетом и ранним созреванием.
При МРТ краниофарингиома четко отграничена, окружена незначительным отеком, чаще гипоинтенсивна на Т1-зависимых и гиперинтенсивна на Т2-зависимых МРТ. Адамантинозный подтип опухоли при МРТ имеет значительный кистозный компонент, а солидный компонент часто содержит кальцинаты, придающий ему “пятнистость”. Кистозный компонент опухоли на МРТ нередко имеет примесь белка, крови и холестерола. Папиллярный подтип при МРТ целиком состоит из солидного компонента и не содержит кальцинатов. Краниофарингиома хорошо усиливается при контрастировании МРТ, обычно больше по периферии.

МРТ головного мозга. Краниофарингиома (стрелка). Адамантинозный тип. Т1-зависимые сагиттальные МРТ до и после контрастирования.
Астроцитома происходит из зрительных нервов, перекреста и трактов. Она составляет около 5% от первичных опухолей ЦНС у детей. Часть случаев относится к проявлениям нейрофиброматоза I типа. Астроцитома также может происходить из тканей гипоталамуса и вторично распространяться на перекрест и тракт. Гистологически опухоль относится к пилоцитарному подтипу, по субарахноидальным пространствам не диссеминирует. Астроцитомы этой локализации растут очень медленно, обычно экспансивно. При распространении вверх опухоль может перекрывать отверстия Монро, вызывая окклюзионную гидроцефалию.
При МРТ головного мозга астроцитома гипоинтенсивна на Т1-зависимых МРТ и гиперинтенсивна на Т2-зависимых МРТ. Внутренняя структура опухоли при МРТ однородная. При МРТ с контрастированием усиливается не всегда, но если контрастирование имеет место, то обычно по периферическому типу.
Герминома, хотя гораздо чаще встречается в области шишковидной железы, также может локализоваться в гипоталамусе, воронке гипофиза и переднем отрезке III желудочка. Нередко супраселлярная локализация сочетается с опухолью в области шишковидной железы, то есть образование первично-множественное. Обычно герминома диагностируется у пациентов в возрасте до 20 лет, чаще женского пола. Клинически проявляется несахарным диабетом и нарушением полей зрения. При МРТ головного мозга обнаруживается изо- или гипоинтенсивное образование на Т1-взвешенных МРТ и слегка гиперинтенсивное на Т2-взвешенных МРТ, видно, что опухоль локализуется по средней линии, однородная по структуре, имеет инфильтративный тип роста, хорошо усиливается при МРТ с контрастированием. Растет опухоль быстро, может диссеминировать по субарахноидальным пространствам и желудочкам.
Менингиома супра- и параселлярной локализации встречается у взрослых. Происходит она из диафрагмы седла, оболочек, покрывающих передний наклонный отросток, бугорок седла и кавернозный синус. Если менингиома распространяется в сторону перекреста зрительных нервов, то вызывает его компрессию и зрительные нарушения. Опухоль может прорастать кавернозный синус, сдавливая расположенные в нем нервы и внутреннюю сонную артерию. При росте вдоль основания черепа вперед (субфронтальный тип роста) опухоль иногда переходит в орбиту и клиновидную пазуху. При распространении назад менингиома может «сползать» вдоль ската.
МРТ признаки менингиомы данной локализации не отличаются от таковых в любой другой области. Относительно невысокий сигнал на Т2-зависимых МРТ и хорошее контрастное усиление и «дуральные хвосты» помогают дифференцировать ее от других супраселлярных опухолей. Отсутствие интраселлярного компонента при МРТ отличает ее от аденомы гипофиза.
МРТ головного мозга. Супраселлярная менингиома. «Дуральные хвосты» (стрелки). Сагиттальная Т1-зависимая МРТ с контрастированием.
Метастазы главным образом попадают гематогенным путем. Они составляют меньше 1% от опухолей гипофиза. Первичная локализация опухоли – молочная железа (гипофиз занимает 6-8% от всех зон метастазирования) и легкое. Только 7% метастазов в гипофиз проявляются клинически, обычно в виде несахарного диабета. На МРТ головного мозга отличительной чертой метастаза является утолщение ножки гипофиза, исчезновение высокого сигнала за задней долей гипофиза, типична также инвазия кавернозного синуса. Метастаз обычно изоинтенсивен на Т1- и Т2-зависимых МРТ.
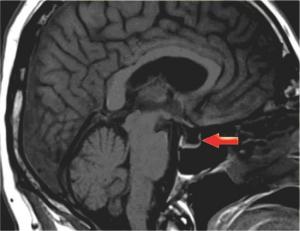
МРТ головного мозга. «Пустое» турецкое седло. Сагиттальная Т1-зависимая МРТ.
МРТ в СПб турецкого седла с одинаковым успехом можно делать в открытых МРТ и закрытых “тоннельных” аппаратах. В центрах МРТ СПб на открытых аппаратах не применяют динамическое контрастирование.