Что такое проба смешения
Большая Энциклопедия Нефти и Газа
Проба смешения этого продукта с соединением ( V), полученным окислением IV бихроматом натрия, не дает депрессии температуры плавления. [1]
Проба смешения кислоты с заведомо полученной окислением псевдо-кумола по способу Шульце [4] тримеллитовой кислотой не дала депрессии температуры плавления. [2]
Проба смешения депрессии точки плавления не дает. [3]
Если проба смешения плавится при той же температуре, что и каждое вещество в отдельности, то идентичность веществ считается доказанной. [4]
Если проба смешения плавится при той же температуре, что и каждое вещество в отдельности, то идентичность веществ считается доказанной. [6]
Если проба смешения обнаруживает депрессию ( понижение) температуры плавления, то испытуемое вещество и заведомо известное-не идентичны. [7]
Если проба смешения плавится при той же температуре, что и каждое вещество в отдельности, то идентичность веществ считается доказанной. [8]
Если проба смешения плавится при той же температуре, что и каждое вещество в отдельности, то идентичность веществ считается доказанной. [10]
Если проба смешения плавится при той же температуре, что и каждое вещество в отдельности, то идентичность веществ считается доказанной. [12]
Если проба смешения обнаруживает депрессию ( понижение) температуры плавления, то испытуемое вещество и заведомо известное-не. [13]
Идентификация этой соли проводилась аналогично описанным выше, проба смешения с продуктом, полученным встречным синтезом, депрессии не дала. [15]
Большая Энциклопедия Нефти и Газа
Чтобы сделать выбор из них, сначала был применен метод окисления 1 % раствором пермаиганата с содой. Пробы смешения с глутаровой и пимелиновой кислотами дали сильное понижение температуры плавления в первом случае и никакого понижения во втором. [32]
Для подтвервдення строения соед. Проба смешения образцов не давала депрессии температуры плавленяя. [33]
Получен фенилизоцианат метилового спирта ст. пл. Проба смешения депрессии не обнаруживает. [34]
Для этого смешивают в равных количествах ( по 0 05 или 0 1 г) исследуемое вещество и химически чистое стандартное вещество ( вещество сравнения) и определяют температуру плавления смеси. Если проба смешения плавится при той же температуре, что и каждый компонент в отдельности, то идентичность исследуемого вещества со стандартными считается доказанной. Если же проба смешения плавится при более низкой тем пературе, чем каждый компонент в отдельности, то это значит, что исследуемое вещество не идентично стандартному. [35]
При этом выделена бензойная кислота, которая после перекристаллизации из спирта плавилась при 121 и не обнаруживала депрессии в пробе смешения с бензойной кислотой. [42]
Прямое доказательство этого было получено при обнаружении соединения VI в продуктах аэробного щелочного расщепления ферментативного L. Соединение VI гидролизовалось при нагревании с серной кислотой; из раствора экстракцией этилацетатом была выделена п-аминобензойная кислота ( XXXIII) [19], идентифицированная по отсутствию депрессии температуры плавления пробы смешения с известным веществом и микробиологически с Acetobacter suboxydans. Аминобензой-ная кислота ( XXXIII) образуется и при сульфитном расщеплении ферментативного L. [43]
Определение температуры плавления
Точное определение фазового равновесия может быть успешным лишь тогда, когда нагревание или охлаждение идет настолько медленно, что действительно устанавливается необходимое равновесие. Определение точки плавления имеет особо важное значение при работе с органическими веществами, однако им пользуются также и при работе с неорганическими препаратами.
В связи с высокими температурами плавления неорганических веществ, определение обычными методами с капиллярами, погружаемыми в нагретые до определенной температуры бани, в большинстве случаев не удается. Определение температуры плавления неорганических веществ выполняют большей частью так называемым тигельным методом, наблюдая скорость охлаждения расплава при помощи погруженной в него термопары.
Одни исследователи считают, что температуре плавления отвечает момент появления жидкой фазы. По мнению других, точкой плавления следует считать момент полного исчезновения твердой фазы, то есть наступление полной прозрачности расплава при условии медленного нагревания.
Часто под температурой плавления подразумевают интервал температур между появлением первых капель жидкости и полным переходом твердого вещества в жидкое состояние. Для чистых индивидуальных веществ этот интервал измеряется долями градуса. Точнее определить температурный интервал плавления можно путем повторного расплавления образца после его застывания. О приближении расплавления узнают по стеканию расплавившихся частиц, которые обыкновенно при застывании высоко поднимаются по стенкам капилляра под действием капиллярных сил.
При наличии примеси точка плавления вещества понижается. Это дало повод предположить, что смеси веществ должны плавиться при более низкой температуре, чем составляющие их индивидуальные вещества. Отсутствие депрессии температуры плавления смеси исследуемого вещества со стандартными рассматривается как доказательство их идентичности (или их полной взаимной нерастворимости). Этим пользуются для идентификации химических соединений. Для этого смешивают в равных количествах (по 0,05 или 0,1 г) исследуемое вещество и химически чистое стандартное вещество (вещество сравнения) и определяют температуру плавления смеси. Если проба смешения плавится при той же температуре, что и каждый компонент в отдельности, то идентичность исследуемого вещества со стандартными считается доказанной. Если же проба смешения плавится при более низкой температуре, чем каждый компонент в отдельности, то это значит, что исследуемое вещество не идентично стандартному.
Определение температуры плавления в капилляре
Температуру плавления гигроскопических и возгоняющихся веществ определяют в капиллярах, запаянных с обоих концов; при этом капиллярная часть должна быть целиком погружена в нагревательную баню (нагревательный блок).
Капилляр закрепляют на термометре резиновым колечком (кольцо отрезают от подходящего по размерам резинового шланга), медной проволокой или приклеивают верхний конец каплей серной кислоты. Проба вещества должна находиться на уровне шарика термометра.
Температуру плавления большей частью считывают с термометра, когда вещество полностью расплавилось, образовав прозрачный расплав.
Чтобы избежать довольно больших и порой недостаточно надежных поправок на выступающий столбик ртути, рекомендуется применять укороченные термометры из набора ТЛ-6 (по Аншютцу).
Многие органические вещества плавятся с разложением (появление окраски, выделение газа). Температура разложения обычно не резко выражена и часто не может быть точно воспроизведена.
Определение температуры плавления в капиллярах может быть выполнено очень точно, если в предварительном опыте определить приблизительно температуру плавления вещества и затем капилляр с веществом поместить в прибор, нагретый до температуры на несколько градусов ниже этого приблизительного значения.
В качестве обогревательной жидкости (теплоносителя) используют концентрированную серную кислоту, парафиновое масло, силиконовое масло. Серную кислоту, применение которой требует большой осторожности, можно использовать при определении температуры плавления вплоть до 250 °С. Смесь конц. H2SO4 (7 масс, ч) и K2SO4 (3 ч.) после 5-минутного кипячения при энергичном перемешивании образуют прозрачную жидкость, которую можно использовать в качестве теплоносителя до 320°С (смесь гигроскопична, и ее следует предохранять от увлажнения).
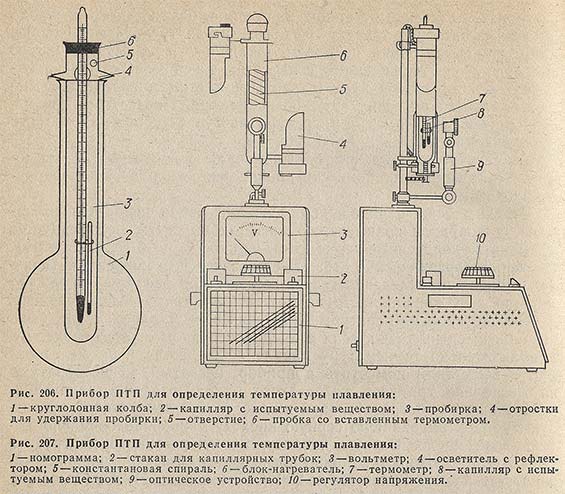
Предложено много конструкций приборов для определения температуры плавления капиллярным методом. Отечественная промышленность выпускает два типа таких приборов.
Прибор ПТОП. Этот прибор (рис. 206) состоит из круглодонной колбы 1 вместимостью 100-150 мл с горлом длиной 90 мм и диаметром 30 мм. В колбу наливают на 2/3 ее объема бесцветной конц. H2SO4 или бесцветного силиконового масла. В горло колбы вставляют специальную пробирку 3 длиной 150 мм и диаметром около 15 мм с приплавленными к ней четырьмя отростками 4 на расстоянии 30 мм от ее верхнего края. Над одним из отростков в пробирке имеется отверстие 5 диаметром 2-3 мм.
Пробирку вставляют в колбу так, чтобы между дном пробирки и колбы оставалось 10-15 мм. Пробирку закрывают корковой пробкой 6 со вставленным в нее укороченным термометром, из набора ТЛ-6 (по Аншютцу), нижний конец которого должен находиться на несколько миллиметров выше дна пробирки. При определении температуры плавления веществ, плавящихся ниже 170 °С, применяют порожнюю пробирку; для веществ с температурой плавления выше 170 °С в пробирку наливают конц. H2SO4 или силиконовое масло так, чтобы ртутный резервуар термометра был погружен в нее. Для веществ с температурой плавления 250-320 °С пробирку и колбу наполняют упомянутой выше смесью H2SO4 и K2SO4.
Содержимое колбы нагревают до температуры на 10-15 °С ниже предполагаемой температуры плавления препарата, измеряя температуру в колбе термометром, после чего в пробирку помещают укороченный термометр с капилляром так, чтобы ни термометр, ни капилляр не касались дна и стенок пробирки. Затем продолжают нагревать прибор, повышая температуру со скоростью 0,5 °С в минуту. Если вещество в процессе определения температуры плавления разлагается, то скорость нагрева увеличивают до 2-3°С в минуту или капилляр с препаратом перемещают в прибор, предварительно нагретый до температуры приблизительно на 5°С ниже предполагаемой температуры плавления.
Прибор ПТП. В отличие от описанного выше, в приборе ПТП (рис. 207) предусмотрен электронагрев капилляра с пробой. Прибор предназначен для определения температуры плавления веществ в диапазоне 20-360 °С при регулируемых скоростях нагрева 1, 2, 4, 6, 8 и 10 °С в минуту.
Основной частью прибора является блок-нагреватель 6; он состоит из двух сосудов из термостойкого стекла, вставленных один в другой. На внутренний сосуд навита бифилярно константановая спираль 5.
В блок-нагреватель устанавливают термометр 8, к которому крепят капилляры 8.
Прибор снабжен номограммой 1, позволяющей при определенной фиксированной глубине погружения термометров установить напряжение, необходимое для заданной скорости нагревания.
Для удобства наблюдения за плавлением вещества и шкалой термометра на приборе установлены оптическое приспособление 9 с фокусировкой н два осветителя 4 с рефлекторами.
Исследуемый образец тонкоизмельченного сухого вещества помещают в капиллярную трубку 8, запаянную с одного конца, которая устанавливается так, чтобы столбик вещества находился на уровне середины ртутного резервуара термометра. Затем включают прибор в сеть.
В виду некоторого влияния температуры окружающей среды и движения воздуха вокруг блока-нагревателя 6, необходима дополнительная коррекция скорости нагрева, которая осуществляется вручную регулятором напряжения 10.
Медные блоки. Температуру плавления высокоплавких веществ (>300 °С) лучше всего определять нагреванием капилляров в медных блоках. Термометр помещают в горизонтальный канал блока, на поверхности которого находится ряд углублений, расположенных на равных расстояниях. Система каналов под острым углом друг к другу позволяет рассматривать капилляр как в проходящем, так и в отраженном свете от источника, установленного за отверстием канала. Выходные отверстия каналов во избежание движения воздуха закрыты стеклом. После предварительного грубого определения температуры плавления образца термометр выдвигают из блока настолько, чтобы можно было только отсчитать ожидаемую температуру. Проба вещества устанавливается в углублении, ближайшем к шарику термометра.
Определение температуры плавления на нагреваемой поверхности
При определении температуры плавления легко разлагающихся при нагревании веществ наиболее точные результаты могут быть получены при максимальном сокращении времени от момента начала нагревания вещества до его плавления. Это достигается применением различного типа блоков для плавления на открытой поверхности. Одним из таких блоков является нагреватель Кофлера.
Нагреватель представляет собой металлический брусок длиной около 370 мм и шириной около 40 мм, в котором посредством одностороннего электрического обогрева создан перепад температур. Благодаря форме бруска и использованию двух металлов с различной теплопроводностью его температурный градиент приближается к линейному. При помощи этого нагревателя можно определять температуру плавления веществ в интервале 50-250 °С. Для отсчета температур служит металлическая шкала с ценой деления 2 °С. Вмонтированный в прибор стабилизатор исключает влияние колебаний напряжения в сети и обеспечивает всегда одинаковое нагревание.
Исследуемое вещество насыпают непосредственно на хромированную поверхность нагревателя. Вскоре можно увидеть более или менее четкую границу жидкой и твердой фазами. Пределы точности определения 1-2°С.
Криоскопический метод
Недостатком этого метода является то, что для этого требуется значительно больше испытуемого вещества, чем при определении в капиллярах.
Определение температуры кристаллизации органических реактивов и препаратов в пределах 20-100 °С по кривой охлаждения проводят в приборе Баумана-Фрома (рис. 208).
Испытуемый препарат помещают в сосуд 3 и расплавляют, погружая в стакан с водой, нагретой до температуры на 15-20 °С выше предполагаемой температуры кристаллизации. Слой расплавленного препарата должен быть высотой 25-30 мм.
Сосуд с расплавленным препаратом вынимают из воды, насухо вытирают, вставляют в пробирку 6 и закрепляют на штативе. В расплавленный препарат погружают термометр 4 и мешалку 5 так, чтобы они не касались ни дна, ни стенок сосуда 3 и чтобы ртутный резервуар термометра был полностью погружен в испытуемое вещество.
Испытуемое вещество в приборе охлаждают на 2-3°С ниже предполагаемой температуры кристаллизации и осторожно помешивают, не касаясь дна и стенок прибора.
В момент кристаллизации вещества температура самопроизвольно повышается (в этот момент прекращают перемешивание) и, достигнув определенного максимума, остается на этом уровне в течение некоторого времени, а затем вновь начинает понижаться. Высшую точку подъема температуры принимают за температуру кристаллизации.
ДЕЗликбез. Выпуск 9. Азопирамовая проба
Друзья, сделали для вас еще один полезный ролик про азопирамовую пробу. Он без звука, поэтому одинаково важно как посмотреть видео, так и прочитать текст ниже.
Если у вас будут вопросы, обязательно спрашивайте в комментариях.
Что такое азопирамовая проба?
Это способ проверки качества предстерилизационной очистки (ПСО) инструментов. Проще говоря, мы проверяем, не остались ли на инструментах даже после ПСО следы крови и биологических жидкостей.
В случае некачественной очистки инструмента рабочий раствор азопирама станет фиолетовым. Если ПСО проведена хорошо, раствор не поменяет цвет.
Кому это нужно знать?
Косметологам, мастерам маникюра и педикюра и, само собой, работникам медицинских учреждений. Всем, кто при работе с инструментами может повредить кожу клиента.
Как правильно провести пробу?
Шаг 1. Приготовление рабочего раствора.
Для этого нужно смешать все компоненты реактива в следующих пропорциях:
Готовая жидкость называется рабочим раствором.
Раствор готовят непосредственно перед проведением пробы и используют в течение двух часов после смешивания компонентов. В противном случае эффективность пробы будет нулевой.
Если реактив хранится в помещении, где температура воздуха выше 25 градусов, он будет розоветь быстрее.
Готовый раствор может пожелтеть, это допустимо, если нет осадка.
Такой вариант приготовления раствора подходит для учреждений, имеющих медицинскую лицензию и осуществляющих медицинскую деятельность.
Согласно СанПиН 2631-10, на предприятиях коммунально-бытового обслуживания запрещено использование спирта, поэтому следует воспользоваться вторым вариантом.
Второй вариант – использование готового «Азопирам-Комплекта».
Такой набор значительно облегчит приготовление азопирамовой пробы. В наборе всего два пузырька с реактивами. Реактив из маленького пузырька нужно перелить в большой пузырек. Получается готовый раствор азопирама.
Шаг 2. Добавление перекиси водорода.
Для проведения азопирамовой пробы потребуется 3%-я перекись водорода.
На чистую салфетку с помощью пипетки наносим три капли готового рабочего раствора азопирамовой пробы и три капли перекиси водорода.
Шаг 3. Проведение пробы.
Протираем салфеткой режущие элементы инструмента или те его части, которые контактируют с биологическими жидкостями или кровью. В видео мы для примера взяли пинцет.
Если инструмент имеет выемки или шероховатости (например, фрезы, а в нашем случае это ложка Уно), средство используется в виде капель. Для этого мы в равных долях смешаем Азопирам с 3%-й перекисью водорода и нанесем пипеткой 2-3 капли на инструмент. Это необходимо для того, чтобы раствор прошел по всем каналам и стыкам деталей инструмента.
После нанесения средства нужно подождать 1 минуту. В течение этого времени раствору дают возможность стечь на чистую белую салфетку (это условие одно из самых важных).
Результаты пробы мы увидим на салфетке спустя минуту. Результат, полученный через более длительное время, диагностического значения не имеет.
Если ПСО проведена некачественно, и на инструментах остались следы крови или биологической жидкости, через минуту на салфетке появится фиолетовое пятно, через несколько секунд оно станет розовато-синим.
Если пятно на салфетке имеет бурый оттенок, значит, на инструментах есть ржавчина или хлорсодержащие окислители. Розовый цвет говорит о наличии моющих средств.
В нашем случае реактив не дал положительных результатов, поэтому считаем, что инструмент прошел ПСО, и повторно ее осуществлять не нужно.
Для оценки качества ПСО берется не менее 1% инструмента, прошедшего одновременную процедуру очистки. В индустрии красоты для более простого подсчета берут не менее трех инструментов из одной партии.
Как проверить пригодность раствора?
При длительном хранении препарата следует проверить его пригодность перед использованием. Перед тем, как делать азопирамовую пробу на поверхности, 2-3 капли раствора наносят на кровяное пятно. Если в течение 60 секунд оно окрашивается в фиолетовый цвет, то реактив пригоден к использованию. Если окрашивания не происходит, то пользоваться таким раствором нельзя.
Несколько важных правил проведения азопирамовой пробы:
Приобрести «Азопирам-Комплект», а также журналы контроля качества ПСО можно на нашем сайте.
На видео мы показали, как проводится азопирамовая проба.
Идентификация вещества методом смешанной пробы
Лабораторная работа № 7 (часть 1)
Очистка b-нафтола методом полумикроперекристаллизации.
В препаративной химии к полумикрометоду относят работу с навесками 100 – 200 миллиграммов. Перекристаллизацию малых количеств вещества
можно вести с применением ампул (рис. 7а) или пробирок с изогнутой трубкой- капилляром (рис. 7б). Ампулы готовят из легкоплавкой пробирки диаметром 10-12 мм и длиной 70-80 мм. Диаметр оттянутого конца ампулы составляет 2-3 мм, угол сгиба 45 – 60º. В качестве фильтрующего материала применяют ватный тампон, вставленный в кончик ампулы или трубки.
Насыщенный раствор вещества в подобранном растворителе готовят в пробирке на 5 мл, снабженной воздушным холодильником. Поместив в пробирку 100 мг вещества, начинают при нагревании по каплям добавлять растворитель, а затем быстро профильтровывают насыщенный раствор в ампулу или пробирку.
А б в
Рисунок 7. Приборы для полумикроперекристаллизации и фильтрования на гвоздике
Для этого в ампуле (пробирке) создают разрежение: в нее помещают несколько капель растворителя, из которого ведут перекристаллизацию, нагревают, при этом пары растворителя вытесняют из ампулы (пробирки) воздух. Оттянутый конец ампулы (изогнутой трубки) опускают в горячий раствор кристаллизуемого вещества, при этом происходит его засасывание с просачиванием через ватный фильтр; для ускорения фильтрования ампулу (пробирку) охлаждают ледяной водой. После кристаллизации ампулу вскрывают (капилляр с пробкой отсоединяют от пробирки), выпавшие кристаллы отфильтровывают с отсасыванием на микроворонке с «гвоздиком» (рис. 7в) и промывают несколькими каплями холодного растворителя.
Выполнение работы
Цель работы: Освоить технику полумикроперекристаллизации. Перекристаллизовать бензонафтол.
Последовательность выполнения работы:
1. Взвешивают 100 – 150 мг бензонафтола, засыпают его в пробирку с воздушным холодильником, помещают туда же кипелки.
2. Приливают 0.5 – 1 мл спирта, доводят до кипения, осторожно нагревая пробирку над плиткой.
3. Если весь бензонафтол не растворился, то осторожно по каплям добавляют еще спирт и доводят раствор до кипения (объем растворителя должен быть измерен).
4. В изогнутую трубку-капилляр вставляют ватный тампон, который служит фильтром.
5. В пробирку-приемник помещают несколько капель спирта, вставляют в нее пробку с капилляром и осторожно нагревают пробирку до кипения.
6. Опускают конец капилляра в пробирку с горячим раствором бензонафтола, при этом происходит засасывание раствора с просачиванием через ватный фильтр. Для ускорения фильтрования пробирку-приемник охлаждают ледяной водой.
7. После кристаллизации капилляр с пробкой отсоединяют от пробирки, кристаллы отфильтровывают на воронке с «гвоздиком» (рис. 7в) и промывают несколькими каплями холодного спирта.
8. Полученные кристаллы сушат и взвешивают.
Отчет по работе должен содержать следующие данные:
1. Название лабораторной работы.
3. Рисунки всех установок.
4. Массу бензонафтола, взятого для перекристаллизации и объем спирта, пошедший на растворение.
5. Массу полученного чистого вещества и выход после перекристаллизации в процентах.
6. Описание внешнего вида вещества до и после очистки.
7. Вывод по проделанной работе.
Лабораторная работа №7 (часть 2)
Идентификация вещества методом смешанной пробы
Цель работы:1. Закрепить умение определять температуру плавления в капилляре.
2. Убедиться в том, что смесь двух разных веществ с одинаковыми температурами плавления плавится при более низкой температуре.
Студент получает два вещества с одинаковыми (или близкими температурами плавления), набивает два капилляра полученными веществами.
Смешанная проба двух веществ готовится тщательным смешиванием на часовом стекле равных количеств двух полученных веществ. Затем в приборе для определения т. пл. одновременно нагревают три капилляра: два – с известными веществами, третий – со смешанной пробой, результаты заносят в табл. 2. Если проба смешения плавится при такой же температуре, что и каждое вещество в отдельности, вещества идентичны.
Если проба смешения обнаруживает депрессию т. пл., то исследуемые вещества – неидентичны. Обычно депрессия достигает 10-30ºС, но нередко составляет всего несколько градусов. Тогда смешанную пробу нужно приготовить при ином соотношении исходных веществ и повторить плавление с тремя капиллярами.
Идентификация вещества методом смешанной пробы
| Вещество в капилляре | Температура, ºС | |
| Съеживание (смокание) | Мениск | Расплав |
| Вещество № 1 | ||
| Смешанная проба | ||
| Вещество № 2 |
Встречаются случаи, когда т. пл. смешанной пробы, наоборот, повышается. Это означает, что в смешанной пробе оба вещества образуют новое соединение, т. пл. которого выше т. пл. каждого компонента.