Что такое потенциал металла
Что такое электродный потенциал
Явления растворения металлов в электролитах используются в химических источниках электроэнергии. Металлическая пластина, опушенная в раствор своей же соли, в той или иной мере стремится в ней раствориться. Это стремление иногда называется упругостью растворения металла.
Эти заряды будут противодействовать дальнейшему переходу металла в раствор — отрицательные пластины удерживают положительный ион металла, а положительный заряд электролита отталкивает ион металла назад на пластину. Иными словами, электрическое поле двойного слоя на границе металл — жидкость противодействует дальнейшему переходу ионов металла в раствор. Устанавливается равновесие между химическими по своей природе силами стремления металла перейти в раствор и электрическими силами, им противодействующими.
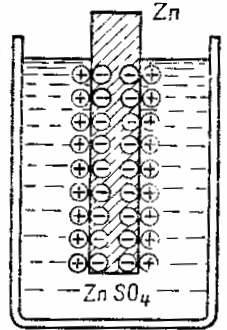
Схема образования двойного электрического слоя на границе металла и электролита
Таким образом, вследствие растворения в электролите металлический электрод приобретает по отношению к электролиту определенный электродный (иначе электрохимический) потенциал, зависящий от материала электрода и состава электролита.
Однако электродные потенциалы могут иметь положительное значение. Это имеет место в тех случаях, когда положительные ионы раствора переходят на электрод, заряжая его положительно, а слой электролита — отрицательно, например, когда медная пластина погружена в достаточно концентрированный раствор сернокислой меди (CuSO4).
Двойной электрический слой можно уподобить конденсатору, одна из обкладок которого представляет собой поверхность металла, а другая — слой ионов в растворе у поверхности металла. Между разноименно заряженными обкладками и возникает разность, или скачок, потенциала.
Скачок потенциала на границе электрод-раствор может служить мерой окислительно-восстановительной способности системы. Однако невозможно произвести измерение такого скачка потенциала или, что то же, разности потенциалов между двумя фазами. Но можно произвести измерение э. д. с. элементов, составленных из интересующих нас электродов и какого-нибудь одного (одинакового во всех случаях) электрода, потенциал которого условно принят за нуль.
Измеренная э. д. с. будет характеризовать окислительно-восстановительную способность интересующего нас электрода относительно некоторого условного нуля. Полученная таким способом величина называется собственным потенциалом металла.
Чтобы измерить электродный потенциал любого металла, необходимо поместить в электролит второй электрод, который и свою очередь будет обладать определенным электродным потенциалом, зависящим от его материала. Следовательно, непосредственно измерить можно только алгебраическую сумму двух электродных потенциалов.
По этой причине электродные потенциалы различных материалов определяются по отношению к стандартному (водородному электроду, потенциал которого условно принимают за нуль.
Для измерения могут применяться и другие электроды сравнения, потенциал которых относительно водородного стандартного электрода известен. Этот потенциал также находят на основании измерения э. д. с. цепи, составленной из выбранного электрода сравнения и стандартного водородного электрода.
Если в соответствующий электролит помещены две пластины из металлов, имеющих различный электродный потенциал, например, в раствор серной кислоты (H2SO4) помещены цинковая (Zn) и медная (С u ) пластины, то вольтметр, присоединенный к этим пластинам, покажет между ними напряжение немного более 1 В.
Это напряжение, называемое в данном случае э. д. с. гальванической пары, будет обусловлено разностью электродных потенциалов меди, обладающей небольшим положительным потенциалам, и цинка, обладающего значительным отрицательным потенциалом. Такое устройство является простейшим гальваническим элементом — элементом Вольта.
В гальваническом элементе происходит превращение химической энергии в электрическую и с его помощью можно совершить электрическую работу за счет энергии химической реакции.
Измерение э. д. с. гальванических элементов необходимо производить при отсутствии тока в цепи элемента. В противном случае измеренная э. д. с. будет меньше, чем величина, определяемая как разность равновесных потенциалов обоих электродов. Действительно, равновесному потенциалу отвечает определенная концентрация электронов на электродах: на более положительном она ниже, на более отрицательном выше. Сообразно с этим различно и строение той части двойного слоя, которая расположена в растворе.
Измерение э. д. с. элемента без протекания тока обычно производится компенсационным методом. Для осуществления его необходимо иметь некоторый эталон э. д. с. Таким эталоном служит так называемый нормальный элемент. Чаще всего пользуются ртутно-кадмиевым нормальным элементом Вестона, э. д. с. которого равна 1,01830 В при 20 °С.
Если Вам понравилась эта статья, поделитесь ссылкой на неё в социальных сетях. Это сильно поможет развитию нашего сайта!
Подписывайтесь на наш канал в Telegram!
Просто пройдите по ссылке и подключитесь к каналу.
Не пропустите обновления, подпишитесь на наши соцсети:
Электродные потенциалы металлов
Существует несколько теорий, объясняющих возникновение тока в гальванических элементах. Наиболее простая из них была выдвинута Нернстом (1888 г.) и позднее подробно развита академиком Л. В. Писаржевским на основе представлений о строении металлов из поло жительно заряженных ионов и свободных электронов.
Лев Владимирович Писаржевский родился в 1874 г.в. г. Кишиневе. Окончив естественный факультет Новороссийского университета (г. Одесса), Писаржевский был оставлен при нем для подготовки к прафессорскому званию. В 1902 г. он защитил магистерскую диссертацию, а в/1913 г. был избран профессором Екатеринославского горного института (г. Днепропетровск). С 1930 г. Писаржевский был действительным членом Академии наук СССР.
Крупный ученый и блестящий педагог, Писаржевский смело использовал достижения физики для изучения и объяснения химических процессов. Важнейшие его работы посвящены исследованию перекисей и надкислот, разработке теории растворов, приложению электронной теории к химии и разработке теории возникновения тока в гальванических элементах.
Возникновение тока в гальваническом элементе происходит следующим образом. Если погрузить любой металл в воду, то ионы его начинают переходить в раствор под влиянием притяжения, испытываемого ими со стороны полярных молекул воды. Вследствие этого металл, в котором остается избыток электронов, заряжается отрицательно, а раствор — положительно. Однако число ионов, которое металл посылает в раствор, как показывает опыт, очень мало. Возникающий на металле по мере ухода ионов отрицательный заряд начинает притягивать обратно ушедшие из металла ионы, так что вскоре наступает состояние равновесия, при котором в единицу времени столько же ионов уходит из металла, сколько и возвращается в него:
металл⇄ионы металла
Перешедшие в раствор ионы не распределяются равномерно по всей массе раствора, а вследствие притяжения к отрицательно заряженному металлу располагаются близ его поверхности, образуя так называемый двойной электрический слой (рис. 127). В результате между металлом и раствором устанавливается определенная разность потенциалов.

Предположим теперь, что мы прибавили к воде, в которую погружен металл, некоторое количество соли того же металла. Вследствие увеличения концентрации ионов металла в растворе равновесие между ними и металлом нарушится и часть ионов перейдет обратно в металл. Следовательно, в раствор своей соли
металл должен посылать меньше ионов, чем в чистую воду, и тем меньше, чем больше концентрация ионов в растворе. При достаточно большой концентрации соли ионы могут совсем не перейти из металла в раствор, так что ни металл, ни раствор не будут заряжены.
Наконец, если концентрация ионов металла в растворе достаточно велика, а активность металла сравнительно мала, то металл не только не посылает ионов в раствор, но, наоборот, часть ионов переходит из раствора в металл. При этом между металлом и раствором тоже возникает разность потенциалов, но теперь уже раствор заряжается отрицательно за счет избытка отрицательных ионов соли, а металл — положительно. Практически дело обстоит так, что одни металлы (более активные) всегда заряжаются в растворах своих солей отри-цательно, другие (менее активные) —положительно.
Следует заметить, что во всех случаях при погружении металла в раствор его соли количество переходящих в раствор или выделяющихся из раствора ионов настолько мало, что не может быть обнаружено химическим путем. Однако заряд их достаточно велик, чтобы создать поддающуюся измерению разность потенциалов.

В гальванических элементах тот электрод, который в процессе работы элемента разрушается, посылая ионы в раствор, называется анодом, а электрод, у которого разряжаются поло жительные ионы, называется катодом.
Гальванический элемент может быть построен из любых двух металлов, погруженных в растворы их солей. При этом совершенно не обязательно, чтобы один металл заряжался «отрицательно, а другой — положительно. Единственным условием для перетекания электронов от одного заряженного тела к другому является существование разности потенциалов между ними. Но последняя должна возникнуть, какие бы металлы мы ни взяли, так как способность отщеплять электроны и переходить в ионы у всех металлов различна. Если, например, составить гальванический элемент из цинка и железа, погруженных в нормальные растворы их солей, то, хотя оба металла заряжаются в растворах отрицательно, между ними все же возникнет некоторая разность потенциалов. При соединении металлов проводником электроны потекут от цинка, как металла более активного, к железу; цинк будет растворяться, а железо — выделяться из раствора. Происходящая в элементе реакция выразится уравнением
Разность потенциалов, возникающая между металлом и раствором его соли, называется электродным потенциалом металла и может служить мерой его способности отдавать электроны или, что то же самое, мерой его химической активности при реакциях в растворах. Поэтому, измерив потенциалы всех металлов при одинаковых концентрациях их ионов, мы могли бы количественно охарактеризовать активность металлов.
К сожалению, прямое измерение этих величин очень затруднительно и не дает точных результатов. Это ясно уже из того, что нельзя, например, присоединить вольтметр к раствору, не погрузив в раствор металлический проводник. Но тогда возникает разность потенциалов между проводником и раствором, так что напряжение, показываемое вольтметром, будет зависеть от двух разностей потенциалов: разности потенциалов между интересующим нас металлом и раствором его соли и разности потенциалов между металлическим проводником и тем же раствором.
Гораздо легче измерить разность потенциалов (разность напряжений электронов) между двумя различными металлическими электродами, погруженными в растворы соответствующих солей, т. е. узнать, насколько потенциал одного металла больше или меньше потенциала другого металла. Если измерить таким образом относительные потенциалы всех металлов, сравнивая их потенциалы с потенциалом какого-нибудь одного из них, то полученные числа будут так же точно характеризовать активность металлов, как и абсолютные величины их потенциалов.
В качестве стандартного электрода, с потенциалом которого сравнивают потенциалы других металлов, принят так называемый нормальный водородный электрод. Последний состоит из платиновой пластинки, покрытой рыхлым слоем платины и погруженной в двунормальный раствор серной кислоты. Через раствор непрерывно пропускают под давлением в 1 ат токчистого водорода, который, приходя в соприкосновение с платиной, в довольно большом количестве поглощается ею. Насыщенная водородом платиновая пластинка ведет себя так, как если бы она была сделана из водорода. При соприкосновении ее с раствором серной кислоты возникает определенная разность потенциалов (потенциал водородного электрода), условно принимаемая при измерениях относительных потенциалов за нуль.
Разность потенциалов между металлом, погруженным в раствор его соли, содержащий 1 грамм ион металла на литр, и нормальным водородным электродом называется нормальным потенциалом металла.
Для измерения нормальных потенциалов обычно пользуются приборами, подобными изображенному на рис. 128. По существу такой прибор представляет собой гальванический элемент, одним из электродов которого служит испытуемый металл, а другим — водородный электрод. Так как потенциал водородного электрода принимается за нуль, то, измерив разность потенциалов на полюсах такого элемента или его электродвижущую силу, мы непосредственно находим нормальный потенциал металла.
Если расположить металлы, включая и водород, по убывающей величине напряжения их электродов, т. е. по убывающим отрицательным нормальным потенциалам (и возрастающим положительным), то получится тот же самый ряд напряжений.
Нормальные потенциалы металлов
| Металл | Ион | Потенциал в вольтах | Металл | Ион | Потенциал в вольтах |
| К | К • | — 2,92 | Ni | Ni •• | — 0,23 |
| Са | Са •• | — 2,84 | Sn | Sn •• | — 0,14 |
| Na | Na • | — 2,713 | Pb | Pb •• | — 0,126 |
| Mg | Mg •• | — 2,38 | н2 | H • | 0,000 |
| Al | Аl ••• | — 1,66 | Сu | Сu •• | + 0,34 |
| Мn | Mn •• | — 1,05 | Hg | Hg2 •• | + 0,798 |
| Zn | Zn •• | — 0,763 | Ag | Ag • | + 0,799 |
| Fe | Fe •• | — 0,44 | Au | Au ••• | + 1,42 |
Зная нормальные потенциалы металлов, легко определить электродвижущую силу любого элемента, состоящего из двух металлов, погруженных в растворы их солей. Для этого нужно только найти разность нормальных потенциалов взятых металлов.
Чтобы величина электродвижущей силы имела положительное значение, всегда вычитают из большего потенциала меньший. Например, электродвижущая сила медно-цинкового элемента:
э. д. с. = 0,34 — (—0,763) = 1,103 вольта
Понятно, что такую величину она будет иметь, если концентрации ионов Zn •• и Сu •• в соответствующих растворах равны 1 граммиону на 1 литр. Для иных концентраций потенциалы металлов, а следовательно, и электродвижущие силы могут быть вычислены по формуле, выведенной Нернстом:
где Е — потенциал металла при данной концентрации ионов; Ео — нормальный потенциал металла; п — валентность ионов металла; с — концентрация ионов в растворе в граммионах на литр.
Так, например, потенциал цинка в 0,001 М растворе его соли будет равняться:
При устройстве гальванических элементов, помимо реакций вытеснения металлов металлами, нередко используются другие окислительно-восстановительные реакции, в которых могут принимать участие и металлоиды. Для некоторых металлоидов также определены их нормальные потенциалы, но ряд напряжений для металлоидов установлен далеко не так полно, как для металлов. В качестве иллюстрации приводим нормальные потенциалы галогенов:
Вы читаете, статья на тему Электродные потенциалы металлов
Похожие страницы:
Понравилась статья поделись ей
Электрохимический ряд напряжений металлов (ряд Бекетова)
Электрохимический ряд напряжений металлов опытным путем установил Алессандро Вольта, на тот момент он выглядел следующим образом: Zn, Pb, Sn, Fe, Cu, Ag, Au. Величина электродного потенциала зависела оттого, насколько далеко отстояли друг от друга члены ряда. Но причина этого была неизвестна. В 1853 г. русский учёный Николай Николаевич Бекетов (1827-1911) сделал в Париже сообщение на тему “Исследование над явлениями вытеснения одних элементов другими”. В этой работе он обобщил различные исследования способности одних металлов вытеснять другие из растворов их солей.
Первоначально Бекетов предполагал, что способность одних металлов вытеснять из растворов солей другие металлы связана с их плотностью: более лёгкие металлы способны вытеснять металлы более тяжелые. Но опыты говорили о ином. Непонятно было и то, как связан “вытеснительный ряд” с рядом напряжений Алессандро Вольта. Со временем накапливалось всё больше экспериментальных данных того, что некоторые правила вытеснения нарушаются при определенных условиях. Бекетов обнаружил, что водород под давлением 10 атмосфер вытесняет серебро из раствора нитрата серебра. Английский химик Уильям Одлинг (1829-1921) описал множество случаев подобных аномалий. Например, медь вытесняет олово из концентрированного подкисленного раствора хлорида олова (II) и свинец – из кислого раствора хлорида свинца (II). Медь, олово и свинец находятся в ряду правее кадмия, однако могут вытеснять его из кипящего слабо подкисленного раствора хлорид кадмия.
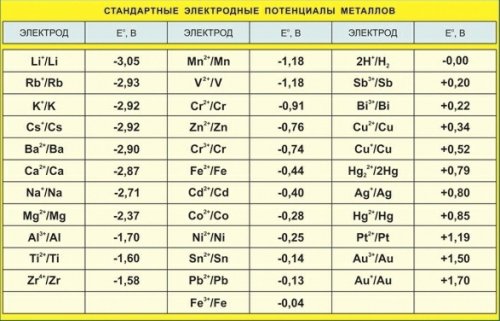
Теоретическую основу ряда активности (и ряда напряжений) заложил немецкий физикохимик Вальтер Нернст (1864-1941). Вместо качественной характеристики – “склонности” металла и его иона к тем или иным реакциям – появилась точная количественная величина. Такой величиной стал стандартный электродный потенциал металла, а соответствующий ряд, выстроенный в порядке изменения потенциалов, называется рядом стандартных электродных потенциалов.
Электрохимический ряд напряжений металлов (ряд Бекетова) это последовательность расположения металлов и их ионов в порядке возрастания стандартных электродных потенциалов в растворах электролитов. Электродом сравнения обычно служит стандартный водородный электрод, электродный потенциал которого условно принимается равным нулю.
| Восстановленная форма | Число отданных електронов | Окисленная форма | Стандартный электродный потенциал, В |
| Li | 1e | Li + | -3,05 |
| K | 1e | K + | -2,925 |
| Rb | 1e | Rb + | -2,925 |
| Cs | 1e | Cs + | -2,923 |
| Ba | 2e | Ba 2+ | -2,91 |
| Sr | 2e | Sr 2+ | -2,89 |
| Ca | 2e | Ca 2+ | -2,87 |
| Na | 1e | Na + | -2,71 |
| Mg | 2e | Mg 2+ | -2,36 |
| Al | 3e | Al 3+ | -1,66 |
| Mn | 2e | Mn 2+ | -1,18 |
| Zn | 2e | Zn 2+ | -0,76 |
| Cr | 3e | Cr 3+ | -0,74 |
| Fe | 2e | Fe 2+ | -0,44 |
| Cd | 2e | Cd 2+ | -0,40 |
| Co | 2e | Co 2+ | -0,28 |
| Ni | 2e | Ni 2+ | -0,25 |
| Sn | 2e | Sn 2+ | -0,14 |
| Pb | 2e | Pb 2+ | -0,13 |
| Fe | 3e | Fe 3+ | -0,04 |
| H2 | 2e | 2H + | 0,00 |
| Cu | 2e | Cu 2+ | 0,34 |
| Cu | 1e | Cu + | 0,52 |
| 2Hg | 2e | Hg2 2+ | 0,79 |
| Ag | 1e | Ag + | 0,80 |
| Hg | 2e | Hg 2+ | 0,85 |
| Pt | 2e | Pt 2+ | 1,20 |
| Au | 3e | Au 3+ | 1,50 |
Место каждого элемента в ряду напряжений условно, т.к. величина электродного потенциала зависит от температуры и состава раствора, в который погружены электроды, в частности от концентрации ионов. Большое значение также имеет состояние поверхности электрода (гладкая, шероховатая). Стандартный электродный потенциал относится к водным растворам при температуре 25 °С, давлении газов 1 атмосфера и концентрации ионов 1 моль/л.
Из электрохимического ряда напряжений металлов вытекает ряд важных следствий:
Восстановление водородом из оксидов
Металлы, которые водород не восстанавливает из их оксидов
Металлы, которые водород восстанавливает из их оксидов
K, Ba, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr
Fe, Cd, Co, Ni, Sn, Pb, W, Sb, As, Bi, Cu, Hg, Ag
Что такое электродный потенциал?
ЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ,разностьэлектростатич. потенциалов между электродоми находящимся с ним в контактеэлектролитом. Возникновение электродного потенциала обусловлено пространств.
разделениемзарядов противоположного знака на границе раздела фаз и образованиемдвойногоэлектрического слоя. На границе между металлич. электродоми р-ромэлектролитапространств.
разделение зарядов связано со след. явлениями:переносом ионовиз металлав р-р в ходе установления электрохим. равновесия,кулоновской адсорбциейионовиз р-ра на пов-сть металла, смещением электронногогазаза пределы положительно заряженного ионного остова кристаллич.
решетки,специфич. (некулоновской) адсорбциейионовили полярных молекулр-рителяна электродеи др. Последние два явления приводят к тому, что электродный потенциал неравен нулю даже при условиях, когда заряд пов-сти металларавен нулю (см.Потенциалнулевого заряда).Абс.
величину электродного потенциала отдельного электродаопределить невозможно, поэтому измеряют всегда разность потенциалов исследуемогоэлектродаи нек-рого стандартного электрода сравнения.Электродный потенциал равенэдс электрохим. цепи, составленной из исследуемого и стандартного электродов(диффузионный потенциалмежду разными электролитами, обусловленныйразличием скоростей движения ионов, при этом должен быть устранен). Дляводных р-ров в качестве стандартного электродаобычно используют водородныйэлектрод(Pt, Н2[0,101 МПа] | Н+[a= 1]), потенциалк-рого при давленииводорода0,101 МПа и термодинамич.
активностиаионовН+ в р-ре, равной 1, принимают условно равным нулю(водородная шкала электродных потенциалов). При схематич. изображении цепи водородный электродвсегда записывают слева; напр., потенциал медного электродав р-ре солимедиравен эдс цепи Pt, H2|HClCuCl2|Cu|Pt(две штриховые черты означают, что диффузионный потенциална фанице НС1и СuС12устранен).Если исследуемый электроднаходится встандартных условиях, когда активностивсех ионов, определяющих электродный потенциал,равны 1, а давлениегаза(для газовых электродов) равно 0,101 МПа, значениеэлектродного потенциала наз.
стандартным (обозначение E°).Оно связано со стандартным изменениемэнергии Гиббсаи константой равновесияКрэлектрохим. р-ции ур-нием:, где F – число Фарадея; п – число электронов, участвующихв р-ции; R – газовая постоянная; Т – абс. т-ра.
ЗначенияE°электрохим. систем по отношению к водородному электродуи протекающие наэлектродахр-ции сведены в спец. таблицы (подробнее см.
Стандартныйпотенциал).Зависимость электродного потенциала от термодинамич. активностейaiучастников электрохим. р-ции выражаетсяНернстауравнением:
где vi- стехиометрич. коэф. участника р-ции, причем для исходных в-в это отрицат.
с чеш., М., 1977; Антропов Л.И., Теоретическаяэлектрохимия, 4 изд., М., 1984; Дамаскин Б. Б., Петрий О. А., Электрохимия,М., 1987; Багоцкий B.C., Основы электрохимии, М., 1988; Практикум по электрохимии,под ред.Б. Б.
Дамаскина, М., 1991.О. А. Петрий.АБВГДЕЖЗИКЛМНОПРСТУФХЦЧШЩЭЮЯ ___ЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ— разность электрических потенциалов (напряжений) между электродом и находящимся с ним в контакте электролитом.Появление Э. п.
вызвано образованием у поверхности электрода двойного электрического слоя.На практике используют значения так… … Большая политехническая энциклопедияЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ— в электрохимии разность электрических потенциалов на границе фаз электрод электролит. На практике пользуются значениями т. н.
относительного электродного потенциала, равного разности электродного потенциала, данного электрода и электрода… … Большой Энциклопедический словарьЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ— ЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ, мера способности электрода вступать в реакцию. Электрод из элемента М, помещенный в раствор его ионов (М+), представляет собой ПОЛУЭЛЕМЕНТ. Теоретически в ходе реакций типа ММ++е между электродом и раствором всегда… … Научно-технический энциклопедический словарьЭлектродный потенциал— мера способности электрода вступать в реакцию.Между электродом и раствором всегда образуется разность потенциалов.
Стандартные потенциалы электродов определяют относительно водородного электрода при определенных величинах температуры,… … Официальная терминологияэлектродный потенциал— — [Я.Н.Лугинский, М.С.Фези Жилинская, Ю.С.Кабиров. Англо русский словарь по электротехнике и электроэнергетике, Москва, 1999 г.] Тематики электротехника, основные понятия EN electrode potentialelectrolytic potentialelectropolarization… … Справочник технического переводчикаэлектродный потенциал— [electrode potential] разность электрических потенциалов между электродами и находящимся с ним в контакте электролитом (чаще всего между металлом и раствором электролита).Практическое значение имеют относительные электродные потенциалы,… … Энциклопедический словарь по металлургииэлектродный потенциал— 3.8 электродный потенциал: Мера способности электрода вступать в реакцию. Между электродом и раствором всегда образуется разность потенциалов.
Стандартные потенциалы электродов определяют относительно водородного электрода при определенных… … Словарь-справочник терминов нормативно-технической документацииЭлектродный потенциал— У этого термина существуют и другие значения, см.Потенциал. Электродный потенциал разность электрических потенциалов между электродом и находящимся с ним в контакте электролитом (чаще всего между металлом и раствором электролита). Возникновение… … ВикипедияЭлектродный потенциал— Electrode potential Электродный потенциал.Потенциал электрода в электролизе измеренный относительно электрода сравнения.
В электродный потенциал не входят потери противодействия потенциалу, как в растворе, так и внешней цепи. Он представляет… … Словарь металлургических терминовэлектродный потенциал— elektrodo potencialas statusas T sritis Standartizacija ir metrologija apibrėžtis Dydis, išreiškiamas potencialų skirtumu, susidarančiu tarp joninės terpės (elektrolito tirpalo ar lydalo) ir į ją įdėto elektrodo.atitikmenys: angl. electrode… … Penkiakalbis aiškinamasis metrologijos terminų žodynasэлектродный потенциал— elektrodo potencialas statusas T sritis Standartizacija ir metrologija apibrėžtis Elektrodo potencialas kito kūno arba terpės, kurioje jis yra, atžvilgiu.
atitikmenys: angl.electrode potential vok. Elektrodenpotential, n rus. потенциал электрода … Penkiakalbis aiškinamasis metrologijos terminų žodynasравновесный (электродный) потенциал— — [Я.Н.Лугинский, М.С.Фези Жилинская, Ю.С.Кабиров.Англо русский словарь по электротехнике и электроэнергетике, Москва, 1999 г.] Тематики электротехника, основные понятия EN equilibrium (electrode) potential … Справочник технического переводчикаНормальный электродный потенциал— В электрохимии стандартный электродный потенциал, обозначаемый Eo, E0, или EO, является мерой индивидуального потенциала обратимого электрода (в равновесии) в стандартном состоянии, которое осуществляется в растворах при эффективной концентрации… … ВикипедияСтандартный электродный потенциал— В электрохимии стандартный электродный потенциал, обозначаемый Eo, E0, или EO, является мерой индивидуального потенциала обратимого электрода (в равновесии) в стандартном состоянии, которое осуществляется в растворах при эффективной концентрации… … ВикипедияОкислительно-восстановительный потенциал— равновесный Электродный потенциал, характеризующий данную электролитическую среду.
при постоянной температуре зависит только от состава среды и может быть сообщен ею погруженному в неё электронному проводнику (электроду), если… … Большая советская энциклопедияЭЛЕКТРОХИМИЯ— раздел физической химии, изучающий химические процессы, которые сопровождаются появлением электрического тока или, наоборот, возникают под действием электрического тока. Предметом электрохимических исследований также являются электролиты и… … Энциклопедия КольераЕ949— Водород / Hydrogenium (H) Атомный номер 1 Внешний вид простого вещества газ без цвета, вкуса и запаха Свойства атома … Википедияцементационный процесс— [electrolitic precipitation] процесс осаждения металлов, основанный на электрохимическом протекании реакции между металлом цементатором и ионом осаждаемого металла, имеющего более положительный электродный потенциал.Цементационный процесс… … Энциклопедический словарь по металлургииЭЛЕКТРООСАЖДЕНИЕ— выделение фазы (металла, сплава, оксида и др.) на пов сти электрода в результате протекания электрохим. р ции.
Э.металлов лежит в основе гидроэлектрометаллургии (см. Электролиз )и гальванотехники. Металлы Au, Ag, Cu, Bi, Pb, Sn, Cd, Co, Ni, Fe,… … Химическая энциклопедияЭЛЕКТРОХИМИЧЕСКИЕ СЕНСОРЫ— устройства, в к рых аналит.
сигнал обеспечивается протеканием электрохим. процесса. Предназначены для качеств.
и количеств. анализа хим. соед.
в жидких и газообразных средах. По сравнению с обычными аналит. приборами отличаются портативностью,… … Химическая энциклопедияВ электрохимиистандартный электродный потенциал, обозначаемый Eo, E0, или EO, является мерой индивидуального потенциала обратимого электрода (в равновесии) в стандартном состоянии, которое осуществляется в растворах при эффективной концентрации в 1 моль/кг и в газах при давлении в 1 атмосферу или 100 кПа (килопаскалей).
Объёмы чаще всего взяты при 25 °C.Основой для электрохимической ячейки, такой как гальваническая ячейка всегда является окислительно-восстановительная реакция, которая может быть разбита на две полуреакции: окислениена аноде (потеря электрона) и восстановлениена катоде (приобретение электрона). Электричествовырабатывается вследствие различия электростатического потенциаладвух электродов. Эта разность потенциалов создаётся в результате различий индивидуальных потенциалов двух металлов электродовпо отношению к электролиту.
Вычисление стандартных электродных потенциалов
Электродный потенциал не может быть получен эмпирически.
Потенциал гальванической ячейки вытекает из «пары» электродов. Таким образом, невозможно определить величину для каждого электрода в паре, используя эмпирически полученный потенциал гальванической ячейки. Для этого установлен водородный электрод, для которого этот потенциал точно определён и равен 0,00 В, и любой электрод, для которого электронный потенциал ещё неизвестен, может быть соотнесён со стандартным водородным электродом с образованием гальванической ячейки — и в этом случае потенциал гальванической ячейки даёт потенциал неизвестного электрода.
Так как электродные потенциалы традиционно определяют как восстановительные потенциалы, знак окисляющегося металлического электрода должен быть изменён на противоположный при подсчёте общего потенциала ячейки. Также нужно иметь в виду, что потенциалы не зависят от количества передаваемых электронов в полуреакциях (даже если оно различно), так как они рассчитаны на 1 моль переданных электронов. Отсюда при расчёте какого-либо электродного потенциала на основании двух других следует проявлять внимательность.
Fe3++ 3e−→ Fe(тв) −0.036 В
Для получения третьего уравнения:
следует умножить потенциал первого уравнения на 3, перевернуть второе уравнение(поменять знак) и умножить его потенциал на 2. Сложение этих двух потенциалов даст стандартный потенциал третьего уравнения.
Таблица стандартных электродных потенциалов
Основная статья: Таблица стандартных электродных потенциалов
Чем больше стандартные восстановительные потенциалы, тем легче их можно восстановить, другими словами, тем более сильными окислителями они являются. И наоборот: низкий отрицательный потенциал означает, что данная форма является сильным восстановителем.
Например, F2имеет 2,87 В, а Li+имеет −3,05 В, фтор — окислитель, литий — восстановитель. Таким образом, Zn2+, стандартный восстановительный потенциал которого равен −0,76 В, может быть окислен любым другим электродом, стандартный потенциал которого больше −0,76 В. (напр., H+(0 В), Cu2+(0,16 В), F2(2,87 В)) и может быть восстановлен любым электродом, стандартный потенциал которого меньше −0,76 В (напр., H−(−2,23 В), Na+(−2,71 В), Li+(−3,05 В)).
В гальванической ячейке, где самопроизвольная окислительно-восстановительная реакция заставляет ячейку производить электрический потенциал, Энергия ГиббсаΔGoдолжна быть отрицательной, в соответствии со следующим уравнением:
где nэто количество молейэлектронов на моль продуктов, а Fявляется постоянной Фарадея,
96485 Кл/моль. Таким образом применимы следующие правила:
если E o яч> 0, тогда процесс самопроизвольный (гальваническая ячейка) если E o яч
Нестандартные условия
Стандартные электродные потенциалы даны при стандартных условиях. Однако, реальные ячейки могут действовать и при нестандартных условиях. При данном стандартном потенциале, потенциал при нестандартных эффективных концентрациях может быть вычислен с использованием уравнения Нернста:
Величины E0зависят от температуры (кроме стандартного водородного электрода) и обычно относятся к стандартному водородному электроду при этой температуре. Для конденсированных фаз величины потенциалов также зависят от давления.
См. также
- Таблица стандартных электродных потенциаловВосстановительный потенциалАбсолютный электродный потенциалЭлектрохимический потенциалРавновесный электродный потенциалУравнение НернстаЭлектрохимическая ячейкаГальваническая ячейка
Литература
- Zumdahl, Steven S., Zumdahl, Susan A (2000) Chemistry(5th ed.), Houghton Mifflin Company. ISBN 0-395-98583-8Atkins, Peter, Jones, Loretta (2005) Chemical Principles(3rd ed.), W.H. Freeman and Company. ISBN 0-7167-5701-XZu, Y, Couture, MM, Kolling, DR, Crofts, AR, Eltis, LD, Fee, JA, Hirst, J (2003) Biochemistry, 42, 12400-12408Shuttleworth, SJ (1820) Electrochemistry(50th ed.), Harper Collins.