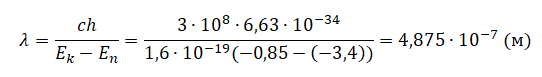Что такое постулаты бора
Постулаты Бора.
Основой квантовой теории атома Бора являются 2 постулата.
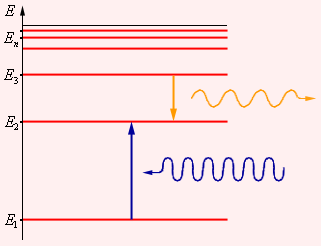
Первый постулат Бора: атомная система может находиться только в особых стационарных, либо квантовых, состояниях, каждому из которых соответствует некоторая энергия En; в стационарном состоянии атом не излучает энергию.
Этот постулат является противоречием классической механике, согласно которой энергия движущихся электронов может быть любой. Также он является противоречием и электродинамике Максвелла, т.к. предполагает возможность ускоренного движения электронов не излучая электромагнитных волн.
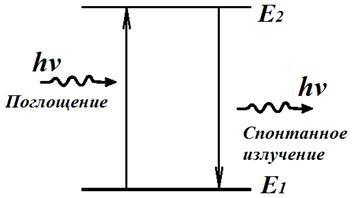
Второй постулат Бора: излучение света случается в процессе перехода атома из стационарного состояния с большей энергией Ek в стационарное состояние с меньшей энергией En. Энергия излученного фотона равняется разности энергий стационарных состояний:

Таким образом можно вычислить частоту излучения:

Поглощая свет атом переходит из стационарного состояния с меньшим количеством энергии в стационарное состояние с большим количеством энергии.
Модель атома водорода Бора.
Чтоб построить модель самой простой системы — атома водорода — Бор также постулировал правило определения стационарных значений энергии атома (уровней энергии) — правило квантования.
Стационарным состояниям атома идентичны разрешенные дискретные значения энергии электрона, такие, что при движении по стационарным круговым орбитам электрон может иметь дискретные значения момента количества движения:
r — является радиусом орбиты,
n является главным квантовым числом (номер орбиты в спектре атома водорода).
Правило квантования орбит и постулаты Бора дали ему и последующим ученым объяснить замеченные закономерности в оптическом спектре излучения атома водорода и в рентгеновских спектрах, и дать физическое толкование Периодического закона элементов Менделеева.
Поглощение света — является процессом, который обратен излучению, при котором атом с нижних энергетических уровней переходит на верхние уровни. В процессе чего он поглощает излучение таких же частот, которые излучает при переходе с верхних энергетических уровней на нижние. На рисунке б стрелками изображены переходы атома из одних состояний в другие с поглощением света.
Постулаты Бора
теория по физике 🧲 квантовая физика
Планетарная модель атома, предложенная Резерфордом, – это попытка применения классических представлений о движении тел к явлениям атомных масштабов. Она оказалась несостоятельной. Классический атом неустойчив. Электроны, движущиеся по орбите с ускорением, должны неизбежно упасть на
Следующий шаг в развитии представлений об устройстве атома в 1913 году сделал выдающийся датский физик Н. Бор. Проанализировав всю совокупность опытных фактов, Бор пришел к выводу, что при описании поведения атомных систем следует отказаться от многих представлений классической физики. Он сформулировал постулаты, которым должна удовлетворять новая теория о строении атомов.
Квантовые постулаты Бора – предположения (утверждения), сделанные Н. Бором для того, чтобы модель строения атома Резерфорда соответствовала реальному поведению атомов водорода.
Первый постулат Бора
Первый постулат Бора также носит название постулата стационарных состояний:
Атомная система может находиться только в стационарных, или квантовых, состояниях, каждому из которых соответствует определенная энергия En. В стационарном состоянии атом не излучает электромагнитные волны.
Этот постулат находится в явном противоречии с классической механикой, согласно которой энергия движущегося электрона может быть любой. Он находится в противоречии и с электродинамикой, так как допускает возможность ускоренного движения электронов без излучения электромагнитных волн.
Согласно первому постулату Бора, атом характеризуется системой энергетических уровней, каждый из которых соответствует определенному стационарному состоянию (см. рисунок ниже). Механическая энергия электрона, движущегося по замкнутой траектории вокруг положительно заряженного
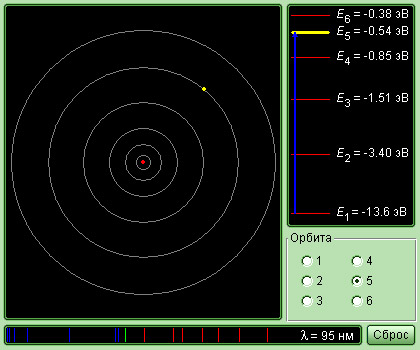
Внимание! В квантовой физике энергию принято измерять не в Джоулях, а в электрон-вольтах, обозначаемых «эВ». 1 эВ равен энергии, приобретаемой электроном при прохождении разницы потенциалов 1 В. 1 эВ = 1,6∙10 –19 Дж.
Отсюда можно выразить частоту излучения:
Частоту найдем по формуле:
Следовательно, длина волны равна:
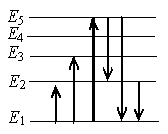
а) с уровня 1 на уровень 5
б) с уровня 5 на уровень 2
в) с уровня 5 на уровень 1
г) с уровня 2 на уровень 1
Алгоритм решения
Решение
Излучение света происходит при переходе атома из стационарного состояния с большей энергией Ek в стационарное состояние с меньшей энергией En. Энергия излученного фотона равна разности энергий стационарных состояний.
Причем чем на более высоком уровне находится электрон, тем с более высокой энергией фотон он испускает при переходе на 1 уровень. Поэтому на рисунке нам подходит переход с уровня 5 на уровень 1.
pазбирался: Алиса Никитина | обсудить разбор | оценить
В сосуде находится разреженный атомарный водород. Атом водорода в основном состоянии (Е1 = – 13,6 эВ) поглощает фотон частотой 3,7⋅10 15 Гц. С какой скоростью υ движется вдали от ядра электрон, вылетевший из атома в результате ионизации? Энергией теплового движения атомов водорода пренебречь.
Квантовые постулаты Бора
В свое время планетарная модель атома была предложена Резерфордом. Фактически, это была неудачная попытка перенести классические представления о движении тел в область явлений атомных масштабов. Планетарная модель оказалась несостоятельной, так как атом неустойчив по причине ускорения, с которым электроны якобы движутся по орбите. В таких условиях электроны должны достаточно быстро растрачивать свою энергию на электромагнитное излучение и падать на ядро.
На смену планетарной теории пришли постулаты Бора. В 1913 году выдающийся датский физик Нильс Бор на основе своих наблюдений и фактов, полученных опытным путем, установил, что большая часть представлений о строении атома не соответствовала действительности. Он же стал основоположником новой теории о строении атома.
Рассмотрим два постулата Бора подробнее.
Первый постулат Бора
В соответствии с классической механикой энергия электрона, движущегося по орбите вокруг ядра, может быть любой. В этом плане первый постулат Бора находится в явном противоречии и с планетарной моделью атома, и с классической механикой.
Второй постулат Бора
Энергия кванта при этом определяется как разность энергий двух квантовых состояний:
где h – постоянная Планка.
Квантовые постулаты Бора
Планетарная модель атома, предложенная Резерфордом, – это попытка применения классических представлений о движении тел к явлениям атомных масштабов. Она оказалась несостоятельной. Классический атом неустойчив. Электроны, движущиеся по орбите с ускорением, должны неизбежно упасть на ядро, растратив всю энергию на излучение электромагнитных волн (рис. 6.2.1).
Неустойчивость классического атома
Следующий шаг в развитии представлений об устройстве атома в 1913 году сделал выдающийся датский физик Н. Бор. Проанализировав всю совокупность опытных фактов, Бор пришел к выводу, что при описании поведения атомных систем следует отказаться от многих представлений классической физики. Он сформулировал постулаты, которым должна удовлетворять новая теория о строении атомов.
Первый постулат Бора (постулат стационарных состояний) гласит: атомная система может находится только в особых стационарных или квантовых состояниях, каждому из которых соответствует определенная энергия En. В стационарных состояниях атом не излучает.
Этот постулат находится в явном противоречии с классической механикой, согласно которой энергия движущегося электрона может быть любой. Он находится в противоречии и с электродинамикой, так как допускает возможность ускоренного движения электронов без излучения электромагнитных волн. Согласно первому постулату Бора, атом характеризуется системой энергетических уровней, каждый из которых соответствует определенному стационарному состоянию (рис. 6.2.2). Механическая энергия электрона, движущегося по замкнутой траектории вокруг положительно заряженного ядра, отрицательна. Поэтому всем стационарным состояниям соответствуют значения энергии En Опубликовано в разделах: Физика атомов и ядра
Квантовые постулаты Бора: формулы
Постулаты Бора: описание теории строения атомов
Изначально предположение о строении атома носило планетарный характер лишь по той причине, что это было классическое представление о закономерностях движения тел. Предложенная Эрнестом Резерфордом планетарная модель оказалась нежизнеспособной, и на смену ей пришли постулаты Бора.
1913 год был ознаменован работой датского физика Нильса Бора. Основываясь на наблюдениях и фактах, Бор заключил, что предыдущая модель строения атома была далека от действительности. Ученый стал основоположником новой теории строения атома, состоящей из трех постулатов.
Постулаты Бор применил для того, чтобы сформулировать теорию о строении атома водорода. Бор смог выделить несколько тезисов касательно атомов водорода, в том числе вычислил возможные радиусы орбит электрона и размеры атома, энергии стационарных состояний атома и частоты излучаемых и поглощаемых электромагнитных волн.
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут.
Однако постулаты Бора не были непогрешимыми: они с абсолютной точностью объясняли процессы водородных элементов, но были несостоятельны применительно к другим.
Постулат стационарных состояний (1 Постулат)
Первый постулат Бора, носящий название постулата стационарных состояний, гласит: атомная система может находиться только в особых стационарных либо квантовых состояниях, каждому из которых соответствует некоторая энергия En. Когда атом находится в стационарном состоянии, электромагнитные волны атома отсутствуют.
Стоит отметить, что этот постулат противоречит не только планетарной модели атома, но и классической механике, согласно которой энергия движущегося по орбите электрона может быть любой. Постулат также идет вразрез с теорией Максвелла об электродинамике в том ключе, что предполагает возможность ускоренного движения электронов при отсутствии излучения электромагнитных волн.
Правило квантования (3 Постулат)
Формулировка третьего постулата Бора следующая: момент импульса электрона, если атом находится в стационарном состоянии и вращается по круговым орбитам, имеет исключительно дискретные квантовые значения, кратные постоянной Планка.
Правило квантования Бора записывается следующим образом:
В данной формуле me — это масса электрона, v — его скорость, r — радиус орбиты, h — постоянная Планка, n — главное квантовое число.
Бор смог определить возможные радиусы орбит и значения энергии стационарных состояний, используя законы механики Ньютона и правило квантования. Величина атома обуславливается минимальным радиусом орбиты, она равна 0,53 ⋅ 10 -10 м. Значения энергий стационарных состояний в электронвольтах размещены на вертикальной оси. 1 эВ — энергия, которая приобретается электроном при расхождении разности потенциалов 1 В.
Эксперименты и подтверждение постулатов
В 1914 году немецкие ученые Густав Герц и Джеймс Франк стали авторами экспериментального исследования, подтверждающего существование дискретных энергетических уровней атома. Впоследствии в 1925 году за эту работу они получили Нобелевскую премию. Опыт Франкаи Герца считается классическим случаем подтверждения квантовой теории.
Перед началом исследования учеными был выдвинут тезис, что электроны, которые проходят через пары ртути, передают энергию дискретно и что это сопровождается эмиссией ультрафиолетовой спектральной линии ртути (λ = 254 нм). В последующем эксперименте немецкие ученые использовали лампу, поместив туда каплю ртути, и измеряли критический потенциал ее атомов.
Ход эксперимента
Чтобы определить критические потенциалы возбуждения атомов, Франком и Герцем был использован метод задерживающего потенциала. Чтобы давление насыщенных паров ртути в лампе достигло нужного уровня, прибор поместили внутрь электрической печи и нагрели до необходимой температуры.
Трубка из стекла, откуда откачали воздух, имела катод накал, сетку и электрод. Электроны, вылетая из катода, ускорялись напряжением U в направлении сетки. Они проходили через нее и достигали электрода, внося вклад в ток мишени I, в том случае, когда их кинетическая энергия была достаточной преодоления замедляющего напряжения UСA между сеткой и мишенью.
Имея малую величину, ток в анодной цепи мог быть зарегистрирован только с помощью системы, состоящий из усилителя постоянного тока и вольтметра. Усилитель поднимал величину падения напряжения, а вольтромер эту величину фиксировал. Падение напряжение измерялось в момент прохождения анодного тока по входному сопротивлению усилителя.
Выводы
В соответствии с теорией Бора любой атом ртути может получить лишь вполне определенную энергию при переходе в одно из возбужденных состояний. В связи с этим при наличии в атомах стационарных состояний электроны при столкновении с атомами ртути должны терять энергию дискретно, определенными порциями, равными разности энергии соответствующих стационарных состояний атома.
Из эксперимента можно заключить, что в случае увеличения ускоряющего потенциала до 4,86 В, анодный ток возрастает монотонным образом, его значение достигает максимума (4,86 В), затем следует резкое уменьшение и вновь рост. Впоследствии максимумы можно наблюдать при 2 ⋅ 4, 86 В и 3 ⋅ 4, 86 В.
Электроны, лишившиеся своей кинетической энергии, более не смогут преодолеть тормозящий потенциал и достигнуть анода. Этим и объясняется резкое падение анодного тока при
\(e\phi\) = 4,86 эВ. Если значения энергии кратны 4,86, электроны могут испытывать с атомами ртути 2, 3 и более неупругих соударения.
Таким образом, опыт показал, что электроны передают свою энергию атомам ртути порциями. Наименьшей порцией будет 4,86 эВ. Это минимум, который может быть поглощен атомом ртути в основном энергетическом состоянии. Из этого следует, что тезис Бора о существовании в атомах стационарных состояний выдержала проверку экспериментом.
Произвести вычисление длины волны светового кванта при известном значении \(\triangle E = 4,86\) можно с помощью формулы:
\(\lambda = hc/ \triangle E \approx 255 нм.\)
Так, в опытах обнаружилась правильность теории о том, что атомы ртути, подвергающиеся бомбардировке электронами с энергией 4,86 эВ, являются источником ультрафиолетового излучения с \(\lambda = 255\ нм.\)
Примеры задач
Вам нужно определить скорость и ускорение электрона на первой боровской орбите, радиус которой можно рассчитать с помощью формулы
Где me и \(e\) — масса и заряд электрона, а \(k_ <э>= 9 ⋅ 10 \frac
\(r_ <1>= \frac<ħ^<2>>
\(r_ <1>= \frac<ħ^<2>>
\(m_ = 9,1 ⋅ 10^<-31>кг \) — масса электрона;
\(e = 1,6 ⋅ 10^ <-19>Кл \) — заряд электрона.
В формуле радиуса первой боровской орбиты: \(ħ = 1,0546 ⋅ 10^<-34>\) Дж ⋅ с — квантовая постоянная Планка. Радиус окружности, по которому происходит движение, равен:
Эта сила в том числе является центростремительной, чему соответствует формула
В таком случае ускорение можно определить по формуле
В задаче дано: \( e = 1,6 ⋅ 10^ <-19>Кл\) – заряд электрона;
\(r_ <1>= 0,53 ⋅ 10^ <-10>м\) — радиус орбиты;
\(v \approx 2,2 ⋅ 10^ <6>\frac<м><с>\) — скорость электрона (мы нашли ее в первой задаче).
Если сила тока равна
То в данной задаче \( <\triangle q>= e, <\triangle t>= T\) (период обращения электрона). Период обращения электрона равен:
Таким образом, сила тока, возникающего при движении электрона по орбите радиусом r1 со скоростью v, равна:
Если подставить в эту формулу известные данные, то получим решение: