Что такое плутоний и для чего он нужен
О плутонии без мифов
Заявляют, что плутоний является «самым токсичным веществом на земле» и настолько опасен, что «даже пятнышко от него может убить». Мы подтверждаем, что плутоний токсичен, и поэтому работы с ним могут проводить только высококвалифицированные специалисты. Токсические свойства плутония проявляются как следствие альфа-радиоактивности. Плутоний по степени радиационной опасности относится к группе А (радионуклиды с минимально значимой активностью 10 3 Бк), к которой принадлежат такие радионуклиды, как 229 Th, 232 U, 231 Ra, U природный, Th природный. Альфа частицы представляют серьезную опасность только в том случае, если их источник находится в теле (т.е. плутоний должен быть принят внутрь). Хотя плутоний излучает еще и гамма-лучи и нейтроны, которые могут проникать в тело снаружи, уровень их слишком мал, чтобы причинить сильный вред.
Нельзя провести прямое сравнение плутония с токсичными веществами, так как эффект вдыхания плутония увеличил бы вероятность возникновения рака в течение нескольких лет, в то время как большинство других токсинов приводят к немедленной смерти. Самые наглядные сопоставления токсинов, например, грамм против грамма, доказывают, что рицин, некоторые яды змей и цианистый калий значительно более токсичны, чем плутоний. Стоит учесть и то, что все чистящие и моющие вещества, которые есть на любой кухне, тоже токсичны, если мы станем поглощать их внутрь. Токсичны и некоторые из продуктов, которые производятся из зерновых культур.
Дополнительная информация:
Если мы рассмотрим риск здоровью человека при облучении плутонием, то надо отметить, что даже прием его внутрь не представляет большой опасности, потому что плутоний, проходя через желудочно-кишечный тракт, плохо поглощается и выводится из организма прежде, чем может нанести вред. Плутоний несложно хранить и достаточно просто изолировать от окружающей среды из-за слабой проникающей способности испускаемой им радиации. Однако, очевидный риск здоровью существует при вдыхании плутония. Хотя, очень трудно создать воздушную дисперсию тяжелого металла, подобного плутонию, некоторые химические соединения, включающие нерастворимую окись плутония размером частиц меньше 10 микрон, представляют потенциальную опасность.
Плутоний. Описание плутония. Свойства плутония
Описание плутония
Плутоний (Plutonium) представляет собой тяжелый химический элемент серебристого цвета, радиоактивный металл с атомным числом 94, который в периодической таблице Менделеева обозначается символом Pu.
Данный электроотрицательный активный химический элемент относится к группе актиноидов с атомной массой 244,0642, и, как и нептуний, который получил свое название в честь одноименной планеты, своим названием этот химический обязан планете Плутон, поскольку предшественниками радиоактивного элемента в периодической таблице химических элементов Менделеева является уран и нептуний, которые также были названы в честь далеких космических планет нашей Галактики.
Происхождение плутония
Элемент плутоний впервые был открыт в 1940 году в Калифорнийском Университете группой ученых-радиологов и научных исследователей Г. Сиборгом, Э. Макмилланом, Кеннеди, А. Уолхом при бомбардировании урановой мишени из циклотрона дейтронами — ядрами тяжелого водорода.
В декабре того же года учеными был открыт изотоп плутония – Pu-238, период полураспада которого составляет более 90 лет, при этом было установлено, что под воздействием сложнейших ядерных химических реакций изначально получается изотоп нептуний-238, после чего уже происходит образование изотопа плутония-238.
В начале 1941 года ученые открыли плутоний 239 с периодом распада в 25 000 лет. Изотопы плутония могут иметь различное содержание нейтронов в ядре.
Чистое соединение элемента смогли получить только в конце 1942. Каждый раз, когда ученые-радиологи открывали новый изотоп, они всегда измеряли время периодов полураспада изотопов.
В настоящий момент изотопы плутония, которых всего насчитывается 15, отличаются по времени продолжительности периода полураспада. Именно с этим элементом связаны большие надежды, перспективы, но и в тот же момент, серьезные опасения человечества.
Плутоний имеет значительно большую активность, чем, к примеру, уран и принадлежит к самым дорогостоящим технически важным и значимым веществам химической природы.
Производство, добыча плутония считается затратной, а стоимость одного грамма металла в наше время уверенно держится на отметке в 4000 американских долларов.
Как получают плутоний? Производство плутония
Производство химического элемента происходит в атомных реакторах, внутри которых уран расщепляется под воздействием сложных химическо-технологических взаимосвязанных процессов.
Уран и плутоний являются главными, основными компонентами при производстве атомного (ядерного) горючего.
При необходимости получения большого количества радиоактивного элемента применяют метод облучения трансурановых элементов, которые можно получить из отработанного атомного топлива и облучения урана. Протекание сложных химических реакций позволяет отделить металл от урана.
Чтобы получить изотопы, а именно плутоний-238 и оружейный плутоний-239, которые представляют собой промежуточные продукты распада, используют облучение нептуния-237 нейтронами.
Ничтожно малую часть плутония-244, который является самым «долгоживущим» вариантом изотопа, по причине его длительного периода полураспада, обнаружили при исследованиях в цериевой руде, которая, скорее всего, сохранилась с момента формирования нашей Планеты Земля. В естественном виде в природе данный радиоактивный элемент не встречается.
Основные физические свойства и характеристики плутония
Плутоний — довольно тяжелый радиоактивный химический элемент серебристого цвета, который блестит только в очищенном виде. Атомная масса металла плутоний равна 244 а. е. м.
По причине своей высокой радиоактивности данный элемент теплый на ощупь, может разогреться до температуры, которая превышает температурный показатель при кипении воды.
Плутоний, под воздействием атомов кислорода быстро темнеет и покрывается радужной тонкой пленочкой изначально светло-желтого, а затем насыщенного красно — коричневого или бурого оттенка.
При сильном окислении происходит образование на поверхности элемента изумрудно — желтого порошка PuO2. Данный вид химического металла подвержен сильным процессам окисления и воздействия коррозии даже при незначительном уровне влажности.
Соли металла быстро нейтрализуются в средах с нейтральной реакцией, щелочных растворах, при этом образовывая нерастворимый гидрооксид плутония.
Температура, при которой происходит плавление плутония равна 641 градусам Цельсия, температура кипения – 3230 градусов.
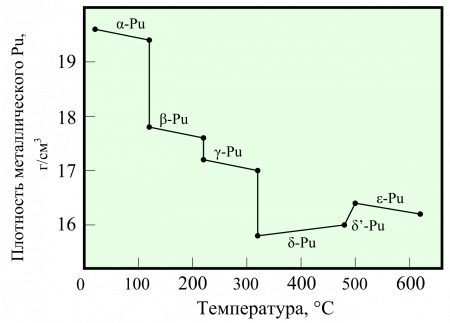
Под воздействием высоких температурных режимов происходят неестественные изменения плотности металла. В твердом виде плутоний обладает различными фазами, имеет шесть кристаллических структур.
При расплавлении происходит сильное сжатие элемента, поэтому металл может держаться на поверхности воды и других неагрессивных жидких сред.
Несмотря на то, что данный радиоактивный элемент принадлежит к группе химических металлов, элемент довольно летуч, и при нахождении в закрытом пространстве за непродолжительный период времени увеличивается и возрастает в несколько раз его концентрация в воздухе.
К основным физическим свойствам металла можно отнести: невысокую степень, уровень теплопроводности из всех существующих и известных химических элементов, низкий уровень электропроводности, в жидком состоянии плутоний относится к одним из наиболее вязких металлов.
Стоит отметить, что любые соединения плутония относятся к токсичным, ядовитым и представляют серьезную опасность облучения для человеческого организма, которое происходит по причине активного альфа-излучения, поэтому все работы нужно выполнять предельно внимательно и только в специальных костюмах с химической защитой.
Больше о свойствах, теориях происхождения уникального металла можно прочитать в книге Обручева «Плутония». Автор В.А. Обручев приглашает читателей окунуться в удивительный и уникальный мир фантастической страны Плутония, которая расположена в глубине недр Земли.
Применение плутония
Промышленный химический элемент принято классифицировать на оружейный и реакторный («энергетический») плутоний.
Так, для производства ядерного вооружения из всех существующих изотопов допустимо применять только плутоний 239, в котором не должно быть более 4.5% плутония 240, так как он подвержен самопроизвольному делению, что значительно затрудняет изготовление боевых снарядов.
Плутоний-238 находит применение для функционирования малогабаритных радиоизотопных источников электрической энергии, к примеру, в качестве источника энергии для космической техники.
Несколько десятилетий тому назад плутоний применяли в медицине в кардиостимуляторах (приборы для поддержания сердечного ритма).
Если провести сравнение ядерного плутония с чистым металлом, изотоп обладает более высокими металлическими параметрами, не имеет фаз перехода, поэтому его широко используют в процессе получения элементов топлива.
Оксиды изотопа Плутония 242 также востребованы как источник питания для космических летальных агрегатов, техники, в ТВЭЛах.
Оружейный плутоний – это элемент, который представлен в виде компактного металла, в котором содержится не меньше 93% изотопа Pu239.
Данный вид радиоактивного металла применяют про производстве различных видов ядерного оружения.
Получают оружейный плутоний в специализированных промышленных атомных реакторах, которые функционируют на природном или на низкообогащенном уране, в результате захвата им нейтронов.
Плутоний (элемент)
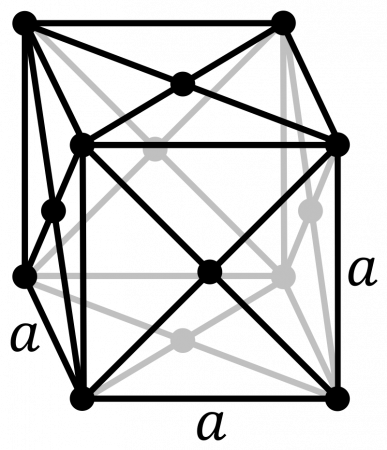
В таблице справа приведены основные свойства α-Pu — основной аллотропной модификации плутония при комнатной температуре и нормальном давлении.
Содержание
История
Изотоп плутония 238 Pu впервые искусственно получен 23.02.1941 года группой американских ученых во главе с Г. Сиборгом путем облучения ядер урана дейтронами. Примечательно, что только после искусственного получения плутоний был обнаружен в природе: в ничтожно малых количествах 239 Pu обычно содержится в урановых рудах как продукт радиоактивного превращения урана.
Нахождение в природе
В урановых рудах в результате захвата нейтронов (например, нейтронов из космического излучения) ядрами урана образуется нептуний ( 239 Np), продуктом β-распада которого и является природный плутоний-239. Однако плутоний образуется в таких микроскопических количествах (0,4—15 частей Pu на 10 12 частей U), что о его добыче из урановых руд не может быть и речи.
Происхождение названия
Физические свойства
Этот изотоп используется почти исключительно в РИТЭГ космического назначения, например, на всех аппаратах, улетавших дальше орбиты Марса.
Эти три изотопа серьёзного промышленного значения не имеют, но получаются, как побочные продукты, при получении энергии в ядерных реакторах на уране, путём последовательного захвата нескольких нейтронов ядрами урана-238. Изотоп 242 по ядерным свойствам наиболее похож на уран-238. Америций-241, получавшийся при распаде изотопа 241, использовался в детекторах дыма.
Плутоний интересен тем, что от температуры затвердевания до комнатной претерпевает шесть фазовых переходов, больше, чем любой другой химический элемент. При последнем плотность увеличивается скачком на 11%, в результате, отливки из плутония растрескиваются. Стабильной при комнатной температуре является альфа-фаза, характеристики которой и приведены в таблице. Для применения более удобной является дельта-фаза, имеющая меньшую плотность, и кубическую объёмно-центрированную решётку. Плутоний в дельта-фазе весьма пластичен, в то время, как альфа-фаза хрупкая. Для стабилизации плутония в дельта-фазе применяется легирование трёхвалентными металлами (в первых ядерных зарядах использовался галлий).
Применение
Биологическая роль
Плутоний высокотоксичен; ПДК для 239 Pu в открытых водоемах и воздухе рабочих помещений составляет соответственно 81,4 и 3,3*10 −5 Бк/л. Большинство изотопов плутония обладают высокой величиной плотности ионизации и малой длиной пробега частиц, поэтому его токсичность обусловлена не столько его химическими свойствами (вероятно, в этом отношении плутоний токсичен не более, чем другие тяжелые металлы), сколько ионизирующим действием на окружающие ткани организма. Плутоний относится к группе элементов с особо высокой радиотоксичностью. В организме плутоний производит большие необратимые изменения в скелете, печени, селезенке, почках, вызывает рак. Максимально допустимое содержание плутония в организме не должно превышать десятых долей микрограмма.
Плутоний
(молярная масса)
Pu 4+ : 86 пм,
Pu 5+ : 74 пм,
Pu 6+ : 71 пм
Pu←Pu 3+ −2,0 В,
Pu←Pu 2+ −1,2 В
(первый электрон)
| P (Па) | 1 | 10 | 100 | 1000 | 10 000 | 100 000 |
| при T (К) | 1756 | 1953 | 2198 | 2511 | 2926 | 3499 |
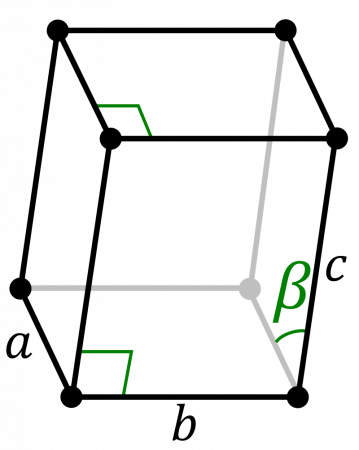
b=4,822 Å
c=10,963 Å
β=101,8°
Плутоний (обозначается символом Pu; атомное число 94) — тяжёлый хрупкий высокотоксичный радиоактивный металл серебристо-белого цвета. В периодической таблице располагается в семействе актиноидов.
Для элемента характерны существенно отличающиеся от остальных элементов структурные и физико-химические свойства. Плутоний имеет семь аллотропных модификаций при определённых температурах и диапазонах давления: α, β, γ, δ, δ’, ε и ζ. Может принимать степени окисления от +2 до +7, основными считаются +4, +5, +6. Плотность варьируется от 19,8 (α-Pu) до 15,9 г/см³ (δ-Pu).
Стабильных изотопов не имеет. В природе в следовых количествах присутствуют самый долгоживущий изотоп из всех трансурановых элементов 244 Pu, его дочерний нуклид 240 Pu, а также 239 Pu и 238 Pu. В окружающей среде находится преимущественно в виде диоксида (PuO2), который в воде ещё менее растворим, чем песок (кварц). Нахождение элемента в природе настолько мало, что его добыча нецелесообразна.
Второй после нептуния (который был ошибочно «получен» в 1934 году группой Энрико Ферми; его первый изотоп 239 Np синтезирован и идентифицирован в мае 1940 года Эдвином Макмилланом и Филипом Абельсоном) искусственный элемент, полученный в микрограммовых количествах в конце 1940 г. в виде изотопа 238 Pu.
Первый искусственный химический элемент, производство которого началось в промышленных масштабах (в СССР с 1946 года в Челябинске-40 было создано несколько предприятий по производству оружейного урана и плутония). США, а затем и СССР были первыми странами, освоившими его получение. Для получения плутония применяется как обогащённый, так и природный уран. Общее количество плутония, хранящегося в мире во всевозможных формах, оценивалось в 2003 г. в 1239 т.
Сообщалось о закрытии последнего в мире ядерного реактора по производству оружейного плутония АДЭ-2, который проработал 46 лет и был остановлен в апреле 2010 г. в России, однако уже через месяц в Японии был запущен реактор «Мондзю» (разрешение на перезапуск было получено только в феврале 2010 года, а сам реактор был фактически запущен в тестовом режиме 6 мая; такой режим работы предполагался вплоть до 2013 года, однако 26 августа 2010 года на реакторе произошла новая авария — в реактор упала трёхтонная металлическая труба, повредившая сам реактор; общая остановка реакторов на японских АЭС после аварии на Фукусима-1 привела к тому, что реактор больше не запускали, в конце 2016 года японское правительство приняло решение об утилизации реактора Мондзю, планируется выгрузка топлива в 2022 и окончание работ по демонтажу в 2047).
В таблице справа приведены основные свойства для α-плутония. Данная аллотропическая модификация является основной для плутония при комнатной температуре и нормальном давлении.
Содержание
История
Открытие
Энрико Ферми вместе со своими сотрудниками в Университете Рима сообщил, что они обнаружили химический элемент с порядковым номером 94, в 1934 году. Ферми назвал этот элемент гесперием, сделав таким образом предположение о существовании трансурановых элементов и став их теоретическим первооткрывателем. Он придерживался этой позиции и в своей Нобелевской лекции в 1938 году, однако, узнав об открытии Отто Фришем и Фрицем Штрассманом деления ядра, был вынужден сделать в печатной версии, вышедшей в Стокгольме в 1939 году, примечание, указывающее на необходимость пересмотра «всей проблемы трансурановых элементов». Работа немецких учёных показала, что активность, обнаруженная Ферми в его экспериментах, была обусловлена именно делением, а не открытием трансурановых элементов, как он ранее полагал.
Открытие плутония группой сотрудников Калифорнийского университета в Беркли под руководством Г. Т. Сиборга было совершено с помощью 60-дюймового циклотрона. Первая бомбардировка октаоксида триурана-238 ( 238 U3O8) дейтронами, разогнанными в циклотроне до 14—22 МэВ и проходящими через алюминиевую фольгу толщиной 0,002 дюйма (50,8 мкм), была произведена 14 декабря 1940 года. Сравнивая образцы, полученные и выдержанные в течение 2,3 суток, с выделенной фракцией чистого нептуния, учёные обнаружили существенную разницу в их альфа-активностях и предположили, что её рост через 2 суток обусловлен влиянием нового элемента, являющегося дочерним по отношению к нептунию. Дальнейшие физические и химические исследования продолжались 2 месяца. В ночь с 23 на 24 февраля 1941 года был проведён решающий эксперимент по окислению предполагаемого элемента с помощью пероксиддисульфат-ионов и ионов серебра в качестве катализатора, который показал, что нептуний-238 спустя два дня претерпевает бета-минус-распад и образует химический элемент под номером 94 в следующей реакции:
238
92 U (d,2n) → 238
93 Np → (β − ) 238
94 Pu
Таким образом, существование нового химического элемента было подтверждено экспериментально Г. Т. Сиборгом, Э. М. Макмилланом, Дж. В. Кеннеди ( англ. ) и А. К. Валем благодаря изучению его первых химических свойств — возможностью обладать, по крайней мере, двумя степенями окисления.
Немного позднее было установлено, что этот изотоп является неделящимся (пороговым), а следовательно, неинтересным для дальнейших исследований в военных целях, так как пороговые ядра не могут служить основой цепной реакции деления. Поняв это, физики-ядерщики США направили свои усилия на получение делящегося изотопа-239 (который по расчётам должен был быть более мощным источником атомной энергии, чем уран-235). В марте 1941 года 1,2 кг чистейшей соли урана, замурованной в большой парафиновый блок, подвергли в циклотроне бомбардировке нейтронами. На протяжении двух суток длилась бомбардировка урановых ядер, в результате чего были получены приблизительно 0,5 мкг плутония-239. Появление нового элемента, как и было предсказано теорией, сопровождалось потоком альфа-частиц.
28 марта 1941 года проведённые эксперименты показали, что 239 Pu способен делиться под действием медленных нейтронов, с сечением, весьма значительно превышающим сечение для 235 U, причём нейтроны, полученные в процессе деления, пригодны для получения следующих актов ядерного деления, то есть позволяют рассчитывать на осуществление цепной ядерной реакции. С этого момента были начаты опыты по созданию плутониевой ядерной бомбы и строительства реакторов для его наработки. Первое чистое соединение элемента было получено в 1942 году, а первые весовые количества металлического плутония — в 1943 году.
В работе, отправленной на публикацию в журнал Physical Review в марте 1941 г., был описан метод получения и изучения элемента. Однако публикация этой работы была остановлена после того, как были получены данные, что новый элемент может быть использован в ядерной бомбе. Публикация работы произошла спустя год после Второй мировой войны из соображений безопасности и с некоторыми корректировками.
В Третьем рейхе исследователи атома также не оставались бездеятельными. В лаборатории Манфреда фон Ардена были разработаны методы получения 94-го элемента. В августе 1941 года физик Фриц Хоутерманс закончил свой секретный доклад «К вопросу о развязывании цепных ядерных реакций». В нём он указывал на теоретическую возможность изготовления в урановом «котле» нового взрывчатого вещества из природного урана.
Происхождение названия
В 1930 году была открыта новая планета, о существовании которой давно говорил Персиваль Ловелл — астроном, математик и автор фантастических очерков о жизни на Марсе. На основе многолетних наблюдений за движениями Урана и Нептуна он пришёл к заключению, что за Нептуном в Солнечной системе должна быть ещё одна, девятая планета, располагающаяся от Солнца в сорок раз дальше, чем Земля. Элементы орбиты новой планеты были им рассчитаны в 1915 году. Плутон был обнаружен на фотографических снимках, полученных 21, 23 и 29 января 1930 г. астрономом Клайдом Томбо в обсерватории Лоуэлла во Флагстаффе (США). Планета была открыта 18 февраля 1930 года. Название планете было дано одиннадцатилетней школьницей из Оксфорда Венецией Бёрни. В греческой мифологии Аид (в римской Плутон) является богом царства мёртвых.
Первое печатное упоминание термина плутоний датируется 21 марта 1942 года. Название 94-му химическому элементу было предложено Артуром Валем и Гленном Сиборгом. В 1948 году Эдвин Макмиллан предложил назвать 93-й химический элемент нептунием, так как планета Нептун — первая за Ураном. По аналогии в честь второй планеты за Ураном, Плутона, был назван плутоний. Открытие плутония произошло через 10 лет после открытия карликовой планеты (примерно такой же отрезок времени понадобился на открытие Урана и на именование 92-го химического элемента).
Первоначально Сиборг предложил назвать новый элемент «плутием», однако позже решил, что название «плутоний» звучит лучше. Для обозначения элемента он в шутку привёл две буквы «Pu» — это обозначение представилось ему наиболее приемлемым в периодической таблице. Также Сиборгом были предложены некоторые другие варианты названий, например, ультимий (англ. ultimium от лат. ultimus — последний), экстремий ( extremium от лат. extremus — крайний), из-за ошибочного в то время суждения, что плутоний станет последним химическим элементом в периодической таблице. Однако элемент назвали «плутоний» в честь последней планеты Солнечной системы.
Первые исследования
После нескольких месяцев первоначальных исследований химия плутония стала считаться похожей на химию урана. Дальнейшие исследования были продолжены в секретной металлургической лаборатории Чикагского университета. Благодаря Каннингему и Вернеру 18 августа 1942 года был выделен первый микрограмм чистого соединения плутония из 90 кг уранилнитрата, облученного нейтронами на циклотроне 10 сентября 1942 года — спустя месяц, на протяжении которого учёные увеличивали количество соединения — произошло взвешивание. Этот исторический образец весил 2,77 мкг и состоял из диоксида плутония; в настоящее время хранится в Лоуренсовском зале в Беркли. К концу 1942 года было накоплено 500 мкг соли элемента. Для более подробного изучения нового элемента в США было сформировано несколько групп:
В ходе исследований было установлено, что плутоний может находиться в степенях окисления от 3 до 6, и что более низшие степени окисления, как правило, более стабильны по сравнению с нептунием. Тогда же было установлено сходство химических свойств плутония и нептуния. В 1942 году неожиданным стало открытие Стэна Томсона, входящего в группу Гленна Сиборга, которое показало, что четырёхвалентный плутоний получается в бо́льших количествах при нахождении в кислом растворе в присутствии фосфата висмута (III) (BiPO4). В дальнейшем это привело к изучению и применению висмут-фосфатного метода экстракции плутония. В ноябре 1943 г. некоторые количества фторида плутония(III) (PuF3) были подвергнуты разделению для получения чистого образца элемента в виде нескольких микрограммов мелкодисперсного порошка. Впоследствии были получены образцы, которые можно было бы рассмотреть невооружённым глазом.
В СССР первые опыты по получению 239 Pu были начаты в 1943—1944 гг. под руководством академиков И. В. Курчатова и В. Г. Хлопина. В короткий срок в СССР были выполнены обширные исследования свойств плутония. В начале 1945 года на первом в Европе циклотроне, построенном в 1937 году в Радиевом институте, был получен первый советский образец плутония путём нейтронного облучения ядер урана. В городе Озёрск с 1945 года началось строительство первого промышленного ядерного реактора по производству плутония, первый объект ПО Маяк, пуск которого был осуществлён 19 июня 1948 года.
Производство в Манхэттенском проекте
Во время Второй мировой войны целью проекта являлось создание ядерной бомбы. Проект атомной программы (англ. atomic programm ), из которой образовался Манхэттенский проект, был одобрен и одновременно создан указом Президента США 9 октября 1941 года. Свою деятельность Манхэттенский проект начал 12 августа 1942 года. Тремя его основными направлениями являлись:
Вторым реактором, который позволил получать плутоний-239, был Графитовый реактор X-10. Он был введён в эксплуатацию 4 ноября 1943 года (строительство длилось 11 месяцев) в городе Оук-Ридж, в настоящее время он располагается на территории Оук-Риджской национальной лаборатории. Этот реактор был вторым в мире после Чикагской поленницы-1 и первым реактором, который был создан в продолжении Манхэттенского проекта. Реактор был первым шагом на пути к созданию более мощных ядерных реакторов (на территории Хэнфорда, Вашингтон), то есть он был экспериментальным. Окончание его работы наступило в 1963 г.; открыт для посещения с 1980-х годов и является одним из старейших ядерных реакторов в мире.
Первым промышленным ядерным реактором по производству 239 Pu является реактор B, расположенный в США. Строительство началось с июня 1943 г. и закончилось в сентябре 1944 г. Мощность реактора составила 250 МВт (в то время как у X-10 всего 1000 кВт). В качестве теплоносителя в этом реакторе впервые применялась вода. Реактор B (вместе с реактором D и реактором F — остальными двумя) позволил получить плутоний-239, который был впервые использован в испытании Тринити. Ядерные материалы, полученные на этом реакторе, были использованы в бомбе, сброшенной на Нагасаки 9 августа 1945 г. Построенный реактор был закрыт в феврале 1968 года и расположен в пустынном районе штата Вашингтон, недалеко от города Ричланд.
В 2004 г. в результате раскопок были обнаружены захоронения на территории Хэнфордского комплекса. В числе них был найден оружейный плутоний, который находился в стеклянном сосуде. Этот образец оружейного плутония оказался самым долгоживущим и был исследован Тихоокеанской национальной лабораторией. Результаты показали, что этот образец был создан на графитовом реакторе X-10 в 1944 году.
Тринити и Толстяк
Холодная война
Большие количества плутония были произведены во время Холодной войны США и СССР. Реакторы США, находящиеся в Savannah River Site (Северная Каролина) и Хэнфорде, во время войны произвели 103 т плутония, в то время как СССР произвел 170 т оружейного плутония. На сегодня около 20 т плутония в ядерной энергетике производится как побочный продукт ядерных реакций. На 1000 т плутония, находящегося в хранилищах, приходится 200 т плутония, извлечённого из ядерных реакторов. На 2007 год СИИПМ оценил мировое количество плутония в 500 т, который примерно одинаково разделён на оружейные и энергетические нужды.
Медицинские эксперименты
Восемнадцать испытаний плутония на людях были проведены без предварительного согласия испытуемых для того, чтобы выяснить, где и как концентрируется плутоний в человеческом организме, и выработать стандарты безопасности обращения с ним. Первые места, в которых проводились эксперименты в рамках Манхэттенского проекта, были: Хэнфорд, Беркли, Лос-Аламос, Чикаго, Оук-Ридж, Рочестер.
Свойства
Физические свойства
Плутоний, как и большинство металлов, имеет яркий серебристый цвет, похожий на никель или железо, но на воздухе окисляется, меняя свой цвет сначала на бронзовый, затем на синий цвет закалённого металла и после превращается в тусклый чёрный или зелёный цвета из-за образования рыхлого окисного покрытия. Также есть сообщения об образовании жёлтого и оливкового цвета оксидной плёнки. При комнатной температуре плутоний находится в α-форме — это наиболее распространённая для плутония аллотропная модификация. Данная структура примерно такая же жёсткая, как серый чугун, если она не легирована другими металлами, которые придадут сплаву пластичность и мягкость. В отличие от большинства металлов, он не является хорошим проводником тепла и электричества.
Плутоний имеет аномально низкую для металлов температуру плавления (примерно 640 °C) и необычно высокую температуру кипения (3235 °C). Свинец является более лёгким металлом, чем плутоний примерно в два раза (разница в плотности составляет 19,86 − 11,34 ≈ 8,52 г/см³).
—
—
| Фаза | T, K | среднее значение e, мкВ/K |
| α α α | 20 100 300 | 1,75 9,8 11,5 |
| β | 400 | 9,1 |
| γ | 500 | 8,4 |
| δ | 600 | 3,0 |
| δ’ | 725 | 2,3 |
| ε | 800 | 3,5 |
Как и у остальных металлов, коррозия плутония увеличивается с увеличением влажности. Некоторые исследования утверждают, что влажный аргон может быть более корродирующим элементом, чем кислород; это связано с тем, что аргон не реагирует с плутонием, и, как следствие, плутоний начинает растрескиваться.
Как известно, электрическое сопротивление характеризует способность материала проводить электрический ток. Удельное сопротивление плутония при комнатной температуре очень велико для металла, и эта особенность будет усиливаться с понижением температуры, что для металлов не свойственно. Эта тенденция продолжается вплоть до 100 K; ниже этой отметки электрическое сопротивление будет уменьшаться. С понижением отметки до 20 K сопротивление начинает возрастать из-за радиационной активности металла, причём данное свойство будет зависеть от изотопного состава металла.
Плутоний обладает самым высоким удельным электрическим сопротивлением среди всех изученных актиноидов (на данный момент), которое составляет 150 мкОм·см (при +22 °C). Его твёрдость составляет 261 кг/мм³ (для α-Pu).
Благодаря тому, что плутоний радиоактивен, он со временем претерпевает изменения в своей кристаллической решётке. Плутоний претерпевает некое подобие отжига также благодаря самооблучению из-за повышения температуры выше 100 K.
В отличие от большинства материалов, плотность плутония увеличивается при нагревании его до температуры плавления на 2,5 %, в то время как у обычных металлов наблюдается уменьшение плотности при повышении температуры. Ближе к точке плавления жидкий плутоний имеет очень высокий показатель поверхностного натяжения и самую высокую вязкость среди других металлов. Характерной особенностью плутония является его уменьшение в объёме в диапазоне температур от 310 до 480 °C, в отличие от других металлов.
Аллотропические модификации
Плутоний имеет семь аллотропных модификаций. Шесть из них (см. рисунок выше) существуют при обычном давлении, а седьмая — только при высокой температуре и определённом диапазоне давления. Эти аллотропы, которые различаются по своим структурным характеристикам и показателями плотности, имеют очень похожие значения внутренней энергии. Это свойство делает плутоний очень чувствительным к колебаниям температуры и давления, и приводит к скачкообразному изменению своей структуры. Показатель плотности всех аллотропных модификаций плутония варьируется от 15,9 г/см³ до 19,86 г/см³. Наличие многих аллотропных модификаций у плутония делает его трудным металлом в обработке и выкатывании, так как он претерпевает фазовые переходы. Причины существования столь разных аллотропных модификаций у плутония не совсем ясны.
| Свойства кристаллических решёток плутония | ||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Фаза | Изображение | Область устойчивости, °C | Симметрия и пространственная группа | Параметры решётки, Å | Число атомов в элементарной ячейке | Рентгеновская плотность, г/см³ | Температура перехода, °C | ΔHперехода, Дж/моль | ||||||||||||||||||||
| a | b | c | β | |||||||||||||||||||||||||
| α | ||||||||||||||||||||||||||||
| Реакционная способность плутония в растворах | |
|---|---|
| Раствор | Реакционная способность |
| Вода | При комнатной температуре реагирует очень медленно, не намного быстрее при температуре кипения; образуется H2 и чёрный порошок Pu(O)H |
| NaCl (водн.) | Даёт H2 и чёрный порошок Pu(O)H |
| HNO3 | Не реагирует при любых концентрациях из-за пассивации; в присутствии 0,005 М HF кипящая концентрированная кислота сравнительно быстро растворяет плутоний |
| HCl, HBr | Очень быстро растворяется в концентрированных и умеренно разбавленных кислотах |
| HF | Реагирует очень медленно. Брикеты, полученные прессованием стружки металлического плутония, часто растворяются быстро и полностью с образованием нерастворимого PuF3 |
| 72%-ая HClO4 | Быстрое растворение |
| H2SO4 | Концентрированная кислота образует на металле защитное покрытие, которое останавливает начавшуюся медленную реакцию. Умеренно разбавленная медленно взаимодействует с металлом; образцы металла, содержащие примеси, могут полностью раствориться в 5 н. кислоте |
| 85%-ая H3PO4 | Реагирует сравнительно быстро |
| Уксусная кислота | Не взаимодействует с ледяной уксусной кислотой, даже с горячей; медленно взаимодействует с разбавленной кислотой |
| Трихлоруксусная кислота | Быстро растворяется в концентрированной кислоте; с разбавленной реагирует медленнее |
| Трифторуксусная кислота | Медленно растворяется в концентрированной кислоте; часто образуется остаток нерастворившегося оксида |
| Сульфаминовая кислота | Довольно быстро растворяется в 1,7 М кислоте, причём температура должна быть ниже 40 °C, чтобы избежать разложения кислоты. Остаётся небольшое количество потенциально пирофорного осадка; в присутствии HNO3 количество осадка больше |
При комнатной температуре свежий срез плутония имеет серебристый цвет, который затем тускнеет до серого. Благодаря тому, что поверхность металла становится пассивированной, он становится пирофорным, то есть способным к самовозгоранию, поэтому металлический плутоний, как правило, обрабатывается в инертной атмосфере аргона или азота. Расплавленный металл должен храниться в вакууме, либо в атмосфере инертного газа, чтобы избежать реакции с кислородом.
Плутоний обратимо реагирует с чистым водородом, образуя гидрид плутония при температурах 25—50 °C. Кроме того, он легко взаимодействует с кислородом, образуя монооксид и диоксид плутония, а также оксиды (но не только их, см. раздел ниже) переменного состава (бертоллиды). Оксиды расширяют плутоний на 40 % от его изначального объёма. Металлический плутоний энергично реагирует с галогеноводородами и галогенами, в соединениях с которыми обычно проявляет степень окисления +3, однако известны галогениды состава PuF4 и PuCl4. При реакции с углеродом образует его карбид (PuC), с азотом — нитрид (при 900 °C), с кремнием — силицид (PuSi2). Карбид, нитрид, диоксид плутония имеют температуру плавления больше 2000 °C и потому применяются в качестве ядерного топлива.
Тигли, используемые для хранения плутония, должны выдерживать его сильные окислительно-восстановительные свойства. Тугоплавкие металлы, такие, как тантал и вольфрам, наряду с более стабильными оксидами, боридами, карбидами, нитридами и силицидами, также могут выдержать свойства плутония. Плавка в электродуговой печи может быть использована для получения малых количеств металла без применения тиглей.
Четырёхвалентный церий применяется в качестве химического симулянта плутония (IV).
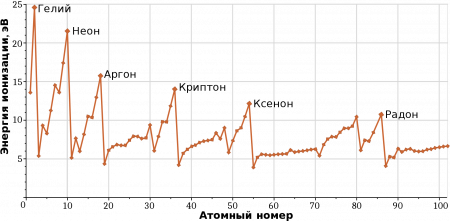
Электронная структура: 5f-электроны
Плутоний является элементом, в котором 5f-электроны расположены на границе локализованных и делокализованных электронов, поэтому он считается одним из самых комплексных и трудных элементов для изучения.
Аномальное поведение плутония обусловлено его электронной структурой. Энергетическая разница между 6d и 5f-электронами очень мала. Размеров 5f-оболочки вполне достаточно для того, чтобы они формировали атомную решётку между собой; это происходит на самой границе между локализованными и соединёнными между собой электронами. Близость электронных уровней приводит к формированию низкоэнергетической электронной конфигурации, с примерно одинаковыми уровнями энергии. Это приводит к формированию 5f n 7s 2 и 5f n−1 7s 2 6d 1 электронных оболочек, что приводит к сложности его химических свойств. 5f-электроны участвуют в формировании ковалентных связей и комплексных соединений у плутония.
- Что такое хорошо и что такое плохо маяковский слушать аудиокнигу
- Окрасились белые кроссовки после стирки что делать