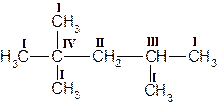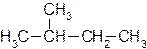Что такое первичный атом углерода
Приложение 1. Первичные, вторичные, третичные и четвертичные атомы углерода. Нормальная и разветвленная углеродная цепь.
В молекулах гомологов метана принято различать первичные, вторичные, третичные и четвертичные атомы углерода в зависимости от числа связей, направленных данным атомом на связь с другими атомами углерода. Первичным называется атом углерода, связанный непосредственно с одним атомом углерода (три оставшиеся валентности направлены на связь с атомами водорода); вторичным – с двумя атомами углерода. Третичный атом углерода связан непосредственно с тремя, а четвертичный – с четырьмя атомами углерода (рис. 1).
Рисунок 1. Структурная формула молекулы 2,2,4-триметилпентана. Первичные, вторичные, третичные и четвертичные атомы углерода обозначены соответственно цифрами I, II, III, IV.
Углеродную цепь относят к нормальной (неразветвленной), если она содержит только первичные и вторичные атомы углерода, например:
Соответствующий углеводород называют алканом нормального строения или просто нормальным алканом.
Если же в углеродной цепи содержатся третичные или четвертичные атомы углерода, то ее называют разветвленной. Алкан с такой цепью называют разветвленным, например:
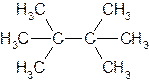
Первичный углерод: характеристики, виды и примеры
Содержание:
В первичный углерод Это соединение, которое в любом соединении, независимо от его молекулярного окружения, образует связь по крайней мере с одним другим атомом углерода. Эта связь может быть одинарной, двойной (=) или тройной (≡), если только два атома углерода связаны и находятся в соседних положениях (логически).
Водороды, присутствующие на этом углероде, называются первичными атомами водорода. Однако химические характеристики первичных, вторичных и третичных атомов водорода мало различаются и преимущественно зависят от молекулярной среды углерода. По этой причине первичный углерод (1 °) обычно считается более важным, чем его атомы водорода.
А как выглядит первичный углерод? Как уже упоминалось, ответ зависит от вашей молекулярной или химической среды. Например, на изображении выше первичные атомы углерода, заключенные в красные кружки, показаны в структуре гипотетической (хотя, вероятно, реальной) молекулы.
Характеристики первичного углерода
Расположение и ссылки
Выше были показаны шесть первичных атомов углерода без каких-либо комментариев, кроме их местоположения и того, какие другие атомы или группы их сопровождают. Они могут быть в любом месте конструкции, и где бы они ни находились, они отмечают «конец дороги»; то есть там, где заканчивается часть скелета. Вот почему их иногда называют терминальными атомами углерода.
Следовательно, все они характеризуются наличием связи C-C, которая также может быть двойной (C = CH2) или тройной (C≡CH). Это остается верным, даже если к этим атомам углерода присоединены другие атомы или группы; точно так же, как остальные три оставшихся 1 ° углерода на изображении.
Низкое стерическое препятствие
Это потому, что они практически находятся в «вакууме». Следовательно, они обычно представляют собой низкие стерические препятствия по сравнению с другими типами углерода (2-й, 3-й и 4-й).
Однако есть исключения: продукт молекулярной структуры со слишком большим количеством заместителей, высокой гибкостью или склонностью к замыканию в себе.
Реактивность
Одним из следствий более низких стерических препятствий вокруг 1-го углерода является большая подверженность реакции с другими молекулами. Чем меньше атомов преграждает путь атакующей молекуле к ней, тем вероятнее будет ее реакция.
Но это верно только со стерической точки зрения. Фактически, наиболее важным фактором является электронный; то есть, какова среда, в которой находятся упомянутые атомы углерода 1 °.
Углерод, прилегающий к первичному элементу, передает часть своей электронной плотности; То же самое может произойти и в обратном направлении, в пользу определенного типа химической реакции.
Таким образом, стерический и электронный факторы объясняют, почему он обычно наиболее реактивен; хотя на самом деле не существует глобального правила реакционной способности для всех первичных углеродов.
Типы
Первичные углеродные атомы не имеют внутренней классификации. Вместо этого они классифицируются на основе групп атомов, к которым они принадлежат или к которым они связаны; Это функциональные группы. И поскольку каждая функциональная группа определяет определенный тип органического соединения, существуют разные первичные атомы углерода.
Примеры
Альдегиды и карбоновые кислоты
Эта пара тесно связана друг с другом из-за реакций окисления, которым формильная группа претерпевает, чтобы превратиться в карбоксил:
В линейных аминах
Обратите внимание, что CH3 это всегда будет первый углерод, но на этот раз CH2 справа также 1 °, поскольку он связан с одним углеродом и группой NH2.
В алкилгалогенидах
Пример, очень похожий на предыдущий, дается с алкилгалогенидами (и во многих других органических соединениях). Допустим, бромпропан:
В нем первичные атомы углерода остаются прежними.
Подводя итог, можно сказать, что атомы углерода 1 ° выходят за рамки типа органических соединений (и даже металлоорганических соединений), потому что они могут присутствовать в любом из них и идентифицируются просто потому, что они связаны с одним атомом углерода.
Ссылки
Деструктивное поведение: описание, причины и сопутствующие расстройства
Как улучшить презентацию проекта со слайдами
Характеристика атома углерода, структура, гибридизация, классификация
атом углерода Это, пожалуй, самый важный и символический из всех элементов, потому что благодаря этому возможно существование жизни. Он включает в себя не только несколько электронов или ядро с протонами и нейтронами, но и звездную пыль, которая в конечном итоге включается и образует живые существа.
Кроме того, атомы углерода находятся в земной коре, хотя их количество не сопоставимо с такими металлическими элементами, как железо, карбонаты, диоксид углерода, нефть, алмазы, углеводы и т. Д., Которые являются частью его физические и химические проявления.
Но как атом углерода? Первым неточным эскизом является тот, который наблюдается на изображении выше, характеристики которого описаны в следующем разделе..
Атомы углерода путешествуют через атмосферу, моря, недра, растения и любые виды животных. Его большое химическое разнообразие обусловлено высокой стабильностью его связей и тем, как они упорядочены в пространстве. Таким образом, он имеет с одной стороны гладкий и смазывающий графит; а с другой стороны, алмаз, твердость которого превосходит твердость многих материалов.
Если бы атом углерода не обладал качествами, которые его характеризуют, органическая химия не существовала бы полностью. Некоторые провидцы видят в нем новые материалы будущего через конструирование и функционализацию его аллотропных структур (углеродные нанотрубки, графен, фуллерены и т. Д.).
Характеристики атома углерода
Атом углерода обозначается буквой C. Его атомный номер Z равен 6, следовательно, он имеет шесть протонов (красные кружки с символом «+» в ядре). Кроме того, он имеет шесть нейтронов (желтые кружки с буквой «N») и, наконец, шесть электронов (голубые звезды).
Сумма масс их атомных частиц дает среднее значение 12.0107 ед. Однако атом на изображении соответствует 12-изотопу углерода ( 12 В), который состоит из д. Другие изотопы, такие как 13 С и 14 С, менее обильные, изменяются только по числу нейтронов.
Итак, если вы рисуете эти изотопы на 13 C будет иметь дополнительный желтый круг, а 14 С, еще два. Это логически означает, что они являются более тяжелыми атомами углерода.
В дополнение к этому, какие еще характеристики могут быть упомянуты в этом отношении? Он четырехвалентен, то есть может образовывать четыре ковалентные связи. Он расположен в группе 14 (НДС) периодической таблицы, более конкретно в блоке p.
Это также очень универсальный атом, способный связывать практически все элементы периодической таблицы; особенно с самим собой, образуя макромолекулы и линейные, разветвленные и пластинчатые полимеры.
структура
Обратите внимание, однако, что две звезды имеют более темный оттенок синего цвета, чем остальные четыре. Почему? Потому что первые два соответствуют внутреннему слою 1с 2 или [He], который не участвует непосредственно в образовании химических связей; в то время как электроны во внешнем слое, 2s и 2p, делают.
S и p орбитали не имеют одинаковую форму, поэтому проиллюстрированный атом не соответствует действительности; в дополнение к большой диспропорции расстояния между электронами и ядром, которое должно быть в сотни раз больше.
Поэтому структура атома углерода состоит из трех орбиталей, где электроны «тают» в рассеянные электронные облака. И между ядром и этими электронами есть расстояние, которое позволяет нам увидеть огромную «пустоту» внутри атома.
гибридизация
Ранее упоминалось, что атом углерода является четырехвалентным. В соответствии с его электронной конфигурацией его 2s-электроны спарены, а 2p-электроны спарены:
Остается свободная орбиталь, которая пуста и заполнена дополнительным электроном в атоме азота (2р 3 ).
Согласно определению ковалентной связи, необходимо, чтобы каждый атом вносил электрон для своего образования; Тем не менее, можно заметить, что в базальное состояние атома углерода, он едва имеет два неспаренных электрона (по одному в каждой 2p-орбитали). Это означает, что в этом состоянии это двухвалентный атом, и, следовательно, он образует только две связи (-C-).
Итак, как это возможно, что атом углерода образует четыре связи? Для этого вы должны продвинуть электрон с орбитали 2s на орбиту с более высокой энергией 2p. Это сделано, четыре получающиеся орбитали вырождаться; другими словами, они имеют одинаковую энергию или стабильность (обратите внимание, что они выровнены).
Этот процесс известен как гибридизация, и благодаря этому теперь атом углерода имеет четыре орбитальных sp 3 с одним электроном каждый, чтобы сформировать четыре связи. Это связано с тем, что он является четырехвалентным.
зр 3
Таким образом, вы можете определить углеродный сп 3 потому что он образует только четыре простые связи, как в молекуле метана (СН4). И вокруг этого можно наблюдать тетраэдрическую среду.
Перекрытие sp орбиталей 3 она настолько эффективна и стабильна, что простая связь C-C имеет энтальпию 345,6 кДж / моль. Это объясняет, почему существуют бесконечные углеродистые структуры и неизмеримое количество органических соединений. В дополнение к этому, атомы углерода могут образовывать другие типы связей.
зр 2 и зр
Атом углерода также способен принимать другие гибридизации, которые позволят ему образовывать двойную или даже тройную связь.
Обратите внимание, что всегда (обычно), если вы добавите ссылки вокруг углерода, вы обнаружите, что число равно четырем. Эта информация важна при рисовании структур Льюиса или молекулярных структур. Атом углерода, образующий пять связей (= C≡C), теоретически и экспериментально недопустим.
классификация
Как классифицируются атомы углерода? Больше, чем классификация по внутренним характеристикам, в действительности это зависит от молекулярной среды. То есть, что внутри молекулы ее атомы углерода могут быть классифицированы в соответствии со следующим.
первичный
вторичный
третичный
четвертичный
И, наконец, четвертичные атомы углерода, как следует из названия, связаны с четырьмя другими атомами углерода. Молекула неопентана, С(СН3)4 имеет четвертичный атом углерода.
приложений
Атомная единица массы
Средняя атомная масса 12 C используется в качестве стандартной меры для расчета массы других элементов. Таким образом, водород весит двенадцатую часть этого изотопа углерода, который используется для определения того, что известно как атомная единица массы u.
Таким образом, другие атомные массы можно сравнить с 12 С а 1 H. Например, магний ( 24 Mg) весит примерно вдвое больше, чем атом углерода, и в 24 раза больше, чем атом водорода.
Углеродный цикл и жизнь
Растения поглощают СО2 в процессе фотосинтеза выделяют кислород в атмосферу и действуют как легкие растений. Когда они умирают, они становятся древесным углем, который после сжигания выделяет СО2. Одна часть возвращается к растениям, а другая попадает в морское дно, питая многие микроорганизмы.
Когда микроорганизмы умирают, оставшиеся твердые в его осадок биологического разложения, и через миллионы лет, он превращается в то, что известно как нефть.
Когда человечество использует это масло в качестве альтернативного источника энергии для сжигания угля, оно способствует выделению большего количества СО2 (и другие нежелательные газы).
С другой стороны, жизнь использует атомы углерода из самых глубоких ее основ. Это происходит из-за стабильности его связей, что позволяет ему формировать цепочки и молекулярные структуры, которые составляют макромолекулы, столь же важные, как ДНК.
ЯМР спектроскопия 13 С
13 С, даже если он в гораздо меньшей пропорции, чем 12 С его обилие достаточно, чтобы выяснить молекулярные структуры с помощью ядерной магнитно-резонансной спектроскопии углерода-13.
Благодаря этой методике анализа можно определить, какие атомы окружают 13 С и к каким функциональным группам они относятся. Таким образом, углеродный скелет любого органического соединения может быть определен.
Основные характеристики углерода, виды и примеры
первичный углерод это то, что в любом соединении, независимо от его молекулярного окружения, образует связь по меньшей мере с одним другим атомом углерода. Эта связь может быть простой, двойной (=) или тройной (≡), если только два атома углерода связаны друг с другом и в соседних положениях (логически).
Водороды, присутствующие в этом углероде, называются первичными водородами. Однако химические характеристики первичных, вторичных и третичных атомов водорода мало различаются и в основном зависят от молекулярных углеродных сред. Именно по этой причине первичный углерод (1 °) обычно обрабатывается с большей важностью, чем его атомы водорода..
И как выглядит первичный углерод? Ответ зависит, как уже упоминалось, от его молекулярной или химической среды. Например, первичное изображение показывает первичные атомы углерода, заключенные в красные круги, в структуре гипотетической молекулы (хотя, вероятно, и реальной).
Характеристики первичного углерода
Расположение и ссылки
Выше были показаны шесть первичных атомов углерода без каких-либо комментариев, кроме их местоположения и того, какие другие атомы или группы сопровождают их. Они могут быть где угодно в структуре, и где бы они ни находились, они указывают на «конец дороги»; то есть, где заканчивается часть скелета. Вот почему их иногда называют терминальными углеродами.
Следовательно, все они характеризуются наличием связи С-С, связь которой также может быть двойной (С = СН2) или тройной (C≡CH). Это остается верным, даже если есть другие атомы или группы, связанные с указанными атомами углерода; как это происходит с остальными тремя углеродами 1 ° оставшегося изображения.
Низкое стерическое воздействие
Это потому, что они практически подвергаются воздействию «вакуума». Поэтому они обычно имеют стерическое препятствие по отношению к другим типам углерода (2-й, 3-й и 4-й).
Однако есть исключения: продукт молекулярной структуры со слишком большим количеством заместителей, высокой гибкостью или тенденцией сближения с самим собой..
реактивность
Одним из последствий более низкого стерического препятствия вокруг углерода 1, является большая подверженность взаимодействию с другими молекулами. Чем меньше атомов препятствует прохождению атакующей молекулы к нему, тем более вероятно, что его реакция будет.
Но это верно только с стерической точки зрения. На самом деле наиболее важным фактором является электронный; то есть, что является окружающей средой указанных углеродов 1 °.
Углерод, примыкающий к первичному, передает ему часть своей электронной плотности; и то же самое может произойти в противоположном направлении, благоприятствуя определенному типу химической реакции.
Таким образом, стерические и электронные факторы объясняют, почему он обычно наиболее реактивен; хотя на самом деле не существует глобального правила реактивности для всех первичных атомов углерода.
тип
Первичные угли не имеют внутренней классификации. Вместо этого они классифицируются в соответствии с группами атомов, к которым они принадлежат или с которыми они связаны; это функциональные группы. И поскольку каждая функциональная группа определяет определенный тип органического соединения, существуют разные первичные атомы углерода..
примеров
Альдегиды и карбоновые кислоты
Эта пара тесно связана друг с другом из-за реакций окисления, с которыми формильная группа превращается в карбоксил:
В линейных аминах
Обратите внимание, что CH3 это всегда будет углерод 1 °, но на этот раз CH2 справа также 1 °, так как он связан с одним углеродом и группой NH2.
В алкилгалогенидах
Пример, очень похожий на предыдущий, приведен для алкилгалогенидов (и многих других органических соединений). Предположим, бромпропан:
В ней первичные углеродные остатки остаются прежними.
В заключение, 1 ° углерода превышают тип органического соединения (и даже металлоорганические), потому что они могут присутствовать в любом из них и идентифицируются просто потому, что они связаны с одним углеродом.
Углерод
Углерод встречается как:
История
Углеро́д в виде древесного угля применялся в глубокой древности для выплавки металлов. Издавна известны алмаз и графит. Элементарная природа углерода установлена А. Лавуазье в конце 1780-х годов.
Происхождение названия
Международное название происходит от латинского carbo — уголь, связанного с древним корнем kar — огонь. Этот же корень в латинском cremare — гореть, а возможно, и в русском « гарь », «жар», «угореть» (в древнерусском «угорати» — обжигать, опалять). Отсюда — и «уголь».
Содержание
Физические свойства
Углерод существует во множестве аллотропных модификаций с очень разнообразными физическими и химическими свойствами. Разнообразие модификаций обусловлено способностью углерода образовывать химические связи разного типа. Основные физические свойства собственно углерода смотри в таблице.
Изотопы углерода
Аллотропные модификации углерода
Упрощенная фазовая диаграмма углерода, заштрихованы области где аллотропные модификации могут быть метастабильны. (diamond — алмаз, graphite — графит, liquid — жидкость, vapor — газ)
Электронное строение атома углерода
Графит и алмаз
Элементарная ячейка (углерода) алмаза
При давлении свыше 60 Г Па предполагают образование весьма плотной модификации С III (плотность на 15—20 % выше плотности алмаза), имеющей металлическую проводимость. При высоких давлениях и относительно низких температурах (ок. 1 200 K) из высокоориентированного графита образуется гексагональная модификация углерода с кристаллической решеткой типа вюрцита — лонсдейлит (а = 0,252 нм, с = 0,412 нм, пространственная группа Р63/ттс), плотность 3,51 г/см³, т. е. такая же, как у алмаза. Лонсдейлит найден также в метеоритах.
Ультрадисперсные алмазы (наноалмазы)
Карбин
Фуллерены и углеродные нанотрубки
Углерод известен также в виде кластерных частиц С60, С70 и подобных (фуллерены), а также графенов и нанотрубок.
Аморфный углерод
Нахождение в природе
Содержание углерода в земной коре 0,1 % по массе. Свободный углерод находится в природе в виде алмаза и графита. Основная масса углерода в виде природных карбонатов (известняки и доломиты), горючих ископаемых — антрацит (94—97 % С), бурые угли (64—80 % С), каменные угли (76—95 % С), горючие сланцы (56—78 % С), нефть (82—87 % С), горючих природных газов (до 99 % метана), торф (53—56 % С), а также битумы и др. В атмосфере и гидросфере находится в виде диоксида углерода СО2, в воздухе 0,046 % СО2 по массе, в водах рек, морей и океанов в
60 раз больше. Углерод входит в состав растений и животных (
В парообразном состоянии и в виде соединений с азотом и водородом углерод обнаружен в атмосфере Солнца, планет, он найден в каменных и железных метеоритах.
Большинство соединений углерода, и прежде всего углеводороды, обладают ярко выраженным характером ковалентных соединений. Прочность простых, двойных и тройных связей атомов С между собой, способность образовывать устойчивые цепи и циклы из атомов С обусловливают существования огромного числа углеродсодержащих соединений, изучаемых органической химией.
Химические свойства
При обычных температурах углерод химически инертен, при достаточно высоких соединяется со многими элементами, проявляет сильные восстановительные свойства. Химическая активность разных форм углерода убывает в ряду: аморфный углерод, графит, алмаз, на воздухе они воспламеняются при температурах соответственно выше 300—500 °C, 600—700 °C и 850—1000 °C.
Степени окисления +4, −4, редко +2 (СО, карбиды металлов), +3 (C2N2, галогенцианы); сродство к электрону 1,27 эВ; энергия ионизации при последовательном переходе от С 0 к С 4+ соответственно 11,2604, 24,383, 47,871 и 64,19 эВ.
Неорганические соединения
Углерод реагирует со многими элементами с образованием карбидов.
Органические соединения
Благодаря способности углерода образовывать полимерные цепочки, существует огромный класс соединений на основе углерода, которых значительно больше, чем неорганических, и изучением которых занимается органическая химия. Среди них наиболее обширные группы: углеводороды, белки, жиры и др.
Применение
Феррит ( твердый раствор внедрения C в α-железе с объемно-центрированной кубической решеткой)
Аустенит ( твердый раствор внедрения C в γ-железе с гранецентрированной кубической решеткой)
Цементит (карбид железа; Fe3C метастабильная высокоуглеродистая фаза)
Графит стабильная высокоуглеродистая фаза
Ледебурит ( эвтектическая смесь кристаллов цементита и аустенита, превращающегося при охлаждении в перлит)
Мартенсит (сильно пересыщенный твердый раствор углерода в α-железе с объемно-центрированной терагональной решеткой)
Перлит ( эвтектоидная смесь, состоящая из тонких чередующихся пластинок феррита и цементита)
Сорбит (дисперсный перлит)
Троостит (высокодисперсный перлит)
Бейнит (устар: игольчатый троостит) — ультрадисперсная смесь кристаллов низкоуглеродистого мартенсита и карбидов железа
Конструкционная сталь (до 0,8 % C)
Инструментальная сталь (до
2 % C)
Нержавеющая сталь ( легированная хромом)
Жаростойкая сталь
Жаропрочная сталь
Высокопрочная сталь
Белый чугун (хрупкий, содержит ледебурит и не содержит графит)
Серый чугун (графит в форме пластин)
Ковкий чугун (графит в хлопьях)
Высокопрочный чугун (графит в форме сфероидов)
Половинчатый чугун (содержит и графит, и ледебурит)
Углерод играет огромную роль в жизни человека. Его применения столь же разнообразны, как сам этот многоликий элемент.
Углерод является основой всех органических веществ. Любой живой организм состоит в значительной степени из углерода. Углерод — основа жизни. Источником углерода для живых организмов обычно является СО2 из атмосферы или воды. В результате фотосинтеза он попадает в биологические пищевые цепи, в которых живые существа пожирают друг друга или останки друг друга и тем самым добывают углерод для строительства собственного тела. Биологический цикл углерода заканчивается либо окислением и возврашением в атмосферу, либо захоронением в виде угля или нефти.
Углерод в виде ископаемого топлива: угля и углеводородов (нефть, природный газ) — один из важнейших источников энергии для человечества.
Углерод в сталелитейной промышленности один из важнеших компонентов сплавов железо-углерод (производсво чугуна и стали).
Графит используется в карандашной промышленности. Также его используют в качестве смазки при особо высоких или низких температурах.
Токсическое действие
Токсическое действие 14 С, вошедшего в состав молекул белков (особенно в ДНК и РНК), определяется радиационным воздействием бета частиц и ядер отдачи азота ( 14 С (β) → 14 N) и трансмутационным эффектом — изменением химического состава молекулы в результате превращения атома С в атом N. Допустимая концентрация 14 С в воздухе рабочей зоны ДКА 1,3 Бк/л, в атмосферном воздухе ДКБ 4,4 Бк/л, в воде 3,0•10 4 Бк/л, предельно допустимое поступление через органы дыхания 3,2•10 8 Бк/год.