Что такое перфузия легких
Что такое перфузия легких
Эффективность выполнения основной функции дыхательной системы зависит от соответствия перфузии (кровотока) в регионах легких с их вентиляцией. Так, хороший кровоток будет недостаточным для газообмена в регионах легких, если они слабо вентилируются воздухом с низким содержанием кислорода, при этом незначительный объем вентиляции легких не позволит удалить из крови углекислый газ. Соответственно, при слабом кровотоке в регионах легких возрастает объем функционального мертвого пространства, и перфузия легких кровью будет недостаточной для транспорта в ней нормального количества газов. Наконец, перфузия кровью регионов легких с недостаточной вентиляцией этих же отделов называется шунтированием, и это состояние является неадекватным для нормального газообмена. При шунтировании венозная кровь в легких не обогащается кислородом, что снижает его содержание в крови организма. В нормальных физиологических условиях фактор гравитации оказывает наиболее выраженный эффект на вентиляцию и перфузию регионов легких кровью.
Эффект гравитации на вентиляцию и перфузию легких кровью
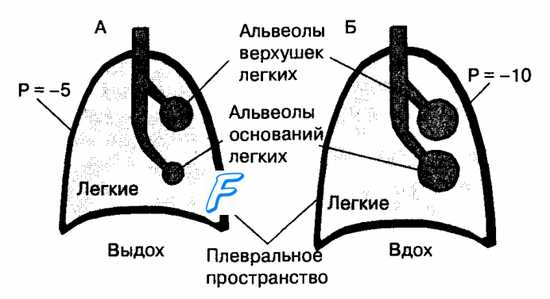
Легкие окружены плевральным пространством, отрицательное давление в котором изменяется от —5 до —10 см водн. ст. в различные фазы дыхательного цикла. Этот фактор взаимодействует с эффектом гравитации на жидкие среды, прежде всего кровь, содержащуюся в артериальных и венозных сосудах тканей легких. В результате под действием силы тяжести на ткань легких величина внутриплеврального давления на уровне основания легких у человека в положении стоя менее отрицательная относительно атмосферного, чем в области верхушек легкого. Поэтому альвеолы верхушек легких имеют большие размеры, а стенка их растянута и более напряжена, чем у альвеол нижних участков легких. Альвеолы на уровне основания легких растянуты в незначительной степени и имеют значительно больше потенциальные возможности для растягивания и вентиляции, чем в области верхушек. Поэтому растянутые альвеолы верхушки легких вентилируются меньше, чем альвеолы основания (рис. 10.13). Эти различия в вентиляции отделов легких приводят к тому, что вдыхаемый воздух неравномерно распределяется в отделах альвеолярного пространства. Особенности распределения воздуха, вдыхаемого в легкие, дополняется разницей в величине кровотока на уровне верхушек и основания легких. Относительно положения тела в пространстве кровоток в верхних и нижних отделах легкого различается под влиянием фактора гравитации.
У человека в вертикальном положении тела величина легочного кровотока на единицу объема ткани легкого линейно убывает в направлении снизу вверх, и меньше всего снабжаются кровью верхушки легких. Соответственно в положении тела человека на спине кровоток в нижних (дорсальных) отделах легких становится выше, чем в верхних (вентральных). Это обусловлено тем, что артериальная кровь, поступающая в легкие из правого желудочка, проходит по сосудам легких из областей низкого внутриплеврального давления в области тонкостенных капилляров, которые окружены альвеолами, содержащими воздух под давлением, близким к атмосферному. Поэтому в зависимости от соотношения давления в альвеолах (РА), мелких артериях (Ра) и мелких легочных венах (Pv) легкие разделены на функциональные зоны Веста (рис. 10.14).
В верхушках легких (зона 1) могут возникнуть области с давлением в легочных капиллярах (особенно в фазу диастолы) ниже альвеолярного (Ра > Ра > Pv)- Капилляры в таких зонах могут спадаться, и кровоток через них становится невозможным. Такие участки легких вентилируются, но не участвуют в газообмене и формируют альвеолярное мертвое пространство.
В средних отделах легких (зона 2) под действием гравитации давление в альвеолах, как правило, превышает венозное (Ра > РА > Pv). Поэтому величину кровотока в зоне 2 по Весту определяет разность между артериальным и альвеолярным давлениями. В зоне 2 практически не возникает альвеолярное мертвое пространство.
В нижних отделах легких (зона 3) давление в легочных венах выше альвеолярного (Ра > Pv > Ра) и величина кровотока, как и в обычных сосудах, определяется разницей между артериальным и венозным давлениями.
Величина зон Веста динамично изменяется в зависимости от положения тела в пространстве или глубины дыхания. При выдохе на уровне функциональной остаточной емкости примерно 2/з объема легких может занимать зона 2. После глубокой экспирации (на уровне остаточного объема) большая часть легких по соотношению перфузии кровью и вентиляции соответствует зоне 3 Веста. Относительная однонаправленность изменения градиента внутриплеврального давления и влияния гравитации на кровоток в легких от верхних отделов легких к нижним теме не менее не сопряжены в каждом отдельном регионе легких.
Химиоперфузия
Эффективных методов лечения большинства метастатических опухолей не существует. Однако разработка и внедрение в клиническую практику комплексных подходов к лечению онкологических больных с использованием перфузионных технологий значительно изменили ситуацию с оказанием помощи таким больным.
Химиоперфузия – что это за метод лечения?
Химиоперфузия – это вариант местной (регионарной) химиотерапии, когда противоопухолевые препараты вводятся не внутривенно (системно), а подводятся непосредственно к месту локализации опухоли. Это «промывание» опухоли или той области, из которой только что удалили опухоль, раствором, содержащим противоопухолевые препараты в дозах, в десятки раз превышающие дозы для стандартной внутривенной химиотерапии. При этом, та область, которая подвергается воздействию максимально изолируется от остального организма — за счет естественных барьеров или с помощью пережатия сосудов.
В результате этого создается высокая концентрация препаратов в месте локализации опухоли, при минимальном всасывании в системный кровоток. Таким образом, появляется возможность для максимально агрессивного воздействия на опухоль при незначительной системной токсичности, которая часто заставляет пациентов прерывать или прекращать курсы внутривенной химиотерапии.
В этом и состоит основное преимущество химиоперфузии — с ее помощью создается максимальная концентрация химиопрепаратов, действующих локально на опухоль. При обычной системной химиотерапии такие дозы невозможны, организм больного просто не смог бы выдержать воздействие такого количества токсичных препаратов.
При химиоперфузии уменьшается риск побочных эффектов и значительно снижается общая токсичность лечения.
В сочетании с химиоперфузией часто применяется тепловая обработка клеток опухоли (гипертермия), которая оказывает самостоятельное противоопухолевое действие и усиливает действие химиопрепаратов.
Виды химиоперфузии
Существует несколько видов химиоперфузии, в зависимости от того, через какую часть организма или органа осуществляется циркуляция раствора химиопрепарата:
По температурному режиму:
Как проходит химиоперфузия
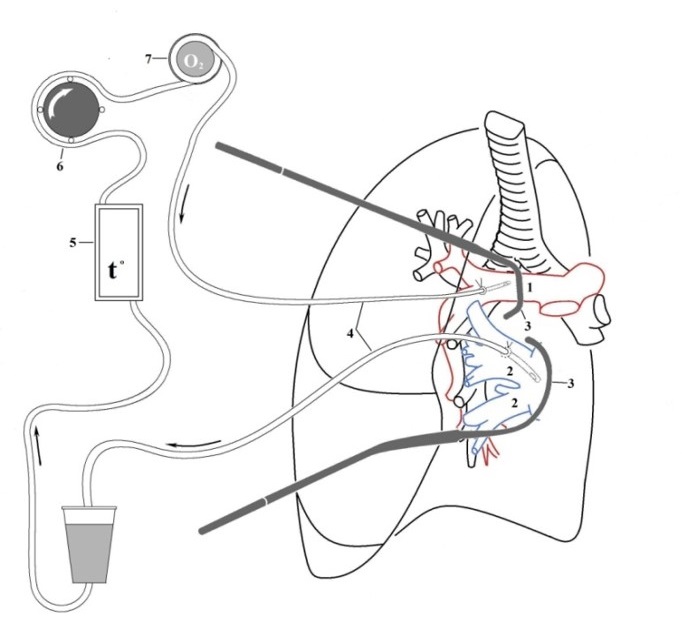
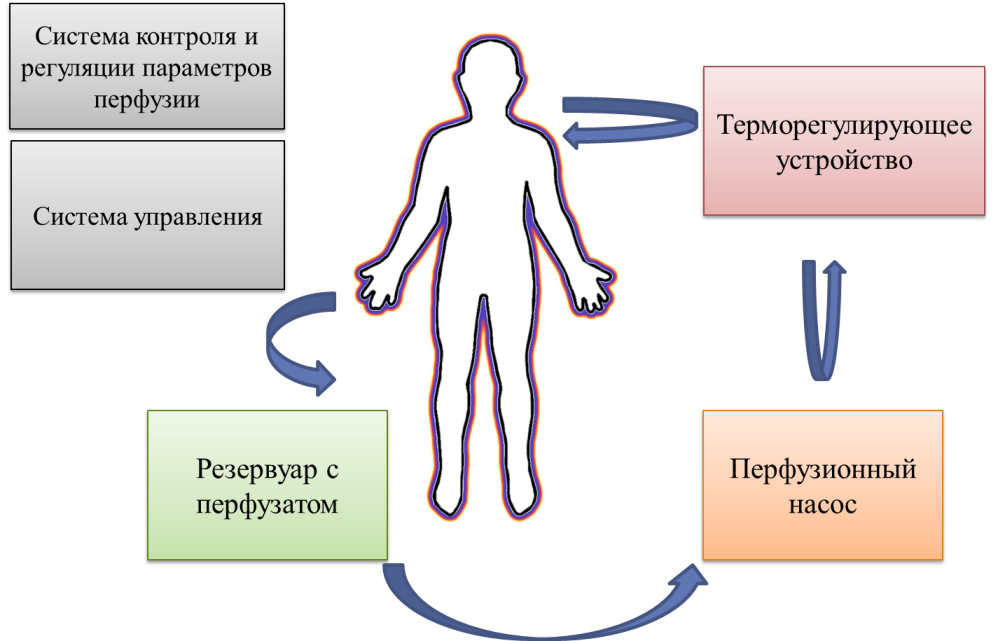
Во время операции нужный орган изолируется при помощи систем катетеров и на него направляется противоопухолевый препарат с помощью внешнего насоса аппарата искусственного кровообращения.
Аппаратно-техническое обеспечение химиоперфузии имеет следующую принципиальную схему (рис. 1):
К основным факторам, определяющим эффективность химиоперфузии, относятся:
Рис. 1. Схема аппаратно-технического обеспечения химиоперфузии
Аппараты для проведения химиоперфузии начали разрабатываться и использоваться в клинической практике с 1990-х годов.
Изолированная химиоперфузия легкого
Метод изолированной химиоперфузии легкого с использованием одного аппарата искусственного кровообращения, подключаемого через полости сердца, был предложен в начале 70-х годов прошлого столетия. Но даже сегодня на тему проведения изолированной химиоперфузии легкого опубликовано, пожалуй, наименьшее количество работ и доступно наименьшее количество информации в сравнении с другими видами химиоперфузии. Это во многом обусловлено сложностью выполнения процедуры – немногие врачи владеют техникой ИХПЛ – а также особенностями послеоперационного ведения таких пациентов, куда входит комплекс мер по профилактике и лечению осложнений.
Каким пациентам необходима изолированная химиоперфузия легкого (ИХПЛ)?
Основным методом оказания помощи больным раком легких является хирургический. Для пациентов с 3-4 стадией, с метастатическими изменениями в лёгких, результаты лечения не всегда являются удовлетворительными. В зависимости от локализации первичной опухоли пятилетняя выживаемость таких больных составляет не более 40 %.
Важным недостатком хирургического лечения является невозможность удаления микрометастазов легочной ткани, высокая вероятность того, что при множественном метастатическом поражении не все метастазы будут обнаружены и удалены во время хирургического вмешательства. Это впоследствии приводит к появлению новых метастазов в легких более чем у трети оперированных пациентов. В таких случаях приходится выполнять повторные операционные вмешательства, отличающиеся повышенным травматизмом и осложненным послеоперационным течением.
Одним из перспективных путей улучшения результатов лечения пациентов с метастатическим поражением лёгких считается комбинированное лечение. Во время хирургического вмешательства, после хирургического удаления легочных метастазов, проводится изолированная перфузия органа противоопухолевым препаратом в высокой дозе.
Противопоказания к ИХПЛ
Абсолютные противопоказания к ИХПЛ:
Аппарат для ИХПЛ представлен на рисунке 2 и состоит из следующих элементов:
Кроме этого, в состав перфузионного контура входит термостатирующее устройство, поддерживающее температуру перфузата на требуемом уровне.
Рис. 2. Аппарат для изолированной химиоперфузии легкого
На таком аппарате в НМИЦ онкологии им. Н.Н. Петрова ИХПЛ производится в течение 30 мин при температуре перфузата 37ºС. В качестве перфузата используется стерильный физиологический раствор объемом 1000-1500 мл. В качестве противоопухолевого препарата для ИХПЛ, как правило используется мелфалан (30-50 мг) или цисплатин (110-135 мг/м 2 ).
Послеоперационный период у пациентов после изолированной химиоперфузии легкого
В послеоперационном периоде все пациенты проходят:
Кроме того, в послеоперационном периоде проводится лечение, включающее кратковременную профилактическую антибактериальную терапию, терапию антикоагулянтами, коррекцию водноэлектролитных нарушений, терапию, направленную на предотвращение развития отека легкого, а также симптоматическая терапия.
Проведение ИХПЛ в процессе хирургического вмешательства по поводу внутрилегочных метастазов позволяет достоверно увеличить показатели общей и безрецидивной выживаемости больных с метастатическим поражением легких.
В НМИЦ онкологии им. Н.Н. Петрова накоплен наибольший в России опыт выполнения как полостных, так и изолированных регионарных химиоперфузий у онкологических больных.
Мировой лидер по выполнению изолированной химиоперфузии легкого — заведующий хирургическим торакальным отделением НМИЦ онкологии им. Н.Н. Петрова, д.м.н., профессор, Евгений Владимирович Левченко. Эффективность процедуры составляет 50% (то есть стойкая ремиссия наступила у каждого второго пациента). За 10 лет, с 2010 по 2017 год им выполнено 168 перфузий.
В 2017 г. за одну из таких операций Е.В. Левченко удостоен премии фонда им. академика В.Н. Перельмана – в 2009 г. хирург провел ИХПЛ 17-летней пациентке с многочисленными метастазами в легких. Во время вмешательства он удалил в общей сложности 70 метастазов и добился стойкой ремиссии несмотря на агрессивность первичной опухоли – остеогенной саркомы. На момент вручения награды прошло почти 9 лет после операции, пациентка благополучно живет без признаков прогрессирования.
«С помощью химиоперфузии нам удается вывести пациентов с 4-й стадией онкозаболевания – метастазами в легких, из «долины смерти», это шанс, который мы даем людям, раньше считавшимся безнадежными» — комментирует Е.В. Левченко успехи методики химиоперфузии.
Кроме ИХПЛ в Центре занимаются химиоперфузиями конечностей и брюшной полости. С 2004 по 2017 г. сделано более 150 регионарных химиоперфузий конечностей – этой темой занимается заведующий научным отделением онкоурологии и общей онкологии, д.м.н. Георгий Иванович Гафтон.
Перфузия брюшной полости выполняется в НМИЦ онкологии им. Н.Н. Петрова с 2008 года на отделениях общей онкологии и урологии (д.м.н. Георгий Иванович Гафтон), онкогинекологии (к.м.н. Константин Джамильевич Гусейнов), абдоминальной онкологии (д.м.н. Алексей Михайлович Карачун). Использование внутрибрюшинной химиоперфузии специалистами разных отделений объясняется тем, что метод применяется у пациентов с перитонеальным канцероматозом (опухолевое поражение брюшной полости), который развивается у пациентов с колоректальным раком, раком яичников, желудка, опухолями аппендикса. Почти за 10 лет было выполнено около 100 перфузий.
Авторская публикация:
КИРЕЕВА ГАЛИНА СЕРГЕЕВНА
старший научный сотрудник научной лаборатории канцерогенеза и старения, кандидат биологических наук,
Председатель Совета молодых ученых НМИЦ онкологии им. Н.Н. Петрова
Что такое перфузия легких
БАП — баллонная ангиопластика
ИО — индекс обструкции
ИПН — индекс перфузионных нарушений
КТ — компьютерная томография
ЛА — легочная артерия
ЛГ — легочная гипертензия
САПГ — селективная ангиопульмонография
СДЛА — систолическое давление в легочной артерии
ТЛ-БАП — транслюминальная баллонная ангиопластика
ТШХ — тест с 6-минутной ходьбой
ТЭЛА — тромбоэмболия легочной артерии
ФК — функциональный класс
ХТЭЛГ — хроническая тромбоэмболическая легочная гипертензия
Под легочной гипертензией (ЛГ) понимают патологический симптомокомплекс, в основе которого лежит повышение легочного сосудистого сопротивления и давления в легочной артерии (ЛА), что приводит к развитию правожелудочковой недостаточности [1].
Хроническая тромбоэмболическая легочная гипертензия (ХТЭЛГ) — единственной наиболее вероятно потенциально излечимая форма ЛГ, характеризующаяся хронической обструкцией ветвей ЛА после однократной или повторной тромбоэмболии. Частота развития ХТЭЛГ после перенесенной острой тромбоэмболии варьирует от 0,1 до 9,1% [2].
В основе лечения больных ХТЭЛГ лежат хирургический и консервативный подходы. При проксимальном поражении сосудистого русла методом выбора является тромбэндартериэктомия (ТЭЭ), при наличии патологических изменений в сегментарных и субсегментарных ветвях ЛА выполнение ТЭЭ часто невозможно, поэтому единственным методом лечения больных ЛГ с дистальным поражением сосудов до недавнего времени оставалась консервативная терапия. В последние годы появились публикации об эффективности относительно новой стратегии лечения пациентов этой категории с помощью транслюминальной баллонной ангиопластики (ТЛ-БАП) ЛА [3].
В процессе выбора тактики лечения — ТЭЭ, БАП или медикаментозное лечение основную роль играет селективная ангиопульмонография (САПГ). Однако при решении вопроса о тактике и эффективности лечения не менее важной является оценка состояния перфузии легочной ткани.
Известно, что выраженная обструкция или полная окклюзия ЛА способствует формированию типичных дефектов перфузии, что является неотъемлемой частью диагностики ХТЭЛГ. Референтным методом оценки легочной перфузии остается вентиляционно-перфузионная сцинтиграфия, в свою очередь САПГ является «золотым стандартом» оценки состояния сосудистого русла. В настоящее время появилась возможность комплексной неинвазивной диагностики как сосудистых, так и перфузионных нарушений легких с помощью современной компьютерной томографии (КТ) с программой полуколичественной оценки легочного кровотока, которая позволит оптимизировать протокол обследования больных ХТЭЛГ.
Цель настоящей работы заключалась в оценке состояния сосудистого русла и перфузии легких методом КТ, сопоставлении выраженности тромботического поражения ЛА с перфузионными нарушениями паренхимы, а также с данными ангиопульмонографии (АПГ) и клиническими характеристиками больных ХТЭЛГ.
Материалы и методы
В период с ноября 2015 г. по май 2016 г. обследовали 22 пациента (7 мужчин, 15 женщин) в возрасте от 27 до 67 лет с диагнозом ХТЭЛГ. Для верификации диагноза всем пациентам проводили стандартный комплекс обследования в соответствии с принятыми рекомендациями по диагностике и лечению больных ЛГ, включающий лабораторные исследования: клинический и биохимический анализ крови, количественную оценку D-димера, коагулологических параметров, тест с 6-минутной ходьбой (ТШХ), обзорную рентгенографию грудной клетки, электрокардиографию, эхокардиографию, спирометрию, дуплексное сканирование вен нижних конечностей, КТ легких с проведением АПГ и перфузии легких. Клиническая характеристика обследованных пациентов представлена в табл. 1.

Катетеризация правых отделов сердца с измерением гемодинамических параметров (табл. 2) и АПГ выполнена 21 пациенту; в связи с тяжестью состояния и высоким риском развития осложнений в ходе катетеризации правых отделов сердца 1 пациенту проведение было невозможно. ТШХ проведен 20 пациентам; 2 пациента ТШХ не выполнили в силу тяжести состояния.

Все пациенты обследованы на компьютерном томографе Aquilion ONE 640 VISION Edition («Toshiba MedicalSystems», Япония) с 320 рядами детекторов с использованием протокола Lungsubstraction. Исследование выполняли в положении больного лежа на спине, в направлении от головы к ногам, при задержке дыхания на максимальной глубине вдоха в нативную и артериальную фазы при соблюдении одинаковых параметров начала и окончания сканирования. Неионный контрастный препарат (70—80 мл) вводили внутривенно со скоростью 4,5—5 мл/с. Артериальная фаза исследования выполнялась автоматически при достижении пикового значения рентгеновской плотности в просвете Л.А. Ток и напряжение на рентгеновской трубке составляли 50—100 мА и 100—120 кВ соответственно. Толщина среза 0,5 мм. Средняя эффективная доза лучевой нагрузки составила 8—10 мЗв.
В визуальный анализ входили оценка состояния просвета легочных сосудов, протяженности и локализации тромботических масс, наличия мелких тромботических структур в виде мембран и перетяжек, извитости легочных сосудов, периферических коллатералей, сосудистых мальформаций, а также оценка состояния легочной паренхимы, а именно наличие симптома «мозаичной перфузии», обеднения сосудистого рисунка, фиброзных и постинфарктных изменений. Под термином «мозаичная перфузия» понимается чередовании участков пониженной и повышенной плотности легочной паренхимы, при этом диаметр легочных сосудов в областях с пониженной плотностью меньше, чем в областях с повышенной.
К косвенным КТ-признакам ЛГ в соответствии с принятыми рекомендациями по диагностике и лечению данного заболевания относились расширение ЛГ (диаметр ствола ЛГ более 2,9 см, отношение диаметров ЛГ/восходящего отдела аорты более 1), ее ветвей, правых отделов сердца (отношение диаметров правого желудочка/левого желудочка больше 1) и гипертрофия миокарда правого желудочка (толщина миокарда правого желудочка более 0,4 см) [4—6].
Количественная оценка включала построение перфузионных карт с полуавтоматическим определением индекса обструкции (ИО) и индекса перфузионных нарушений (ИПН).
Построение перфузионных карт и оценку дефекта перфузии в представленном исследовании выполняли с использованием нового программного обеспечения SURE Subtraction Lung, позволяющего проводить анализ перфузионных нарушений легких по первому прохождению контрастного препарата через правые отделы сердца, ЛА и ее ветви, совмещая контрастные и бесконтрастные изображения методом субтракции (рис. 1) [7].

Количественную оценку осуществляли путем расчета ИО и ИПН. При этом расчет ИО выполняли по формуле, описанной S. Qanadli и соавт. [8]: КТ индекс обструкции =∑(n·d)/40·100, где n — количество сегментарных ветвей (минимум 1, максимум 20), а d — степень обструкции [8—10]. Степень обструкции варьировала от 0 до 2 баллов, где 0 баллов — отсутствие обструкции; 1 балл — частичная обструкция; 2 балла — субтотальная или тотальная обструкция. При этом артериальное русло каждого легкого представлено 10 сегментарными артериями (3 в верхних долях, 2 в средней доле и язычковой, 5 в нижних долях).
Расчет ИПН выполняли по формуле: КТ индекс перфузионных нарушений =∑(n·d)/40·100, где n — число сегментов (3 в верхних долях, 2 в средней доле и язычковой, 5 в нижних долях), а d — степень перфузионных нарушений также варьировала от 0 до 2 баллов (0 — нормальная перфузия, 1 — умеренное снижение перфузии, 2 — выраженное снижение перфузии или отсутствие перфузии) [8]. Баллы присваивались в зависимости от цветовой маркировки легочной ткани, которая соответствовала нормальному (от желтого до красного), сниженному (от фиолетового до темно-синего) контрастированию или отсутствию контрастирования (от темно-синего до черного) паренхимы легких в единицах Хаунсфилда. Параметры визуальной и полуколичественной оценки состояния паренхимы и сосудов легких по данным КТ представлены в табл. 3.

Результаты
В ходе исследования у 20 пациентов в сегментарных ветвях обоих легких определялись тромботические массы, из них у 17 (85%) выявлены двусторонние зоны выраженного снижения или отсутствия перфузии, у 3 (15%) — зоны умеренного снижения перфузии в соответствующих тромботическому поражению областях. У 2 пациентов тромботические массы в крупных и сегментарных ветвях ЛА не определялись, однако выявлены обеднение сосудистого рисунка, линейные дефекты контрастирования в виде мембран, наличие перетяжек в сегментарных ветвях. При этом в одном случае отмечалось умеренное снижение перфузии, в другом — выраженное снижение перфузии. Средние значения ИО и ИПН составили 38,18±24,05 и 53,52±20,38% соответственно.
Между ИО и ИПН у пациентов с ХТЭЛГ обнаружена статистически значимая корреляция (r Пирсона 0,56; p=0,0065), отражающая зависимость перфузионных нарушений легких от степени тромботического поражения ЛА (рис. 2).

Взаимосвязей СДЛА и сосудисто-перфузионных показателей (ИО и ИПН), а также сосудисто-перфузионных показателей и результатов ТШХ не выявлено.
При сравнении данных КТ-АПГ и САПГ локализация и протяженность дефектов контрастирования совпала в 20 (90,9%) случаях. У 2 больных при САПГ не удалось визуализировать перетяжки и линейные дефекты контрастирования в виде мембран в мелких ветвях ЛА, которые отчетливо определялись на КТ-изображениях.
Для демонстрации клинической значимости КТ в алгоритме обследования пациентов с ХТЭЛГ представляем клинический случай динамического наблюдения пациентки Н. с подтвержденным диагнозом ХТЭЛГ, которой проведено 6 сеансов БАП, КТ-исследование выполнено до и после лечения (рис. 3).

Женщина 41 года, впервые поступила в Институт кардиологии им. А.Л. Мясникова в декабре 2015 г. с жалобами на резкое нарастание одышки при умеренных физических нагрузках в течение последних месяцев, общую слабость, сердцебиение, отеки нижних конечностей. Из анамнеза известно, что в марте 2015 г. больная госпитализирована по месту жительства в связи с резко возникшей отечностью левой голени и одышкой. По данным обследования выявлен тромбоз глубоких вен левой ноги и предположена тромбоэмболия легочной артерии (ТЭЛА), проводилось консервативное лечение непрямыми антикоагулянтами.
В ходе первой госпитализации, по данным стандартного клинического и лабораторно-инструментального обследования, впервые установлен диагноз ХТЭЛГ, ФК III, легочное сердце: относительная недостаточность трикуспидального клапана II степени. При проведении САПГ с катетеризацией правых отделов сердца в ветвях ЛА выявлены двусторонние дефекты наполнения (1 долевая и 4 сегментарных ветви), гемодинамически значимые стенозы (5 сегментарных ветвей) и окклюзии (5 сегментарных ветвей), определялось повышение среднего давления в ЛА до 50 мм рт.ст.
По данным КТ-АПГ с оценкой перфузии легких выявлен двусторонний тромбоз сегментарных и субсегментарных ветвей ЛА той же локализации, признаки ЛГ: расширение правых отделов сердца, ствола ЛА и ее ветвей. При построении и визуальной оценке перфузионных карт в соответствующих тромботическому поражению областях определялись участки снижения перфузии, наиболее выраженные в нижней доле правого легкого (общий ИПН 77,5%).
С учетом дистального типа поражения, а также отсутствия клинического эффекта от консервативной терапии (индапамид 1,5 мг/сут, эноксопарин натрия 100 мг/сут, силденафил 60 мг/сут, спиронолактон 100 мг/сут, ивабрадин 15 мг/сут) принято решение о проведении эндоваскулярного лечения в бассейнах сегментарных ветвей нижних долей легких. Повторное КТ-исследование выполнено после 6 сеансов БАП. По данным контрольного исследования (КТ и САПГ) отмечались значительное улучшение кровоснабжения и перфузии нижней доли правого легкого, уменьшение диаметра ствола ЛА и снижение степени выраженности «мозаичной перфузии» (рис. 3; рис. 4), определялось снижение среднего давления в ЛА с 50 до 27 мм рт.ст. Значительно улучшились клинические показатели: уменьшилась одышка, увеличилось пройденное в ТШХ расстояние с 235 до 624 м, что сопровождалось снижением ФК с III до II—III.

Обсуждение
КТ-АПГ на протяжении последних 25 лет входит в стандартный алгоритм обследования пациентов с подозрением на острую ТЭЛА, а с появлением высокоскоростных компьютерных томографов стала методом выбора для этой категории больных [11].
При острой ТЭЛА тромботические массы в большинстве случаев определяются в крупных и средних ветвях, не вызывая сложности визуальной оценки состояния их просвета. Наибольшие трудности диагностики возникают при дистальном поражении сосудистого русла, в частности у больных ХТЭЛГ без типичной клинической картины ТЭЛА в анамнезе и постепенном нарастании симптомов Л.Г. Поэтому актуальность комплексного подхода к диагностике у больных этой категории с использованием современных методов визуализации не вызывает сомнения.
С появлением двухэнергетической КТ стала возможна оценка не только состояния сосудов и паренхимы легких, но и перфузии легочной ткани, что особенно важно при дистальном поражении сосудистого русла. Принцип работы двухэнергетической КТ основан на разнице поглощения тканями рентгеновского излучения при различном напряжении на рентгеновской трубке [12, 13]. Помимо оценки перфузии легочной ткани в режиме двухэнергетического сканирования в настоящее время появилась возможность оценки легочного кровотока с помощью метода субтракции с последующим построением перфузионных карт [7].
В зарубежной литературе опубликовано достаточное количество работ по изучению роли КТ в диагностике перфузионных нарушений легких [8, 14, 15]. Единичные отечественные публикации, посвященные этой теме, касались оценки состояния артерий и перфузии легких методом двухэнергетической КТ у больных ХТЭЛГ до и после ТЭЭ [16, 17].
Известно, что обструкция ветвей ЛА способствует повышению легочного сосудистого сопротивления, что в дальнейшем приводит к развитию Л.Г. Поэтому степень выраженности тромботического поражения и состояние перфузии легочной ткани играют важную роль в определении эффективности терапии, указывая на необходимость изменения тактики лечения, отдаленного прогноза и стратификации риска.
В представленной работе мы впервые применили метод КТ-субтракции для оценки перфузии при ХТЭЛГ. У всех обследованных больных на перфузионных картах определялись дефекты контрастирования легочной ткани. При этом изображения дефектов контрастирования на перфузионных картах, полученных с помощью метода КТ-субтракции и двухэнергетической КТ, оказались идентичными. Логично предположить, что чем больше тромботических масс в просветах легочных сосудов, тем хуже кровоснабжение легочной ткани. С помощью корреляционного анализа нами выявлена связь между степенью тромботической обструкции ЛА и выраженностью перфузионных нарушений (r=0,56; p=0,0065). Среди 440 сегментов соответствие между перфузионными нарушениями и обструкцией сосудов выявлено у 9 (41%) пациентов. У 13 (59%) пациентов степень перфузионных нарушений оказалась выше, чем степень обструкции, что, вероятно, связано с нарушением перфузии легочной ткани на уровне мелких ветвей ЛА.
Наши данные совпали с работой E. Chae и соавт. [9], в которой также выявлена прямая корреляция между ИО и индексом перфузии, но у пациентов с острой ТЭЛА (r=0,56; p