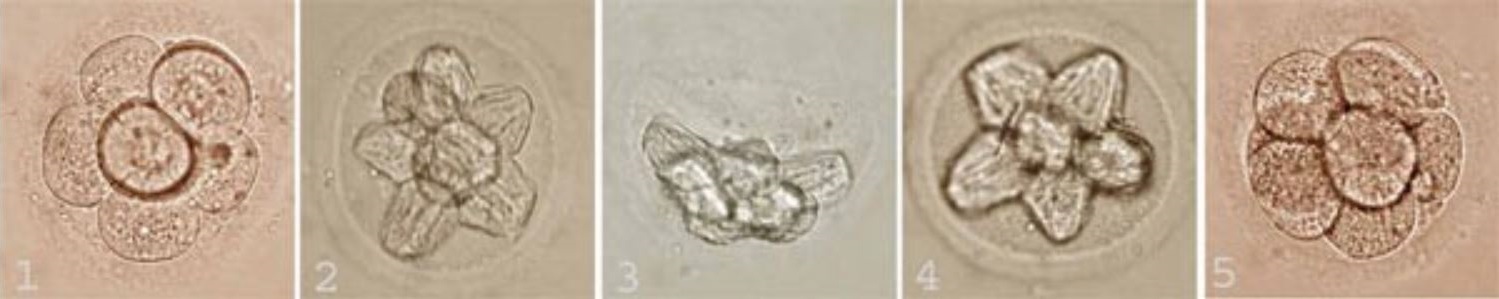
что такое фрагментация эмбриона
Результативность программы ЭКО в зависимости от количества и качества перенесенных эмбрионов
| Частота наступления беременности, по данным разных центров ЭКО, находится в пределах 20–40%. Этот показатель зависит от многих факторов: причины бесплодия, применяемой схемы индукции суперовуляции, качества аспирированных яйцеклеток, показателей спермограммы, способности эндометрия к имплантации полученных эмбрионов. |
По данным большинства исследователей, одним из важных критериев удачного исхода программы ЭКО является количество и качество переносимых эмбрионов.
Вопрос оптимального количества клеток, используемых для переноса эмбрионов, остается самым дискуссионным. Так, в некоторых центрах ЭКО рекомендуют использовать для переноса эмбрионов не более 2 эмбрионов [7], в других – в полость матки переносят все полученные эмбрионы [3].
Что касается морфологических особенностей переносимых эмбрионов, то одни авторы настаивают на выборе клеток оптимального качества, другие, ссылаясь на то, что эмбрионы до 8-клеточной стадии развития являются тотипотентными, считают не обязательным учитывать степень их фрагментации [8, 11].
Целью настоящего исследования явился выбор оптимального числа переносимых эмбрионов, а также изучение влияния процесса фрагментации эмбрионов на частоту наступления беременности.
Материалом служили эмбрионы, полученные после экстракорпорального оплодотворения ооцитов пациенток, участвующих в программе ЭКО в Харьковском Центре репродукции человека.
Проанализированы результаты 356 циклов ЭКО, закончившихся переносом эмбрионов.
Под наблюдением находилось 213 пациенток с первичным и 143 с вторичным бесплодием.
Показаниями к ЭКО во всех случаях послужил трубно-перитонеальный фактор. Возраст пациенток составил 23–36 лет (средний возраст 33,7 года).
Индукцию суперовуляции осуществляли с использованием агонистов рилизинг-гормона (супрефакт, «Choechst») и фолликулостимулирующего гормона (метродин, «Serono»).
Ультразвуковой мониторинг, аспирацию фолликулов, культивирование гамет и эмбрионов проводили по общепринятым протоколам программы ЭКО [1, 2].
Проанализирована частота наступления беременности в результате переноса 1340 эмбрионов в 356 циклах ЭКО. Для переноса эмбрионов использовали клетки как с нормальной морфологией, так и с признаками фрагментации. Контроль качества эмбрионов осуществлялся визуально при их микроскопировании. Перед переносом эмбрионов оценивали морфологию бластомеров, степень фрагментации и вакуолизации цитоплазмы. Эмбрионы считали нормального качества, если бластомеры имели ровные, четкие границы и были одинаковы по величине, отсутствовали признаки вакуолизации и фрагментации цитоплазмы. Эмбрионы с неровными бластомерами, с наличием фрагментации цитоплазмы бластомеров классифицировали как фрагментированные.
Перед переносом эмбрионов отмечали количество переносимых клеток, описывали их морфологические характеристики и стадию развития.
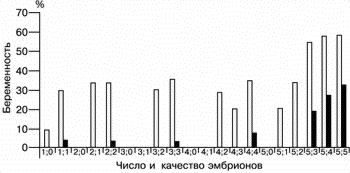
На рис. 1 представлены данные о частоте наступления беременности в зависимости от числа перенесенных эмбрионов с фрагментацией и без таковой.
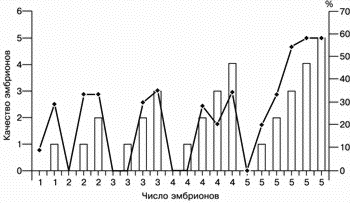 |
| Рис. 1. Частота наступления беременности (в %; кривая линия) в зависимости от числа и качества перенесенных эмбрионов (прямоугольники). |
Прежде всего следует отметить, что частота наступления беременности положительно коррелирует с числом перенесенных эмбрионов.
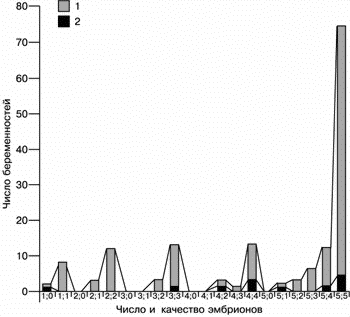
При переносе 1, 2, 3, 4 и 5 эмбрионов (без учета их морфологических особенностей) частота наступления беременности составила 23, 30, 30,6, 31,7 и 47,2% соответственно (рис. 2).
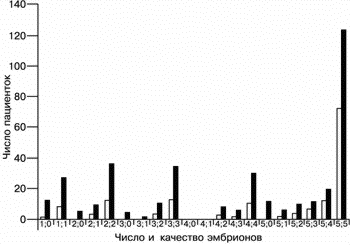 |
| Рис. 2. Число переносов эмбрионов (темные столбики) в сравнении с числом положительных результатов (число беременностей – светлые столбики). |
При переносе эмбрионов без признаков фрагментации частота наступления беременности была довольна высокой во всех исследуемых группах и составляла при переносе 1, 2, 3, 4 и 5 эмбрионов соответственно 29,6, 33,3, 35,3, 34,5 и 58,1%.
Проводя программу ЭКО, мы в исключительных случаях использовали для переноса эмбрионы с сильной степенью фрагментации. Так, 12 пациенткам был перенесен 1 эмбрион с фрагментацией бластомеров, пятерым – 2 эмбриона, четырем – 3. Не было зарегистрировано случаев переноса четырех эмбрионов, и 5 эмбрионов с признаками фрагментации было перенесено 11 пациенткам. Таким образом, эмбрионы с признаками фрагментации были перенесены 34 женщинам. Беременность наступила лишь в 1 случае, причем при переносе одного эмбриона.
При «смешанном» переносе эмбрионов, т.е. с признаками фрагментации и без таковых, вероятность наступления беременности увеличивалась с возрастанием числа эмбрионов без фрагментации. Особенно наглядно это прослеживалось в группе, где осуществлялся перенос 5 эмбрионов. При переносе эмбрионов с признаками фрагментации ни в одном случае не наступила беременность: перенос 1 нормального эмбриона и 4 фрагментированных позволил в 20% случаях получить беременность. Если из общего числа клеток морфологической целостностью обладали 2 эмбриона, то результативность программы возрастала до 33,3%, 3 эмбриона – до 54,5%, 4 эмбриона – до 57,9% и всех – до 58,1%. Однако следует отметить, что с увеличением числа перенесенных эмбрионов возрастает не только общее число беременностей, но и количество многоплодия (рис. 3 и 4).
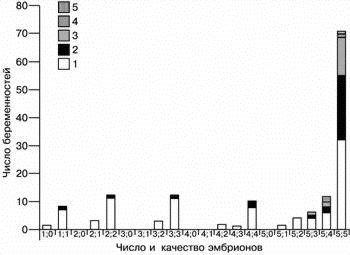 |
| Рис. 3. Число многоплодных беременностей к общему числу беременностей. |
1 – одноплодные беременности; 2 – двухплодные; 3 – трехплодные; 4 – четырехплодные; 5 – пятиплодные.
 |
| Рис. 4. Процент многоплодных беременностей (темные столбики) к общему проценту беременностей (светлые столбики). |
С увеличением числа эмбрионов и их качества возрастают не только положительные характеристики, такие, как процент беременности, но и отрицательные – многоплодие. Перенос 5 эмбрионов предполагает возможность появления пятиплодной беременности, несмотря на малую вероятность этого события.
 |
| Рис. 5. Частота возникновения самопроизвольных абортов в исследуемых группах (1 – число самопроизвольных абортов; 2 – общее число беременностей). |
Нами была изучена частота возникновения самопроизвольных абортов во всех исследуемых группах. Как видно на рис. 5, самопроизвольные аборты являются практически случайным явлением и их частота не зависит от числа и качества перенесенных эмбрионов.
Как мы уже отмечали, в литературе вопрос оптимального количества переносимых эмбрионов остается открытым. Так, одни авторы [4] указывают на резко возрастающую частоту наступления беременности с увеличением числа переносимых клеток, другие [3] не отмечают линейной зависимости. Одни – категорически настаивают на переносе только 1 эмбриона отличного качества [4], другие [8] – на большом экспериментальном материале демонстрируют, что перенос даже шести эмбрионов не вызывает увеличения числа многоплодных беременностей.
Авторы [3] показали хорошую корреляцию между качеством переносимых эмбрионов и частотой наступления беременности, в работах [6, 9] не наблюдается такой зависимости.
A.Shulman отметил положительную корреляцию между частотой имплантации и качеством переносимых эмбрионов. Отмечено, что при переносе 6 и более эмбрионов низкого качества не было зарегистрировано случаев наступления многоплодных беременностей. Обнаружена корреляция между числом переносимых эмбрионов низкого качества и частотой имплантации: вероятность многоплодия увеличивалась с 10% при переносе эмбрионов низкого и высокого качества до 30,76% при переносе эмбрионов только наилучшего качества. Автор делает вывод, что при лечении бесплодия методом ЭКО следует уделять особое внимание морфологии эмбрионов.
Интересными в сравнительном аспекте являются работы H.Tasdemir. Он изучил 486 циклов ЭКО у 287 пар и при этом оценивал качество 1224 эмбрионов по характеру дробления и морфологии как хорошее (А) и низкое (В). При переносе АА, ААА, ВВ или ВВВ частота наступления беременности составила соответственно 40,5, 42,9, 11 и 22,9%. Вероятность многоплодия при переносе 2 и 3 эмбрионов составила 14,3 и 32,4% [11].
При нескольких безуспешных попытках программы ЭКО в некоторых центрах переносят более 6 клеток. Примечательным является тот факт, что в таких случаях отмечается низкая имплантация эмбрионов, а частота возникновения многоплодных беременностей остается незначительной.
Самым интересным в данном аспекте является вопрос развития эмбрионов с признаками фрагментации. Ведь зачастую встречаешься с явлениями, когда фрагментированный эмбрион достигает стадии бластоцисты и после переноса дает начало прогрессивно развивающейся беременности. Природа и причины возникновения фрагментации остаются малоизученными.
Большинство авторов считают, что фрагментация участков цитоплазмы –генетически запрограммированная гибель эмбрионов на ранних этапах дробления. Подтверждением этому служит ряд работ по изучению хромосомного баланса фрагментированных эмбрионов. Так, в работе A.Bongso и соавт. [4] показано, что более 30% таких эмбрионов несут те или иные хромосомные аномалии: мозаицизм встречается в 19,8% клеток, а полиплоидия в 5,5%. По данным M.Plachot и соавт. [10], хромосомные аномалии фрагментированных эмбрионов встречаются в 2 раза чаще, чем у эмбрионов с нормальной морфологией. Кроме того, эти авторы считают, что эмбрионы с признаками фрагментации в большинстве случаев не имплантируются, а если имплантация происходит, то до 60% таких эмбрионов все же абортирует.
N.Winston и соавт. [12] считают, что фрагментация цитоплазмы бластомеров является результатом неравномерного распределения ядерного материала в процессе деления бластомеров.
Встречаются работы, в которых делается вывод о том, что фрагментация эмбрионов происходит из-за неоптимальных условий культивирования и тактики работы с клетками. После попадания эмбрионов в условия in vivo остаются возможными их дальнейшее развитие и имплантация.
С увеличением числа переносимых эмбрионов пропорционально возрастает частота наступления беременности. Несмотря на то, что фрагментация эмбрионов снижает вероятность их имплантации, это не исключает наступление беременности в случае переноса таких клеток. Перенос 5 эмбрионов чреват возникновением пятиплодной беременности, несмотря на малую вероятность этого события. Частота самопроизвольных абортов является случайным явлением и не зависит от количества и качества перенесенных эмбрионов.
В.И. Грищенко, М.П. Петрушко, В.И. Пиняевя
Центр репродукции человека «Имплант», Харьков
Эмбриологические аспекты ЭКО/ИКСИ
Яйцеклетки (ооциты) полученные во время трансвагинальных пункций в программе ЭКО
День 1. Эмбрионы — оплодотворенные яйцеклетки
День 2. Эмбрионы — классификация качества
Оценка качества эмбрионов по степени фрагментации (A. VanSteiterghemetal., 1995)
— Тип A — эмбрион отличного качества без ануклеарных (безъядерных) фрагментов (4А)
— Тип В — эмбрион хорошего качества с содержанием ануклеарных фрагментов до 20% (4В)
— Тип С — эмбрион удовлетворительного качества с содержанием ануклеарных фрагментов от 21% до 50% (4С)
— Тип D — эмбрион неудовлетворительного качества с содержанием ануклеарных фрагментов более 50% (4D)
День 3. Эмбрионы
На 3-и сутки эмбрион уже состоит из 6-8 бластомеров. До этого момента эмбрион развивался как бы «по инерции», исключительно на материнских «запасах», накопленных в яйцеклетке за время ее роста и развития в яичнике. Если «генетическая книга», в которой закодирована программа нормального развития эмбриона, содержит ошибки, эмбрион останавливается в развитии. Это природный процесс отбора генетически нормальных эмбрионов. Поэтому именно на стадии 4-8 бластомеров 4-19% эмбрионов останавливаются в развитии (так называемый «блок развития»).
День 4. Морула
На 4-е сутки развития эмбрион человека состоит уже, как правило, из 10-16 клеток, межклеточные контакты постепенно уплотняются и поверхность эмбриона сглаживается (процесс компактизации) – начинается стадия морулы (от лат. Morulae – тутовая ягода). Именно на этой стадии invivo (в организме матери) эмбрион попадает из маточной трубы в полость матки. К концу 4-х суток развития внутри морулы постепенно образуется полость – начинается процесс кавитации.
День 5. Бластоцисты
Перенос бластоцисты (перенос на 5-е сутки) имеет большую частоту успешной имплантации, позволяя переносить меньшее количество эмбрионов высокого качества, снижать риск многоплодной беременности при увеличении частоты наступления беременности.
Развитие бластоцисты и имплантация
Вероятность формирования бластоцисты
Преимущества переноса бластоцисты в ЭКО
Вспомогательный хэтчинг
Одним из основных факторов, от которого зависит успех лечения бесплодия методом экстракорпорального оплодотворения является способность эмбриона имплантироваться в стенку матки.
Яйцеклетка человека и эмбрион на ранних стадиях развития окружены защитной двухслойной оболочкой (zona pellucida – блестящая оболочка).
Она играет очень важную роль:
Оболочка эмбриона может быть очень толстой и плотной, и это может мешать его нормальному прикреплению к стенке матки.
Считается, что у «лабораторных» эмбрионов может снижаться выделение специальных ферментов, которые растворяют оболочку, делают её тоньше, способствуя выходу эмбриона. Поэтому было разработано искусственное подобие хетчинга, которое так и назвали – вспомогательный хэтчинг.
Суть метода вспомогательного хетчинга – искусственное истончение блестящей оболочки эмбриона различными способами:
Для этой процедуры мы используем лазерный аппарат OCTAX Laser Shot ТМ (Германия).
OCTAX Laser Shot ТМ — это передовая лазерная технология для ВРТ с цифровым управлением, цифровой обработкой, использованием последних компьютерных технологий и оптики высокого качества.
Суть метода лазерного хетчинга — это использование лазерного луча, что позволяет сделать высокоточный надрез необходимого размера. Лазерный хэтчинг делается только эмбрионам, предназначенным для переноса. Для этого эмбрион фиксируется микропипеткой и высокоточным лазером делается небольшое отверстие в наружной части его оболочки или несколько насечек для истончения ее слоя.
Лазерный хэтчинг практикуется в ведущих центрах всего мира. Исследования утверждают, что его использование повышает шансы наступления беременности (для пациентов которым показана эта процедура). Нет никаких данных о негативном влияние хэтчинга на результат программы лечения бесплодия, эта процедура абсолютно безопасна для самого эмбриона.
Лазерный хэтчинг назначается:
Криоконсервация эмбрионов
Одной из стремительно развивающихся технологий является замораживание или криоконсервация эмбрионов и яйцеклеток с последующим долговременным хранением. Первая беременность, полученная при переносе замороженных эмбрионов человека, наступила ещё в 1983 году. С этого момента технологии криконсервации совершенствовались, отрабатывались и проверялись исследователями и временем. Было установлено, что заморозка не ухудшает качества эмбрионов, но и не улучшает его. Только здоровые, крепкие эмбрионы переживают режим «заморозка / оттаивание».
Что же дает эта процедура пациентам, нужна ли она?
Конечно, нужна, особенно если в цикле ЭКО остаются «неперенесенные» эмбрионы хорошего качества. Такой случай возможен по нескольким причинам.
Во-первых, когда на пункции яичников было получено большое количество яйцеклеток, а в последствии и нормальных, жизнеспособных эмбрионов. Кстати, такой исход возможен не всегда, и пара которой предложили криоконсервацию — счастливчики.
Это дает некую подстраховку и уверенность в будущем. При удачной попытке в цикле стимуляции хранящиеся эмбрионы можно использовать для рождения второго и третьего ребенка, а в случае неудачи — повторить попытку в естественном цикле без большой гормональной нагрузки и операции.
Криоконсервации можно подвергнуть и яйцеклетки. Особенно это актуально в том случае, когда женщина планирует отсрочить материнство до наступления более подходящих социально-экономических условий. С возрастом организм женщины все хуже откликается на гормональную стимуляцию, и получить достаточное количество яйцеклеток хорошего качества не всегда возможно. Новые технологии дают возможность сохранить фертильность пациентам, планирующим химио- и радиотерапию. Криоконсервация в этих случаях дает возможность сохранить молодые, более здоровые яйцеклетки, и в последующем родить своего биологического ребенка.
Методов криоконсервации на сегодняшний день разработано несколько. В эмбриологической лаборатории центра «Тонус МАМА» используется метод ультра быстрого замораживания — витрификация по методу доктора М. Куваямы. Эмбриологи «Тонус МАМА» считают именно его наиболее эффективным, опираясь на многочисленные статистические исследования мирового уровня. Этот метод используется в клинической практике с 2000 года.
При витрификации (от лат. vitrum — стекло и facio — делаю, превращаю) происходит охлаждение до температуры жидкого азота, и переход яйцеклеток и эмбрионов в твердое, стекловидное состояние. Такой особенный вид заморозки возможен благодаря действию специальных веществ — криопротекторов.
Но криопротекторы — это не естественные для клеток составляющие, они токсичны. Чтобы криопротекторы в меньшей степени успели проявить свою токсичность, процедура витрификации проводится достаточно быстро, в чем и состоит преимущество этого метода заморозки. Только эмбрионы и яйцеклетки, застывшие в виде аморфной стекловидной массы, могут долго сохранять жизнеспособность, а при осторожном размораживании их жизнедеятельность полностью восстанавливается, что повышает возможность наступления беременности.
Полное освобождение от криопротекторов происходит приблизительно за 3 часа. По прошествии этого времени эмбрион полностью восстанавливается и готов для переноса в полость матки, а яйцеклетка к процедуре оплодотворения методом ИКСИ.
Особенностью криоконсервации является уплотнение оболочки яйцеклетки или эмбриона, но эта проблема легко решается. В случае разморозки эмбриона проводят вспомогательный хэтчинг (дополнительное рассечение оболочки для выхода из нее эмбриона и удачной имплантации в эндометрий). А в случае яйцеклеки проводят оплодотворение при помощи ИКСИ, и также вспомогательный хэтчинг развившемуся эмбриону.
Таким образом, витрификация позволяет:
Все это значительно увеличивает результативность процедуры ЭКО, сокращает ее стоимость и затрачиваемое время и дает возможность оказать помощь большему количеству семей, желающих иметь ребенка.
Фотографии эмбрионов человека, полученные на различных этапах витрификации
1 — эмбрион до криоконсервации;
2, 3, 4 — так выглядит эмбрион при температуре жидкого азота (−196 °C) — его клетки сильнее обезвожены, но живы;
5 — восстановление размера клеток эмбриона после разморозки (оттаивания).
Записаться на прием к акушеру-гинекологу, репродуктологу вы можете по телефону 8 (831) 411-11-20
Цитоплазматическая фрагментация предимплантационных эмбрионов человека
1) Клиника репродукции человека «АльтраВита», ООО «ЭКО ЦЕНТР», Москва, Россия;
2) ФГБОУ ВО «Московский государственный университет имени М.В. Ломоносова», физический факультет, Москва, Россия
В настоящей работе предпринята попытка обобщить и систематизировать знания относительно феномена цитоплазматической фрагментации эмбрионов, раскрыть причины и механизмы ее возникновения, а также описать ее влияние на жизнеспособность эмбрионов и клинические исходы программ экстракорпорального ЭКО. Поскольку с фрагментацией эмбрионов человека чаще всего сталкиваются во время эмбриологического этапа программ ЭКО, само явление изучено недостаточно. Редкие попытки исследовать этот феномен были узко сфокусированы на связи фрагментации с апоптозом. Причинами такого ограниченного знания явились этические препятствия и практические трудности, связанные с использованием для экспериментов яйцеклеток и эмбрионов человека. Отсутствие подходящей модели среди эмбрионов животных и относительно низкая встречаемость и значимость фрагментации в экспериментальной эмбриологии (у эмбрионов мыши) также способствовали исключению феномена фрагментации как достойного объекта исследования. В обзор вошли данные, полученные за достаточно обширный период, и предпринята попытка всесторонне охватить тему, касающуюся фрагментации эмбрионов. Заключение. Несмотря на то что влияние низкой доли фрагментации (25–30%) снижает жизнеспособность эмбрионов. Результаты исследований по микрохирургическому удалению цитоплазматических фрагментов, его положительному влиянию на жизнеспособность эмбрионов и клинические исходы программ ЭКО являются спорными и требуют дальнейшего подтверждения.
В рамках программ экстракорпорального оплодотворения (ЭКО), при культивировании эмбрионов in vitro, часто наблюдается их атипичное развитие. Появление плеоморфной популяции цитоплазматических фрагментов под zona pellucida является общей чертой ранних эмбрионов. У более чем 50% получаемых in vitro эмбрионов человека можно наблюдать присутствие цитоплазматической фрагментации, то есть наличие в перивителлиновом пространстве эмбриона фрагментов бластомеров различного размера, не содержащие ядра или содержащих фрагменты ядерного материала. Наблюдения показали, что наличие фрагментации часто сопровождается другими аномалиями в развитии, такими как мультиядерность бластомеров, дезорганизация и несоответствие размеров бластомеров стадии развития эмбриона, уменьшение межклеточной адгезии, увеличение толщины zona pellucida.
У эмбрионов человека, полученных посредством ЭКО, фрагментация была впервые описана в 1970 г. [1], однако этот феномен не является уникальным ни для метода ЭКО, ни для эмбрионов человека. Данное явление было описано как у эмбрионов человека, развивающихся in vivo [2–5], так и у эмбрионов практически всех видов млекопитающих, развивающихся в условиях как in vivo, так и in vitro.
Давно известно, что фрагментация эмбрионов человека ассоциирована со снижением их жизнеспособности [6] и представляет собой большую проблему в рамках повышения эффективности вспомогательных репродуктивных технологий (ВРТ). Причины возникновения фрагментации и ее влияние на жизнеспособность эмбриона являются актуальными вопросами как биологии развития, так и практической репродуктивной медицины.
Феномен фрагментации эмбрионов
В 70-х гг. прошлого века Эдвардс при in vitro культивировании эмбрионов человека наблюдал явление, которое он описал как «деление клеток без деления ядра» [1]. Этот феномен наблюдался как у развивающихся, так и у остановившихся в развитии эмбрионов.
В редких случаях фрагментация может возникать на стадии зиготы, перед сингамией, и связана с зиготической/эмбриональной остановкой в развитии. Значительная часть эмбрионов, подвергшихся фрагментации на стадии пронуклеусов, останавливаются в развитии на 1–2-й день либо становятся чрезмерно фрагментированными на 3-й день и непригодными ни для переноса эмбриона, ни для криоконсервации [7]. Цитоплазматическая фрагментация является наиболее распространенной аномалией развития эмбрионов человека, развивающихся in vitro.
Таким образом, фрагментация – это явление, в результате которого образуется плеоморфная популяция безъядерных/микроядерных/мультиядерных, ограниченных оолеммой цитоплазматических структур предимплантационного эмбриона, обнаруживаемых в перивителлиновом пространстве между бластомерами или между бластомерами и zona pellucida.
Фрагментация в условиях in vivo
Фрагментация не является феноменом, наблюдаемым исключительно в условиях in vitro. Эмбрионы различных видов животных, включая приматов и сельскохозяйственных животных, полученные in vivo, также могут быть фрагментированы.
Является ли фрагментация эмбрионов человека столь же распространенным явлением in vivo, как и in vitro, пока неясно. Информация о морфологических особенностях эмбрионов человека, развивающихся in vivo, весьма ограничена. С середины прошлого века было проведено 3 значимых исследования, которые отвечают на некоторые вопросы относительно феномена фрагментации эмбрионов, полученных in vivo [2–4].
В исследованиях Hertig (1954) 4 эмбриона были оценены как аномальные. Помимо присутствия многоядерных бластомеров, при анализе тонких срезов эмбрионов авторы обнаружили в них признаки «клеточной дегенерации или некробиоза», что можно интерпретировать как наличие фрагментации [2].
Ortiz и Croxatto (1979) ассоциировали феномен цитоплазматической фрагментации со «старением» неоплодотворенного ооцита: фрагментация была зафиксирована у 42% неоплодотворенных яйцеклеток, полученных через 96 ч и более, после овуляторного пика лютеинизирующего гормона (ЛГ) у женщин, воздерживающихся от половых контактов. Они также обнаружили 25 аномальных яйцеклеток, полученных из половых путей женщин, у которых были половые контакты. Неясно, была ли фрагментация вызвана «старением» неоплодотворенного ооцита или произошла после оплодотворения [3].
В исследовании Buster et al. (1985) было обнаружено, что 4 яйцеклетки, полученные при лаваже матки через 100 ч и более после овуляции у фертильных доноров ооцитов были полностью интактными. Другие 15 эмбрионов содержали от 2 до 16 бластомеров. Один 6-клеточный эмбрион имел полностью интактные, хотя и неравного размера, бластомеры. Некротический дебрис содержался в перивителлиновом пространстве одного 2-клеточного эмбриона (возможно, вследствие лизиса одного из бластомеров). Другой эмбрион, оцененный как 14-клеточный с неравномерным дроблением, мог фактически содержать цитоплазматические фрагменты, однако сейчас это уже трудно установить [4].
В целом фрагментация присуща эмбрионам, полученным как in vitro, так и in viv.