что такое фиш обследование
ТЕСТ HER2 FISH
Как выбрать правильное лечение рака молочной железы
Чтобы наиболее точно и полно диагностировать заболевание и начать его своевременное лечение, необходимо принимать во внимание рецепторный статус гормонов опухоли, а также обратить внимание на показатели онкомаркеров – в частности, на показатели HER2 и Ki 67.
Выявить рецепторный статус опухоли можно при помощи гормонального теста. Для определения статуса HER2 применяются иммуногистохимия (ИГХ) и флуоресцентная гибридизация in situ (FISH). Данные тесты могут быть проведены одновременно с первым этапом хирургического вмешательства. Могут использоваться образцы раковой ткани с предыдущих биопсий или хирургического вмешательства.
При проведении FISH-теста на образце ткани пациента используются флуоресцентные метки, которые связываются только с определеннымиучастками хромосом. Затем с помощью флуоресцентного микроскопа определяют участки хромосом, с которыми связались флуоресцентные зонды, и наличие возможных отклонений, провоцирующих развитие рака.
Транслокации помогают диагностировать некоторые виды лейкемии, лимфомы и саркомы. Наличие дупликации в раковых клетках молочной железы помогает врачу подобрать оптимальное лечение.
Данный тест не заменяет общепринятую диагностику при раке молочной железы, а является вспомогательным обследованием, позволяющим лучше понимать прогноз заболевания и строить лечение соответственно ему. В частности, тест может помочь определить агрессивность опухоли в дальнейшем, а, следовательно, и назначить постоперационную химиотерапию, если, например, маленькое на первый взгляд образование имеет высокий прогноз рецидива. Либо по результатам теста какие-то виды лечения могут быть отменены как нецелесообразные.
HER2 принуждает рецепторы на поверхности опухолевой клетки к гиперэкспрессии — слишком большой активности по отлавливанию фактора роста и передаче клетке сигналов по неуправляемому и очень быстрому, даже по сравнению с раковыми клетками, делению. Опухоли, имеющие HER2, становятся очень агрессивными и молниеносно вырабатывают невосприимчивость к лекарствам.
Данный показатель имеет важное значение при диагностике раковых опухолей. Он позволяет определить чувствительность опухоли к гормонотерапии.
Ещё один важный фактор – индекс пролиферативной активности ki-67. Маркер Ki 67 является показателем скорости деления раковых клеток. Его оценка происходит в процентах. Показатель Ki 67 – прогностический. Уровень Ki 67 30% при раке молочной железы говорит о том, что опухоль развивается достаточно быстро, и она среагирует на химиотерапию. При уровне ниже 30% лечение можно проводить при помощи гормонотерапии.
Важно! Определение данного маркера является актуальным по тому, что он позволяет определить скрытый пролиферативный потенциал злокачественного образования. Позитивная реакция Ki-67 является прогнозирующим показателем при выборе химиотерапии и лучевой терапии. Согласно данным учёных при уровне Ki 67 ниже 10 % выживаемость почти 95%, а при уровне выше 10 % — уровень общей 5-ти летней выживаемости составляет около 85 %. Исходя из этого можно сказать, что при уровне Ki 67 90 % при раке молочной железы выживаемость фактически равна нулю.
Статус HER2
Мутация гена HER2, расположенного в 17 хромосоме, является одной из основных причин возникновения раковых опухолей. Специальный тест на статус HER2 позволит не только назначить наиболее эффективное лечение, но и прогнозировать риск возникновения опухолей и различных заболеваний.
HER2 это ген, аббревиатура которого происходит от Human Epidermal Growth Factor Receptor 2 – человеческий рецептор эпидермального фактора роста. У него есть ещё несколько имён: Neu, а также же ErbB-2, он же CD340 или p185. Когда его обнаружили впервые (как думалось), каждый исследователь называл его по-своему. А после выяснилось, что это совсем не разные гены, а один и тот же, поэтому ему нашли унифицированное официальное название: ген HER2.
Ген HER2/neu локализуется в 17 хромосоме, и нарушение нормального функционирования (в том числе мутация какого-либа гена данной хромосомы) может вызвать ряд заболеваний: спорадический рак груди, рак прямой кишки, диабет, буллезный эпидермолиз, гемолитическая анемия, эссенциальная гипертония, рак языка, острая лейкемия, мышечная дистрофия, миостенический синдром, миелопероксидазная недостаточность, наследственная миотония, нейробластома, рак яичника, синдром Ватсона и др.
HER2 принуждает рецепторы на поверхности опухолевой клетки к гиперэкспрессии — слишком большой активности по отлавливанию фактора роста и передаче клетке сигналов по неуправляемому и очень быстрому, даже по сравнению с раковыми клетками, делению. Есть ещё один научный термин, характеризующий состояние этого гена, – амплификация, то есть образование в нитке ДНК хромосомы не одной копии гена, а множества, как будто заклинило кнопку копировального аппарата генов на ксероксе. Опухоли, имеющие HER2, становятся очень агрессивными и молниеносно вырабатывают невосприимчивость к лекарствам.
Что такое фиш обследование
Подобно тому, как в ходе Саузерн-блоттинга нуклеотидные зонды используют для идентификации фрагментов ДНК, цитогенетики могут применять подобные зонды для анализа хромосомных аберраций. Для этого гибридизируют меченные флюоресцентным красителем зонды с ДНК, содержащейся в фиксированных хромосомах на предметных стеклах.
Эта техника называется Fluorescence In Situ Hybridisation (FISH), поскольку ДНК, содержащаяся в интерфазном хроматине или в метафазных хромосомах, фиксирована и денатурируется на стекле в одном месте (т.е. in situ), для обработки меченым зондом, гибридизирующимся с хромосомной ДНК. Зонд флюоресцирует при освещении хромосом светом с длиной волны, возбуждающей флюоресцентный краситель. Положение гибридизационного сигнала и, таким образом, позицию сегмента ДНК с гибридизированным зондом определяют микроскопически.
Обычно для FISH-анализа используют зонды — фрагменты ДНК, имеющие уникальное положение в хромосоме. Такие зонды проходят гибридизацию и помечают место в каждой гомологичной хромосоме, соответствующее нормальному положению последовательности зонда. FISH-зонд также может быть сложной смесью ДНК, полученной из всего плеча или даже целой хромосомы. В зависимости от состава зонда, при гибридизации с ним помечается вся хромосома или ее часть.
Такие смеси зондов известны как хромосомные зонды. Наконец, можно объединить 24 различных хромосомных зонда, меченных различными комбинациями флюоресцентных красителей, испускающих свечение разной длины волны, для каждой из 24 хромосом человека. Каждая хромосома помечается зондом с собственной характерной комбинацией длин световой волны. Все 24 хромосомных зонда объединяют и используют для FISH-анализа метафазных хромосом. Эта техника известна как спектральное кариотипирование (SKY).
Поскольку каждый хромосомоспецифичный зонд имеет флюоресценцию с собственной комбинацией длин волн, мутантные хромосомы, состоящие из частей различных хромосом, при SKY-анализе хорошо различаются, а хромосомы, включенные в перестройку, могут быть легко идентифицированы. FISH, использующий единичную непрерывную последовательность нуклеотидов, хромосомоспецифические зонды и SKY-метод с комбинацией зондов для всех хромосом, широко применяют в клинической цитогенетике для обнаружения хромосомных аберраций, таких как делеции, инсерции и транслокализации.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Что такое фиш обследование
Соматические клетки человека содержат диплоидный (2n = 46), а половые — гаплоидный (n = 23) наборы хромосом. Неполовые хромосомы (аутосомы) нумеруются по мере уменьшения их длины (от 1 до 22), а половые хромосомы указываются отдельно (X и Y).
Систематизация хромосом по парам и идентификация измененных хромосом в каждой отдельной метафазной пластинке, согласно Международной цитогенетической номенклатуре, создает кариотип клетки. Нормальный мужской кариотип — 46, XY, нормальный женский 46, XX.
Каждая хромосома разделена центромерой (перетяжкой) на два плеча: короткое, которое по международной номенклатуре обозначают латинской буквой р, и длинное — q. Терминальные участки хромосомных плеч называют теломерными.
При специальной окраске каждая хромосома приобретает индивидуальный рисунок, плечи хромосом выглядят поперечно исчерченными, в них видны светлые и темные полосы (bands) разной интенсивности. Эти полосы пронумерованы и объединены в районы (regions). Район может содержать несколько полос.
При описании любого участка хромосомы, в том числе перестроенного, используют 4 показателя:
1) номер хромосомы;
2) плечо;
3) район;
4) полоса.
Например, 14q32 (место локализации гена Н-цепей иммуноглобулина, область перестроек при В-клеточных лимфомах и остром лимфобластном лейкозе) — длинное плечо хромосомы 14 и вторая полоса района 3.
Различают числовые и структурные изменения кариотипа.
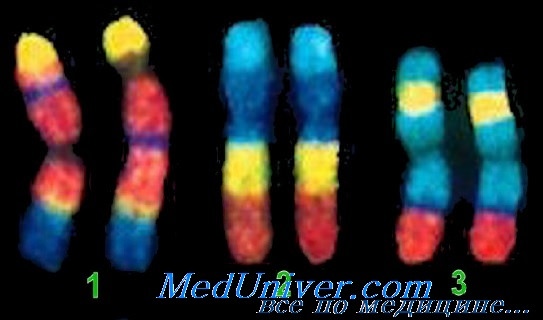
Применение FISH на интерфазных ядрах, а не на метафазных хромосомах (интерфазный анализ) позволяет за короткое время изучить сотни клеток. Метод быстро развивается, совершенствуется, количество зондов растет. В настоящее время уже многие специфические хромосомные аномалии могут быть обнаружены с помощью FISH.
Можно проводить FISH на клетках, окрашенных по Романовскому—Гимзе или в сочетании с различными цитохимическими и иммунохимическими методиками. Это создает условия для изучения гистогенеза клеток, в которых произошли изменения кариотипа.
В хорошо оборудованных лабораториях используется дорогостоящая установка для спектрального анализа хромосом SKY (multicolor spectral karyotyping), в основе SKY тоже лежит принцип FISH. Эта установка позволяет увидеть весь кариотип, причем каждая хромосома окрашивается в свой цвет.
Использование SKY дает возможность улавливать большинство транслокаций, поскольку маркеры, возникшие в результате обмена между хромосомами, окрашенными в разные цвета, состоят из разноцветных участков. Такие маркеры очень демонстративны, и при определенном опыте легко увидеть и понять, какие хромосомы приняли участие в перестройке и образовании маркеров.
Существуют опухоли и лейкозы, при которых происхождение маркерных хромосом невозможно установить без применения SKY или некоторых других модификаций FISH. Изредка возникают ситуации, когда надежную информацию о кариотипе можно получить только при сочетанном использовании перечисленных методических приемов.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
FISH-возможности использования в гематологической клинике

За последнее десятилетие в гематологической цитогенетике произошли принципиально важные изменения, связанные с появлением и быстрым развитием молекулярно-цитогенетических исследований. Развитие молекулярной цитогенетике позволило перейти на новый уровень изучения клональных генетических нарушений, лежащих в основе развития онкогематологических заболеваний.
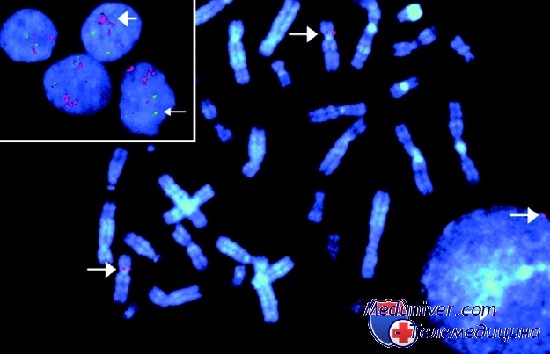
Предметом анализа в подобном исследовании являются не только метафазы, но и неделящиеся клетки, составляющие абсолютное большинство клеток в любой популяции. Гибридизация происходит со всеми клетками независимо от фазы клеточного цикла. Это означает что для анализа доступны клеточные популяции в целом, что координально изменяет ситуацию по сравнению с классической цитогенетикой. Становятся доступными для анализа те случаи, когда невозможно получить делящиеся клетки. Кроме того, исключается фактор выборочного выхода в митоз определенных популяций клеток, который при анализе метафаз способен порой существенно исказить реальную картину. Возможность анализа всех без исключения клеточных популяций, присутствующих в исследуемом препарате, включая терминально-дифференцированные клетки, делает метод FISH объективным и репрезентативным методом исследования. С введением в практику этого метода стремительно стало нарастать количество исследований по его использованию в клинической цитогенетике, в том числе применительно к онкогематологическим заболеваниям. В настоящее время метод FISH является важнейшем инструментом для цитогенетического анализа клональных нарушений у гематологических больных.
ДНК-зонды, используемые для FISH-исследования представляют собой созданные по специальным технологиям нуклеотидные последовательности ограниченного размера. ДНК-зонд несет «метку», то есть содержит нуклеотиды, напрямую связанные с флуорохромом, или связанные с гаптеном для дальнейшей визуализации антителами, несущими флуорохром. В основе метода лежит проведение реакции гибридизации между ДНК-зондом и комплементарным ему участком ядерной ДНК препарата, нанесенного на предметное стекло. Связанная с ДНК-зондом метка может быть визуализирована с помощью флуоресцентного микроскопа и позволяет определить место связывания зонда в интерфазном ядре или на метафазной пластинке.
Флуоресцентная гибридизация in situ включает несколько обязательных этапов: денатурации, гибридизации, выявления (детекции) ДНК-зонда.
Полученные одиночные полинуклеотидные цепи ДНК вступают затем в реакцию гибридизации с предварительно денатурированным в тех же условиях ДНК-зондом. Обязательным условием эффективной гибридизации является многократное избыточное количество зонда по отношению к количеству ядерной ДНК. Только в этом случае зонд может успешно конкурировать за место связывания со второй комплементарной цепью ДНК, присутствующей на стекле. Инкубацию проводят в гибридизационном буфере при 37 °C, время гибридизации зависит от типа используемого зонда. В результате гибридизации вновь образуется двухцепочечная молекула, включившая ДНК-зонд, связанный с комплементарной ему последовательностью нуклеотидов. После этого полученные препараты многократно отмывают для удаления несвязавшегося избытка зонда и предотвращения возможного неспецифического связывания его с другими участками ДНК.
Задачей следующего этапа является идентификация встроенного ДНК-зонда и проведения визуального анализа с помощью флуорисцентного микроскопа. Этот этап зависит от типа используемого ДНК-зонда. В случае, если ДНК-зонд был «помечен» гаптеном, для его детекции применяют иммунохимическое связывание с несущими флуорохром антителами. При использовании ДНК-зондов, уже содержащих в своем составе флуорохром, этого этапа не требуется.
Следующим шагом является контрастное по цвету окрашивание клеточных ядер с помощью ДНК-специфичного флуоресцентного красителя. После этого препарат готов к анализу с помощью флуоресцентного микроскопа, где под воздействием возбуждающего света определенного спектра, молекулы флуорохромов начинают испускать кванты света, длина волны которых зависит от свойств используемого флуорохрома. Анализ флуоресцентных сигналов позволяет получить объективную информацию о состоянии исследуемого хромосомного локуса.
ДНК-зонды являются центральным и определяющим звеном при проведении in situ гибридизации. Необходимо всегда помнить, что та или иная хромосомная аномалия может быть выявлена только в том случае, если в распоряжении исследователя имеется соответствующий задаче ДНК-зонд. От типа зонда зависит и система анализа наблюдаемых флуоресцентных сигналов. Поэтому полная информация о специфике используемого зонда является залогом успешной гибридизации и правильной оценки полученных результатов FISH-анализа.
ДНК-зонды бывают двух типов – непрямые и прямые, в зависимости от того, каким образом они помечены. В непрямых ДНК-зондах в синтезированную полинуклеотидную цепь включены нуклеотиды, к которым присоединены гаптены: биотин (витамин H) или дигоксигенин (фитогормон). Эти биологически активные вещества имеют небольшого размера молекулы, обладают термоустойчивостью и легко выдерживают жесткие условия тепловой денатурации ДНК и горячего отмывания препаратов при проведении гибридизации, кроме того они недороги и удобны в работе.
Детекция биотинилированных ДНК-зондов основана на высоком сродстве к биотину белка авидина. Конъюгированный с флуорохромом авидин необратимо связывается с молекулами биотина, наблюдается затем флуоресцентный сигнал позволяет обнаружить ДНК-зонд в клеточном ядре. Меченые дигоксигенином ДНК-зонды инкубиуют с антителами к дигоксигенину, конъюгированными с флуорохромом. Интенсивность флуорисценции непрямых зондов может быть усилена за счет дополнительной инкубации с меченными флуорохромом антителами. Эта возможность усиления флуорисцентного сигнала повышает чувствительность метода при использовании непрямых зондов.
При использовании прямых ДНК-зондов, уже содержащих в своем составе флуорохром, дополнительного инкубирования с антителами естественно не требуется.
В качестве флуорохромов для мечения зондов чаще всего используют зеленый флуоресцеин (FITC), красные родамин и техасский красный (Texas Red). Для визуализации ядерного материала на препараты наносят раствор, содержащий флуорохром, тропный кДНК. В состав раствора входит также вещество, предохраняющее флуорохромы от быстрого истощения.
Основными флуорохромами, используемыми для визуализации клеточных ядер, являются красный пропидиум йодид (PI) и голубой 4.6 диамино-2-фенилиндол (DAPI). Главный принцип при подборе флуорохромов – это принцип цветового контраста.
ДНК-зонды, применяемые в гематологической цитогенетике, можно подразделить на несколько групп.
ДНК-зонды к центромерным участкам хромосом предназначены для идентификации центромерных регионов хромосом и выявления количественных нарушений кариотипа в интерфазных ядрах и метафазах. Эти зонды содержат сравнительно короткие последовательности нуклеотидов, комплементарные многочисленным хромосом-специфическим альфа-сателлитным ДНК-повторам, локализованным в центромерных участках хромосом. Поэтому для зондов этого типа характерна строгая хромосомная специфичность и яркость генерированного флуоресцентного сигнала.
Для выявления диагностически и прогностически значимых количественных хромосомных нарушений в гематологии используют индивидуальные центромерные зонды, например к хромосомам 7,8,12,X/Y. При использовании одного центромерного ДНК-зонда в нормальном интерфазном ядре или метафазе наблюдается два ярких флуоресцентных сигнала. В случае изменения числа копий данной хромосомы наблюдается один (моносомия), три (трисомия) или более сигналов.
При использовании комбинированного ДНК-зонда к хромосомам X/Y центромерные участки половых хромосом помечены флуорохромами генерирующими сигнал разного цвета. Клетки с женским кариотипом в этом случае характеризуются двумя одноцветными сигналами, в клетках с мужским кариотипом наблюдается два сигнала разного цвета.
ДНК-зонды к теломерным участкам хромосом предназначены для выявления делеций и перестроек, затрагивающих концевые участки плечей хромосом. Теломерные ДНК-зонды специфичны для p или q плечей хромосом и комплементарны участку длиной около 300 kb от конца хромосомы. Как правило, зонды к теломерным участкам p и q плечей связаны с разными флуорохромами. Это обстоятельство позволяет проводить детекцию двух различных концевых хромосомных участков на одном цитогенетическом препарате. При проведении анализа концевых делеций с помощью подобных зондов в интерфазных ядрах возникает неопределенность. Отсутствие одного сигнала может свидетельствовать как о делеции концевого участка хромосомы, так и о потере хромосомы. В этом случае удобно одновременно использовать ДНК-зонд к центромерному участку той хромосомы, связанный с флуорохромом другого цвета. В интерфазном ядре, несущем делецию, будет наблюдаться два флуоресцентных сигнала от центромерных участков хромосомы и только один сигнал другого цвета – от теломерного участка.
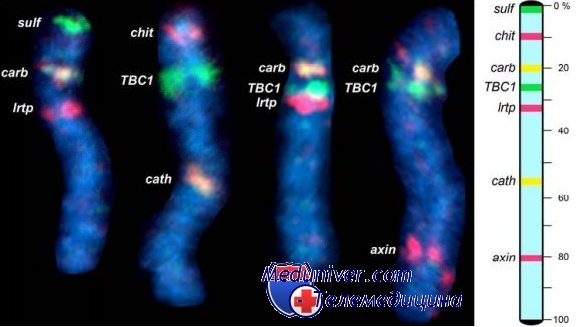
Локус-специфичные ДНК-зонды составляют еще одну группу зондов. К этому виду относят все ДНК – зонды, которые гибридизуются с уникальными (неповторяющимися) последовательностями ДНК. Среди них заметное место занимают зонды, предназначенные для выявления диагностически и прогностически значимых в гематологии транслокаций, делеций, инверсий.
Проведенные исследования эффективности применения FISH-анализа при различных онкогематологических заболеваний в сравнении с результатами, полученными при кариотипировании, показали, что FISH-анализ позволяет выявлять исследуемые хромосомные абберации достоверно чаще. Во-первых, во всех без исключения случаях(100 %), когда они были обнаружены при стандартном кариотипировании. Во-вторых, в ряде случаев, когда был зарегистрирован нормальный кариотип либо другие хромосомные аномалии, а также в отсутствие делящихся клеток. Кроме того, FISH-анализ позволяет эффективно решить задачу выявления малых клеточных клонов с хромосомными аберрациями, не обнаруженных при стандартном исследовании. Для клинической практики это особенно актуально при детекции минимальной остаточной болезни, выявлении ранних рецидивов, исследовании опухолей с низким митотическим индексом.
Что такое фиш обследование
Традиционная цитогенетика при изучении кариотипа всегда была ограничена бэндовым уровнем разрешения. Даже при использовании высокоразрешающих методов дифференциального окрашивания хромосом мы всего лишь выявляли большее количество бэндов на хромосоме, но не были уверены, что добираемся до молекулярного уровня разрешения. Последние достижения ДНК-технологий и цитогенетики сделали возможным использование методов FISH для анализа изменений хромосомной ДНК на молекулярном уровне. Молекулярная цитогенетика обеспечила революционный прорыв в цитогенетике, позволив:
• осуществлять анализ структуры ДНК хромосом в диапазоне 10-100 килобаз;
• проводить диагностику неделящихся интерфазных клеток, что оказало огромное влияние на пренатальную диагностику и преимплантационную генетическую диагностику (ПГД).
Технология FISH использует ДНК-зонд, который связывается или ренатурирует специфические последовательности ДНК внутри хромосомы. Денатурированный зонд инкубируется с нативной ДНК клетки, также денатурированной до одноцепочечного состояния. Зонд замещает биотин-дезоксиуридинтрифосфат или дигоксигенин-уридинтрифосфат на тимидин. После ренатурации зондом нативной ДНК комплекс «зонд-ДНК» можно обнаружить при добавлении меченного флюорохромом авидина, связывающегося с биотином, или меченного флюорохромом антидигоксигенина. Дополнительное усиление сигнала можно получить, добавив антиавидин и изучив получившийся комплекс с помощью флюоресцентной микроскопии. Пометив несколькими различными флюорохромами разные ДНК-зонды, можно одновременно визуализировать несколько хромосом или хромосомных сегментов внутри одной клетки в виде разноцветных сигналов.
Возможность определения специфических генных сегментов, имеющихся или отсутствующих на хромосомах, позволила диагностировать синдромы генных последовательностей на уровне ДНК, как, впрочем, и транслокации в интерфазных ядрах, зачастую — в отдельных клетках.
Материалом для FISH могут служить или метафазные хромосомы, полученные из делящихся клеток, или интерфазные ядра из клеток, не находящихся в стадии деления. Срезы предварительно обрабатывают РНКазой и протеиназой для удаления РНК, которая может вступать в перекрестную гибридизацию с зондом и хроматином. Затем их нагревают в формамиде, чтобы денатурировать ДНК, и фиксируют ледяным спиртом. Затем зонд подготавливают к гибридизации путем нагревания. После этого зонд и хромосомный препарат смешивают и герметизируют покровным стеклом при 37 °С для гибридизации. Изменяя температуру инкубации или солевой состав раствора для гибридизации, можно повысить специфичность связывания и уменьшить фоновую маркировку.
Эффективность технологии FISH впервые была продемонстрирована при локализации генов на хромосомах. С внедрением метода флюоресцентного мечения, гибридизация in situ оказалась незаменимой для диагностики хромосомных аномалий, не выявляемых традиционными методами бэндинга. FISH также сыграла ключевую роль в совершении одного из самых необычных открытий современной генетики — геномного импринтинга.
Свое развитие технология FISH получила в трех формах. Центромерные, или альфа-сателлитные, зонды характеризуются относительной хромосомной специфичностью, их использовали чаще всего в генетике интерфазных клеток. Эти зонды генерируют в некоторой степени диффузные сигналы адекватной силы в области центромеры, но не вступают в перекрестную гибридизацию с хромосомами, имеющими аналогичные центромерные последовательности. В настоящее время разработаны однокопийные зонды, дающие дискретный сигнал от специфического бэнда хромосомы и позволяющие избежать феномена перекрестной гибридизации. Эти зонды также можно использовать для определения копийности и специфичных регионов хромосомы, предположительно связанных с тем или иным синдромом. Однокопийные и центромерные зонды, разработанные для хромосом 13, 18, 21, X и Y, используют для пренатальной диагностики.
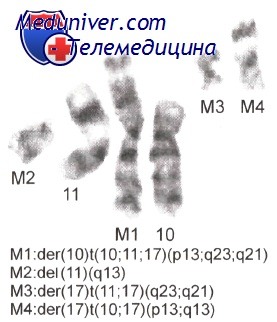
Возможно также «окрашивание» целых хромосом с помощью FISH. Благодаря технологии спектрального кариотипирования, при которой используют смесь различных флюорохромов, теперь стало возможным создание уникального флюоресцентного паттерна для каждой отдельной хромосомы с 24 отдельными цветами. Эта технология позволяет определять сложные хромосомные перестройки, не видимые при использовании традиционных цитогенетических методик.
Метод FISH в пренатальной диагностике. Для женщин старшего репродуктивного возраста беременность может оказаться поводом не столько для радости, сколько для беспокойства. С возрастом женщины связан риск развития хромосомных аномалий плода. Амниоцентез, осуществляемый на 16-й неделе беременности, с последующим анализом кариотипа занимает 10-14 дней. Использование FISH в предварительном обследовании позволяет ускорить диагностику и уменьшить время ожидания. Большинство генетиков и лабораторий придерживаются мнения, что метод FISH не следует использовать изолированно для принятия решения о дальнейшем ведении беременности. Метод FISH обязательно следует дополнять кариотипическим анализом, и его результаты как минимум должны коррелировать с патологической картиной ультразвукового исследования (УЗИ) или биохимического скрининга по крови матери.
Синдромы генных последовательностей известны также под названием синдромов микроделеции, или сегментарной анеусомии. Это делеции смежных фрагментов хромосомы, вовлекающие, как правило, многие гены. Синдромы генных последовательностей были впервые описаны в 1986 г. с использованием классических методик цитогенетики. Теперь, благодаря FISH, возможна идентификация субмикроскопических делеции на уровне ДНК, что позволило выявлять наименьший делецированный регион, связанный с развитием того или иного синдрома, получивший название критического региона. После определения критического региона для синдрома зачастую становится возможным идентифицировать специфические гены, отсутствие которых признают ассоциированным с этим синдромом. В недавно вышедшем руководстве по синдромам генных последовательностей сообщают о 18 синдромах делеции и микроделеции, ассоциированных с 14 хромосомами. Некоторые наиболее часто встречающиеся синдромы генных последовательностей и их клинические проявления приведены в табл. 5-2.
Теломеры — образования, прикрывающие с концов длинные и короткие плечи хромосом. Они состоят из повторяющихся последовательностей TTAGGG и предотвращают слияние концевых участков хромосом между собой. Теломерные зонды играют важную роль в распознавании комплексных транслокаций, которые невозможно определить традиционными цитогенетическими методами. Кроме того, одним из открытий Проекта «Геном человека» был тот факт, что регионы хромосом, прилежащие к теломерам, богаты генами. В настоящее время показано, что субмикроскопические субтеломерные делеции ответственны за возникновение многих генетически обусловленных заболеваний.
— Вернуться в оглавление раздела «физиология человека»