Что такое энтальпия и энтропия
Основы теплотехники
Что такое энтальпия?
Попробуем уяснить физический смысл и суть понятия энтальпия, которое широко используется при расчетах и прогнозировании различных процессов в теплотехнике.
Уравнение первого закона термодинамики, выражающее закон сохранения энергии в термодинамических процессах, можно преобразовать к следующему виду:
Слово энтальпия в переводе с греческого означает «нагреваю».
Энтальпия тоже является параметром состояния, поскольку составляющие u и pv имеют для каждого состояния вполне определенные значения. Тогда первый закон термодинамики можно записать в виде:
Выражение (cv + T) в соответствии с уравнением Майера можно выразить через cp :
Значение энтальпии различных веществ в разных состояниях приведены в справочниках.
Энтальпия используется в вычислениях для определения разницы уровней энергии между двумя состояниями термодинамической системы.
Это бывает необходимо для настройки оборудования и определения коэффициента полезного действия процесса.
Понятие энтропии
В переводе с греческого слово «энтропия» означает превращение.
Этот параметр не имеет физического смысла и введен формально на основании математических построений для облегчения решения многих теплотехнических задач применительно к идеальному газу.
Произведение энтропии на изменение температуры системы характеризует изменение энергии системы. При этом даже если энергия системы будет изменяться, энтропия этой системы может оставаться неизменной. Очевидно, что при изотермических процессах (температура системы неизменна) составляющая энергии системы в которую входит энтропия равна нулю.
В общем случае изменение энергии термодинамической системы не является обязательным условием изменения энтропии этой системы.
Скачать теоретические вопросы к экзаменационным билетам
по учебной дисциплине «Основы гидравлики и теплотехники»
(в формате Word, размер файла 68 кБ)
Скачать рабочую программу
по учебной дисциплине «Основы гидравлики и теплотехники» (в формате Word):
Скачать календарно-тематический план
по учебной дисциплине «Основы гидравлики и теплотехники» (в формате Word):
Что такое энтальпия и энтропия
Основы биохимии. Физическая химия
Энтальпия и энтропия

А.Теплота реакции и калориметрия
У многих химических реакций ΔG и ΔН имеют близкие значения (см., например, Б1 ). Это обстоятельство позволяет определять энергетическую ценность пищевых продуктов. В живых организмах пища обычно окисляется кислородом до СО 2 и H 2 O (см. с. 114). Максимальную химическую работу, которую питательные вещества могут совершить в организме, т. е. ΔG реакции окисления компонентов пищи, определяют путем сжигания взятой навески соответствующего вещества в калориметре в атмосфере кислорода. Выделившееся тепло повышает температуру воды в калориметре. По разности температур рассчитывают теплоту реакции (энтальпию сгорания).
Б. Энтальпия и энтропия
Энтропия системы тем выше, чем больше степень неупорядоченности (беспорядка) системы. Таким образом, если процесс идет в направлении увеличения неупорядоченности системы (а повседневный опыт показывает, что это наиболее вероятный процесс), ΔS — величина положительная. Для увеличения степени порядка в системе (ΔS > 0) необходимо затратить энергию. Оба этих положения вытекают из фундаментального закона природы — второго закона термодинамики. Количественно зависимость между изменениями энтальпии, энтропии и свободной энергии описывается уравнением Гиббса-Гельмгольца :
Поясним зависимость этих трех величин на двух примерах.
Энтальпия и энтропия
Вы будете перенаправлены на Автор24
Термодинамические свойства систем выражают при помощи характеристических функций и их производных. Вид характеристической функции зависит от переменных, которые используют при описании состояния системы. Так, если в качестве переменных избрать внутреннюю энергию и объем, то характеристической функцией может служить энтропия.
Функции состояния
$\sigma =f_<1>\left( x,y \right)dx+f_<2>\left( x,y \right)dy\, \left( 1\right)$,
К функциям состояния в термодинамике, например, можно отнести:
Функции состояния часто носят названия: термодинамические функции или термодинамические потенциалы.
Термодинамических функции имеется бесконечно много. Допустим, что нам известна одна термодинамическая функция, тогда функция от этой функции – термодинамический потенциал.
Энтальпия
Энтальпию, как физическую величину, предложил ввести А.У. Портер, как содержание тепла при неизменном давлении в 1922 году.
Энтальпией ($H$) называют функцию, которая определена равенством:
Готовые работы на аналогичную тему
При постоянном давлении можно записать, что:
Энтальпию можно связать с теплоемкостью при постоянном давлении соотношением:
$C_
=\left( \frac
\left( 4 \right),$
Полный дифференциал энтальпии ($H(S,p)$) можно записать так:
В процессе при постоянном давлении изменение энтальпии равно:
$\Delta H=\Delta U+p\Delta V=\Delta Q\left( 6 \right)$.
Энтальпию применяют при расчетах выделяющего тепла для процессов, происходящих при постоянном давлении.
Энтальпию сложной системы можно находить как сумму энтальпий отдельных ее компонент.
Пусть термодинамическая система состоит из нескольких веществ, тогда имеем:
$dH=TdS+Vdp+\sum\limits_i \mu_ dm_\left( 8 \right)$.
Энтальпию идеального газа можно выразить через коэффициент Пуассона этого газа (γ):
Энтропия
Энтропия, как и энтальпия, является функцией состояния.
Для обратимого процесса энтропию определяют как:
Формула (9) определяет энтропию с точностью до постоянной величины. Физическим смыслом обладает именно изменение энтропии, а не она сама.
Как и энтальпия, энтропия аддитивная величина:
$S=\sum\limits_i S_ \left( 11 \right)$,
$S_i$ – энтропия компоненты термодинамической системы.
Процесс в замкнутой термодинамической системе, протекающий без изменения энтропии называют изоэнтропийным. Это, например, адиабатный процесс, происходящий без теплообмена системы с внешней средой.
Энтропия имеет связь с вероятностью в термодинамике.
Формула Больцмана реализует связь термодинамической вероятности и энтропии:
$S=k_b\ln \left( W \right)$ (12),
Смысл энтропии в том, что она является мерой беспорядка в термодинамической системе. Большее количество микросостояний, которое осуществляет макросостояние, соответствует большей энтропии.
Если система находится в состоянии термодинамического равновесия, что соответствует наиболее вероятному состоянию системы, количество микросостояний наибольшее, энтропия в этом случае максимальна.
Соотношения Максвелла
Это означает, что только две из названных переменных являются независимыми.
Запишем полные дифференциалы от термодинамических потенциалов:
Используя выражения для дифференциалов термодинамических функций получим:
Получаем уравнение Максвелла:
Применяя сказанное выше полный дифференциал энтальпии можно записать как:
$dH=C_
dT+\left[ V-T\left( \frac<\partial V> <\partial T>\right)_
\right]dp\left( 14 \right)$,
Полный дифференциал энтропии:
Если в качестве независимых переменных использовать температуру и давление, тогда имеем:
Получи деньги за свои студенческие работы
Курсовые, рефераты или другие работы
Автор этой статьи Дата последнего обновления статьи: 29 03 2021
Что такое энтальпия и энтропия


Изменение свободной энергии (ΔG) химической реакции зависит от ряда факторов, в том числе от температуры и концентрации реагентов (см. с. 24). В этом разделе обсуждаются еще два параметра, которые связаны со структурными и энергетическими изменениями молекул.
У многих химических реакций ΔG и ΔН имеют близкие значения (см., например, Б1 ). Это обстоятельство позволяет определять энергетическую ценность пищевых продуктов. В живых организмах пища обычно окисляется кислородом до СО 2 и H 2 O (см. с. 114). Максимальную химическую работу, которую питательные вещества могут совершить в организме, т. е. ΔG реакции окисления компонентов пищи, определяют путем сжигания взятой навески соответствующего вещества в калориметре в атмосфере кислорода. Выделившееся тепло повышает температуру воды в калориметре. По разности температур рассчитывают теплоту реакции (энтальпию сгорания).
Энтропия системы тем выше, чем больше степень неупорядоченности (беспорядка) системы. Таким образом, если процесс идет в направлении увеличения неупорядоченности системы (а повседневный опыт показывает, что это наиболее вероятный процесс), ΔS — величина положительная. Для увеличения степени порядка в системе (ΔS > 0) необходимо затратить энергию. Оба этих положения вытекают из фундаментального закона природы — второго закона термодинамики. Количественно зависимость между изменениями энтальпии, энтропии и свободной энергии описывается уравнением Гиббса-Гельмгольца :
Поясним зависимость этих трех величин на двух примерах.
Энтальпия — что это такое простыми словами
Про энтальпию на простом языке
При работе с какими-либо расчётами, вычислениями и выполнении прогноза разнообразных явлений, связанных с теплотехникой, каждый сталкивается с понятием энтальпия. Но для людей, специальность которых не касается теплоэнергетики или которые лишь поверхностно сталкиваются с подобными терминами, слово «энтальпия» будет наводить страх и ужас. Итак, давайте разберёмся, действительно ли всё так страшно и непонятно?
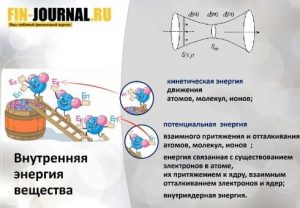
Если попытаться сказать совсем просто, под термином энтальпия понимается энергия, которая доступна для преобразования в теплоту при некотором постоянном давлении. Понятие энтальпия в переводе с греческого значит «нагреваю». То есть формулу, содержащую элементарную сумму внутренней энергии и произведенную работу, называют энтальпией. Эта величина обозначается буквой i.
Если записать вышесказанное физическими величинами, преобразовать и вывести формулу, то получится i = u + pv (где u – внутренняя энергия; p, u – давление и удельный объем рабочего тела в том же состоянии, для которого взято значение внутренней энергии). Энтальпия — аддитивная функция, т. е. энтальпия всей системы равна сумме всех составляющих её частей.
Термин «энтальпия» сложен и многогранен.
Но если постараться в нём разобраться, то всё пойдёт очень просто и понятно.
Ну, что же, механизм работы понятен. Вам лишь нужно внимательно читать и вникать. С термином «Энтальпии» мы уже разобрались, также привели и его формулу. Но тут же возникает ещё один вопрос: откуда взялась эта формула и почему энтропия связана, к примеру, с внутренней энергией и давлением?
Суть и смысл
Для того, чтобы попытаться выяснить физический смысл понятия «энтальпия» нужно знать первый закон термодинамики:
энергия не исчезает в никуда и не возникает из ничего, а лишь переходит из одного вида в другой в одинаковых количествах. Таким примером может служить переход теплоты (тепловой энергии) в механическую энергию, и наоборот.
Уравнение первого закона термодинамики нам нужно преобразить в вид dq = du + pdv = du + pdv + vdp – vdp = d(u + pv) – vdp. Отсюда мы видим выражение (u + pv). Именно это выражение и называется энтальпией (полная формула приводилась выше).
Энтальпия также является величиной состояния, потому что составляющие u (напряжение) и p (давление), v (удельный объём) имеют для каждой величины определенные значения. Зная это, первый закон термодинамики возможно переписать в виде: dq = di – vdp.
В технической термодинамике используются значения энтальпии, которые высчитываются от условно принятого нуля. Все абсолютные значения этих величин весьма трудно определить, так как для этого необходимо учесть все составляющие внутренней энергии вещества при изменении его состояния от О к К.
Формулу и значения энтальпии привёл в 1909 г. учёный Г.Камерлинг-Оннесом.
В выражении i — удельная энтальпия, для всей массы тела полная энтальпия обозначается буквой I, по всемирной системе единиц энтальпия измеряется в Джоулях на килограмм и рассчитывается как:
Функции
Энтальпия («Э») является одной из вспомогательных функций, благодаря использованию которой можно значительно упростить термодинамический расчёт. Так например, огромное количество процессов подвода теплоты в теплоэнергетике (в паровых котлах или камере сгорания газовых турбин и реактивных двигателей, а также в теплообменных аппаратах) осуществляют при постоянном давлении. По этой причине в таблицах термодинамических свойств обычно приводят значения энтальпии.
Условие сохранения энтальпии лежит, в частности, в основе теории Джоуля — Томсона. Или эффекта, нашедшего важное практическое применение при сжижении газов. Таким образом, энтальпия есть полная энергия расширенной системы, представляющая сумму внутренней энергии и внешней – потенциальной энергии давления. Как любой параметр состояния, энтальпия может быть определена любой парой независимых параметров состояния.
Также, исходя из приведённых выше формул, можно сказать: «Э» химической реакции равна сумме энтальпий сгорания исходных веществ за вычетом суммы энтальпий сгорания продуктов реакции.
В общем случае изменение энергии термодинамической системы не является необходимым условием для изменения энтропии этой системы.
Итак, вот мы и разобрали понятие «энтальпии». Стоит отметить, что «Э» неразрывно связана с энтропией, о которой вы также можете прочесть позже.