Что такое электролиз в физике
Электролиз
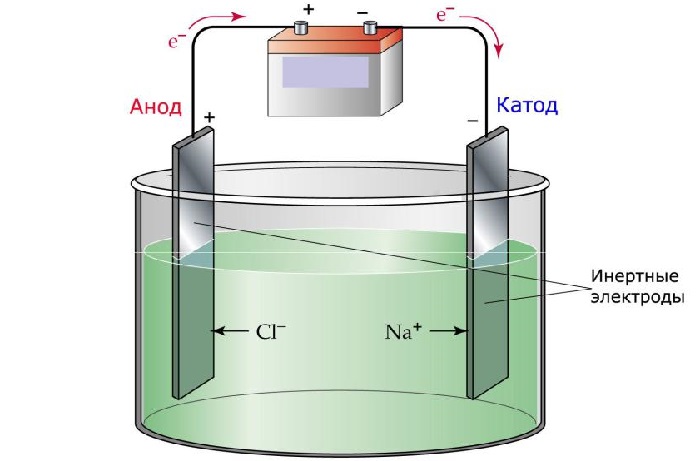
Процесс электролиза заключается в перемещении катионов (положительно заряженных ионов) к катоду (заряжен отрицательно), и отрицательно заряженных ионов (анионов) к аноду (заряжен положительно).
Итак, анионы и катионы устремляются соответственно к аноду и катоду. Здесь и происходит химическая реакция. Чтобы успешно решать задания по этой теме и писать реакции, необходимо разделять процессы на катоде и аноде. Именно так и будет построена эта статья.
Катод
Чтобы установить, какая реакция идет на катоде, прежде всего, нужно определиться с активностью металла: его положением в электрохимическом ряду напряжений металлов.
Примеры решения
В процессе тренировки вам могут попадаться металлы, которые пропущены в ряду активности. На этапе обучения вы можете пользоваться расширенным рядом активности металлов.
Теперь вы точно будете знать, что выделяется на катоде 😉
Итак, потренируемся. Выясним, что образуется на катоде и аноде при электролизе растворов AgCl, Cu(NO3)2, AlBr3, NaF, FeI2, CH3COOLi.
Иногда в заданиях требуется записать реакцию электролиза. Сообщаю: если вы понимаете, что образуется на катоде, а что на аноде, то написать реакцию не составляет никакого труда. Возьмем, например, электролиз NaCl и запишем реакцию:
NaCl + H2O → H2 + Cl2 + NaOH (обычно в продуктах оставляют именно запись «NaOH», не подвергая его дальнейшему электролизу)
Запишем реакцию электролиза для CuSO4:
Медь относится к малоактивным металлам, поэтому сама в чистом виде выделяется на катоде. Анион кислородсодержащий, поэтому в реакции выделяется кислород. Сульфат-ион никуда не исчезает, он соединяется с водородом воды и превращается в серую кислоту.
Электролиз расплавов
Все, что мы обсуждали до этого момента, касалось электролиза растворов, где растворителем является вода.
Но как быть с активными металлами: Na, K, Li? Ведь при электролизе их растворов они не выделяются на катоде в чистом виде, вместо них восстанавливаются молекулы воды и выделяется водород. Тут нам как раз пригодятся расплавы, которые не содержат воды.
В безводных расплавах реакции записываются еще проще: вещества распадаются на составные части:
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Электролиз
Электро́лиз — физико-химический процесс, состоящий в выделении на электродах составных частей растворённых веществ или других веществ, являющихся результатом вторичных реакций на электродах, который возникает при прохождении электрического тока через раствор либо расплав электролита.
Электролиз находит применение в очистке сточных вод (процессы электрокоагуляции, электроэкстракции, электрофлотации).
Содержание
Первый закон Фарадея
В 1832 году Фарадей установил, что масса m вещества, выделившегося на электроде, прямо пропорциональна электрическому заряду q, прошедшему через электролит: 
если через электролит пропускается в течение времени t постоянный ток с силой тока I. Коэффициент пропорциональности 
Вывод закона Фарадея
Подставляя (2)-(5) в (1), получим

где 

Второй закон Фарадея
Электрохимические эквиваленты различных веществ относятся, как их химические эквиваленты.
Химическим эквивалентом иона называется отношение молярной массы A иона к его валентности z. Поэтому электрохимический эквивалент
где 
Второй закон Фарадея записывается в следующем виде:
где 




Изменение электролизом веществ
Не все вещества будут электролизироваться при пропускании электрического тока. Существуют некоторые закономерности и правила.
Примеры
Расплавы
1) Активные металлы
1.Соль активного металла и бескислородной кислоты
K»катод»(-): Na + + 1e = Na 0
A»анод»(+): Cl − — 1e = Cl 0 ; Cl 0 +Cl 0 =Cl2
Вывод: 2NaCl → (электролиз) 2Na + Cl2
2.Соль активного металла и кислородосодержащей кислоты
3. Гидроксид: активный металл и гидроксид-ион
Вывод: 4NaOH → (электролиз) 4Na + 2H2O + O2
2) Менее активные металлы
3) Неактивные металлы
Растворы
1) Активные металлы
1.Соль активного металла и бескислородной кислоты
A»анод»(+): Cl − — 1e = Cl 0 ; Cl 0 +Cl 0 =Cl2
Вывод: 2NaCl + 2H2O(электролиз) → H2 + Cl2 +2NaOH
2.Соль активного металла и кислородсодержащей кислоты
3. Гидроксид: активный металл и гидроксид-ион
2) Менее активные металлы
1.Соль менее активного металла и бескислородной кислоты
K»катод»(-): Zn 2+ + 2e = Zn 0
A»анод»(+): 2Cl − — 2e = 2Cl 0
Вывод: ZnCl2 (электролиз) → Zn + Cl2
2.Соль менее активного металла и кислородсодержащей кислоты
3. Гидроксид: невозможно (нерастворим)
3) Неактивные металлы
Мнемоническое правило
Для запоминания катодных и анодных процессов в электрохимии существует следующее мнемоническое правило:
В первой строке все слова начинаются с гласной буквы, во второй — с согласной.
Электролиз в газах
Электролиз в газах, при наличии ионизатора, объясняется тем, что при прохождении через них постоянного электрического тока, наблюдается выделение веществ на электродах. Законы Фарадея в газах не действительны, но существуют несколько закономерностей;
1) При отсутствии ионизатора электролиз проводиться не будет даже при высоком напряжении.
2) Электролизу подвергаются только бескислородные кислоты в газообразном состоянии и некоторые газы.
3) Уравнения электролиза как в электролитах, так и в газах всегда остаются постоянными.
См. также
Примечания
Ссылки
 Статьи, относящиеся к электролизу Статьи, относящиеся к электролизу | |
|---|---|
| Начала электролиза | Химические источники тока • Законы Фарадея • Стандартный электродный потенциал |
| Электролитические процессы | |
| Материалы, полученные электролизом | Алюминий • Металлический кальций • Хлор • Фтор • Водород • Металлический литий • Магний • Металлический калий • Металлический натрий • Гидроксид натрия • Цинк |
| См. также | Электрохимия • |
| Химические методы разделения |
|---|
| Дефлегмация | Дистилляция | Зонная плавка | Многократное испарение | Однократное испарение | Постепенное испарение | Рефлюкс (химия) | Твердофазная экстракция | Фракционированная конденсация | Хроматография | Электролиз | Экстракция |
Полезное
Смотреть что такое «Электролиз» в других словарях:
электролизёр — электролизёр … Русское словесное ударение
электролизёр — электролизёр, а … Русский орфографический словарь
электролизёр — электролизёр … Словарь употребления буквы Ё
электролизёр — электролизёр, электролизёры, электролизёра, электролизёров, электролизёру, электролизёрам, электролизёр, электролизёры, электролизёром, электролизёрами, электролизёре, электролизёрах (Источник: «Полная акцентуированная парадигма по А. А.… … Формы слов
ЭЛЕКТРОЛИЗ — совокупность электрохим. процессов, проходящих на электродах, погружённых в электролит, при прохождении по нему электрич. тока. В результате этих процессов в ва, входящие в состав электролита, выделяются в свободном виде. Проводимость… … Физическая энциклопедия
ЭЛЕКТРОЛИЗ — (греч.) Разложение химических соединений посредством электрического (гальванического) тока на их составные части. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. ЭЛЕКТРОЛИЗ греч. Разложение химических соединений на … Словарь иностранных слов русского языка
электролиз — а, м. électrolyse f., > нем. Elektrolyse. Разложение веществ при помощи электрического тока на составные элементы (напр. воды на кислород и водород). Павленков 1911. Химический процесс разложения вещества на составные части при прохождении… … Исторический словарь галлицизмов русского языка
ЭЛЕКТРОЛИЗ — ЭЛЕКТРОЛИЗ, ХИМИЧЕСКАЯ РЕАКЦИЯ, происходящая при прохождении постоянного тока через ЭЛЕКТРОЛИТ. Процесс заключается в перемещении положительных ионов к отрицательному ЭЛЕКТРОДУ (КАТОДУ) и отрицательных ионов к положительному электроду (АНОДУ).… … Научно-технический энциклопедический словарь
электролизёр — а, м. électrolyseur m. Аппарат для электролиза, состоящий из наполненного электролитом сосуда и расположенных в нем электродов. Электролизер для получения химических продуктов. Электролизер высокого давления. БАС 1. Продукт в виде шлама золота и… … Исторический словарь галлицизмов русского языка
электролиз — Ток, проходя по жидким проводникам, разлагает их на составные части. Поэтому жидкие проводники называются проводниками второго рода или электролитами в отличие от металлических проводников, которые называются проводниками. Разложение электролитов … Справочник технического переводчика
ЭЛЕКТРОЛИЗ — ЭЛЕКТРОЛИЗ, процессы электрохимического окисления восстановления, происходящие на погруженных в электролит электродах при прохождении электрического тока. Применяется для получения многих веществ (металлов, водорода, хлора и др.), при нанесении… … Современная энциклопедия
Огромной популярностью в металлургии и химической промышленности имеет такой физико-химический процесс, как электролиз, происходящий с помощью электролизера. Чтобы понять принцип его действия, нужно изучить определение, нюансы и особенности явления.
Понятие электролиза
Значение явления заключается в том, что путём воздействия электричества на ионы можно организовывать новые формы, структуры или даже сами вещества. Это позволяет человеку контролировать некоторые процессы, протекающие на молекулярном уровне. Законы данного явления в химии и физике открыл английский учёный Фарадей.
Явление происходит при участии электродов, которые делятся на катод и анод:
Приборы чаще всего изготавливаются из материалов, пропускающих электрический ток, например, из графита или большинства металлов. Оба прибора подключаются к отрицательному и положительному полюсам соответственно.
Явление происходит в следующем порядке:
Очень важно не путать такие близкие определения, как гидролиз и электролиз. Первым явлением считается разложение раствора вещества на ионы (заряженные частицы) в воде.
Первый закон Фарадея
Установленный Фарадеем первый закон говорит о прямой пропорциональности между массой вещества, выделившейся в ходе электролиза, и величиной заряда, который прошел через электролит.
Правило подкреплено формулой m = k * q, то есть произведение заряда вещества на его электрохимический эквивалент, что равняется его массе.
Проверка первого закона Фарадея происходит следующим образом:
нужно взять три любых электролита, например, А, Б и В и пропустить ток через каждый;
если вещества одни и те же, то массы выделившихся можно назвать Г, Г1 и Г2;
при этом будет верным следующее равенство: Г= Г1+Г2.
Второй закон Фарадея
Данное правило, установленное Фарадеем, указывает на зависимость между атомной массой вещества, количеством возможных химических связей и самим электрохимическим эквивалентом.
Таким образом, электрохимический эквивалент прямо пропорционален атомной массе вещества, но валентности вещества он обратно пропорционален.
Таблица изменения веществ с помощью электролиза
Усиление восстановительных способностей веществ:
Что такое электролиз и где он применяется?
Вопрос о том, что такое электролиз, рассматривается еще в школьном курсе физике, и для большинства людей не является секретом. Другое дело – его важность и практическое применение. Этот процесс с большой пользой используется в различных отраслях и может пригодиться для домашнего мастера.
Что такое электролиз?
Электролиз представляет собой комплекс специфических процессов в системе электродов и электролита при протекании по ней постоянного электрического тока. Его механизм основывается на возникновении ионного тока. Электролит – это проводник 2-го типа (ионная проводимость), в котором происходит электролитическая диссоциация. Она связана с разложением на ионы с положительным (катион) и отрицательным (анион) зарядом.
Электролизная система обязательно содержит положительный (анод) и отрицательный (катод) электрод. При подаче постоянного электрического тока катионы начинают двигаться к катоду, а анионы – к аноду. Катионами в основном являются ионы металлов и водород, а анионами – кислород, хлор. На катоде катионы присоединяют к себе избыточные электроны, что обеспечивает протекание восстановительной реакции Men+ + ne → Me (где n – валентность металла). На аноде, наоборот, электрон отдается из аниона с протеканием окислительной реакции.
Таким образом, в системе обеспечивается окислительно-восстановительный процесс. Важно учитывать, что для его протекания необходима соответствующая энергия. Ее должен обеспечить внешний источник тока.
Законы электролиза Фарадея
Великий физик М.Фарадей своими исследованиями позволил не только понять природу электролиза, но и производить необходимые расчеты для его осуществления. В 1832 г. появились его законы, связавшие основные параметры происходящих процессов.
Первый закон
Первый закон Фарадея гласит, что масса восстанавливающегося на аноде вещества прямо пропорциональна электрическому заряду, наведенному в электролите: m = kq = k*I*t, где q — заряд, k – коэффициент или электрохимический эквивалент вещества, I – сила тока, протекающего через электролит, t – время прохождения тока.
Второй закон
Второй закон Фарадея позволил определить коэффициент пропорциональности k. Он звучит следующим образом: электрохимический эквивалент любого вещества прямо пропорционален его молярной массе и обратно пропорционален валентности. Закон выражается в виде:
k = 1/F*A/z, где F – постоянная Фарадея, А- молярная масса вещества, z – его химическая валентность.
С учетом обоих законов можно вывести окончательную формулу для расчета массы, оседающего на электроде вещества: m = A*I*t/(n*F), где n – количество электронов, участвующих в электролизе. Обычно n соответствует заряду иона. С практической точки зрения важна связь массы вещества с подаваемым током, что позволяет контролировать процесс, изменяя его силу.
Электролиз расплавов
Один из вариантов электролиза – использование в качестве электролита расплав. В этом случае в электролизном процессе участвуют только ионы расплава. В качестве классического примера можно привести электролиз солевого расплава NaCl (поваренная соль). К аноду устремляются отрицательные ионы, а значит, выделяется газ (Cl). На катоде будет происходить восстановление металла, т.е. оседание чистого Na, образующегося из положительных ионов, притянувших избыточные электроны. Аналогично можно получать другие металлы (К, Са, Li и т.д.) из расправа соответствующих солей.
При электролизе в расплаве электроды не подвергаются растворению, а участвуют только в качестве источника тока. При их изготовлении можно использовать металл, графит, некоторые полупроводники. Важно, чтобы материал имел достаточную проводимость. Один из наиболее распространенных материалов – медь.
Особенности электролиза в растворах
Электролиз в водном растворе существенно отличается от расплава. Здесь имеют место 3 конкурирующих процесса: окисление воды с выделением кислорода, окисление аниона и анодное растворение металла. В процессе задействованы ионы воды, электролита и анода. Соответственно, на катоде может происходить восстановление водорода, катионов электролита и металла анода.
Возможность протекания указанных конкурирующих процессов зависит от величины электрических потенциалов системы. Протекать будет только тот процесс, который требует меньше внешней энергии. Следовательно, на катоде будут восстанавливаться катионы, имеющие максимальный электродный потенциал, а на аноде – окисляться анионы с наименьшим потенциалом. Электродный потенциал водорода принят за «0». Для примера, у калия он равен (-2,93 В), натрия – (-2,71 В), свинца (-0,13 В), а у серебра – (+0,8 В).
Электролиз в газах
Газ может исполнить роль электролита только при наличии ионизатора. В этом случае ток, проходя через ионизированную среду, вызывает необходимый процесс на электродах. При этом законы Фарадея не распространяются на газовый электролиз. Для его осуществления необходимы такие условия:
Важно! При выполнении необходимых условий процесс протекает аналогично электролизу в жидком электролите.
Особенности процессов, происходящих на катоде и аноде
Для практического применения электролиза важно понимать, что происходит на обоих электродах при подаче электрического тока. Характерны такие процессы:
При обеспечении электролиза важно учитывать склонность материала электродов к окислению. В этом отношении выделяются инертные и активные аноды. Инертные электроды делаются из графита, угля или платины и не участвуют в снабжении ионами.
Факторы, влияющие на процесс электролиза
Процесс электролиза зависит от следующих факторов:
Важно! Электролиз можно ускорить или замедлить путем различных воздействий и выбора состава электролита. Для каждого варианта применения существует свой режим, который следует строго соблюдать.
Где применяется электролиз?
Электролиз применяется во многих сферах. Можно выделить несколько основных направлений использования для получения практических результатов.
Гальваническое покрытие
Тонкое, прочное гальваническое покрытие из металла можно наложить путем электролиза. Покрываемое изделие устанавливается в ванну в виде катода, а электролит содержит соль нужного металла. Так можно покрыть сталь цинком, хромом или оловом.
Электроочистка — рафинирование меди
Примером электроочистки может служить такой вариант: катод – чистая медь, анод – медь с примесями, электролит – водный раствор медного сульфата. Медь из анода переходит в ионы и оседает в катоде уже без примесей.
Добыча металлов
Для получения металлов из солей они переводятся в расплав, а затем обеспечивается электролиз в нем. Достаточно эффективен такой способ для получения алюминия из бокситов, натрия и калия.
Анодирование
При этом процессе покрытие выполняется из неметаллических соединений. Классический пример – анодирование алюминия. Алюминиевая деталь устанавливается, как анод. Электролит – раствор серной кислоты. В результате электролиза на аноде оседает слой из оксида алюминия, обладающего защитными и декоративными свойствами. Указанные технологии широко используются в различных отраслях промышленности. Можно осуществить процессы и своими руками с соблюдением техники безопасности.
Энергетические затраты
Электролиз требует больших энергетических затрат. Процесс будет иметь практическую ценность при достаточной величине анодного тока, а для этого необходимо приложить значительный постоянный ток от источника электроэнергии. Кроме того, при его проведении возникают побочные потери напряжения – анодное и катодное перенапряжение, потери в электролите за счет его сопротивления. Эффективность работы установки определяется путем отнесения мощности энергозатрат к единице полезной массы полученного вещества.