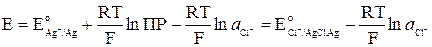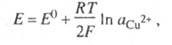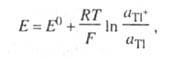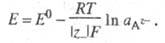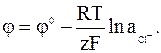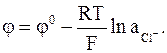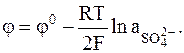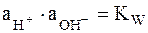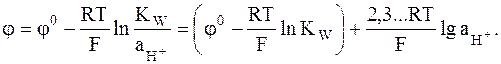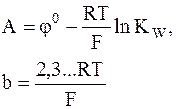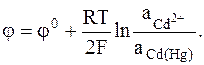Что такое электрод второго рода
Что такое электрод второго рода
Электроды второго рода представляют собой металлические электроды, покрытые слоем труднорастворимой соли того же металла. При погружении в раствор соли одноименного аниона его потенциал будет определяться активностью иона в растворе.
а) Хлорсеребряный электрод (ХСЭ) Ag, AgCl|Cl – представляет собой серебряный проводник, покрытый твердым AgCl, который погружен в насыщенный раствор KCl.
Серебро электрохимически взаимодействует со своим ионом:
| Ag + + e – = Ag. |
Уравнение Нернста для этого процесса:
| (7.2) |
Однако в присутствии труднорастворимого AgCl активность ионов серебра очень мала и ее трудно определить. Но активность ионов Ag + связана с легко задаваемой в данной системе активностью ионов Cl – произведением растворимости хлорида серебра ПРAgCl:
 |
откуда
 |
Подставляя это выражение в (7.2)
 |
и обозначив
 |
получим уравнение Нернста для хлорсеребряного электрода:
|
Потенциалопределяющими являются ионы хлора, а электродный процесс может быть представлен уравнением
 |
б) Каломельный электрод (КЭ) Hg, Hg2Cl2|Cl – – это ртуть, находящаяся в контакте с пастой из смеси ртути и каломели Hg2Cl2, которая, в свою очередь, соприкасается с насыщенным раствором KCl.
Принцип действия каломельного электрода тот же, что и хлорсеребряного.
Электроды второго рода



Электродом второго рода называют систему, в которой металл покрыт слоем его труднорастворимого соединения, а в растворе находятся анионы, одноименные с анионами, содержащимися в этом труднорастворимом соединении.
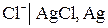
В потенциалопределяющей реакции на этом электроде принимают участие как катионы, так и анионы. Электрохимическому процессу
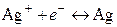
сопутствует химическая реакция, приводящая к осаждению или растворению AgCl:
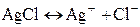
Суммарное уравнение реакции, согласно которой электрод обратим относительно аниона записывается в виде:
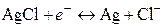
Реакции (7) соответствует следующее выражение для расчета электродного потенциала:

Хлорсеребряный электрод можно рассматривать и как электрод первого рода, обратимый относительно катиона (реакция 6). У такого электрода активность ионов серебра в растворе определяется растворимостью AgCl. Потенциал электрода равен
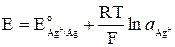
Для труднорастворимой соли AgCl
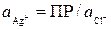
Подставив выражение (10) в (9), получим:
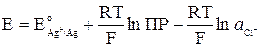
Выражения (8) и (11) определяют одно и тоже значение 
Откуда видно, что связь стандартных потенциалов соответствующих электродов I и II рода определяется уравнением
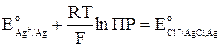
Последнее выражение позволяет определить ПР труднорастворимого соединения по значениям стандартных электродных потенциалов.
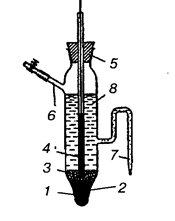
Другим примером электрода второго рода является каломельный электрод (рис. 2), состоящий из ртути, покрытой пастой, содержащей каломель Hg2Cl2, и соприкасающейся с раствором KCl: 
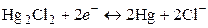
потенциал каломельного электрода определяется выражением
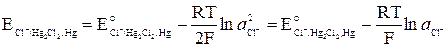
Рис. 2. Каломельный электрод.
1 — ртуть, 2 — платиновая проволока, 3 — паста из каломели, 4 — стеклянная трубка, 5 — пробка, 6 — боковая трубка, 7 — сифон, 8 — раствор KCl.
По концентрации применяемого раствора KCl различают 0,1 н., 1 н. и насыщенный каломельные электроды. Последний используется наиболее широко.
Вследствие стабильности своих потенциалов, электроды второго рода используются как электроды сравнения при потенциометрических измерениях.
Что такое электрод второго рода
ФИЗИЧЕСКАЯ И КОЛЛОИДНАЯ ХИМИЯ
Конспект лекций для студентов биофака ЮФУ (РГУ)
3.5 ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
3.5.4 Классификация электродов
По типу электродной реакции все электроды можно разделить на две группы (в отдельную группу выделяются окислительно-восстановительные электроды, которые будут рассмотрены особо в разделе 3.5.5).
Электроды первого рода
К электродам первого рода относятся электроды, состоящие из металлической пластинки, погруженной в раствор соли того же металла. При обратимой работе элемента, в который включен электрод, на металлической пластинке идет процесс перехода катионов из металла в раствор либо из раствора в металл. Т.о., электроды первого рода обратимы по катиону и их потенциал связан уравнением Нернста (III.40) с концентрацией катиона (к электродам первого рода относят также и водородный электрод).
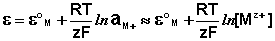
Электроды второго рода
Электродами второго рода являются электроды, в которых металл покрыт малорастворимой солью этого металла и находится в растворе, содержащем другую растворимую соль с тем же анионом. Электроды этого типа обратимы относительно аниона и зависимость их электродного потенциала от температуры и концентрации аниона может быть записана в следующем виде:
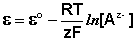
Водородный электрод представляет собой платиновую пластинку, омываемую газообразным водородом, погруженную в раствор, содержащий ионы водорода. Адсорбируемый платиной водород находится в равновесии с газообразным водородом; схематически электрод изображают следующим образом:
Электрохимическое равновесие на электроде можно рассматривать в следующем виде:
Потенциал водородного электрода зависит от активности ионов Н + в растворе и давления водорода; потенциал стандартного водородного электрода (с активностью ионов Н + 1 моль/л и давлением водорода 101.3 кПа) принят равным нулю. Поэтому для электродного потенциала нестандартного водородного электрода можно записать:
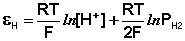
Каломельный электрод обратим относительно анионов хлора и уравнение Нернста для него имеет вид:
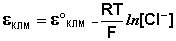
Величина потенциала хлорсеребряного электрода зависит от активности ионов хлора; данная зависимость имеет следующий вид:
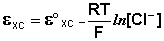
Чаще всего в качестве электрода сравнения используется насыщенный хлорсеребряный электрод, потенциал которого зависит только от температуры. В отличие от каломельного, он устойчив при повышенных температурах и применим как в водных, так и во многих неводных средах.
Электроды, обратимые относительно иона водорода, используются на практике для определения активности этих ионов в растворе (и, следовательно, рН раствора) потенциометрическим методом, основанном на определении потенциала электрода в растворе с неизвестным рН и последующим расчетом рН по уравнению Нернста. В качестве индикаторного электрода может использоваться и водородный электрод, однако работа с ним неудобна и на практике чаще применяются хингидронный и стеклянный электроды.
Хингидронный электрод является т.н. окислительно-восстановительным электродом (см. разд. 3.5.5); зависимость его потенциала от активности ионов водорода имеет следующий вид:
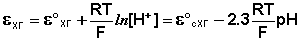
Принцип действия мембранного электрода заключается в следующем. Мембрана, селективная по отношению к некоторому иону (т.е. способная обмениваться этим ионом с раствором), разделяет два раствора с различной активностью этого иона. Разность потенциалов, устанавливающаяся между двумя сторонами мембраны, измеряется с помощью двух электродов. При соответствующем составе и строении мембраны её потенциал зависит только от активности иона, по отношению к которому мембрана селективна, по обе стороны мембраны.
Наиболее часто употребляется стеклянный электрод в виде трубки, оканчивающейся тонкостенным стеклянным шариком. Шарик заполняется раствором НСl с определенной активностью ионов водорода; в раствор погружен вспомогательный электрод (обычно хлорсеребряный). Потенциал стеклянного электрода с водородной функцией (т.е. обратимого по отношению к иону Н + ) выражается уравнением
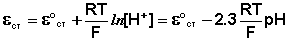
Необходимо отметить, что стандартный потенциал ε °ст для каждого электрода имеет свою величину, которая со временем изменяется; поэтому стеклянный электрод перед каждым измерением рН калибруется по стандартным буферным растворам с точно известным рН.
3.5.5 Окислительно-восстановительные электроды
Зависимость потенциала редокс-электрода ε RO от концентрации (активности) окисленной [Ox] и восстановленной форм [Red] для окислительно-восстановительной реакции, в которой не участвуют никакие другие частицы, кроме окислителя и восстановителя, имеет следующий вид (здесь n – число электронов, участвующих в элементарном акте окислительно-восстановительной реакции):
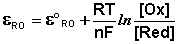
Из данного выражения следует уравнение для потенциала металлического электрода (III.40), т.к. активность атомов металла (восстановленной формы) в материале электрода равна единице.
В случае более сложных систем в выражении для окислительно-восстановительного потенциала фигурируют концентрации всех участвующих в реакции соединений, т.е. под окисленной формой следует понимать все соединения в левой части уравнения реакции
а под восстановленной – все соединения в правой части уравнения. Так, для окислительно-восстановительных реакций, протекающих с участием ионов водорода
уравнение Нернста будет записываться следующим образом:
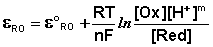
Знание величин электродных потенциалов позволяет определить возможность и направление самопроизвольного протекания любой окислительно-восстановительной реакции при одновременном наличии в растворе двух или более окислительно-восстановительных пар. Восстановленная форма любого элемента или иона будет восстанавливать окисленную форму другого элемента или иона, имеющего более положительный электродный потенциал.
ЭЛЕКТРОДЫ I И II РОДА



ЭЛЕКТРОДЫ I И II РОДА.
ЭЛЕКТРОДЫ в электрохимии, электронно-проводящие фазы, контактирующие с ионным проводником (электролитом). Часто под электродом понимают лишь одну электронно-проводящую фазу. При пропускании тока от внешнего источника через систему из двух электродов, соединенных друг с другом через электролит, на электродах протекают два процесса: заряжение двойного электрического слоя и электрохимическая реакция.
Непрерывность прохождения тока через фаницу фаз в этом случае обеспечивается электродной реакцией. Электрод называется анодом, если на его поверхности преобладает реакция, приводящая к генерированию электронов, т. е. происходит окисление веществ, содержащихся в электролите, либо ионизация металла анода. Электрод называется катодом, если с его поверхности электроны металла переходят на частицы реагирующих веществ, которые при этом восстанавливаются.
Соответствующее такому электродному процессу Нернста уравнение для электродного потенциала Е имеет вид:
Уравнение Нернста имеет вид:
К электродам 2-го рода относятся многие электроды сравнения, например каломельный, хлорсеребряный, оксидно-ртутный.
Среди окислительно-восстановительных электродов выделяют газовые электроды, состоящие из химически инертного металла (обычно Pt), к которому подводится электрохимически активный газ (например, Н2 или С12). Молекулы газа адсорбируются на поверхности металла, распадаясь на адсорбированные атомы, которые непосредственно участвуют в переносе электронов через границу раздела фаз.
Наиболее распространен водородный электрод, на поверхности которого образуются адсорбированные атомы Надс и устанавливается равновесие: Н2 

Электроды называют идеально поляризуемым, если вследствие термодинамических или кинетических причин переход электронов через межфазную границу невозможен. При изменении потенциала такого электрода происходит только изменение строения двойного электрического слоя, что сопровождается протеканием тока заряжения, спадающего до нуля, когда перестройка двойного электрического слоя заканчивается. Для неполяризуемых, или обратимых, электродов переход электронов через границу фаз, напротив, незаторможен, и при пропускании тока через такой электрод его потенциал практически не изменяется.
На практике электроды классифицируют по химической природе материала (металлические, неметаллические, оксидные, электроды из соединений с ковалентной связью, углеграфитовые и т.д.), форме (сферические, плоские, цилиндрические, дисковые и т. д.), условиям функционирования (неподвижные, вращающиеся и т. п.), размерам (микро- и ультрамикроэлектроды), пористости, гидрофильности, участию электродного материала в электродном процессе (расходуемые и нерасходуемые) и др. признакам.
Использование капельного ртутного электрода лежит в основе полярографии. Вращающийся дисковый электрод представляет интерес как система, для которой существует строгое решение диффузионной кинетические задачи. К особо практически важным электродам следует отнести каталитически активные и высоко коррозионностойкие оксидные рутениево-титановые аноды (ОРТА), применение которых революционизировало самое широкомасштабное электрохимическое производство – электролитическое получение хлора и щелочей.
Модифицирование электроды, получившее широкое распространение в электрокатализе, производстве химических источников тока, электрохимических сенсоров и т. п., основано как на физических (ионная имплантация, разрыхление поверхности, выращивание монокристаллических граней, создание монокристаллических структур, физическая адсорбция ионов и молекул и др.), так и химических методах. В частности, химически модифицированные электроды представляют собой проводящий или полупроводниковый материал, покрытый мономолекулярными (в т. ч. субатомными), полимолекулярными, ионными, полимерными слоями, в результате чего электрод проявляет химические, электрохимические и оптические свойства слоя.
Из-за малой величины токов электрохимической ячейки с микроэлектродами характеризуются незначительным падением потенциала, что позволяет изучать системы с высокими концентрациями реагирующих частиц, обычно используемые в технологических процессах, применять высокие скорости сканирования потенциала при вольтамперометрических измерениях, проводить работы в плохо проводящих средах и т. п. Микроэлектроды используют для анализа ультрамалых проб, исследования процессов в живых организмах, в клинических целях. Ультрамикроэлектроды применяют в туннельной сканирующей микроскопии и в электрохимической нанотехнологии.
Электроды 2-го рода
Электроды 2-го рода содержат металл и труднорастворимое соединение этого металла, контактирующие с раствором, содержащим анионы, входящие в состав труднорастворимого соединения.
В зависимости от типа труднорастворимого соединения металла различают металлогалогенидные электроды, содержащие труднорастворимые галогениды металлов, металлосульфатные, содержащие труднорастворимые сульфаты металлов, и др.
Общая запись электродной реакции для электродов 2-го рода такова:
Приведенная выше запись результирующей электродной реакции соответствует двум ее основным стадиям:
· растворению труднорастворимой соли
· восстановлению ионов металла на катоде
Таким образом, по механизму катодного процесса электроды 2-го рода принципиально не отличаются от электродов 1-го рода.
Отвечающая суммарной реакции (а) условная запись электрода 2-го рода имеет следующий вид:
Этой же реакции соответствует выражение для электродного потенциала:
Потенциал электродов 2-го рода зависит от активности анионов. Поэтому их часто называют электродами, обратимыми по анионам.
Электроды 2-го рода широко применяются при проведении электрохимических измерений. Кроме того, данные по их стандартным электродным потенциалам используются для расчета произведения растворимости PS труднорастворимых солей. С этой целью сравнивают стандартный потенциал электрода 2-го рода 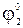
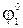
характеризуемое константой равновесия
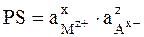
то стандартным условиям для электрода 2-го рода ( 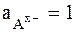
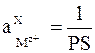
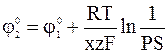
из которого следует:
Изучение наиболее известных электродов 2-го рода начнем с класса металлогалогенидных, из которых наиболее распространена группа металлохлоридных электродов.
Каломельный электрод характеризуют:
· выражение для электродного потенциала:
Для изготовления каломельного электрода каломель перетирают с раствором хлорида калия и несколькими каплями ртути до получения однородной пасты, которую наслаивают на поверхность ртути, помещаемой в стеклянную емкость. Сверху на пасту наслаивают раствор хлорида калия. Металлический контакт осуществляют платиновой проволокой, которую впаивают в стекло (платина и лабораторное стекло имеют близкие значения термического коэффициента расширения).
Каломельный электрод отличается прекрасной воспроизводимостью электродного потенциала и очень высокой устойчивостью. Известно, что при хранении свыше 25 лет каломельного электрода не было замечено никакого изменения его электродного потенциала. В связи с этим он широко применялся в качестве практического электрода сравнения. Было предложено использовать следующие типы каломельного электрода:
· децинормальный каломельный электрод, заполняемый 0,1 н. раствором KCl (электродный потенциал такого электрода по отношению к стандартному электроду сравнения при 25°С равен 0,3365 В),
· нормальный каломельный электрод, заполняемый 1 н. раствором KCl (его электродный потенциал по отношению к стандартному электроду сравнения при 25°С равен 0,2828 В),
· насыщенный каломельный электрод, заполняемый насыщенным раствором KCl (потенциал при 25°С равен 0,2438 В).
Наиболее употребительным является насыщенный каломельный электрод. Однако по сравнению с другими типами каломельных электродов у него наибольшая зависимость электродного потенциала от температуры.
Трудности миниатюризации каломельного электрода и работа с ртутью привели к тому, что он повсеместно заменялся серебряногалогенидными электродами.
Серебрянохлоридный электрод является наиболее распространенным представителем группы серебряногалогенидных электродов.
Приводим электродную реакцию, условную запись и выражение для электродного потенциала серебрянохлоридного электрода:
Серебрянохлоридный электрод подобно каломельному электроду имеет хорошую воспроизводимость и устойчивость электродного потенциала. Он широко применяется в качестве практического электрода сравнения (иногда такие электроды называют вспомогательными) не только в водных средах, но и в водных растворах спиртов, кетонов и эфиров.
Для получения серебрянохлоридного электрода тонкую серебряную проволоку покрывают слоем хлорида серебра. С этой целью ее погружают в водный раствор, содержащий хлорид-ионы, и пропускают электрический ток, используя серебряную проволоку в качестве анода. Погруженная в раствор KCl серебряная проволока с электролитическим покрытием AgCl представляет собой готовый электрод сравнения.
Миниатюрные серебрянохлоридные электроды используются в физиологических и биохимических исследованиях.
Ртутносульфатный электродявляется представителем группы металлосульфатных электродов с наиболее устойчивым электродным потенциалом и наиболее высокой воспроизводимостью.
Характеристики этого электрода приводятся ниже:
Металлооксидные электроды. В этих электродах анионом, содержащимся в водной среде, служит гидроксид-ион. Частную реакцию на этих электродах можно представить как двухстадийный процесс:
Электродной реакции соответствует следующая форма условной записи электрода:
Выражение для электродного потенциала металлооксидного электрода имеет следующий вид:
Оно может быть преобразовано с использованием ионного произведения воды
и принимая во внимание, что десятичный логарифм активности водородных ионов представляет собой водородный показатель среды pH, получим
Входящий в уравнение коэффициент b называется электрохимическим коэффициентом. При 25°С он равен 0,059157 В.
Линейная зависимость между водородным показателем среды и потенциалом металлооксидного электрода предполагает его применение для измерений рН. Такая возможность действительно существует. Однако в кислой среде происходит растворение оксидов и электрод перестает функционировать как рН-метрический.
Примерами металлооксидных электродов могут служить ртутнооксидный и сурьмянооксидный электроды.
Ртутнооксидный электрод характеризуется следующим:
а сурьмянооксидный электрод может быть описан электродной реакцией и условной записью в таком виде:
Для изготовления сурьмянооксидного электрода достаточно заполнить стеклянную трубку расплавленной сурьмой и окислить выступающую поверхность сурьмы нагреванием на воздухе.
Электроды на основе металлических сплавов и растворов. Они представляют собой разновидность электродов 1-го и 2-го рода, в которых вместо чистого металла в кристаллической форме используются металлические сплавы или растворы. Многие металлы хорошо растворяются в ртути с образованием амальгамы. В качестве примера амальгамного электрода можно привести кадмиевый амальгамный электрод:
Обращаем внимание на то, что потенциал металла входит в выражение для электродного потенциала, так как в отличие от обычных электродов 1-го и 2-го рода металл не находится в стандартном состоянии.
Дата добавления: 2015-07-22 ; просмотров: 1638 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ