Что такое эквимолярная смесь
Что такое эквимолярная смесь
Репетитор по химии и биологии
100 баллов ЕГЭ по химии!
Первый МГМУ им. И.М. Сеченова
выпускница репетитора В.Богуновой
РГМУ по химии 2010
РНИМУ им. Н.И. Пирогова
выпускница репетитора В.Богуновой
Первый МГМУ им. И.М. Сеченова
выпускница репетитора В.Богуновой
МГМСУ, лечебный факультет
выпускник репетитора В.Богуновой
МГМСУ, лечебный факультет
выпускница репетитора В. Богуновой
Первый МГМУ им. И.М. Сеченова
выпускница репетитора В.Богуновой
МГМСУ им. А.И. Евдокимова
выпускница репетитора В.Богуновой
РНИМУ им. Н.И. Пирогова
выпускник репетитора В.Богуновой
Первый МГМУ им. И.М. Сеченова
выпускница репетитора В.Богуновой
МГМСУ им. А.И. Евдокимова
выпускница репетитора В. Богуновой
РНИМУ им. Н.И. Пирогова
выпускник репетитора В.Богуновой
МГМСУ им. А.И. Евдокимова
выпускник репетитора В.Богуновой
Секретная шпаргалка по химии
4.5 Избыток-недостаток, степень превращения, выход реакции в смеси газов
Вы хотите познавать химию и профессионально, и с удовольствием? Тогда вам сюда! Автор методики системно-аналитического изучения химии Богунова В.Г. раскрывает тайны решения задач, делится секретами мастерства при подготовке к ОГЭ, ЕГЭ, ДВИ и олимпиадам
Совсем немного прошло времени, а я уже соскучилась по своим читателям. Как вы там? Справляетесь с задачами, которые я вывалила на вас в большом количестве? Давайте, не подведите! Вы должны подготовиться к ЕГЭ фундаментально и сдать на 100 баллов! Хотите, чтобы ваше самое сокровенное желание исполнилось? Произнесите волшебное заклинание: «Трах-тибидох-тибидох!» и стукните правой ногой три раза по полу. Ждать исполнения желания осталось недолго. Как только решите все задачи, которые я для вас написала в статье, желание исполнится обязательно! Кстати, в конце статьи я даю рецепт колдовского кекса, который можно приготовить за 5 минут. И вкусно, и полезно, и волшебно! Читайте, решайте, готовьте, кушайте!
Однако, вернемся к основной теме. В статье «Секретная шпаргалка по химии. 4.3. Горение смеси газов» я рассказала о гипотетических (предполагаемых) алгоритмических приемах для 28 задания ЕГЭ и подробно описала первую фишку:
1) Расчеты по уравнениям реакции горения смеси газов, состав которой нужно определить предварительно
2) Определение объемного состав смеси по участникам процесса горения (задачи на систему уравнений с двумя неизвестными)
3) Определение состава смеси газообразных продуктов, если в условии избыток-недостаток, степень превращения, выход реакции
4) Задачи на изменение объема смеси газов в процессе реакции
В статье «Секретная шпаргалка по химии. 4.4. Смеси газов и уравнения с двумя неизвестными» я рассказала о второй предполагаемой фишке «Определение объемного состав смеси по участникам процесса горения (задачи на систему уравнений с двумя неизвестными)».
2 л метиламина смешали с 6 л кислорода (н.у.) и подожгли. Определить плотность и объем (н.у.) образовавшихся газов
Задачу решаем стандартно, по Четырем Заповедям
• Первая Заповедь . Выписать данные в разделе «Дано»
• Вторая Заповедь . Написать уравнение реакции.
При написании реакции, не забываем, что при обычном сжигании атомы элемента азота (в реагенте) превращаются в простой газ азот. Оксид азота образуется только при температуре выше 3000°С или при каталитическом окислении. Расстановку коэффициентов начинаем с азота. Для дальнейших расчетов сделаем отступ над реакцией.
• Третья Заповедь . Сделать предварительные расчеты.
• Четвертая запов едь. Составить алгоритм решения задачи.
Алгоритм решения составляем по вопросам задачи: «Определить плотность и объем (н.у.) образовавшейся газовой смеси». Объем смеси образовавшихся газов хорошо виден по таблице.
В указанной выше статье я также рассматривала понятие средней молярной массы. Напомню:
• Средняя молярная масса газа — рассчитывается на основе молярных масс составляющих эту смесь газов и их объемных долей
В данной задаче плотность газа рассчитываем по средней молярной массе, которую определяем по формуле суммы произведений объемных долей каждого газа и их молярных масс.
Решим еще парочку задач на закрепление алгоритма.
Определить состав газовой смеси, образовавшейся при смешивании 60 мл СО, 40 мл NO и 120 мл воздуха.
Маленький комментарий. Монооксид азота реагирует с кислородом самопроизвольно, поэтому при смешивании газов, монооксид азота прореагировал с кислородам воздуха. Далее задачу решаем по аналогии с предыдущей. Кислород «извлекаем» из воздуха по формуле объемной доли. Мы должны помнить, что объемная доля кислорода в воздухе 20% (более точно, 21%).
Приготовили 2000 л (н.у.) эквимолярной смеси метана и углекислого газа и привели ее к условиям реакции. Степень превращения метана 15%. Определите объемные доли компонентов в образовавшейся смеси газов (н.у.)
Маленький комментарий. В более ранних статьях я рассказывала, как решать задачи на избыток-недостаток «Секретная шпаргалка по химии. 3.4 Избыток-недостаток» и выход реакции «Секретная шпаргалка по химии. 3.5 Выход реакции» Сегодня мы познакомимся с понятием Степень превращения.
Эквимолярное соотношение — равные количества веществ. Одинаковые количества вещества газов могут быть только в одинаковых объемах. Это следует из закона Авогадро:
В равных объемах различных газов, измеренных при одинаковых условиях, содержится одинаковое число молекул.
Задача решается стандартно с учетом степени превращения.
После пропускания стехиометрической смеси водорода и азота через контактный аппарат определили, что прореагировало 12% азота. Рассчитайте степень превращения водорода и содержание компонентов в образовавшейся смеси.
Рецепт Колдовского Кекса (можно кушать только особо одаренным)
В небольшой миске смешать жидкие ингредиенты, затем добавить к ним сухие. Все тщательно перемешать. Кружку объемом 500 мл смазать растительным маслом. Вылить жидкое тесто в кружку и поставить в микроволновку на 1,5 минуты при высокой мощности. Достать и кушать. Можно полить сметаной или йогуртом. Отличный завтрак или полдник. Приятного аппетита!
Вы готовитесь к ЕГЭ и хотите поступить в медицинский? Обязательно посетите мой сайт Репетитор по химии и биологии. Здесь вы найдете огромное количество задач, заданий и теоретического материала, познакомитесь с моими учениками, многие из которых уже давно работают врачами.
Полный каталог статей репетитора Богуновой В.Г. вы найдете на странице сайта Статьи репетитора
Подписывайтесь на YouTube-канал Репетитор по химии и биологии. Ежедневно появляются новые вебинары, видео-уроки, видео-консультации, видео-решения заданий ЕГЭ.
Большая Энциклопедия Нефти и Газа
Эквимолярная смесь
Эквимолярная смесь дифенилртути и перекиси беп-зоила, сильно разбавленная бензолом, нагревалась при 55 С в течение 22 час. [16]
Эквимолярная смесь этилена и водорода при 1 атм пропускается над гидрирующим катализатором со скоростью, достаточно малой для того, чтобы газ, покидающий катализатор, можно было считать равновесной смесью, соответствующей температуре катализатора. [18]
Эквимолярная смесь метанола и азота при давлении 100 атм и температуре 600 К расширяется в изотермической турбине со скоростью 1 моль / с. Применив уравнение Соава, определите получаемую работу. Давление на выходе из турбины составляет 5 атм. [19]
Эквимолярная смесь этанола и бензола при 200 С представляет собой жидкость. Если давление смеси адиабатически понизить до 12 6 атм, образуется некоторое количество паровой фазы. [20]
Эквимолярная смесь метанола и азота при давлении 100 атм и температуре 600 К расширяется в изотермической турбине со скоростью 1 моль / с. Применив уравнение Соава, определите получаемую работу. Давление на выходе из турбины составляет 5 атм. [21]
Эквимолярная смесь этанола и бензола при 200 С представляет собой жидкость. Если давление смеси адиабатически понизить до 12 6 атм, образуется некоторое количество паровой фазы. [22]
Эквимолярная смесь метанола и азота при давлении 100 атм и температуре 600 К расширяется в изотермической турбине со скоростью 1 моль / с. Применив уравнение Соава, определите получаемую работу. Давление на выходе из турбины составляет 5 атм. [23]
Эквимолярная смесь этанола и бензола при 200 С представляет собой жидкость. Если давление смеси адиабатически понизить до 12 6 атм, образуется некоторое количество паровой фазы. [24]
Эквимолярную смесь Н8О3Р в 8ЬР5 называют магической к-т о и. Сверхкислотность обусловлена исключительной слабостью взаимод. В среде сверхкислот протонируются в-ва, обычно не проявляющие основных св-в, в частности углеводороды. Это явление используют на практике, преим. [27]
Эквимолярную смесь этих родственных соединений можно выкристаллизовать как особое химическое вещество, называемое хингидроном, и поэтому электрод называется кингидронным. Эта система не может быть применена к растворам с рН выше 9, так как гидрохинон, будучи слабой кислотой, нейтрализуется основанием. Описываемый электрод отчасти менее удобен, чем стеклянный, но он гораздо дешевле, так как не требует электронно-лампового усиления; поэтому он все еще находит применение. [29]
Эквимолярную смесь бензонитрила и изобутилового спирта насыщают сухим НС1 и оставляют на ночь в закрытом сосуде. Образовавшуюся кристаллическую массу промывают эфиром и высушивают. Затем ее растирают в порошок и оставляют на 7 суток над каустической содой. Раствор упаривают до малого объема и оставляют кристаллизоваться. [30]
Научная электронная библиотека
Таланов В. М., Житный Г. М.,
1.1.2. рН смеси растворов двух слабых кислот или оснований
Пусть кислота А1 сильнее, чем кислота А2, тогда основание В2 сильнее, чем основание В1, то есть в растворах до их сливания рН1 > pK2.
Система в состоянии равновесия описывается уравнением (9). Обратим внимание на то, что в этом состоянии [B1] = [A2], а [A1]= [B2]. В ходе установления равновесия рН1 и рН2 сравняются и установится новое значение рН раствора, которое можно найти путем суммирования выражений рН1 и рН2 отдельных кислотно-основных пар, учитывая, что к моменту достижения равновесия в системе рН1=рН2=рН:
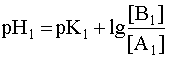
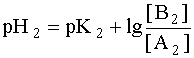
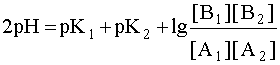
Поскольку дробь под знаком логарифма равна единице, то окончательно имеем:
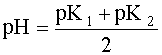
Полученное выражение позволяет сделать весьма важный вывод:
если в водном растворе сосуществуют две сопряженные кислотно-основные пары, то рН такого раствора не зависит от исходных концентраций содержащихся в нем форм, а зависит только от констант кислотности сосуществующих пар.
Данный вывод позволяет рассчитать рН растворов в некоторых особых случаях, что можно пояснить с помощью следующих примеров.
1. рН раствора соли слабого основания и слабой кислоты. Классическим примером такой соли является ацетат аммония NH4CH3COO. В водном растворе эта соль, будучи хорошо растворимой, существует в виде своих ионов:
С другой стороны, эти ионы в водной среде входят в состав сопряженных кислотно-основных пар, каждая из которых характеризуется своей константой кислотности:
NH4 + + H2O D NH3 + H3O + ; 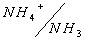
CH3COO –– + H2O D CH3COOH + OH – ; 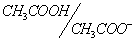
Таким образом, рассмотренный случай является типичным примером сочетания двух кислотно-основных пар и поэтому рН раствора равен
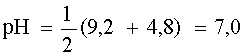
2. Смесь соли с кислотой (основанием). Если имеется эквимолярная смесь соли, образованной сильным основанием и слабой кислотой, с другой слабой кислотой; или соли, образованной слабым основанием и сильной кислотой с другим слабым основанием, то это тоже случай сочетания двух кислотно-основных пар, к которому применимо соотношение (10).
В качестве примера можно взять эквимолярную смесь NaF и CH3COOH. Здесь взаимодействуют между собой кислотно-основные пары 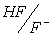
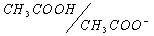
Дифференцированный подход к выбору растворимых кальциевых препаратов второго поколения
Результаты фундаментальных и клинических исследований показывают, что роли кальция в организме вовсе не ограничены поддержкой структуры костей. Препараты кальция (часто в сочетании с витамином D) используются для профилактики остеопороза, остеопении, пере
The results of basic and clinical studies indicate that the role of calcium in the body is not limited only to support of the bone structure (prevention of osteoporosis, osteopenia, fractures, often in combination with vitamin D). Calcium is also used for the increase resistance to cancer, eliminating seizures, arrhythmias, normalization of blood pressure, prevention of atherosclerosis and in aesthetic medicine. Accordingly, there is need for the use of such such calcium preparations as to prevent calcium deficiency and which could be used by a wide range of patients — men, women, pregnant, nursing, children from 3 years of age and adolescents. Calcium presented by inorganic (1st generation) and organic calcium salts (second generation), soluble and insoluble forms. Undeniable advantages of the preparations of 2nd generation are high efficiency (including high bioavailability and its independence on the acidity of gastric juice) as well as safety (reduced risk of kidney stones, cancrophilia and constipation). Soluble calcium supplements on the basis of citrate and lactate do not reduce the acidity of the stomach and, therefore, have a beneficial effect on the absorption of other micronutrients. In this paper we consider the prospects for the use of soluble calcium preparations on the on the basis of calcium citrate.
Недостаточная обеспеченность организма ионами кальция является фактором риска ряда хронических патологий, включая нарушения метаболизма костей, функционирования мышц, эндотелия, иммунной и сердечно-сосудистой систем. По данным Всемирной организации здравоохранения, содержание кальция в питьевой воде является одним из фундаментальных факторов, определяющих состояние здоровья человека на уровне популяций [1].
Однако питьевая вода в подавляющем большинстве географических регионов содержит количество кальция, заведомо недостаточное для компенсации суточной потребности организма (1000 мг/сут для взрослых). Кроме того, доступная большинству людей питьевая вода проходит многократные циклы очистки от органических примесей и токсичных «тяжелых» металлов — свинца, ртути, кадмия. В ходе очистки и без того невысокое содержание кальция существенно снижается. По этой причине возникает необходимость насыщать питьевую воду необходимыми для здоровья макро- и микроэлементами, прежде всего кальцием, с использованием специальных препаратов.
С фармакологической точки зрения, поступление кальция в организм в виде водного раствора имеет ряд существенных преимуществ. Во-первых, кальций уже находится в растворенном состояниии (в отличие, скажем, от таблеток нерастворимого карбоната кальция). Во-вторых, в водном растворе отсутствуют лиганды, мешающие усвоению кальция (например, в пищевых продуктах присутствует значительное количество фитиновой кислоты, переводящей ионы кальция в нерастворимую и низкоусвояемую форму). В-третьих, поступление воды с ионами кальция в растворе препарата способствует решению проблемы недостаточного потребления жидкости (взрослый человек должен выпивать не менее 2–2,5 л/сут чистой питьевой воды). В-четвертых, водный раствор кальция может быть обогащен специальными синергидными микронутриентами, улучшающими фармакокинетику и фармакодинамику кальция.
В настоящей работе обсуждаются особенности препаратов кальция, которые обязательно надо учитывать при их назначении, чтобы применение было максимально эффективным и безопасным. Последовательно рассмотрены результаты исследований обеспеченности кальцием различных популяций, особенности фармакологии различных препаратов кальция и целевое назначение растворимых препаратов органического кальция. Приведены данные клинико-эпидемиологических исследований и доказательной медицины.
Обеспеченность кальцием различных популяций
Рекомендуемое в РФ суточное потребление (РСП) кальция составляет в среднем 1000 мг/сут для взрослых, для лиц старше 60 лет — 1200 мг/сут. Физиологическая потребность для детей — от 400 до 1200 мг/сут [2]. РСП в других странах лежат в сравнимых интервалах значений (табл., рис. 1).
Проведенные в разных странах клинико-эпидемиологические исследования показывают, что среднесуточное потребление кальция среди различных слоев населения составляет 500–1000 мг/сут и редко превышает РСП.
Таким образом, имеющиеся клинико-эпидемиологические данные показывают, что потребление кальция недостаточно. Нормализация потребления кальция может осуществляться как за счет изменения состава потребляемой диеты, так и с использованием специальных препаратов кальция.
Клиническая фармакология препаратов кальция на основе неорганических и органических солей
Компенсация дефицита кальция может осуществляться как за счет изменения состава потребляемой диеты, так и с использованием специальных препаратов кальция.
Существенной проблемой для проведения наиболее эффективной и безопасной компенсации диетарного дефицита кальция является выбор фармакологической субстанции (соли кальция) и фармацевтической формы кальция (таблетки, драже, раствор для питья). В настоящем разделе приведены пролего?мены для дифференцированного подхода к выбору безопасных и эффективных препаратов кальция.
Усвоение кальция из препаратов зависит от таких факторов, как 1) субстанция кальция, 2) доза кальция, 3) режим приема, 4) рН желудочного сока и, конечно же, 5) совместный прием с другими препаратами. В соответствии с субстанцией, выделяют неорганические (1-е поколение) и органические (2-е поколение) препараты кальция. Подавляющее большинство препаратов кальция 1-го поколения представлены карбонатом кальция, который нерастворим в воде и требует определенного диапазона кислотности среды (pH) для усвоения. Органические препараты кальция (2-е поколение) лучше растворяются в воде, существенно меньше зависят от рН желудочного сока и характеризуются более высокой биодоступностью, чем таблетированные формы [4].
Неорганические соли кальция
Карбонат кальция
Карбонат кальция — наиболее распространенная одна из самых дешевых форм кальция, которая широко используется в медицине в качестве антацида [5]. Антациды действуют на поверхности слизистой желудка, нейтрализуя соляную кислоту желудочного сока (HCl). При нейтрализации соляной кислоты часть антацида на основе карбоната кальция растворяется в соответствии с уравнением:
Образующийся хлорид кальция всасывается эпителиоцитами желудка и поступает в кровь. Большая же часть карбоната кальция остается нерастворенной и продвигается с кишечным транзитом в толстый кишечник. Поэтому усвоение карбоната кальция в значительной степени зависит от кислотности желудка (лучшее усвоение наблюдается при более низких рН [6]) — ведь карбонат кальция нерастворим в воде и его усвоение в организме происходит исключительно за счет взаимодействия с HCl желудочного сока. Значимое усвоение кальция из карбоната кальция следует ожидать только у пациентов с повышенной кислотностью желудка.
Органические соли кальция
Лактат кальция
Лактат кальция — характерный компонент зрелых сыров. Лактат кальция может усваиваться при различных значениях рН, и эту форму кальция можно принимать вне зависимости от приема пищи. Лактат кальция успешно нивелирует недостаточные эффекты воздействия эстрогенсодержащих препаратов на минеральную плотность костной ткани [7]. Однако прием только препаратов лактата кальция не может обеспечить полное удовлетворение кальциевой потребности.
Глюконат кальция
Глюконат кальция используется как топическое средство или в виде раствора для инъекций [8, 9]. При определенном методе лечения глюконат кальция способен физиологически стимулировать высвобождение активной формы молекулы кальцитонина из парафолликулярных C-клеток [10], характеризуется отчетливым позитивным воздействием на функцию почек, проявляя сосудорасширяющие и натрийуретические свойства [11]. Также глюконат кальция является эффективной и безопасной пероральной формой кальция для повышения плотности костной массы у недоношенных новорожденных [12].
Цитрат кальция
Цитрат кальция является исключительной по своей эффективности и безопасности формой кальция. Во-первых, цитрат кальция полностью растворяется в воде. Во-вторых, кальций из цитрата усваивается независимо от приема пищи или кислотности желудочного сока. Химические свойства цитрата кальция делают его препаратом первого выбора у пациентов с пониженной кислотностью желудочного сока, а также у пожилых больных и пациентов, употребляющих антациды и ингибиторы протонной помпы. В-третьих, цитрат-анион сам по себе имеет собственно физиологическое значение, являясь основным субстратом центрального энергетического цикла каждой клетки — цикла Кребса. В-четвертых, цитрат-анион способствует снижению риска образования камней в почках и, более того, способствует растворению почечных камней [13].
Синергия свойств компонентов Кальций Д3 Сандоз® Остео, предлагающего как потребление высокоусвояемых органических солей кальция, так и витамина D, позволяет принимать его для компенсации дефицита кальция, и состояний, связанных с дефицитом этого элемента: для повышения минеральной плотности кости и снижения риска переломов, для снижения риска развития остеопороза в пре- и постменопаузальный период.
Цитрат кальция (1200 мг/сут) в сочетании с витамином D (800 мг/сут) снижает риск развития переломов [16]. Метаанализ включал 17 плацебо-контролируемых исследований (n = 52 625) и показал, что сочетание солей кальция с витамином D сокращает риск переломов всех типов на 13% [17]. Сравнительный метаанализ 15 клинических исследований, в которых проводилось сравнение биодоступности карбоната кальция и цитрата кальция, суммарно включил 184 пациента и показал лучшую биоусвояемость цитрата кальция. В соответствии с результатами метаанализа, абсорбция кальция из цитрата кальция была достоверно выше, чем из карбоната кальция: на 20% в среднем по выборке, на 24% в категории «А», на 27% при приеме на пустой желудок и на 22% при приеме во время еды [18].
Цитрат-анион и сам по себе способствует нормализации метаболизма кости. Рандомизированное исследование пожилых пациентов без остеопороза (n = 201, 65 лет и старше) показало, что долговременный прием цитрата калия (4,5 г/сут в течение 2 лет) способствовал наращиванию минеральной плотности кости (в среднем на 1,7 ± 1,5%, 95% доверительный интервал (ДИ) 1,0–2,3, p лактат кальция > глюконат кальция).
Растворимые препараты кальция на основе органических солей, выпускаемые, в частности, компанией «Сандоз» в форме шипучих таблеток, полностью растворяются в воде и поэтому гораздо лучше усваиваются, чем нерастворимые карбонат или фосфат кальция. Кальций Сандоз® Форте (1000 мг/табл. элементарного кальция в виде органических солей) может применяться для профилактики и лечения дефицита кальция среди широкого круга пациентов, включая беременных, женщин в период лактации и детей после трех лет. БАД Кальций Д3 Cандоз® Остео (органические соли кальция в сочетании с витамином D) предназначен для снижения риска развития остеопороза, в том числе для повышения минеральной плотности кости и снижения риска переломов, связанных с дефицитом кальция; для поддержания нормального уровня кальция и витамина D с целью снижения риска развития остеопороза в пре- и постменопаузальный период. Таким образом, в современной фармакологии наметился переход к максимально естественной компенсации дефицита кальция в виде использования водных растворов полностью растворимого и быстроусвояемого цитрата кальция.
Литература
* ГБОУ ВПО ИвГМА МЗ РФ, Иваново
** РСЦ Международного института микроэлементов ЮНЕСКО, Москва
*** ГБОУ ВПО РНИМУ им. Н. И. Пирогова МЗ РФ, Москва





m.jpg)
m.jpg)
m.jpg)

m.jpg)
m.jpg)
m(2).jpg)
_m.jpg)


m.jpg)
_m.jpg)
_1.jpg)
_02.jpg)
_04.jpg)
_2.jpg)
_0.jpg)
_3.jpg)
_4.jpg)



.gif)
.gif)
_575.gif)