Что такое чистый водород
$100 млрд на зеленом и голубом газу
Документ разработан в Минэнерго и согласован с компаниями и профильными ведомствами, сообщил РБК представитель Минэнерго. По его словам, сейчас начата процедура согласования концепции с правительством. РБК направил запрос в пресс-службу правительства.
Разница в прогнозах связана с различными сценариями развития мирового рынка водорода в качестве энергоносителя и, соответственно, от спроса на него, следует из документа. Сейчас такого рынка нет, но в будущем он может стать крупным благодаря развитию технологий и масштабированию водородной энергетики, считают авторы концепции. Рынок может быть как глобальным — «с крупнотоннажными перевозками водорода от центров производства к центрам потребления по аналогии с рынками нефти и сжиженного природного газа (СПГ)», так и локальным, когда производство и потребление водорода будут сосредоточены в рамках одних и тех же стран или регионов, говорится в документе.
Россия как потенциально крупный поставщик водорода заинтересована в формировании глобального рынка водородных энергоносителей, подчеркивается в концепции.
Цветовая шкала для водорода
Для классификации водорода по технологиям производства и исходному сырью используется цветовая шкала. «Серый» водород производят из природного газа путем конверсии метана на крупнотоннажном производстве, «бурый» водород — из угля. Производство «серого» и «бурого» водорода предполагает выбросы углекислого газа (СО2) в атмосферу.
«Зеленый» водород получается электролизом воды из возобновляемых источников (ВИЭ), «желтый» — за счет электролиза при использовании атомной энергии (оба без выбросов СО2 или с их минимальным количеством). «Голубой» и «синий» водород производят из природного газа с последующим преобразованием CO2 в углерод по технологии CCS (Carbon Capture and Sequestration, улавливание и хранение углерода).
Как нарастить экспорт водорода
В России будут развивать технологии производства как «зеленого», так и «голубого» водорода, заявлял глава Минпромторга Денис Мантуров 13 апреля на конференции Ассоциации европейского бизнеса. По его словам, водород будет использоваться для нужд автотранспорта наряду с другими видами газомоторного топлива (сжиженный и компримированный, или сжатый, природный газ).
Сейчас в России нет промышленных проектов по производству «зеленого» водорода, говорил РБК глава столичного дептранса Максим Ликсутов. «Росатом» производит в год 4,2 тыс. т «желтого» низкоуглеродного водорода, уточняет доцент базовой кафедры возобновляемых источников энергии Российского государственного университета нефти и газа им. Губкина Владислав Карасевич. По его данным, российская нефтяная, атомная и аграрная промышленность производит около 3 млн т «серого» водорода в год для собственных нужд. Ежегодный же экспорт и импорт — это лишь 5 т, добавляет он.
Россия нацелена занять 20% мирового рынка водорода к 2030 году, говорил замглавы Минэнерго Павел Сорокин на коллегии министерства 12 апреля. «Мы считаем, что это (экспорт из России «зеленого» водорода. — РБК) в 2035 году может быть от 1 млн до 2 млн т в «низком» сценарии, до 7 млн т — при более активном бурном развитии [спроса на водород в мире]», — сказал он.
По данным Минэнерго, спрос на экологически чистый водород может существенно вырасти из-за планов Евросоюза к 2050 году достичь полной углеродной нейтральности (равенства вредных выбросов, выделяемых в атмосферу и извлекаемых оттуда). Частью «зеленых» инициатив ЕС является введение трансграничного углеродного налога — пошлины на импортируемые товары с большим углеродным следом. Этот налог может обойтись российским экспортерам от €33 млрд до €50,6 млрд до 2030 года, оценивали эксперты KPMG.
Кто планирует производить экологичный водород в России
Для достижения амбициозных целей в области производства и экспорта экологичных типов водорода Минэнерго к 2024 году предлагает создать четыре кластера по географическому принципу — Северо-Западный, Восточный, Арктический и Южный. Ведомство считает необходимым предоставить производителям меры господдержки: от специальных инвестконтрактов и возмещения части затрат на производство высокотехнологичной продукции до возмещения части затрат на купонный доход по «зеленым» облигациям, средства от продажи которых пойдут на финансирование таких проектов.
Для выполнения целей, указанных в проекте Концепции развития водородной энергетики, необходимо уже сейчас значительно активизировать работу по созданию мощностей для производства водорода, ориентированных на экспорт, а также договориться с заинтересованными потребителями и определить возможные варианты его транспортировки, замечает Карасевич.
«Росатом» к лету 2021 года рассчитывает представить результаты технико-экономического обоснования пилотного проекта поставок в Японию водорода, произведенного методом электролиза, сообщил 26 марта вице-президент по маркетингу и развитию бизнеса «Русатом Оверсиз» Антон Москвин, выступая на вебинаре «Водородная стратегия и ключевые тренды энергоперехода». В феврале «Росатом» сообщал, что способен обеспечить до 40% спроса Японии на водород до конца ближайшего десятилетия. В качестве приоритетного сценария экспортного японского проекта рассматривается организация производства сжиженного водорода на территории Сахалинской области и поставок его по морю в Японию. Кроме того, компания планирует в тестовом режиме запустить поезда на водороде на Сахалине.
Замглавы правления «Газпрома» Олег Аксютин в конце марта говорил, что компания планирует экспортировать водород в страны Азии. «Особый интерес представляет возможность производства водорода на территории Дальнего Востока методом парового риформинга метана с обеспечением улавливания и захоронения диоксида углерода («синий» водород. — РБК) и последующим экспортом водорода в страны-потребители (Япония, Южная Корея, Китай)», — отмечал он, не уточняя сроков начала экспорта.
Крупнейший в России производитель сжиженного природного газа НОВАТЭК вместе со своим французским партнером Total прорабатывает проект улавливания CO2 на Ямале и создания производств водорода для собственных нужд и на продажу, указывал начальник управления по связям с инвесторами компании Александр Назаров на конференции Московской школы управления «Сколково». Тогда же президент BP Russia Дэвид Кэмпбелл сказал, что британский мейджор заинтересован в сотрудничестве с российскими компаниями в проектах по производству водорода и развития технологии улавливания и хранения СО2. Сама компания собирается построить завод по производству «голубого» водорода в Великобритании.
РБК направил запросы в пресс-службы «Росатома», «Газпрома» и НОВАТЭКа по поводу их участия в разработке Концепции развития водородной энергетики и планов по производству и экспорту водорода до 2050 года.
Водород для транспорта
Как собирать, хранить и поставлять водород
В одном из прошлых постов мы выяснили, что в обозримой перспективе себестоимость производства водорода снизится настолько, что этот газ станет конкурентоспособным энергоносителем на транспорте и в энергетике. Но есть ещё одна потенциальная проблема водородной экономики: хранить, транспортировать и поставлять H2 не так просто, как кажется. В этот раз мы расскажем, какие технологии решат эти задач и не «съедят» ли транспортные издержки прибыль будущих водородных магнатов.
Где и как хранить водород
По мере превращения водорода из промышленного в потребительский товар — им будут заправлять машины, питать электросистему и отопление домов — его нужно будет запасать в больших количествах. Это нужно будет и для того, чтобы цены на водород не скакали. Причём газ будет храниться долго, поэтому не столько важна скорость закачки/откачки и расположение, сколько объём хранилищ.
Второй естественный резервуар для водорода — истощённые пласты залежей природного газа или нефти и водоносные горизонты. Они больше соляных пещер, но водород в них сильнее загрязняется, вступая в реакцию с горной породой, микробами, жидкостями. В такие пещеры водород пока не закачивают, поэтому считать «экономику» рано.

Однако для краткосрочного и мелкомасштабного хранения водорода такие «пещеры горного короля» не подходят — нужны баки. В резервуарах хранят сжатый или сжиженный водород, который можно быстро закачать или откачать в нужных объёмах.
Сжатый водород (при давлении 700 бар, т. е. приблизительно 690 атм.) имеет только 15% плотности энергии (количество энергии на единицу объёма) бензина, и чтобы хранить эквивалентное количество топлива, скажем, на водородной заправке, нужно в семь раз больше места.
Поэтому водород скорее всего будут мешать с аммиаком, у которого плотность больше, а места такой смеси требуется меньше, что позволит транспортировать больше водорода без увеличения объёма хранилища. Правда, придётся потратиться на конверсию и реконверсию смеси.
В каком виде транспортировать водород
Проблема подготовки водорода для транспортировки решается по-разному: H2 сжимают, сжижают, смешивают с другими веществами. У каждого из этих вариантов свои преимущества и недостатки, а оптимальное решение зависит от географии поставок, расстояния, объёма и вида водорода для потребителя.
В любом агрегатном состоянии (кроме твёрдого, конечно) водород можно пустить по имеющимся газовым трубам, что однозначно дешевле, чем строить новую инфраструктуру. Первый кандидат — газовые сети. В мире насчитывается 3 млн километров газопроводов и 400 млрд кубометров подземных хранилищ метана. Но с этим есть технические проблемы:
у водорода низкая плотность энергии, и объёмы (или время) его поставки через газопровод придётся увеличить;
водород очень горюч на воздухе, поэтому чтобы снизить риски, придётся менять оборудование по всей цепочке поставок;
не всякая инфраструктура для, например, метана подойдёт водороду; особенно это касается потребительских котлов, бойлеров и т. п. (об этом подробнее ниже);
В итоге наряду с газообразным водородом нам придётся производить его сжиженные и смешанные версии.

Схожим образом водород можно включить в жидкий органический носитель. На конверсию и реконверсию при этом уйдёт 35-40% водорода, хотя объёмы поставок эти издержки покрывают.
Некоторые жидкие органические носители водорода могут быть негорючими, что делает перевозку безопаснее. Источник: Hydrogenious LOHC Technologies / YouTube
Как доставлять водород
Как и углеводороды сейчас, водород перемещать по миру в основном будут трубы, суда и автоцистерны. Отправлять H2 поездами в целом будет дороже, хотя удалённым потребителям в локациях без трубопровода это возможно. В мире сегодня существует много водородопроводов, но в основном они не выходят за пределы технологических площадок химических и нефтеперерабатывающих заводов. Поэтому более оптимальный вариант — трубы для передачи природного газа.
Однако далеко не все они подходят для прокачки водорода из-за типа стали: трубы из низкопрочной стали будут портиться из-за контакта с водородом (водородное охрупчивание) и давления прокачки. При этом их пропускная способность должна быть в три раза выше из-за низкой плотности водорода. Последнее решается, как мы уже выяснили, смешиванием водорода с жидкостями, и для таких соединений также есть трубопроводы. В частности, трубы используют для прокачки аммиачно-водородной смеси. Один из аммиакопроводов, к примеру, идёт из Тольятти (Россия) до Одессы (Украина) (2,4 тыс. км).
Однако трубопровод подойдёт не для всех потребителей. В некоторые страны H2 доставят морем. Пока танкеры для перевозки водорода массово не производят. Первое такое судно, получившее название Suiso Frontier, построила компания Kawasaki Heavy Industries, а спустили его на воду в декабре 2019 года в Кобе (Япония). В марте 2020 года на танкер установили резервуар объёмом 1 250 куб. м, в котором водород будут перевозить в сжиженном состоянии.
В других проектах предполагаются танкеры, схожие по размеру с судами для СПГ, которые в качестве топлива будут сжигать в день примерно 0,2% от перевозимого водорода. Более перспективны в этом отношении танкеры, которые сейчас перевозят сжиженный нефтяной газ (СНГ). В их резервуары можно залить аммиачную и другие подобные смеси водорода. Газовозами доставлять водород дороже, чем по трубопроводам.
Правда, обычно перевозят таким способом в пределах 300 км: дальше становится невыгодно. Развитие автоперевозок водорода будет зависеть от вместимости баков. Теоретически один прицеп со сжатым газообразным водородом может вместить до 1 100 кг в лёгких композитных цилиндрах (под давлением 500 бар). Однако этот показатель редко достигается на практике, поскольку правила во всем мире ограничивают допустимое давление, высоту, ширину и вес цистерн.

Второй вариант — автоцистерны со сжиженным водородом, если есть постоянные потребители и объёмы поставки компенсируют расходы на сжижение.
Как видно, экономика автоперевозок зависит от объёма поставок: чем больше требуется водорода, тем более выгодно построить трубопровод. Чем меньше и чем ближе потребитель, тем выгоднее возить водород грузовиками
Итого: сколько стоят путешествия водорода
Прежде чем подвести предварительный итог напомним, во сколько обойдётся производство «зелёного» водорода и при какой цене он станет конкурентоспособным относительно традиционных энергоносителей.

Более того, мы в Toshiba знаем, как включить в цепь добавленной водородной стоимости новые технологии, которые позволят снизить транспортные издержки.
Как построить водородную цепь добавленной стоимости
Вырисовывается такая картина: в густонаселенных районах Европы и США водород от большого числа местных поставщиков для небольших потребителей в основном будут возить грузовики. Крупные потребители будут получать водород либо по трубопроводам от дальних поставщиков, либо импортировать морем из соседних стран (Латинская Америка для США и Северная Африка с Ближним Востоком — для Европы).
Японии будет сложнее: местный водород будет сравнительно дорогим, поэтому для крупных потребителей возможны поставки морем из стран ближнего и дальнего зарубежья. Правда, водородная энергетика всё-таки будет «демократичнее» углеводородной благодаря доступности возобновляемых источников энергии большому числу потребителей.
В последнем случае конвертировать полученный водород поможет наш генератор на топливных элементах H2Rex, который уже производит электричество и тепло из водорода и воздуха, к примеру, для гостиницы в Кавасаки. Небольшим и удалённым от производства H2 потребителям подойдут мини-электростанции типа нашей H2One. Она вырабатывает водород методом электролиза из воды, который поддерживается встроенной солнечной батареей.
Мы убеждены, что интеграция таких источников и преобразователей энергии в сочетании со строительством водородных электростанций на ВИЭ позволит снизить зависимость потребителей от зарубежных поставок H2, которые могут оказаться для них дорогими.
Водород
(молярная масса)
(первый электрон)
Водород (H, лат. hydrogenium ) — химический элемент периодической системы с обозначением H и атомным номером 1, самый лёгкий из элементов периодической таблицы. Его одноатомная форма — самое распространённое химическое вещество во Вселенной, составляющее примерно 75 % всей барионной массы. Звёзды, кроме компактных, в основном состоят из водородной плазмы.
Три изотопа водорода имеют собственные названия: 1 H — протий, 2 H — дейтерий и 3 H — тритий (радиоактивен). Ядро самого распространённого изотопа, протия, состоит из одного только протона и не содержит нейтронов.
При стандартных температуре и давлении водород — бесцветный, не имеющий запаха и вкуса, нетоксичный двухатомный газ с химической формулой H2, который в смеси с воздухом или кислородом горюч и крайне пожаро- и взрывоопасен. В присутствии других окисляющих газов, например фтора или хлора, водород также взрывоопасен. Поскольку водород охотно формирует ковалентные связи с большинством неметаллов, большая часть водорода на Земле существует в молекулярных соединениях, таких как вода или органические вещества. Водород играет особенно важную роль в кислотно-основных реакциях.
Растворим в этаноле и ряде металлов: железе, никеле, палладии, титане, платине, ниобии.
Содержание
История открытия
Выделение горючего газа при взаимодействии кислот и металлов наблюдали в XVI и XVII веках на заре становления химии как науки. Впервые водород получил Парацельс, погружая железные опилки в серную кислоту в XVI веке.
В 1671 году Роберт Бойль подробно описал реакцию между железными опилками и разбавленными кислотами, при которой выделяется газообразный водород.
В 1766 году Генри Кавендиш был первым, кто признал газообразный водород индивидуальным элементом, назвав газ, выделяющийся при реакции металла с кислотой «горючим воздухом». Он предположил, что «горючий воздух» идентичен гипотетическому веществу, называемому «флогистон», и в 1781 году обнаружил, что при его сгорании образуется вода.
Прямо указывал на выделение водорода и Михаил Ломоносов, но он уже понимал, что это не флогистон.
Французский химик Антуан Лавуазье совместно с инженером Жаном Мёнье, используя специальные газометры, в 1783 году осуществил синтез воды, а затем и её анализ, разложив водяной пар раскалённым железом. Так он установил, что «горючий воздух» входит в состав воды и может быть из неё получен.
Происхождение названия
Лавуазье дал водороду название hydrogène (от др.-греч. ὕδωρ — вода и γεννάω — рождаю) — «рождающий воду». В 1801 году последователь Лавуазье, академик Василий Севергин, называл его «водотворное вещество», он писал:
Водотворное вещество в соединении с кислотворным составляет воду. Сие можно доказать, как через разрешение, так и через составление.
Русское наименование «водород» предложил химик Михаил Соловьёв в 1824 году — по аналогии с «кислородом» Ломоносова.
Распространённость
Во Вселенной
В настоящее время водород — самый распространённый элемент во Вселенной. На его долю приходится около 88,6 % всех атомов (около 11,3 % составляют атомы гелия, доля всех остальных вместе взятых элементов — порядка 0,1 %). Таким образом, водород — основная составная часть звёзд и межзвёздного газа. Повсеместное возникновение атомарного водорода впервые произошло в эпоху рекомбинации.
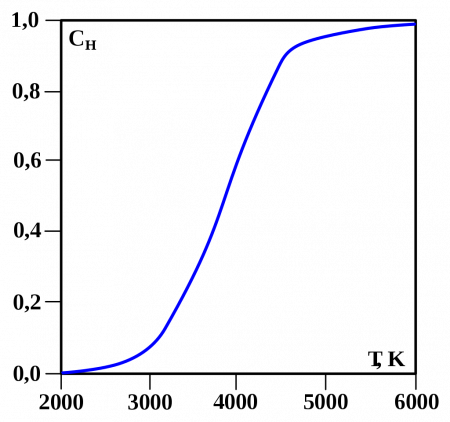
В условиях звёздных температур (например, температура поверхности Солнца
6000 °C) водород существует в виде плазмы, в межзвёздном пространстве этот элемент существует в виде отдельных молекул, атомов и ионов и может образовывать молекулярные облака, значительно различающиеся по размерам, плотности и температуре.
Земная кора и живые организмы
Массовая доля водорода в земной коре составляет 1 % — это десятый по распространённости элемент. Однако его роль в природе определяется не массой, а числом атомов, доля которых среди остальных элементов составляет 17 % (второе место после кислорода, доля атомов которого равна
52 %). Поэтому значение водорода в химических процессах, происходящих на Земле, почти так же велико, как и кислорода.
В отличие от кислорода, существующего на Земле и в связанном, и в свободном состояниях, практически весь водород на Земле находится в виде соединений; лишь в очень незначительном количестве водород в виде простого вещества содержится в атмосфере (0,00005 % по объёму для сухого воздуха).
Водород входит в состав практически всех органических веществ и присутствует во всех живых клетках, где по числу атомов на водород приходится почти 63 %.
Получение
В промышленности
На 2019 год в мире потребляется 75 млн тонн водорода, в основном в нефтепереработке и производстве аммиака. Из них более 3/4 производится из природного газа, для чего расходуется более 205 млрд м 3 газа. Почти все остальное получают из угля. Около 0,1 % (
100 тыс. тонн) вырабатывается электролизом. При производстве водорода в атмосферу поступает
830 млн тонн CO2. Себестоимость водорода из природного газа оценивается в 1,5-3 доллара за 1 кг.
В лаборатории
Очистка
В промышленности реализованы несколько способов очистки водорода из углерод-содержащего сырья (т. н. водородсодержащий газ — ВСГ).
Стоимость
Стоимость водорода при крупнооптовых поставках колеблется в диапазоне 2—7 USD/кг. В небольших количествах перевозится в стальных баллонах зелёного или тёмно-зелёного цвета.
Физические свойства
Водород — самый лёгкий газ: он легче воздуха в 14,5 раз. Поэтому, например, мыльные пузыри, наполненные водородом, на воздухе стремятся вверх. Чем меньше масса молекул, тем выше их скорость при одной и той же температуре. Как самые лёгкие, молекулы водорода движутся быстрее молекул любого другого газа и тем самым быстрее могут передавать теплоту от одного тела к другому. Отсюда следует, что водород обладает самой высокой теплопроводностью среди газообразных веществ. Его теплопроводность примерно в 7 раз выше теплопроводности воздуха.
Водород хорошо растворим во многих металлах (Ni, Pt, Pd и др.), особенно в палладии (850 объёмов H2 на 1 объём Pd). С растворимостью водорода в металлах связана его способность диффундировать через них; диффузия через углеродистый сплав (например, сталь) иногда сопровождается разрушением сплава вследствие взаимодействия водорода с углеродом (так называемая декарбонизация). Практически не растворим в серебре.
В 1935 году Уингер и Хунтингтон высказали предположение о том, что при давлении свыше 250 тысяч атм водород может перейти в металлическое состояние. Получение этого вещества в устойчивом состоянии открывало очень заманчивые перспективы его применения — ведь это был бы сверхлёгкий металл, компонент лёгкого и энергоёмкого ракетного топлива. В 2014 году было установлено, что при давлении порядка 1,5—2,0 млн атм водород начинает поглощать инфракрасное излучение, а это означает, что электронные оболочки молекул водорода поляризуются. Возможно, при ещё более высоких давлениях водород превратится в металл. В 2017 году появилось сообщение о возможном экспериментальном наблюдении перехода водорода в металлическое состояние под высоким давлением.
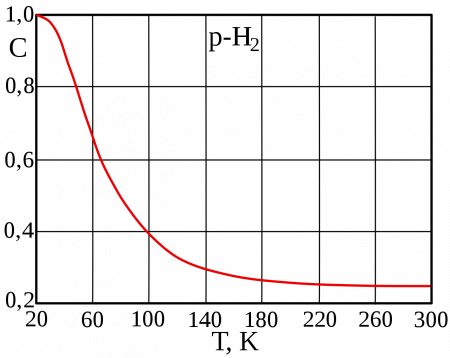
Молекулярный водород существует в двух спиновых формах (модификациях): ортоводород и параводород. Модификации немного различаются по физическим свойствам, оптическим спектрам, также по характеристикам рассеивания нейтронов. В молекуле ортоводорода o-H2 (т. пл. −259,10 °C, т. кип. −252,56 °C) спины ядер параллельны, а у параводорода p-H2 (т. пл. −259,32 °C, т. кип. −252,89 °C) — противоположно друг другу (антипараллельны). Равновесная смесь o-H2 и p-H2 при заданной температуре называется равновесный водород e-H2.
Разделить модификации водорода можно адсорбцией на активном угле при температуре жидкого азота. При очень низких температурах равновесие между ортоводородом и параводородом почти нацело сдвинуто в сторону параводорода, так как энергия пара-молекулы немного ниже энергии орто-молекулы. При 80 К соотношение модификаций приблизительно 1:1. Десорбированный с угля параводород при нагревании превращается в ортоводород с образованием равновесной смеси. При комнатной температуре равновесна смесь ортоводорода и параводорода в отношении около 75:25. Без катализатора взаимное превращение происходит относительно медленно, что даёт возможность изучить свойства обеих модификаций. В условиях разреженной межзвёздной среды характерное время перехода в равновесную смесь очень велико, вплоть до космологических.
Изотопы
Наиболее известны три изотопа водорода: протий 1 H (атомное ядро — протон), дейтерий 2 H (ядро состоит из одного протона и одного нейтрона) и тритий 3 H (ядро состоит из одного протона и двух нейтронов). Эти изотопы имеют собственные химические символы: протий — H, дейтерий — D, тритий — T.
Искусственно получены также тяжёлые радиоактивные изотопы водорода с массовыми числами 4—7 и периодами полураспада 10 −21 —10 −23 с.
Природный молекулярный водород состоит из молекул H2 и HD (дейтероводород) в соотношении 3200:1. Содержание в нём молекул из чистого дейтерия D2 ещё меньше, отношение концентраций HD и D2 составляет примерно 6400:1.
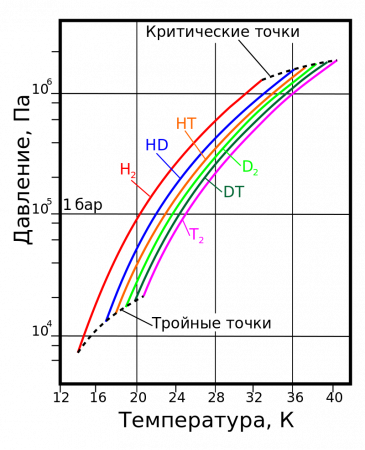
Из всех изотопов химических элементов физические свойства изотопов водорода отличаются друг от друга наиболее сильно. Это связано с наибольшим относительным изменением масс атомов.
| Температура плавления, K | Температура кипения, K | Тройная точка | Критическая точка | Плотность, кг/м³ | ||||
|---|---|---|---|---|---|---|---|---|
| T, K | P, кПа | T, K | P, МПа | жидкий | газ | |||
| H2 | 13,96 | 20,39 | 13,96 | 7,3 | 32,98 | 1,31 | 70,811 | 1,316 |
| HD | 16,65 | 22,13 | 16,6 | 12,8 | 35,91 | 1,48 | 114,0 | 1,802 |
| HT | 22,92 | 17,63 | 17,7 | 37,13 | 1,57 | 158,62 | 2,31 | |
| D2 | 18,65 | 23,67 | 18,73 | 17,1 | 38,35 | 1,67 | 162,50 | 2,23 |
| DT | 24.38 | 19,71 | 19,4 | 39,42 | 1,77 | 211,54 | 2,694 | |
| T2 | 20,63 | 25,04 | 20,62 | 21,6 | 40,44 | 1,85 | 260,17 | 3,136 |
Молекулы чистых протия, дейтерия и трития могут существовать в двух аллотропных модификациях (отличающихся взаимной ориентацией спинов ядер) — орто- и параводород: o-D2, p-D2, o-T2, p-T2. Молекулы водорода с другим изотопным составом (HD, HT, DT) не имеют орто- и парамодификаций.
Свойства изотопов
Свойства изотопов водорода представлены в таблице.
| Изотоп | Z | N | Масса, а. е. м. | Период полураспада | Спин | Содержание в природе, % | Тип и энергия распада | |
|---|---|---|---|---|---|---|---|---|
| 1 H | 1 | 0 | 1,007 825 032 07(10) | стабилен | 1 ⁄2 + | 99,9885(70) | ||
| 2 H | 1 | 1 | 2,014 101 777 8(4) | стабилен | 1 + | 0,0115(70) | ||
| 3 H | 1 | 2 | 3,016 049 277 7(25) | 12,32(2) года | 1 ⁄2 + | β − | 18,591(1) кэВ | |
| 4 H | 1 | 3 | 4,027 81(11) | 1,39(10)⋅10 −22 с | 2 − | -n | 23,48(10) МэВ | |
| 5 H | 1 | 4 | 5,035 31(11) | более 9,1⋅10 −22 с | ( 1 ⁄2 + ) | -nn | 21,51(11) МэВ | |
| 6 H | 1 | 5 | 6,044 94(28) | 2,90(70)⋅10 −22 с | 2 − | −3n | 24,27(26) МэВ | |
| 7 H | 1 | 6 | 7,052 75(108) | 2,3(6)⋅10 −23 с | 1 ⁄2 + | -nn | 23,03(101) МэВ | |
В круглых скобках приведено среднеквадратическое отклонение значения в единицах последнего разряда соответствующего числа.
Свойства ядра 1 H позволяют широко использовать ЯМР-спектроскопию в анализе органических веществ.
Химические свойства
Молекулы водорода достаточно прочны, и для того, чтобы водород мог вступить в реакцию, должна быть затрачена большая энергия:
Поэтому при обычных температурах водород реагирует только с очень активными металлами, например, с кальцием, образуя гидрид кальция:
и с единственным неметаллом — фтором, образуя фтороводород:
С большинством же металлов и неметаллов водород реагирует при повышенной температуре или при другом воздействии, например, при освещении:
Записанное уравнение отражает восстановительные свойства водорода.
С галогенами образует галогеноводороды:
С сажей взаимодействует при сильном нагревании:
Взаимодействие со щелочными и щёлочноземельными металлами
При взаимодействии с активными металлами водород образует гидриды:
Гидриды — солеобразные, твёрдые вещества, легко гидролизуются:
Взаимодействие с оксидами металлов
Оксиды металлов (как правило, d-элементов) восстанавливаются до металлов:
Гидрирование органических соединений
Молекулярный водород широко применяется в органическом синтезе для восстановления органических соединений. Эти процессы называют реакциями гидрирования. Эти реакции проводят в присутствии катализатора при повышенных давлении и температуре. Катализатор может быть как гомогенным (напр., Катализатор Уилкинсона), так и гетерогенным (напр., никель Ренея, палладий на угле).
Так, в частности, при каталитическом гидрировании ненасыщенных соединений, таких как алкены и алкины, образуются насыщенные соединения — алканы.
Геохимия водорода
На Земле содержание водорода понижено по сравнению с Солнцем, планетами-гигантами и первичными метеоритами, из чего следует, что во время образования Земля была значительно дегазирована: основная масса водорода, как и других летучих элементов, покинула планету во время аккреции или вскоре после неё. Однако точное содержание данного газа в составе геосфер нашей планеты (исключая земную кору) — астеносферы, мантии, ядра Земли — неизвестно.
Свободный водород H2 относительно редко встречается в земных газах, но в виде воды он принимает исключительно важное участие в геохимических процессах. Известно содержание водорода в составе вулканических газов, истечение некоторых количеств водорода вдоль разломов в зонах рифтогенеза, выделение этого газа в некоторых угольных месторождениях.
В состав минералов водород может входить в виде иона аммония, гидроксил-иона и воды.
В атмосфере молекулярный водород непрерывно образуется в результате разложения формальдегида, образующегося в цепочке окисления метана или другой органики, солнечным излучением (31—67 гигатонн/год), неполного сгорания различных топлив и биомасс (по 5—25 гигатонн/год), в процессе фиксации азота микроорганизмами из воздуха (3−22 гигатонн/год).
Имея малую массу, молекулы водорода в составе воздуха обладают высокой тепловой скоростью (она близка ко второй космической скорости) и, попадая в верхние слои атмосферы, могут навсегда улететь в космическое пространство (см. Диссипация атмосфер планет). Объёмы потерь оцениваются в 3 кг в секунду.
Меры предосторожности
Водород при смеси с воздухом образует взрывоопасную смесь — так называемый гремучий газ. Наибольшую взрывоопасность этот газ имеет при объёмном отношении водорода и кислорода 2:1, или водорода и воздуха приближённо 2:5, так как в воздухе кислорода содержится примерно 21 %. Также водород пожароопасен. Жидкий водород при попадании на кожу может вызвать сильное обморожение.
Считается, что взрывоопасные концентрации водорода с кислородом возникают от 4 % до 96 % объёмных. При смеси с воздухом от 4 % до 75 (74) % по объёму. Такие цифры фигурируют сейчас в большинстве справочников, и ими вполне можно пользоваться для ориентировочных оценок. Однако следует иметь в виду, что более поздние исследования (примерно конец 80-х) выявили, что водород в больших объёмах может быть взрывоопасен и при меньшей концентрации. Чем больше объём, тем меньшая концентрация водорода опасна.
Источник этой широко растиражированной ошибки в том, что взрывоопасность исследовалась в лабораториях на малых объёмах. Поскольку реакция водорода с кислородом — это цепная химическая реакция, которая проходит по свободнорадикальному механизму, «гибель» свободных радикалов на стенках (или, скажем, поверхности пылинок) критична для продолжения цепочки. В случаях, когда возможно создание «пограничных» концентраций в больших объёмах (помещения, ангары, цеха), следует иметь в виду, что реально взрывоопасная концентрация может отличаться от 4 % как в большую, так и в меньшую стороны.
Применение
Водород сегодня применяется во многих областях. Структура мирового потребления водорода представлена в следующей таблице
| Применение | Доля |
|---|---|
| Производство аммиака | 54 % |
| Нефтепереработка и химическая промышленность | 35 % |
| Производство электроники | 6 % |
| Металлургия и стекольная промышленность | 3 % |
| Пищевая промышленность | 2 % |
Химическая промышленность
Химическая промышленность — это крупнейший потребитель водорода. Около 50 % мирового выпуска водорода идёт на производство аммиака. Ещё около 8 % используется для производства метанола. Из аммиака производят пластмассы, удобрения, взрывчатые вещества и прочее. Метанол является основой для производства некоторых пластмасс.
Нефтеперерабатывающая промышленность
В нефтепереработке водород используется в процессах гидрокрекинга и гидроочистки, способствуя увеличению глубины переработки сырой нефти и повышению качества конечных продуктов. Для этих целей используется порядка 37 % всего производимого в мире водорода.
Пищевая и косметическая промышленность
При производстве саломаса (твёрдый жир, производимый из растительных масел). Саломас является основой для производства маргарина, косметических средств, мыла. Водород зарегистрирован в качестве пищевой добавки E949.
Химические лаборатории
Водород используется в химических лабораториях в качестве газа-носителя в газовой хроматографии. Такие лаборатории есть на многих предприятиях в пищевой, парфюмерной, металлургической и химической промышленности. Несмотря на горючесть водорода, его использование в такой роли считается достаточно безопасным, поскольку водород используется в незначительных количествах. Эффективность водорода как газа-носителя при этом лучше, чем у гелия, при существенно более низкой стоимости.
Авиационная промышленность
В настоящее время водород в авиации не используется. Когда-то дирижабли и воздушные шары наполняли водородом. Но в 30-х гг. XX в. произошло несколько катастроф, в ходе которых дирижабли взрывались и сгорали. В наше время дирижабли наполняют гелием, несмотря на его существенно более высокую стоимость.
Метеорология
Водород используется в метеорологии для заполнения оболочек метеозондов. Водород в этом качестве имеет преимущество перед гелием, так как он дешевле. Ещё более существенно, что водород вырабатывается прямо на метеостанции с помощью простого химического генератора или с помощью электролиза воды. Гелий же должен доставляться на метеостанцию в баллонах, что может быть затруднительно для удалённых мест.
Топливо
Ведутся исследования по применению водорода как топлива для легковых и грузовых автомобилей.
В водородно-кислородных топливных элементах используется водород для непосредственного преобразования энергии химической реакции в электрическую.
Электроэнергетика
Водород применяется для охлаждения мощных электрических генераторов.
Прочее
Атомарный водород используется для атомно-водородной сварки. Высокая теплопроводность водорода используется для заполнения сфер гирокомпасов и стеклянных колб филаментных LED-лампочек.