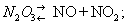Окислы азота что это
Азота окислы
Полезное
Смотреть что такое «Азота окислы» в других словарях:
Окислы азота — Смесь различных окислов азота, кроме закиси NO2, образовавшихся в цилиндре дизеля в процессе сгорания Источник: ГОСТ 24585 81: Дизел … Словарь-справочник терминов нормативно-технической документации
ОКИСЛЫ — ОКИСЛЫ, соединения элементов с кислородом. Кислород соединяется со всеми элементами кроме благородных газов. Недавно открытая юкись фтора заполняет существовавший в отношении фтора пробел. В зависимости от степени окисления и валентности элемента … Большая медицинская энциклопедия
Окислы азота (NOх) — 5. Окислы азота (NOх) Смесь окиси и двуокиси азота, содержащихся в пробе газа Примечание. В расчетах условно предполагается, что окись азота находится в виде двуокиси азота Источник … Словарь-справочник терминов нормативно-технической документации
Окислы азота — С кислородом азот образует ряд соединений N2O5 азотный ангидрид [О над азотной кислоте см. Крепкая водка.], N2O4 или NO2 азотноватый ангидрид или двуокись азота, N2O3 азотистый ангидрид, NO окись азота, N2O закись азота. Определения Фавра,… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Окислы азота — Оксиды азота соединения азота с кислородом. Содержание 1 Список оксидов 2 N2O 3 NO 4 N2O3(III) 5 NО2, N2O4 … Википедия
Окислы — Оксид (окисел, окись) соединение химического элемента с кислородом, в котором сам кислород связан только с менее электроотрицательным элементом. Химический элемент кислород по электроотрицательности второй после фтора, поэтому к оксидам… … Википедия
Окислы азота и азотная кислота — 4.6. Окислы азота и азотная кислота оказывают в основном вредное влияние на активную массу отрицательных электродов, окисляя свинец в окись. Окись свинца, в свою очередь, вступая в реакцию с оставшейся неиспользованной кислотой, образует… … Словарь-справочник терминов нормативно-технической документации
Окислы — О. называются соединения простых тел с кислородом. Если придерживаться деления простых тел на две группы, на металлы и металлоиды (см.), то вообще в характере их О. можно заметить довольно ясную разницу. Тогда как типические представители первой… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Закись азота — веселящий газ, один из окислов азота (см. Азота окислы); в медицине применяют в смеси с кислородом как средство для ингаляционного Наркоза при хирургических операциях, родах, иногда при инфаркте миокарда. Назван веселящим газом английским … Большая советская энциклопедия
Закись азота — химический состав см. Окислы азота. В медицине З. азота получила название веселящего газа: вдыхаемая в смеси с атмосферным воздухом или кислородом при обыкновенной температуре и давлении она вызывает особое состояние опьянения, уничтожающего… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Азота окислы
Аз о та о кислы, соединения азота с кислородом. Известны N2O, NO, N2O3, NO2 (и его димер N2O4), N2O5; есть сведения о существовании NO3, не выделенного в свободном состоянии. При высокой температуре в пламени вольтовой дуги, а в природе — при электроразряде из смеси азота с кислородом образуется окись азота NO, которая при охлаждении переходит в NO2. Другие азота окислы получают косвенным путём. N2O5 — твёрдое вещество; остальные окислы при обычных условиях газообразны.
Азотистый ангидрид (трёхокись азота) N2O3 — в обычных условиях неустойчивое соединение. Разлагается уже при 0°С:
Около 3,5°С кипит с разложением, при 25°C содержит только 10% недиссоциированного N2O3. При низкой температуре может быть получен в виде тёмно-голубой жидкости, при сильном охлаждении — светло-голубой массы с tпл —102°С. С водой образует азотистую кислоту: N2O3 + H2O = 2HNO2, со щелочами — соли (см. Нитриты). N2O3 получают по реакции: N2O4+ 2NO = 2N2O3; практического применения не находит.
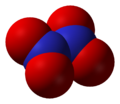
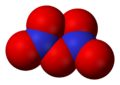
Азотный ангидрид (пятиокись азота) N2O5 — бесцветные очень летучие кристаллы. Крайне неустойчив и взрывоопасен. Взаимодействует с водой, давая азотную кислоту: N2O5 +Н2O = 2HNO3, со щелочами образует соли — нитраты. В лаборатории получают по реакции: 2HNO3 + P2O5 = N2O5+ 2HPO3. Практического применения не находит. Все азота окислы физиологически активны.
Окислы азота
ОКИСЛЫ АЗОТА ЧТО ЭТО

Закись азота N2O. Закись азота получается при нагревании нитрата аммония:
При этой реакции один из атомов азота, входящих в состав NH4NO3, теряет электроны, а другой — приобретает их, причем оба атома азота становятся положительно одновалентными.
Закись азота что такое
Закись азота представляет собой бесцветный, не имеющий запаха газ, сгущающийся в жидкость при 0° под давлением 30 ат. Она довольно хорошо растворима в воде: при 0° один объем воды растворяет 1,3, а при 25° — 0,6 объема N2O. При растворении закись азота никакого соединения с водой не образует.
Закись азота — эндотермическое соединение, легко разлагающееся при нагревании на азот и кислород:
поэтому она хорошо поддерживает горение. Тлеющая лучинка, опущенная в закись азота, вспыхивает в ней, как в чистом кислороде; фосфор, сера и другие вещества также энергично сгорают в закиси азота, освобождая азот.
Закись азота для чего
Вдыхание небольших количеств закиси азота приводит к притуплению болевой чувствительности, вследствие чего этот газ иногда применяют в смеси с кислородом для наркоза при легких операциях. Большие количества закиси азота возбуждающе действуют на нервную систему; поэтому раньше ее называли «веселящим газом».
Азот оксид

Образование окиси азота при электрическом разряде может быть иллюстрировано следующим опытом. В большую колбу (рис.) через боковые горла вставляют на пробках две толстые медные проволоки и соединяют их с полюсами большой индукционной катушки. При пропускании через катушку тока между концами проволок образуется непрерывная искра, а над ней появляется желтоватое пламя «горящего» в кислороде азота.
Реакция образования окиси азота из азота и кислорода обратима и сопровождается поглощением большого количества тепла:
При низкой температуре равновесие этой реакции практически полностью сдвинуто влево, т. е, количество образующейся окиси азота ничтожно мало. С повышением температуры равновесие начинает смещаться вправо, и о так медленно, что даже при 1000° в смеси газов содержится всего лишь около 1% окиси азота. При понижении температуры окись азота снова разлагается на азот и кислород.
Но если очень быстро охладить газовую смесь, то равновесие не успевает сразу сместиться, а потом уже не смещается вследствие крайне малой скорости реакции при низкой температуре, и таким образом, в смеси остается почти то же количество NO, которое образовалось при высокой температуре. В лаборатории окись азота получают обычно взаимодействием разбавленной азотной кислоты с медью:
или в ионной форме
3Cu + 2NO3‘ + 8H • = 3Cu •• + 2NO + 4H2O
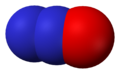
Газ no или окись азота представляет собой бесцветный газ, очень трудно сжижаемый. Жидкая окись азота кипит при —151,8° и затвердевает при —163,7°
В воде она растворима лишь незначительно один объем воды растворяет при 0 ° всего 0,07 объема NO газа.
По химическим свойствам окись азота относится к числу безразличных окислов, так как не образует никакой кислоты.
Окись азота труднее других окислов азота отдает свой кислород. Поэтому в ней могут гореть лишь такие вещества, которые особенно энергично соединяются с кислородом, как, например, фосфор. Но зажженная свеча, лучинка, сера гаснут при внесении их в окись азота.
Наиболее характерным свойством окиси азота является ее способность легко, без всякого нагревания, соединяться с кислородом с образованием бурой двуокиси азота:
Если, например, открыть цилиндр, наполненный окисью азота, то у отверстия его тотчас же появляется бурое облако двуокиси азота.
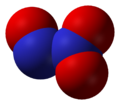
Двуокись азота
Изменение окраски двуокиси азота при повышении температуры сопровождается и изменением плотности ее пара. При низкой температуре плотность пара приблизительно отвечает удвоенной формуле N2O4. С повышением температуры плотность пара уменьшается и при 140 ° в точности соответствует формуле NО2— Отсюда следует, что бесцветные кристаллы, существующие при —10 ° и ниже, состоят, вероятно, целиком из молекул N2О4 и могут быть названы четырехокисью азота.
По мере нагревания бесцветная четырехокись азота постепенно диссоциирует с образованием молекул темно-бурой двуокиси азота N02; полная диссоциация происходит при 140°. Поэтому при температурах от —10° до + 140° всегда имеется смесь молекул NO2 и N2О4, находящихся в равновесии друг с другом:
Выше 140° начинается диссоциация NО2 на NO и кислород.
Двуокись азота очень энергичный окислитель. Многие вещества могут гореть в двуокиси азота, отнимая от нее кислород. Сернистый газ окисляется ею в серный ангидрид, на чем основан нитрозный метод получения серной кислоты.
Пары двуокиси азота довольно ядовиты. Вдыхание их вызывает сильное раздражение дыхательных путей и может привести к серьезному отравлению.
При растворении в воде двуокись или, вернее, четырехокись азота вступает в реакцию с водой, образуя азотную и азотистую кислоты:
Но азотистая кислота очень неустойчива и быстро разлагается на азотную кислоту, окись азота и воду:
Поэтому практически взаимодействие двуокиси (четырех окиси) азота с водой, особенно с теплой, идет по уравнению
которое легко может быть получено сложением двух предыдущих уравнений, если предварительно первое из них умножить на 3.
В присутствии воздуха образующаяся окись азота немедленно окисляется в двуокись азота, так что в этом случае NO2 полностью переходит в азотную кислоту. Эта реакция имеет важное техническое значение и используется в современных способах получения азотной кислоты.
Если растворять двуокись (четырехокись) азота в щелочах, то образуется смесь солей азотной и азотистой кислот:
Приведенные выше реакции взаимодействия четырехокиси азота с водой и щелочами показывают, что в молекуле этого вещества один атом азота имеет валентность +5, а другой — валентность +3. Поэтому четырехокись азота часто называют смешанным ангидридом азотистой и азотной кислот и изображают ее структурную формулу следующим образом:
Если мы подсчитаем общее число валентных электронов у всех атомов в молекулах N O и NO2, то найдем, что оно равно соответственно 11 (5 + 6) и 17 (5 + 2•6), т. е. выражается нечетными числами. Окись и двуокись азота относятся к ограниченному числу молекул с нечетным числом электронов. Такие молекулы ведут себя в химическом отношении, как свободные атомы, тоже имеющие неспаренные электроны. Молекулы с неспаренными электронами называются свободными радикалами.
Азотистый ангидрид N2 O 3
Представляет собой темно-синюю жидкость, кипящую при +4° и разлагающуюся при этом на окись и двуокись азота. Смесь равных объемов окиси и двуокиси азота при охлаждении вновь образует азотистый ангидрид:
Азотистому ангидриду соответствует азотистая кислота.
Азотный ангидрид N2O5 — твердое кристаллическое вещество, плавящееся при 30°. Он может быть получен действием фосфорного ангидрида на азотную кислоту:
Азотный ангидрид является очень сильным окислителем. Многие органические вещества при соприкосновении с ним воспламеняются. В воде азотный ангидрид легко растворяется с образованием азотной кислоты.
Вы читаете, статья на тему Окислы азота
Похожие страницы:
Понравилась статья поделись ей
Окислы азота
Оксиды азота — соединения азота с кислородом.
Содержание
Список оксидов
Азот образует несколько соединений с кислородом:
Оксид азота N2O — бесцветный газ со слабым запахом, растворим в воде. Не взаимодействует с водой, растворами кислот и щелочей. При нагревании разлагается на азот и кислород. При высоких концентрациях N2O возбуждает нервную систему («веселящий газ»). В медицине N2O применяют как слабое средство для наркоза.
Оксид азота NO — бесветный газ, незначительно растворим в воде. Не взаимодействует с водой, растворами кислот и щелочей. Оксид азота (II) — очень реакционноспособное соединение, может вступать в реакции присоединения с рядом солей (нитрозосоли), с галогенами (напр., нитрозилхлорид NOCl), органическими соединениями. При обычной температуре NO соединяется с кислородом с образованием NO2. Оксид NO получают каталитическим окислением при производстве азотной кислоты.
N2O3(III)
Оксид N2O3 (азотистый ангидрид) неустойчив при обычных условиях, взаимодействует с водой, образуя азотистую кислоту HNO2.
NО2, N2O4
Оксид азота NО2 — бурый газ, токсичен, тяжелее воздуха, легко сжижается. При комнатной температуре NО2 находится в смеси с его бесцветным димером N2O4, приблизительно 1:1. Взаимодействует с водой:
Сильный окислитель. Многие вещества (уголь, сера, фосфор, органические соединения) могут гореть в NО2. Этот оксид окисляет SО2 до SO3, на этой реакции основан нитрозный метод получения серной кислоты. Раздражает дыхательные пути, при больших концентрациях появляется отёк легких.
N2O5(V)
Оксид N2O5 (азотный ангидрид) — бесцветное кристаллическое вещество, легко разлагается на NО2 и О2. Сильный окислитель. В воде легко растворяется с образованием азотной кислоты HNO3.
Воздействие на организм
Применение
Оксиды азота зарегистрированы в качестве пищевой добавки E918.
См.также
Полезное
Смотреть что такое «Окислы азота» в других словарях:
Окислы азота — Смесь различных окислов азота, кроме закиси NO2, образовавшихся в цилиндре дизеля в процессе сгорания Источник: ГОСТ 24585 81: Дизел … Словарь-справочник терминов нормативно-технической документации
Окислы азота — С кислородом азот образует ряд соединений N2O5 азотный ангидрид [О над азотной кислоте см. Крепкая водка.], N2O4 или NO2 азотноватый ангидрид или двуокись азота, N2O3 азотистый ангидрид, NO окись азота, N2O закись азота. Определения Фавра,… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Окислы азота (NOх) — 5. Окислы азота (NOх) Смесь окиси и двуокиси азота, содержащихся в пробе газа Примечание. В расчетах условно предполагается, что окись азота находится в виде двуокиси азота Источник … Словарь-справочник терминов нормативно-технической документации
Окислы азота и азотная кислота — 4.6. Окислы азота и азотная кислота оказывают в основном вредное влияние на активную массу отрицательных электродов, окисляя свинец в окись. Окись свинца, в свою очередь, вступая в реакцию с оставшейся неиспользованной кислотой, образует… … Словарь-справочник терминов нормативно-технической документации
ОКИСЛЫ — ОКИСЛЫ, соединения элементов с кислородом. Кислород соединяется со всеми элементами кроме благородных газов. Недавно открытая юкись фтора заполняет существовавший в отношении фтора пробел. В зависимости от степени окисления и валентности элемента … Большая медицинская энциклопедия
Азота окислы — соединения азота с кислородом. Известны N2O, NO, N2O3, NO2 (и его димер N2O4), N2O5; есть сведения о существовании NO3, не выделенного в свободном состоянии. При высокой температуре в пламени вольтовой дуги, а в природе при электроразряде … Большая советская энциклопедия
Окислы — Оксид (окисел, окись) соединение химического элемента с кислородом, в котором сам кислород связан только с менее электроотрицательным элементом. Химический элемент кислород по электроотрицательности второй после фтора, поэтому к оксидам… … Википедия
Окислы — О. называются соединения простых тел с кислородом. Если придерживаться деления простых тел на две группы, на металлы и металлоиды (см.), то вообще в характере их О. можно заметить довольно ясную разницу. Тогда как типические представители первой… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Закись азота — химический состав см. Окислы азота. В медицине З. азота получила название веселящего газа: вдыхаемая в смеси с атмосферным воздухом или кислородом при обыкновенной температуре и давлении она вызывает особое состояние опьянения, уничтожающего… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Закись азота — веселящий газ, один из окислов азота (см. Азота окислы); в медицине применяют в смеси с кислородом как средство для ингаляционного Наркоза при хирургических операциях, родах, иногда при инфаркте миокарда. Назван веселящим газом английским … Большая советская энциклопедия
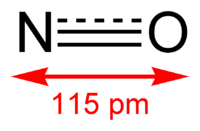
Окись азота
Окись азота
| Оксид азота(II) | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Оксид азота(II) |
| Химическая формула | NO |
| Отн. молек. масса | 30.0061 а. е. м. |
| Молярная масса | 30.0061 г/моль |
| Физические свойства | |
| Плотность вещества | 0.00134 (газ) г/см³ |
| Состояние (ст. усл.) | бесцветный газ |
| Термические свойства | |
| Температура плавления | −163.6 °C |
| Температура кипения | −151.7 °C |
| Энтальпия (ст. усл.) | 81 кДж/моль |
| Химические свойства | |
| Растворимость в воде | 0,01 г/100 мл |
| Классификация | |
| номер CAS | [10102-43-9] |
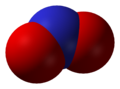
Окси́д азо́та (II) NO (моноксид азота, окись азота, нитрозил-радикал) — несолеобразующий оксид азота. Он представляет собой бесцветный газ, плохо растворимый в воде. Сжижается с трудом; в жидком и твёрдом виде имеет голубой цвет.
Наличие неспаренного электрона обусловливает склонность NO к образованию слабосвязанных димеров N2O2. Это непрочные соединения с ΔH° димеризации = 17 кДж. Жидкий оксид азота (II) на 25% состоит из молекул N2O2, а твердый оксид целиком состоит из них.
Содержание
Получение
Оксид азота(II) — единственный из оксидов азота, который можно получить непосредственно из свободных элементов соединением азота с кислородом при высоких температурах (1200—1300 °C) или в электрическом разряде. В природе он образуется в атмосфере при грозовых разрядах:
и тотчас же реагирует с кислородом:
При понижении температуры оксид азота(II) разлагается на азот и кислород, но если температура падает резко, то не успевший разложиться оксид существует достаточно долго: при низкой температуре скорость распада невелика. Такое резкое охлаждение называется «закалкой» и используется при одном из способов получения азотной кислоты.
В лаборатории его обычно получают взаимодействием 30%-ной HNO3 с некоторыми металлами, например, с медью:
Более чистый, не загрязнённый примесями NO можно получить по реакциям:
Промышленный способ основан на окислении аммиака при высокой температуре и давлении при участии Pt, Cr2O3 (как катализаторов):
Химические свойства
При комнатной температуре и атмосферном давлении окисление NO кислородом воздуха происходит мгновенно:
Для NO характерны также реакции присоединения галогенов с образованием нитрозилгалогенидов, в этой реакции NO проявляет свойства восстановителя:
В присутствии более сильных восстановителей NO проявляет окислительные свойства:
В воде NO мало растворим и с ней не реагирует, являясь несолеобразующим оксидом.
Физиологическое действие
Как и все оксиды азота (кроме N2O), NO — токсичен, при вдыхании поражает дыхательные пути.
За два последних десятилетия было установлено, что эта молекула NO обладает широким спектром биологического действия, которое условно можно разделить на регуляторное, защитное и вредное. NO, являясь одним из мессенджеров, участвует в регуляции систем внутри- и межклеточной сигнализации. Оксид азота, производимый клетками эндотелия сосудов, отвечает за расслабление гладких мышц сосудов и их расширение(вазодилатацию), предотвращает агрегацию тромбоцитов и адгезию нейрофилов к эндотелию, участвует в различных процессах в нервной, репродуктивной и иммунной системах. NO также обладает цитотоксическими и цитостатическими свойствами. Клетки-киллеры иммунной системы используют оксид азота для уничтожения бактерий и клеток злокачественных опухолей. С нарушением биосинтеза и метаболизма NO связаны такие заболевания, как ассенциальная артериальная гипертензия, ишемическая болезнь сердца, инфаркт миокарда, первичная легочная гипертензия, бронхиальная астма, невротическая депрессия, эпилепсия, нейродегенеративные заболевания (болезнь Альцгеймера, болезнь Паркинсона), сахарный диабет, импотенция и др.
Клиренс NO (скорость очищения крови от NO в процессе его химических превращений) происходит путем образования нитритов и нитратов и составляет в среднем не более 5 секунд. В клиренс могут быть вовлечены промежуточные ступени, связанные со взаимодействием с супероксидом или с гемоглобином с образованием пероксинитрита. Оксид азота может быть восстановлен NO-редуктазой – ферментом, тесно связанным с NO-синтазой.
Применение
Полезное
Смотреть что такое «Окись азота» в других словарях:
ОКИСЬ АЗОТА — ОКИСЬ АЗОТА, см. монооксид АЗОТА … Научно-технический энциклопедический словарь
окись азота — — [http://www.dunwoodypress.com/148/PDF/Biotech Eng Rus.pdf] Тематики биотехнологии EN nitric oxide … Справочник технического переводчика
окись азота — azoto oksidas statusas T sritis ekologija ir aplinkotyra apibrėžtis Azoto junginys su deguonimi: N₂O, NO, NO₂, N₂O₃, N₂O₄, N₂O₅. atitikmenys: angl. nitric oxide; nitrogen monoxide vok. Stickoxid, n; Stickstoffmonoxid, n rus. окись азота, f … Ekologijos terminų aiškinamasis žodynas
Азота окислы — соединения азота с кислородом. Известны N2O, NO, N2O3, NO2 (и его димер N2O4), N2O5; есть сведения о существовании NO3, не выделенного в свободном состоянии. При высокой температуре в пламени вольтовой дуги, а в природе при электроразряде … Большая советская энциклопедия
азота окись — azoto(II) oksidas statusas T sritis chemija formulė NO atitikmenys: angl. nitrogen monoxide; nitrogen(II) oxide rus. азота окись; азота(II) оксид ryšiai: sinonimas – azoto monoksidas … Chemijos terminų aiškinamasis žodynas
азота(II) оксид — azoto(II) oksidas statusas T sritis chemija formulė NO atitikmenys: angl. nitrogen monoxide; nitrogen(II) oxide rus. азота окись; азота(II) оксид ryšiai: sinonimas – azoto monoksidas … Chemijos terminų aiškinamasis žodynas
Окись этилена — Окись этилена … Википедия
Окись — Оксид (окисел, окись) соединение химического элемента с кислородом, в котором сам кислород связан только с менее электроотрицательным элементом. Химический элемент кислород по электроотрицательности второй после фтора, поэтому к оксидам… … Википедия
Окись углерода — Монооксид углерода Общие Систематическое наименование Монооксид углерода Химическая формула … Википедия
Окислы азота — С кислородом азот образует ряд соединений N2O5 азотный ангидрид [О над азотной кислоте см. Крепкая водка.], N2O4 или NO2 азотноватый ангидрид или двуокись азота, N2O3 азотистый ангидрид, NO окись азота, N2O закись азота. Определения Фавра,… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона