Окись водорода что это
Водорода оксид: описание вещества, получение, свойства
Что собой представляет кислородное соединение водорода? Оксид данного элемента обладает определенными физическими и химическими свойствами. Попробуем понять двойственность признаков данного соединения и выявить его отличительные характеристики.
Определение
Самым важным и распространенным на нашей планете веществом является именно кислородное соединение водорода. Оксид его знаком нам в качестве обычной воды. Сложно представить себе какое-то иное соединение, которое имеет такое же значение для живых организмов. Оксидами принято называть бинарные соединения, в составе которых есть кислород. Важным условием при этом является расположение кислорода в конце химической формулы.
Классификация
В настоящее время выделяют три группы оксидов. Основными считают кислородные соединения, которые образованы металлами, имеющими низкую валентность (один или два). В качестве исключений из общего правила можно рассмотреть оксиды бериллия и цинка. Несмотря на то что валентность этих металлов равна двум, их кислородные соединения относят к амфотерным оксидам. Особенностью амфотерных соединений считают их взаимодействие с кислотами и щелочами. Двойственные свойства также проявляют оксиды металлов, имеющих валентность три.
Кислотные оксиды образуются неметаллами, а также металлами с валентностью от четырех до семи. К какой группе относится соединение водорода? Оксид данного элемента проявляет двойственные химические свойства, поэтому считается амфотерным соединением.
Получение в лаборатории
Восстановление оксидов водородом является одним из способов получения воды. Данный процесс используется в промышленности для переработки металлолома, выделения из него черных и цветных металлов. Гидрирование относится к термическому и каталитическому процессу, одним из продуктов которого является жидкая вода.
Распространенность в природе
Физические свойства и особенности строения
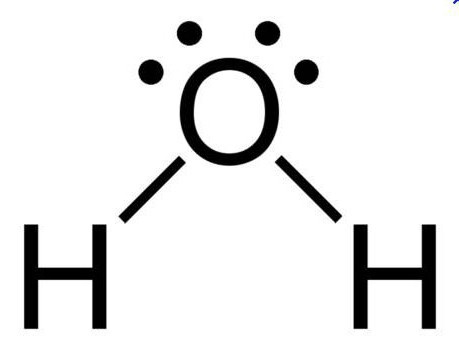
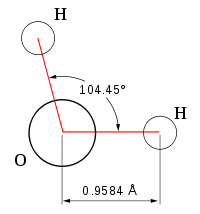
При нормальных условиях вода является бесцветной жидкостью, не имеющей вкуса и запаха. Данное вещество считается отличным полярным растворителем, поэтому многие процессы протекают именно в водной среде. Температура ее кипения составляет 100 градусов. При нулевой же температуре вода превращается в лед. Данное соединение имеет дипольное строение, а объяснить это можно особенностями молекулы. Так как у кислорода остаются незадействованными две электронные пары, в оксиде sp3 гибридное состояние имеет атом кислорода, величина валентного угла составляет 110 градусов.
Химические свойства
Конечным продуктом такого взаимодействия является щелочь.
Помимо реакций с оксидами, вода способна к взаимодействию с металлами. Щелочные металлы (без нагревания) образуют щелочь, при этом образуется и газообразный водород.
Металлы средней активности (при нагревании) образуют в реакции с водой оксид и водород. Малоактивные металлы, которые располагаются в электрохимическом ряду напряжений металлов после водорода, не способны взаимодействовать с водой.
Последовательность лабораторного получения воды может быть представлена в следующем виде: водород-оксид. Реакция, протекающая в этом случае, является экзотермической и сопровождается выделением большого количества тепловой энергии. Конечным продуктом ее является оксид водорода. Уравнение реакции имеет вид: 2Н2+О2=2Н2О
Дипольное строение молекулы воды объясняет возможность образования этим неорганическим соединением водородных связей, имеющих ковалентный характер. У этого соединения самое высокое значение теплопроводности, поэтому именно вода является тем веществом, которое применяют в отопительных системах.
Биологическое значение
Невозможно представить жизнь человека без воды. Этот универсальный растворитель нужен не только в химической лаборатории. Каждую секунду в живых существах осуществляются сложные биохимические процессы. Вода не только является активным участником многих синтезов, но и выступает в качестве побочного продукта многих из них. За шестьдесят лет своего существования, человек пропускает через свой организм около 50 тонн этого уникального неорганического вещества.
Оксид водорода нашел применение во многих сферах промышленной деятельности человека. Данное соединение незаменимо в медицине, востребовано в сельском хозяйстве.
Например, в теплоэнергетике описываемое химическое соединение является рабочим телом и основным теплоносителем. Электрические станции, базирующиеся на нем, расходуют до 40 кубических метров воды за одну секунду. К примеру, для полного охлаждения конденсатора гидротурбины, необходимо до десяти тысяч кубических метров оксида водорода. В металлургической отрасли вода применяется в качестве охлаждающего вещества для основного оборудования, используются и ее физические характеристики, например высокая теплопроводность.
В химической отрасли она востребована как хороший растворитель, а также отличное «транспортное средство» для перемещения реагентов из одного технологического препарата в другой.
Отметим, что и вывод жидких производственных отходов также осуществляется в виде суспензий и эмульсий. Сложно достоверно оценить те объемы оксида водорода, которые идут на бытовые и промышленные нужды.
Кстати, среди многочисленных существ, которые обитают на нашей планете, не нуждаются в воде только вирусы.
Окись водорода что это
ВОДА – оксид водорода H2O.
В течение многих столетий вода считалась простым веществом. Лишь в 1783 французский химик Антуан Лоран Лавуазье (1743–1794) сумел разложить ее. Он показал, что вода состоит из водорода и кислорода, а в 1789 дал первую оценку ее количественного состава: 15% водорода и 85% кислорода. В дальнейшем количественный анализ воды проводили многие ученые. Долгое время образцовыми считались результаты французского химика и физика Жозефа Луи Гей-Люссака (1778–1850), полученные около 1808: 13,27% водорода и 86,73% кислорода. Только в 1821 шведский химик Йенс Якоб Берцелиус (1779–1848) и французский физик и химик Пьер Луи Дюлонг (1785–1838) сделали более правильный анализ воды и нашли, что она содержит 11,1% водорода и 88,9% кислорода, что очень близко к современным значениям (11,19% водорода и 88,81% кислорода).
Изучая объемные отношения реагирующих газов, Гей-Люссак показал, что один объем кислорода и два объема водорода при взаимодействии дают два объема водяного пара (при температуре выше 100° С). На основании этих результатов с учетом закона Авогадро был сделан вывод, что две частицы водяного пара образуются из одной частицы кислорода и двух частиц водорода. Таким образом была выведена формула воды H2O.
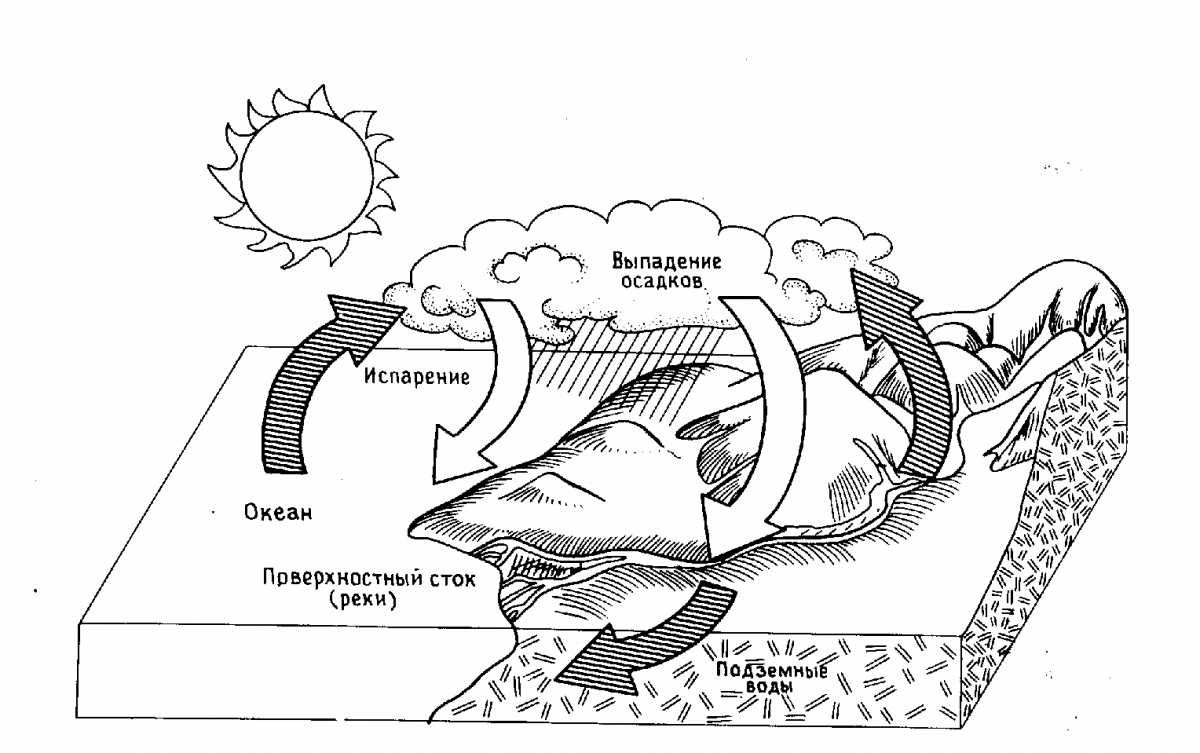
На нашей планете вода играет очень важную роль. В природе она совершает непрерывный круговорот. Под влиянием солнечной энергии жидкая вода (главным образом, в теплых морях и океанах) превращается в пар, который поднимается в верхние слои атмосферы. Это происходит благодаря тому, что водяной пар легче воздуха. Так происходит образование облаков, которые ветрами переносятся в другие части планеты, где в виде дождя и других осадков вода попадает на поверхность земли. Здесь она образует ручьи и реки, которые возвращают испаренную воду в океаны (рис. 1).
Чистой воды в природе нет. Даже наиболее чистая дождевая вода при падении через атмосферу растворяет газы и захватывает пыль. При ее испарении всегда остается небольшой остаток – около 0,03 г на литр. На поверхности земли вода дополнительно растворяет многие твердые вещества. Часть ее впитывается в почву. В глубине земли продолжается растворение различных веществ, так что при выходе на поверхность вода иногда образует минеральные источники. Ключевая и колодезная вода от растворенных в ней солей часто бывает жесткой.
Речная (пресная) вода содержит до 0,5 г растворенных солей в одном литре. В конце концов, все это попадает в море. Таким образом, море, испаряя чистую воду, получает взамен воду с растворенными в ней веществами. Количество солей, поставляемое реками в моря и океаны, огромно. Так, река Дон ежегодно вносит в Азовское море около 16 млн. т солей, Дунай в Черное море – 9 млн. т.
В океанской воде содержится около 35 г солей в литре. Столько же имеется в водах большинства морей. Однако для закрытых морей встречаются отклонения от средней солености, связанные с числом впадающих рек, средней температурой и другими факторами. Балтийское море содержит лишь 3–8 г солей на литр, а Красное – до 45 г. В соленых озерах содержание солей может быть намного больше: в Мертвом море – 228 г в одном литре, в оз. Эльтон – 270 г. В морской воде растворен, в основном, хлорид натрия; кроме того, имеются и другие соли натрия, магния, кальция.
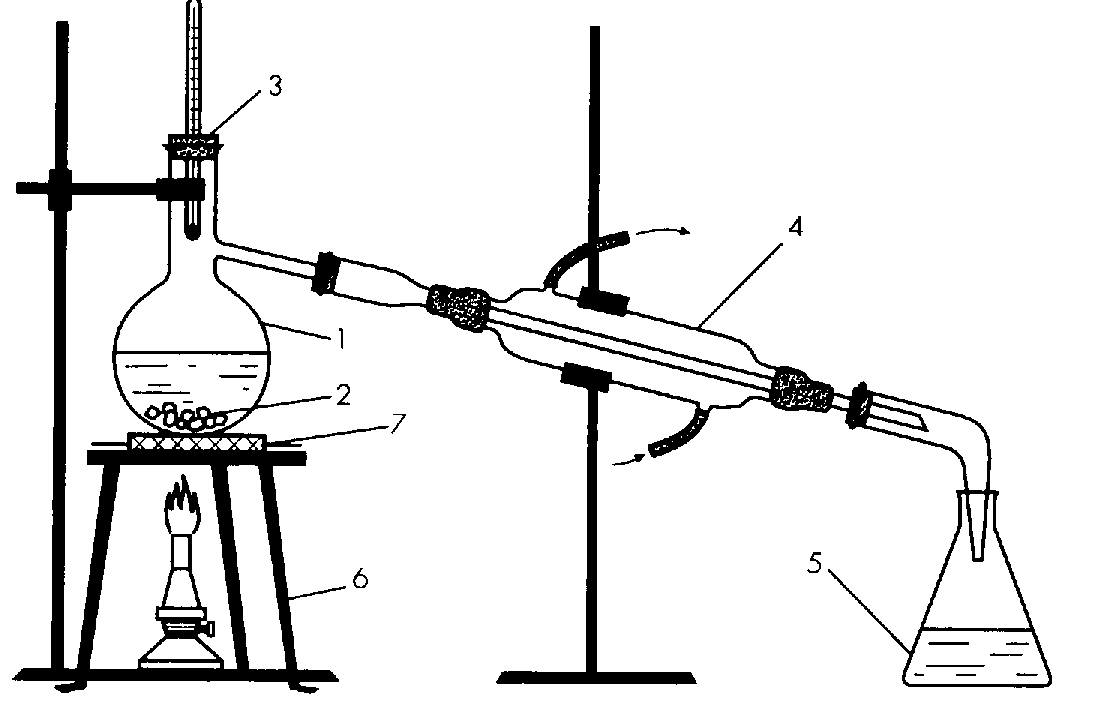
Для научной работы, а также для фармацевтических и других целей, воду перегоняют (рис. 2). Для этого ее превращают в пар, который затем охлаждают, получая чистую дистиллированную воду. Примеси остаются в перегонном сосуде.
Природная вода содержит следы «тяжелой» воды (оксида дейтерия) D2O. Физические свойства H2O и D2O заметно различаются.
| H2O | D2O | |
| t плав.,°С | 0,0 | 3,8 |
| t кип., °С | 100,0 | 101,4 |
Свойства воды служат точкой отсчета для многих физических величин. Так, температуры замерзания и кипения воды лежат в основе шкалы Цельсия. Один литр – это объем 1 кг чистой воды, взвешенной при +4 °С (при этой температуре вода имеет максимальную плотность).
Многие физические свойства воды аномальны по сравнению с другими жидкостями. Одной из причин этого служат малые размеры молекул воды – минимальные среди всех жидких веществ при обычных условиях. Однако наиболее важным свойством воды является ее способность образовывать прочные водородные связи.
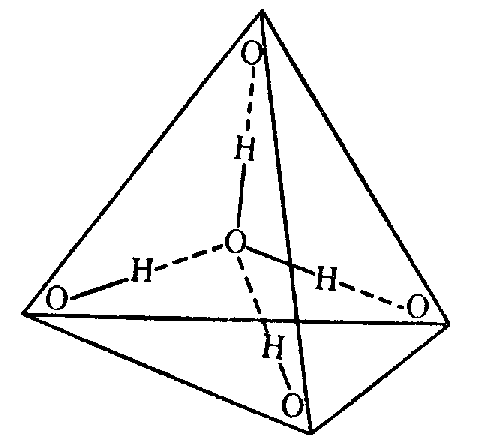
В водяном паре при температуре кипения и атмосферном давлении присутствует около 1% димеров, в которых молекулы воды объединены в пары водородными связями. В жидком и твердом состоянии каждая молекула воды образует четыре водородные связи: две как донор протонов и две – как акцептор протонов. Водородные связи молекулы воды направлены приблизительно к вершинам правильного тетраэдра (рис. 3.).
Если бы водородных связей не было, то температуры плавления и кипения воды были бы существенно ниже, как это наблюдается у других водородных соединений неметаллов. Водородные связи являются причиной и другого уникального свойства воды – при плавлении ее плотность возрастает. При 0°С плотность льда (0,9168 г/см 3 ) меньше, чем плотности жидкой воды (0,9998 г/см 3 ), поэтому лед плавает на поверхности воды. Если бы у льда была более высокая плотность, по мере замерзания он опускался бы на дно, что сделало бы жизнь в водоемах зимой невозможной.
Чтобы превратить воду в пар, надо затратить много энергии – около 44 кДж/моль. При обратном переходе пара в жидкую воду выделяется то же количество теплоты.
Вода устойчива при нагревании вплоть до 1000°С. При более высоких температурах она частично разлагается на водород и кислород. Эти же продукты образуются при электролизе воды.
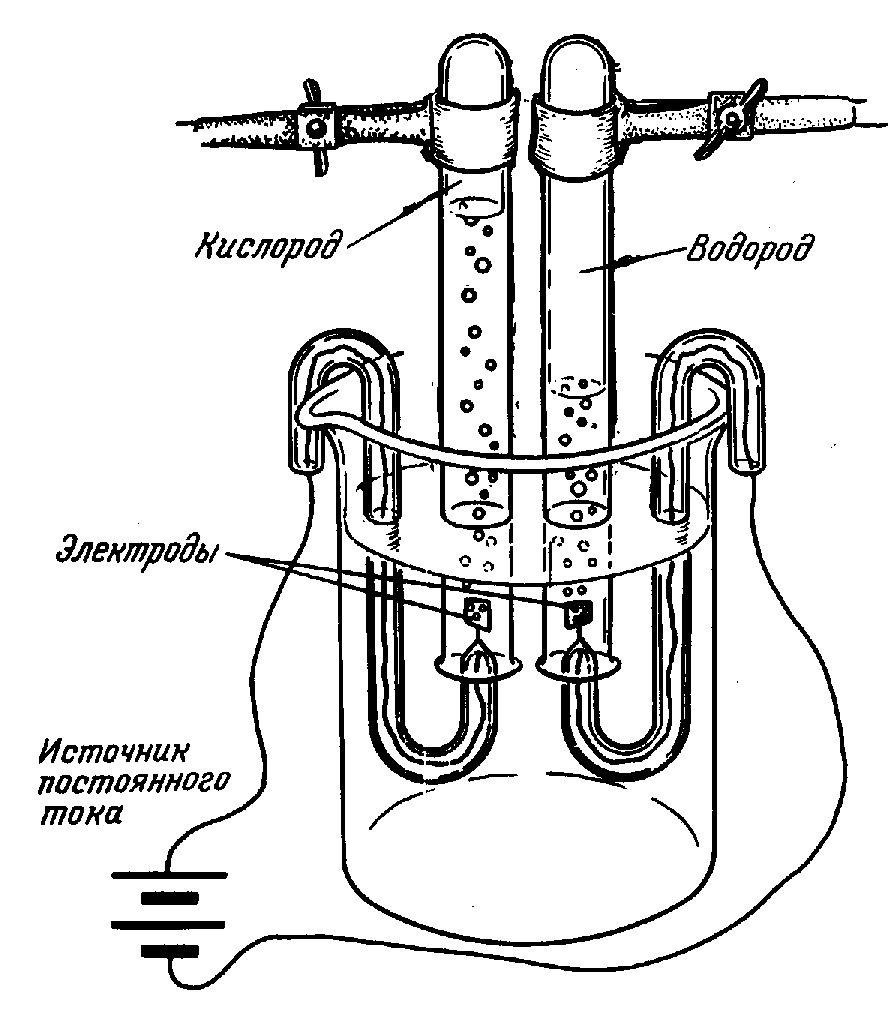
Разложение воды искрами электрической машины заметили еще в 1789, а годом позже воду разложили с помощью гальванического электричества. В России это впервые было сделано профессором С.-Петербургской Медико-Хирургической Академии В.В. Петровым летом 1802 посредством огромной «гальвани-вольтовой батареи», состоявшей из 4200 медных и цинковых кружков. Электролиз чистой воды идет очень медленно. Для более быстрого разложения воды электрическим током в нее добавляют какую-либо кислоту, щелочь или соль. Этот процесс иногда используют для получения чистого водорода и кислорода (рис. 4).
Вода вступает в химическое взаимодействие со многими простыми веществами. Большинство таких реакций протекает при высокой температуре. Только наиболее активные металлы (щелочные и щелочноземельные) и неметаллы (галогены) реагируют с водой при комнатной температуре. Однако при одновременном воздействии воды и окислителей даже при обычной температуре происходит разрушение металлов средней активности (таких как железо) в результате коррозии.
Очень сильными восстановителями вода восстанавливается до водорода, очень сильными окислителями – окисляется до кислорода.
Вода взаимодействует со многими основными оксидами с образованием гидроксидов. В реакциях воды с большинством кислотных оксидов образуются кислоты.
РЕАКЦИИ ВОДЫ
| С простыми веществами: | |
| металлами | неметаллами |
| 2Na + 2H2O = 2NaOH + H2 | Cl2 + H2O⇋ HCl + HClO |
| 2Fe + 3H2O = Fe2O3 + 3H2 (600 °C) | H2O + C ⇋ CO + H2 (800–1000 °C) |
| С оксидами: | |
| основными | кислотными |
| CaO + H2O = Ca(OH)2 | SO3 + H2O = H2SO4 |
| Na2O + H2O = 2NaOH | N2O5 +H2O = 2HNO3 |
| Термическое разложение: 2Н2О⇋ 2Н2 + О2 | |
Некоторые сложные вещества полностью разлагаются водой – подвергаются необратимому гидролизу:
Вода может служить катализатором. Например, щелочные металлы и водород реагируют с хлором только в присутствии следов воды. Иногда вода является каталитическим ядом, например, для железного катализатора при синтезе аммиака.
В результате образования водородных связей твердая вода (лед) имеет рыхлую структуру с обширными замкнутыми полостями двух типов: больших и малых. В этих полостях могут размещаться молекулы других веществ, имеющие соответствующие размеры. Они удерживаются в них ван-дер-ваальсовыми силами. Так образуются газовые гидраты – клатраты, соединения типа «гость-хозяин», в которых «гостями» являются молекулы газов или легкокипящих жидкостей (благородные газы, галогены, углеводороды и др.), а «хозяевами» – молекулы воды, образующие кристаллический каркас. По внешнему виду газовые гидраты напоминают снег или рыхлый лед, но могут существовать только при повышенном давлении и отрицательной (по Цельсию) температуре. Наиболее важным на сегодняшний день газовым гидратом является гидрат природного газа метана, колоссальные скопления которого обнаружены в недрах земли, в особенности на шельфе морей и океанов.
Вода хорошо растворяет многие вещества, имеющие ионное строение (соли, щелочи), а также вещества, молекулы которых полярны. Наличие в жидкой воде ассоциатов (элементов кристаллической структуры) наряду с большим дипольным моментом молекул приводит к высокой диэлектрической проницаемости воды (ε = 78,3 при 25 °С). Это вызывает заметное ослабление кулоновского притяжения в водной среде, а, следовательно, способствует электролитической диссоциации ионных и полярных ковалентных соединений. При этом полярные молекулы воды участвуют в процессе гидратации за счет притяжения соответствующих полюсов полярных молекул воды к образующимся катионам и анионам. В ряде случаев образующиеся связи являются настолько прочными, что можно говорить о возникновении аквакомплексов. Аквакомплексы обнаружены не только в водных растворах, но и во многих кристаллических структурах.
Твердые вещества, как правило, лучше растворяются при нагревании. При этом вещества с очень прочной кристаллической решеткой мало растворимы в воде. К ним относятся хлориды, бромиды и иодиды серебра и свинца, сульфаты щелочноземельных металлов и свинца, большинство гидроксидов, сульфидов, ортофосфатов и карбонатов металлов.
Газы обычно плохо растворяются в воде. Исключение составляют газообразные вещества, взаимодействующие с водой, например аммиак, хлороводород или диоксид серы. Растворимость всех газов возрастает при увеличении давления и, как правило, понижается при нагревании.
В жидкой воде одна из каждых 10 миллионов молекул диссоциирует, образуя ионы: катионы водорода Н + и гидроксид-ионы ОН – :
Н2О ⇋ Н + + ОН –
| Индикатор | Кислотная среда | Нейтральная среда | Щелочная среда |
| Лакмус | Красный | Фиолетовый | Синий |
| Фенолфталеин | Бесцветный | Бесцветный | Малиновый |
| Метиловый оранжевый | Розовый | Оранжевый | Желтый |
| Вещества | Сильные | Слабые |
| Основания | NaOH, KOH, Ca(OH)2, Ba(OH)2 | NH3 |
| Кислоты | HCl, HBr, HI, H2SO4, HNO3 | H3PO4, H2CO3, H2S |
Соли при растворении в воде диссоциируют на катионы металла и анионы кислоты. Растворы многих солей имеют кислотную или щелочную среду за счет обратимого гидролиза по катиону или по аниону (см. ГИДРАТАЦИЯ, ГИДРАТЫ, ГИДРОЛИЗ).