какая валентность у хлора постоянная
Валентность хлора
Общие сведения о валентности хлора
Хлор – активный окислитель.
Молекула хлора двухатомна Cl2.
Валентность хлора в соединениях
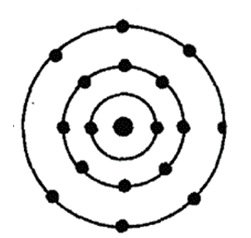
Хлор — семнадцатый по счету элемент Периодической таблицы Д.И. Менделеева. Он находится в третьем периоде в VIIA группе. В ядре атома хлора содержится 17 протонов и 18 нейтронов (массовое число равно 35). В атоме хлора есть три энергетических уровня, на которых находятся 17 электронов (рис. 1).
Рис. 1. Строения атома хлора.
Электронная формула атома хлора в основном состоянии имеет следующий вид:
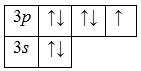
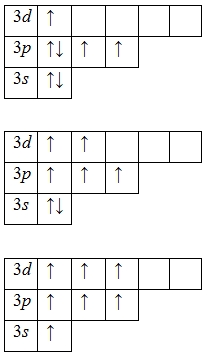
А энергетическая диаграмма (строится только для электронов внешнего энергетического уровня, которые по-другому называют валентными):
Наличие трех, пяти и семи неспаренных электронов в возбужденном состоянии свидетельствует о том, что хлор проявляет в своих соединениях валентности III (NaCl III O2), V (KCl V O3) и VI (KCl VII O4, Cl VII 2O7) (высшая валентность).
Формально хлор может проявлять валентности IV (ClO2) и VI (Cl2O6).
Примеры решения задач
| Задание | Какой объем хлора надо взять для реакции с 10 л водорода? Газы находятся при одинаковых условиях. |
| Решение | Запишем уравнение реакции взаимодействия хлора с водородом: |
Рассчитаем количество вещества водорода, вступившего в реакцию:
n (H2)= 10 / 22,4 = 0,45 моль.
Согласно уравнению, n (H2)= n (Cl2)= 0,45 моль. Тогда, объем хлора, вступившего в реакцию взаимодействия с водородом равен:
Валентность хлора
Валентность хлора.
Валентность хлора:
Валентность (от лат. valēns – «имеющий силу») – способность атомов химических элементов образовывать определённое число химических связей.
Валентность – это мера (численная характеристика) способности химических элементов образовывать определённое число химических связей.
Значения валентности записывают римскими цифрами I, II, III, IV, V, VI, VII, VIII.
Валентность определяют по числу химических связей, которые один атом образует с другими.
Первоначально за единицу валентности была принята валентность атома водорода. Валентность другого элемента можно при этом выразить числом атомов водорода, которое присоединяет к себе или замещает один атом этого другого элемента. Определенная таким образом валентность называется валентностью в водородных соединениях или валентностью по водороду: так, в соединениях HCl, H2O, NH3, CH4 валентность по водороду хлора равна единице, кислорода – двум, азота – трём, углерода – четырём.
Валентность кислорода, как правило, равна двум. Поэтому, зная состав или формулу кислородного соединения того или иного элемента, можно определить его валентность как удвоенное число атомов кислорода, которое может присоединять один атом данного элемента. Определенная таким образом валентность называется валентностью элемента в кислородных соединениях или валентностью по кислороду: так, в соединениях K2O, CO, N2O3, SiO2, SO3 валентность по кислороду калия равна единице, углерода – двум, азота – трём, кремния – четырём, серы – шести.
С точки зрения электронной теории валентность определяется числом неспаренных (валентных) электронов в основном или возбужденном состоянии.
Известны элементы, которые проявляют постоянную валентность. У большинства химических элементов валентность переменная.
| Валентность хлора в соединениях | |
| I | NaCl, NaClO, Cl2O |
| III | NaClO2 |
| IV | ClO2 |
| V | KClO3 |
| VI | Cl2O6 |
| VII | KClO4, Cl2O7 |
Таблица валентности.
В таблице валентности приведены значения валентности элементов периодической таблицы Менделеева. Что такое валентность?
Точками здесь обозначаются неподеленные пары электронов, однако в структурных формулах их отмечают не каждый раз.
В химии принято, что валентность химических элементов можно узнать по группе (колонке) в таблице Менделеева. В действительности не всегда валентность элемента соответствует номеру группы, но в большинстве случаев определенная валентность по такому методу даст правильный результат часто элементы, в зависимости от разных факторов, имеют не одну валентность. Чтобы проще было понимать и не путаться, ниже приведена таблица валентностей всех элементов периодической таблицы.
Цифра положительной валентности элемента соответствует количеству отданных атомом электронов, а отрицательной валентности – количеству электронов, которые атом должен забрать себе для завершения внешнего энергетического уровня.
Значение, приведенное в скобках таблицы валентности, перечисляет менее распространенные валентности. Если у элемента указана только одна цифра, значит он может иметь только одну валентность.
Таблица валентности химических элементов.
Порядковый номер химического элемента, он же: атомный номер, он же: зарядовое число атомного ядра, он же: атомное число
Русское / Английское наименование
Таблица валентности химических элементов
Таблица валентности химических элементов.
Таблица валентности химических элементов:
Ниже приводится таблица валентности химических элементов с примерами соединений.
Валентность (от лат. valēns – «имеющий силу») – способность атомов химических элементов образовывать определённое число химических связей.
Валентность – это мера (численная характеристика) способности химических элементов образовывать определённое число химических связей.
Значения валентности записывают римскими цифрами I, II, III, IV, V, VI, VII, VIII.
Валентность определяют по числу химических связей, которые один атом образует с другими.
Таблица валентности химических элементов:
Первоначально за единицу валентности была принята валентность атома водорода. Валентность другого элемента можно при этом выразить числом атомов водорода, которое присоединяет к себе или замещает один атом этого другого элемента. Определенная таким образом валентность называется валентностью в водородных соединениях или валентностью по водороду: так, в соединениях HCl, H2O, NH3, CH4 валентность по водороду хлора равна единице, кислорода – двум, азота – трём, углерода – четырём.
Валентность кислорода, как правило, равна двум. Поэтому, зная состав или формулу кислородного соединения того или иного элемента, можно определить его валентность как удвоенное число атомов кислорода, которое может присоединять один атом данного элемента. Определенная таким образом валентность называется валентностью элемента в кислородных соединениях или валентностью по кислороду: так, в соединениях K2O, CO, N2O3, SiO2, SO3 валентность по кислороду калия равна единице, углерода – двум, азота – трём, кремния – четырём, серы – шести.
С точки зрения электронной теории валентность определяется числом неспаренных (валентных) электронов в основном или возбужденном состоянии.
Известны элементы, которые проявляют постоянную валентность. У большинства химических элементов валентность переменная.
Валентность. Определение валентности. Элементы с постоянной валентностью.
Необходимо четко усвоить следующие принципы:
Существуют элементы с постоянной валентностью (их относительно немного) и элементы с переменной валентностью (коих большинство).
Элементы с постоянной валентностью необходимо запомнить:
Остальные элементы могут проявлять разную валентность.
Высшая валентность элемента в большинстве случаев совпадает с номером группы, в которой находится данный элемент.
Например, марганец находится в VII группе (побочная подгруппа), высшая валентность Mn равна семи. Кремний расположен в IV группе (главная подгруппа), его высшая валентность равна четырем.
Следует помнить, однако, что высшая валентность не всегда является единственно возможной. Например, высшая валентность хлора равна семи (убедитесь в этом!), но известны соединения, в которых этот элемент проявляет валентности VI, V, IV, III, II, I.
Если известна валентность одного из элементов в бинарном соединении, можно найти валентность другого.
Зная валентности двух элементов, можно составить формулу бинарного соединения.
Ответ прост: берите минимально возможные значения х и у. В приведенном примере эти минимальные (натуральные!) значения как раз и равны 1 и 2.
Несмотря на все сказанное, в большинстве случаев можно руководствоваться правилом: берите наименьшие значения индексов.
Вот, собственно, и все основные моменты.
Хотите узнать, почему «классическое» определение валентности часто не «работает»? Почему валентность железа в FeO не равна двум? Почему для описания комплексных веществ используется понятие «координационное число»?