какая валентность у фтора
Валентность фтора
Общие сведения о валентности фтора
Фтор самый электроотрицательный элемент. В обычных условиях фтор представляет собой газ бледно-желтого цвета. Ядовит. В малых концентрациях запах фтора напоминает запах озона и хлора одновременно.
Молекула фтора двухатомна F2. Обладает самой низкой поляризуемостью среди галогенов. Температура плавления фтора аномально низкая. Не растворим в воде, т.к. разлагает ее (2F2 + 2H2O = 4HF + O2).
Валентность фтора в соединениях
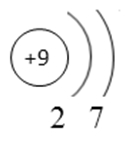
Фтор — девятый по счету элемент Периодической таблицы Д.И. Менделеева. Он находится во втором периоде во VIIA группе. В ядре атома фтора содержится 9 протонов и 10 нейтронов (массовое число равно 19). В атоме фтора есть два энергетических уровня, на которых находятся 9 электронов (рис. 1).
Рис. 1. Строения атома фтора.
Электронная формула атома фтора в основном состоянии имеет следующий вид:
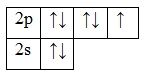
А энергетическая диаграмма (строится только для электронов внешнего энергетического уровня, которые по-другому называют валентными):
Примеры решения задач
| Задание | Валентность элемента равна: 1) числу образуемых им σ-связей; 2) числу образуемых им π-связей; 3) числу образуемых им ковалентных связей; 4) степени окисления с противоположным знаком. |
| Ответ | Под валентностью понимают свойство атома химического элемента присоединять или замещать определенное число атомов другого элемента, т.е., валентность — это количество ковалентных химических связей, которые атом данного химического элемента может образовывать с другими атомами. |
| Задание | Число неспаренных электронов в атоме бора в основном состоянии такое же, как и в атоме: 1) рубидия; 2) кремния; 3) кислорода; 4) кальция. |
| Решение | Число неспаренных электронов в атоме химического элемента чаще всего равно одному из значений валентности, которые проявляет этот элемент. Чтобы определить число неспаренных электронов в атоме бора в основном состоянии запишем электронную формулу этого элемента: |
На внешнем электронном уровне бора находится 3 электрона из которых только один неспаренный. Один неспаренный электрон в основном состоянии также имеет рубидий, поскольку он расположен в IA группе и на его внешнем электронном уровне находится всего один электрон, который, естественно, является неспаренным.
Таблица валентности.
В таблице валентности приведены значения валентности элементов периодической таблицы Менделеева. Что такое валентность?
Точками здесь обозначаются неподеленные пары электронов, однако в структурных формулах их отмечают не каждый раз.
В химии принято, что валентность химических элементов можно узнать по группе (колонке) в таблице Менделеева. В действительности не всегда валентность элемента соответствует номеру группы, но в большинстве случаев определенная валентность по такому методу даст правильный результат часто элементы, в зависимости от разных факторов, имеют не одну валентность. Чтобы проще было понимать и не путаться, ниже приведена таблица валентностей всех элементов периодической таблицы.
Цифра положительной валентности элемента соответствует количеству отданных атомом электронов, а отрицательной валентности – количеству электронов, которые атом должен забрать себе для завершения внешнего энергетического уровня.
Значение, приведенное в скобках таблицы валентности, перечисляет менее распространенные валентности. Если у элемента указана только одна цифра, значит он может иметь только одну валентность.
Таблица валентности химических элементов.
Порядковый номер химического элемента, он же: атомный номер, он же: зарядовое число атомного ядра, он же: атомное число
Русское / Английское наименование
Валентность фтора
Валентность фтора.
Валентность фтора:
Валентность (от лат. valēns – «имеющий силу») – способность атомов химических элементов образовывать определённое число химических связей.
Валентность – это мера (численная характеристика) способности химических элементов образовывать определённое число химических связей.
Значения валентности записывают римскими цифрами I, II, III, IV, V, VI, VII, VIII.
Валентность определяют по числу химических связей, которые один атом образует с другими.
Первоначально за единицу валентности была принята валентность атома водорода. Валентность другого элемента можно при этом выразить числом атомов водорода, которое присоединяет к себе или замещает один атом этого другого элемента. Определенная таким образом валентность называется валентностью в водородных соединениях или валентностью по водороду: так, в соединениях HCl, H2O, NH3, CH4 валентность по водороду хлора равна единице, кислорода – двум, азота – трём, углерода – четырём.
Валентность кислорода, как правило, равна двум. Поэтому, зная состав или формулу кислородного соединения того или иного элемента, можно определить его валентность как удвоенное число атомов кислорода, которое может присоединять один атом данного элемента. Определенная таким образом валентность называется валентностью элемента в кислородных соединениях или валентностью по кислороду: так, в соединениях K2O, CO, N2O3, SiO2, SO3 валентность по кислороду калия равна единице, углерода – двум, азота – трём, кремния – четырём, серы – шести.
С точки зрения электронной теории валентность определяется числом неспаренных (валентных) электронов в основном или возбужденном состоянии.
Известны элементы, которые проявляют постоянную валентность. У большинства химических элементов валентность переменная.
Какая валентность у фтора?
Электронная схема фтора
Порядок заполнения оболочек атома фтора (F) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ — до 6, на ‘d’ — до 10 и на ‘f’ до 14
Фтор имеет 9 электронов, заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
5 электронов на 2p-подуровне
Видео
Соединения
Формула фтора (F2) составлена из двух атомов элемента. Он может вступать в соединения со всеми другими элементами, кроме гелия и неона, образуя ионные или ковалентные фториды. Некоторые металлы, такие как никель, быстро покрываются слоем этого галогена, что предотвращает дальнейшую связь металла с элементом. Некоторые сухие металлы, такие как мягкая сталь, медь, алюминий или монель (66 % никеля и 31,5 % сплава меди) при обычных температурах с фтором не реагируют. Для работы с элементом при температурах до 600 °C подходит монель; спеченный глинозем устойчив до 700 °C.
Фторуглеродные масла являются наиболее подходящими смазочными материалами. Элемент бурно реагирует с органическими веществами (например, резиной, деревом и тканями), поэтому контролируемое фторирование органических соединений элементарным фтором возможно только при принятии специальных мер предосторожности.
Анализ
Сложно точно определить количество данного галогена в соединениях. Свободный фтор, валентность которого равна 1, можно выявить по его окислению ртути Hg + F2 → HgF2, а также измеряя увеличения веса ртути и изменение объема газа. Основными качественными тестами на присутствие ионов элемента являются:
Количественные методы анализа:
Валентность фтора в соединениях
Фтор — девятый по счету элемент Периодической таблицы Д.И. Менделеева. Он находится во втором периоде во VIIA группе. В ядре атома фтора содержится 9 протонов и 10 нейтронов (массовое число равно 19). В атоме фтора есть два энергетических уровня, на которых находятся 9 электронов (рис. 1).
Рис. 1. Строения атома фтора.
Электронная формула атома фтора в основном состоянии имеет следующий вид:
А энергетическая диаграмма (строится только для электронов внешнего энергетического уровня, которые по-другому называют валентными):
Энергия ионизации
Чем ближе электрон к центру атома — тем больше энергии необходимо, что бы его оторвать. Энергия, затрачиваемая на отрыв электрона от атома называется энергией ионизации и обозначается Eo. Если не указано иное, то энергия ионизации — это энергия отрыва первого электрона, также существуют энергии ионизации для каждого последующего электрона.
Фтор F
Фтор в таблице менделеева занимает 9 место, в 2 периоде.
| Символ | F |
| Номер | 9 |
| Атомный вес | 18.9984032 |
| Латинское название | Fluorum |
| Русское название | Фтор |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
Электронная схема фтора
Порядок заполнения оболочек атома фтора (F) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
Фтор имеет 9 электронов, заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
5 электронов на 2p-подуровне
Степень окисления фтора
Ионы фтора
Валентность F
Валентность фтора характеризует способность атома F к образованию хмических связей. Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа F
Видео заполнения электронной конфигурации (gif):
Результат:
Соединения фтора
Энергия ионизации
Перейти к другим элементам таблицы менделеева